Introducción
La mejoría de las técnicas quirúrgicas, de los esquemas de inmunosupresión y del control de las infecciones han convertido el trasplante de órgano sólido en una estrategia segura para el tratamiento de enfermedades crónicas irreversibles. En general, y a pesar de cierta controversia, podemos considerar que el trasplante renal mejora la supervivencia del enfermo en tratamiento sustitutivo con diálisis1. En el paciente con diabetes tipo 1 menor de 50 años y con insuficiencia renal crónica terminal en hemodiálisis, el doble trasplante de riñón y páncreas mejora la supervivencia en comparación con la hemodiálisis o el trasplante renal único2. Sin embargo, al hacer la indicación de trasplante renal o renopancreático deberá evaluarse siempre el equilibrio entre el beneficio del mismo y el riesgo de complicaciones, entre ellas la infección.
Muchos de los grandes logros en la supervivencia del paciente trasplantado se han conseguido con estrategias de prevención de las infecciones. Por ello, no podemos analizar la infección en el paciente con trasplante de riñón y de páncreas sin hacer hincapié en las mismas, detalladas a continuación en el manuscrito.
Toda la información de este artículo está referida a los pacientes adultos con trasplante renal o pancreático y, por lo tanto, no debe interpolarse la información a la población pediátrica, que tiene un comportamiento y manejo muy distinto.
Principios generales de la infección en el paciente con trasplante renal y pancreático
Cronología de la infección tras un trasplante de órgano sólido
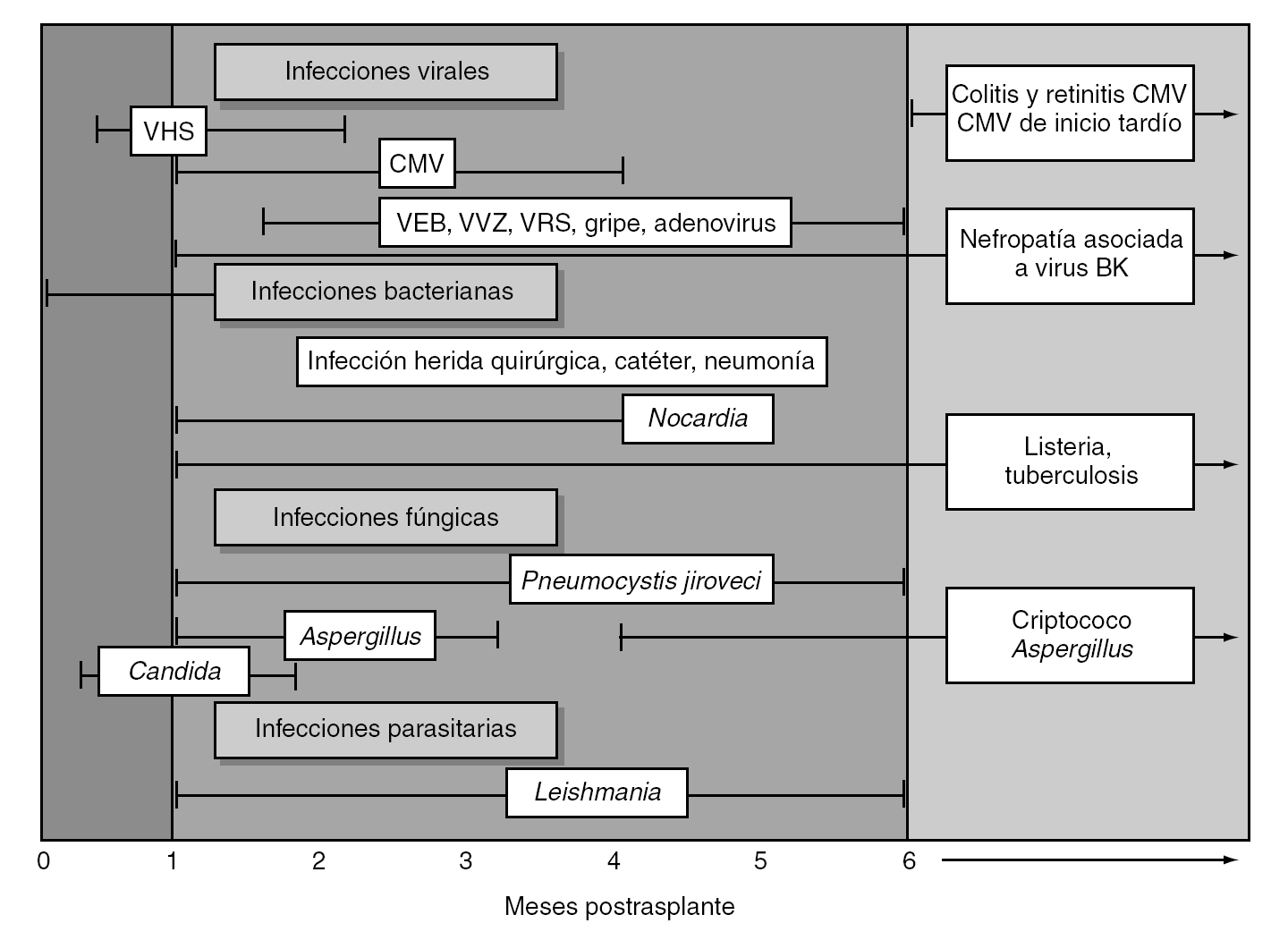
Por lo general, el paciente con trasplante de órgano sólido (TOS) presenta una evolución cronológica en los riesgos de infección diferente a lo largo del período posttrasplante que es fundamental conocer para enfocar el tratamiento. Esta cronología fue definida por Rubin et al3 hace más de 15 años en pacientes con trasplante renal (y posteriormente revisada) y sigue siendo útil en la actualidad con escasas modificaciones4. La figura 1 muestra la cronología de las infecciones postrasplante adaptada a España y a la epidemiología y conocimientos actuales. De forma resumida, en el primer mes postrasplante los pacientes presentarán infecciones nosocomiales derivadas de la intervención quirúrgica y del uso de sondaje vesical y catéteres intravenosos; en el período comprendido entre el primer y el sexto mes los pacientes presentan mayor riesgo de infecciones oportunistas (enfermedad por citomegalovirus [CMV], infección fúngica invasora, etc.) al ser el período en el que la inmunosupresión es máxima; a partir del sexto mes los pacientes presentarían infecciones comunitarias, de forma similar a la población general, pero también puede producirse reactivación de ciertos virus latentes (virus BK, CMV). Sin embargo, recientemente se ha descrito que una proporción de pacientes con TOS presenta infección oportunista de forma tardía, es decir, más allá del sexto mes postrasplante, condicionado por diversos factores como el incremento en la edad del receptor, la sobreinmunodepresión, el uso de profilaxis prolongadas (p. ej., antivirales), el desarrollo de insuficiencia renal postrasplante, etc.5,6. Así pues, siendo válidos los postulados de Rubin para la infección tras el trasplante de órgano sólido, no podemos olvidar que ciertos pacientes pueden presentar infecciones oportunistas en el período tardío.
Figura 1. Cronograma de las infecciones tras un trasplante de órgano sólido. Se han incluido las infecciones de aparición tardía (infección fúngica invasora por Aspergillus spp. y CMV tardíos) recientemente descritas y la infección por el virus BK, poco conocida en el momento de la publicación de la figura. Así mismo el lector comprobará que ciertas infecciones extraordinariamente poco frecuentes en la actualidad en el trasplante renal o pancreático (toxoplasmosis) o inexistentes en España (micosis endémicas, estrongiloidiasis) han sido omitidas. (Adaptada de Fishman JA, Rubin RH. Infection in organ-transplant recipients. N Engl J Med. 1998;338:1741-51. Con permiso del editor.) VHS: virus del herpes simple; CMV: citomegalovirus; VEB: virus de Epstein-Barr; VVZ: virus varicela-zóster.
Origen del órgano y técnica quirúrgica en el trasplante renal y pancreático
El injerto renal puede proceder de un donante cadáver (situación más frecuente), pero también de donante a corazón parado (en los cuales el donante se encuentra en asistolia y sometido a masaje cardíaco externo) y donante vivo (emparentado o no emparentado). El donante a corazón parado presenta la peculiaridad de tener una elevada incidencia de necrosis tubular que, a menudo, hace necesario el uso de hemodiálisis postrasplante y, por lo tanto, podría condicionar un incremento de ciertas infecciones asociadas a la hemodiálisis. El injerto pancreático puede proceder de donantes cadáver o de donantes a corazón parado.
Por lo general, el injerto renal se sitúa en la pelvis del receptor (en situación heterotópica), con la anastomosis vascular a nivel de los vasos pélvicos. En situaciones en las que el receptor presenta importante afectación arteriosclerosa en las arterias pélvicas y/o aorta abdominal, se puede plantear realizar un trasplante renal en fosa lumbar (ortotópico), en los que la anastomosis arterial se realiza sobre la arteria renal nativa o la arteria esplénica y el drenaje venoso sobre la vena renal nativa. Aunque es probablemente segura, esta técnica se asocia a mayor morbilidad quirúrgica7.
El trasplante de páncreas se practica la mayoría de las veces asociado a un trasplante renal (trasplante renopancreático). Su indicación principal es el tratamiento de la nefropatía terminal asociada a diabetes tipo 1; en esta patología el trasplante puede resultar curativo para la insuficiencia renal y la diabetes del paciente. El páncreas del donante conserva un segmento duodenal y se implanta en la cavidad peritoneal. El duodeno se anastomosará la mayoría de veces a un asa de yeyuno (derivación entérica) y más raramente a la vejiga urinaria (derivación urinaria). La anastomosis arterial y venosa se realizarán a arteria y vena ilíacas primitiva derechas respectivamente.
Prevención de las infecciones
Dentro del campo de la prevención de las infecciones, nos centraremos en 4 apartados: la vacunación, el estado serológico e intradermorreacción de Mantoux (PPD) pretrasplante, la profilaxis quirúrgica y la monitorización y profilaxis postrasplante. Para ampliar la información en la valoración y prevención de infecciones a un candidato a trasplante, remitimos al lector al documento de consenso GESITRA-SEIMC a dicho respecto8.
Vacunación
En el período pretrasplante, en nuestro medio está indicada la administración de las siguientes vacunas: vacuna polisacárida antineumocócica, Neisseria meningitidis, tos ferina, difteria y antitetánica. Está indicada también la vacunación pretrasplante de los sujetos con serología negativa para el virus del sarampión, rubéola, parotiditis, poliomielitis inactivada (tipo Salk), varicela, hepatitis A y hepatitis B (esta última con monitorización del título de anticuerpos). En el período postrasplante no deben administrarse las vacunas de virus vivos atenuados (parotiditis, sarampión y rubéola y varicela), contraindicadas en pacientes inmunodeprimidos. La vacuna antigripal debe administrarse anualmente y la vacuna antineumocócica cada 5 años. El lector puede consultar las guías de la Sociedad Americana de Trasplante para ampliar la información9.
Estado serológico e intradermorreacción de Mantoux
En el período pretrasplante deben determinarse las siguientes serologías: anticuerpos frente a CMV, virus de la inmunodeficiencia humana (VIH), varicela, virus de Epstein-Barr, virus de la hepatitis A, virus de la hepatitis C, virus de la hepatitis B (título de anticuerpos anti-HbsAg y HBsAg), Toxoplasma gondii y serología luética. Además es recomendable disponer de las serologías frente a los virus del sarampión, rubéola, parotiditis, herpes simple y herpes humano tipo 6. Del donante del órgano debemos disponer también de la serología frente a VIH-1 y VIH-2, CMV, virus de Epstein-Barr, virus de la hepatitis B (HBsAg y anticuerpos totales anti-HBc), virus de la hepatitis C (anticuerpos totales) y serología reagínica y treponémica10.
A todo paciente en lista de espera para un trasplante renal o pancreático se le debe realizar un PPD y una radiografía de tórax. Si el PPD es positivo o la radiografía de tórax muestra lesiones de tuberculosis antigua (independientemente del resultado del PPD) y no tenemos evidencia de que haya recibido tratamiento antituberculoso correcto o quimioprofilaxis con isoniazida, deberá recibir isoniazida durante al menos 6 meses.
Profilaxis quirúrgica
La profilaxis quirúrgica dependerá siempre de la incidencia y microorganismos aislados en cada centro. Basándonos en un ensayo clínico aleatorizado en este grupo de pacientes, proponemos una profilaxis basada en cefalosporinas de primera generación en los pacientes que se sometan a un trasplante renal y de una cefalosporina de tercera generación asociada a un glucopéptido en pacientes sometidos a trasplante renopancreático11. Insistimos en que dependerá de la prevalencia de algunos microorganismos resistentes (p. ej., Staphylococcus aureus resistente a la meticilina [SARM]) en que deban modificarse las pautas habituales (p. ej., añadir un glucopéptido).
Monitorización y profilaxis postrasplante
En el período postrasplante está indicada la monitorización de la replicación de CMV para el diagnóstico de infección asintomática con el fin de instaurar el tratamiento anticipado (tratamiento de la infección por CMV antes de que sea sintomática). Las técnicas más usadas son la determinación de antigenemia (detección del antígeno pp65 en leucocitos polimorfonucleares de sangre periférica) y la determinación del número de copias de ADN de CMV en sangre (mediante técnica de reacción en cadena de la polimerasa [RCP]). Esta última es de elección en casos en los que el paciente presente leucopenia, ya que en este contexto la antigenemia tiene baja sensibilidad. Así mismo, está indicada la monitorización de la presencia de células decoy en orina para evaluar la presencia de nefropatía asociada al virus BK (ver apartado de infección por poliomavirus).
El uso de cotrimoxazol en dosis bajas hasta el sexto mes postrasplante ha disminuido la incidencia de neumonía por Pneumocystis jiroveci en el paciente trasplantado, hasta el punto de su práctica desaparición. Así mismo, constituye una excelente profilaxis para evitar la infección por bacterias intracelulares, como Listeria monocytogenes y Nocardia spp., frecuentes antes de la instauración de la profilaxis y actualmente muy infrecuentes. En el caso del trasplante renal, además, la profilaxis con cotrimoxazol previene la aparición de infecciones urinarias. En pacientes alérgicos o intolerantes al cotrimoxazol, el uso de pentamidina inhalada puede ser una alternativa eficaz para la prevención de la neumonía por P. jiroveci, aunque carece de los efectos preventivos sobre las otras infecciones12. El uso de atovaquone se ha asociado a numerosos efectos adversos en trasplantados hepáticos13 y sólo debe utilizarse como profilaxis en el caso de aparecer efectos adversos a cotrimoxazol y pentamidina inhalada.
La profilaxis y tratamiento anticipado de la infección por CMV ha sido evaluada por el grupo de expertos de España de GESITRA-SEIMC y las siguientes recomendaciones se basan en este documento14. En receptores de un trasplante renal o pancreático de alto riesgo, es decir en el receptor seronegativo para CMV de un donante seropositivo (D+/R), está indicada la profilaxis con valganciclovir oral, hasta un máximo de 3 meses postrasplante, a dosis ajustadas por función renal14-16. También está indicada la profilaxis cuando los pacientes reciben tratamiento de inducción con anticuerpos antilinfocitarios durante 14 días en el caso de trasplante renal o durante 3 meses en el caso de doble trasplante de riñón y páncreas. En el caso del trasplante doble de riñón y páncreas de bajo riesgo (es decir, con serología para CMV positiva pretrasplante) está indicada la profilaxis con ganciclovir intravenoso (en dosis de 5 mg/kg/12 h) o valganciclovir oral durante las primeras 3 semanas.
La profilaxis antifúngica en el paciente renal no está indicada por protocolo y deberá individualizarse en función del riesgo y del estado de inmunosupresión del paciente. En el paciente con doble trasplante de riñón y páncreas se aconseja una pauta de 30 días de profilaxis con fluconazol en el postrasplante inmediato. Hay que tener en cuenta también que en determinadas ocasiones en las que el paciente se encuentra en situación de sobreinmunodepresión (p. ej., rechazo agudo celular o humoral, complicaciones quirúrgicas graves, etc.), puede ser necesario reintroducir la profilaxis antes descrita y replantear el uso de profilaxis frente a la infección por hongos filamentosos (fundamentalmente Aspergillus spp.).
En la tabla 1 se resumen las medidas pretrasplante, peritrasplante y postrasplante para la prevención de infecciones en el paciente con trasplante renal y pancreático.
Infecciones en el período postrasplante
Infección bacteriana
Infección urinaria
La infección urinaria es la infección más frecuente en el receptor de un injerto renal y su aparición está condicionada por numerosos factores como la presencia de diabetes pretrasplante, edad del receptor17, antecedentes de infección urinaria de repetición, etc. Sin embargo, la necesidad de sondaje vesical más o menos prolongado en el período postrasplante es el principal factor causante de la elevada incidencia de infecciones urinarias en este grupo de pacientes. La etiología más frecuente son las enterobacterias, predominantemente Escherichia coli y Klebsiella spp., seguidas de Pseudomonas aeruginosa y Enterococcus spp.18. Es de destacar el incremento progresivo de infección urinaria por enterobacterias resistentes a cefalosporinas (cromosómica o por producción de betalactamasa de espectro ampliado) que puede llegar a representar cerca de un 20% de las infecciones urinarias18,19. La elevada incidencia de este tipo de infecciones es secundaria a múltiples factores, pero la colonización rectal pretrasplante podría ser importante en su desarrollo20.
Desde el punto de vista topográfico, la infección urinaria en el trasplantado renal puede tratarse de una cistitis, prostatitis, orquiepididimitis, pielonefritis de riñón propio y pielonefritis del injerto, cada una de ellas con un comportamiento y enfoque particulares.
La cistitis es sin duda la complicación infecciosa más frecuente del paciente con trasplante renal. La medida general más efectiva para su prevención es la retirada precoz del sondaje vesical. En líneas generales debemos considerar no realizar tratamiento antibiótico en la bacteriuria asintomática, un ciclo de 7 a 10 días en el caso de cistitis no complicadas y reservar los tratamientos prolongados (6 semanas) para las cistitis recurrentes21.
La pielonefritis aguda del injerto se caracteriza por fiebre, dolor en la región del injerto renal y reactantes de fase aguda en la analítica. Su asociación a pérdida del injerto es controvertida, aunque cursa con mayor frecuencia con bacteriemia e inducción de rechazo agudo22,23. Su gravedad en infecciones producidas por E. coli está asociada a la expresión de factores de virulencia (serotipos O:H, expresión de fimbrias P y adhesinas)24.
Respecto a la pielonefritis de riñón propio, los receptores de un injerto debido a poliquistosis renal representan un caso particular. En estos pacientes debemos tener en cuenta la posibilidad de crisis quísticas e infecciones urinarias de riñón propio con mayor frecuencia que los trasplantados por otro motivo. Ciertos autores han propuesto realizar una nefrectomía de riñones propios previa al trasplante en pacientes con enfermedad poliquística para minimizar la incidencia de complicaciones25. Aunque la indicación de nefrectomía bilateral sigue siendo controvertida, parece claro que el mejor momento para realizarla, cuando esté indicada, es en el mismo acto del trasplante, siendo una maniobra segura en la mayor parte de ocasiones26,27.
El tratamiento antibiótico empírico de la infección urinaria del trasplantado renal dependerá en gran medida de los índices de resistencia bacteriana de cada centro. Por lo general se aconseja un tratamiento activo frente a P. aeruginosa en las infecciones urinarias precoces (en los primeros 3 meses postrasplante). Dado que en estos pacientes la incidencia de infección por enterobacterias resistentes a cefalosporinas puede ser elevada, es aconsejable escoger un carbapenem como tratamiento empírico inicial.
Neumonía bacteriana
La incidencia de neumonía tras un trasplante renal está estimada en 2,86 casos por persona/año y es una causa mayor de mortalidad postrasplante28,29.
La neumonía en receptores de un injerto renal es predominantemente de adquisición comunitaria (75%), mientras que en los receptores de un injerto doble de riñón y páncreas la neumonía nosocomial tiene un mayor protagonismo (50% de las neumonías)30. Esta diferencia es debida a que los receptores de trasplante renal rara vez ingresan en unidades de cuidados intensivos y la duración de la intubación orotraqueal se limita en la mayoría de los casos al acto operatorio. El diagnóstico, tratamiento y pronóstico de la neumonía comunitaria del paciente trasplantado es similar al del paciente inmunocompetente. En la neumonía nosocomial el diagnóstico microbiológico muestra una mayor proporción de bacilos gramnegativos y patógenos oportunistas como Aspergillus spp. y CMV. Para el diagnóstico microbiológico, el uso de fibrobroncoscopia con lavado broncoalveolar tiene una rentabilidad del 77% para la neumonía de origen nosocomial mientras que su rentabilidad cae al 47% en la adquirida en la comunidad. La mortalidad cruda de la neumonía nosocomial en el receptor de un TOS es del 58%, mientras que la de la neumonía comunitaria es del 8%, por ello aconsejamos un manejo diagnóstico agresivo con la práctica de broncoscopia y lavado broncoalveolar en la neumonía nosocomial y un manejo convencional en la neumonía adquirida en la comunidad del paciente con trasplante renal o pancreático30.
Infección de la herida quirúrgica
La infección de la herida quirúrgica puede condicionar un fracaso del injerto y un mayor número de complicaciones postrasplante. En el trasplante renal la incidencia de infección de la herida quirúrgica es inferior a un 5% mientras que en el trasplante pancreático se sitúa en torno al 10%31,32. Sin embargo, debemos tener en cuenta la alta incidencia de infección intraabdominal en receptores de trasplante pancreático, que puede llegar a ser superior al 15%, dada la manipulación intestinal durante el acto quirúrgico31. La prevención y el tratamiento de la infección de la herida quirúrgica no difiere del empleado en pacientes no trasplantados.
Infección por micobacterias
Tuberculosis. La incidencia de tuberculosis en nuestro medio en el paciente con trasplante renal oscila entre un 0,6-0,8% de todos los trasplantes, lo que representa una incidencia 20 veces mayor que en la población general33. La forma más frecuente de adquisición es la reactivación de una infección tuberculosa latente, aunque también se han descrito la transmisión a través del injerto y brotes nosocomiales34. En los receptores de un trasplante de órgano sólido la tuberculosis es más agresiva que en la población no inmunodeprimida. En una amplia serie de tuberculosis en estos pacientes, las formas extrapulmonares o diseminadas representaron casi la mitad de los casos, con una mortalidad global del 29%35. El diagnóstico de la enfermedad tuberculosa en el trasplantado renal o pancreático debe basarse siempre en el aislamiento de la micobacteria en cultivo. La realización del PPD en el período postrasplante es de baja utilidad debido a la situación de inmunodepresión. Los tests basados en la secreción de interferón gamma por las células T de memoria en respuesta a antígenos micobacterianos (QuantiFERONTM-TB Gold test [Cellesties, Carnegie, Australia] basado en ELISA y T-SPOTTM TB test [Oxford Immunotec, Abingdon, UK] basado en ELISPOT) podrían ser prometedores pero requieren validación en pacientes inmunodeprimidos36. El tratamiento de la tuberculosis en el trasplantado renal y pancreático supone un problema en la mayor parte de casos. En general, todos los pacientes deberían recibir isoniazida a menos que existan contraindicaciones claras. La rifampicina, por sus características de potente inductor enzimático, disminuye rápidamente los niveles de inhibidores de la calcineurina (ciclosporina A y tacrolimus) y en un estudio su uso supuso la pérdida de un 25% de los injertos33. El uso de rifabutina, con menor capacidad de inducción enzimática, podría representar una alternativa más segura. El etambutol y la pirazinamida presentan menos problemas de interacción farmacológica y pueden usarse con mayor seguridad. Por último, moxifloxacino puede convertirse en un fármaco de primera línea, por su actividad antituberculosa, su perfil de seguridad y sus escasas interacciones, aunque son necesarios más estudios que evalúen su eficacia.
Micobacteriosis atípica. La infección por micobacterias atípicas es una complicación infrecuente en el trasplante renal y pancreático. La mayor parte de los casos descritos en el trasplante renal son producidos por Mycobacterium chelonae y Mycobacterium kansasii, siendo menos frecuente la infección por Mycobacterium avium complex. La mayor parte de los casos descritos son infecciones cutáneas localizadas, pero es frecuente la afectación diseminada (casi un 20%). El pronóstico de estas infecciones en trasplantados renales suele ser bueno, siendo algo más de un 3% la mortalidad atribuible a la infección micobacteriana37.
Infección viral
La infección viral en el paciente con trasplante de órgano sólido produce 2 tipos de efecto. El efecto directo es el producido propiamente por el virus. Además puede producir efectos indirectos, entre los que se incluyen la inducción de rechazo agudo y crónico del injerto, el desarrollo de neoplasias y otros. Dado que los efectos de la infección viral en el receptor de un trasplante serán tratados en un capítulo posterior de esta serie, nos limitaremos a describir someramente la epidemiología y manifestaciones clínicas de la infección viral en el trasplantado de riñón y de páncreas.
Infección y enfermedad por CMV
Desde los inicios de los programas de trasplante, la enfermedad por CMV ha sido la infección oportunista más frecuente, condicionando elevada morbimortalidad. La aparición de ganciclovir y posteriormente de valganciclovir, han permitido desarrollar pautas de profilaxis y tratamiento anticipado que han modificado la incidencia y la gravedad de las infecciones. En el paciente con trasplante renal que no recibe profilaxis, la incidencia de infección por CMV es del 68% independientemente del estado serológico donante/receptor (D/R), mientras que la incidencia de enfermedad (infección por CMV asociada a sintomatología típica) es del 56% en los pacientes de alto riesgo (D+/R) y del 20% en los R+38. El riesgo de primoinfección (D+/R) es de un 17% cuando se realiza profilaxis con valganciclovir durante los primeros 100 días postrasplante15. Por último, la profilaxis universal o tratamiento anticipado son equivalentes para prevenir la aparición de enfermedad por CMV en el paciente R+39. En el paciente con trasplante pancreático la información es menor, pero podemos decir que la incidencia de infección o enfermedad por CMV global es muy variable entre diferentes estudios y se sitúa entre el 10 y el 42%31,40,41.
Desde el punto de vista clínico existen dos formas principales de enfermedad por CMV. El síndrome viral, enfermedad por CMV no invasiva (sin afectación orgánica), consiste en fiebre, presencia de neutropenia o trombocitopenia y la detección de CMV en sangre (sea mediante antigenemia, cultivo o detección de ADN viral)14,42. Cuando CMV produce invasión tisular hablaremos de afectación de órgano o focal. Las formas clínicas más frecuentes son la afectación gastrointestinal, la neumonitis y la hepatitis. La retinitis, cistitis, nefritis, afectación del sistema nervioso central, miocarditis y pancreatitis son más raras. En el trasplante renal y pancreático la enfermedad tisular invasiva por CMV es mucho menos frecuente que el síndrome viral (en un estudio fue de 0,9 y 2,6%, respectivamente)43. La enfermedad focal por CMV presenta mayor gravedad que el síndrome viral (perforaciones digestivas, neumonitis grave, etc.) con una mortalidad superior al 10%43. Uno de los factores de riesgo más importante para enfermedad por CMV con afectación de órgano, asociada generalmente a un desarrollo tardío en el postrasplante, es la profilaxis prolongada previa en pacientes serodiscordantes para CMV (D+/R)15,44,45.
Infección por otros herpesvirus
La aparición de herpes simple labial es una complicación muy frecuente en el postrasplante inmediato que no suele dar problemas y responde bien al tratamiento con aciclovir oral. Menos frecuente son la infecciones diseminadas por herpes simple y por el virus varicela-zóster, que presentan alta letalidad, con afectación de múltiples órganos (gastrointestinal, neumonitis, afectación cutánea diseminada, etc.).
El virus del herpes humano tipo 6 puede producir infección grave en el trasplantado46. Desde el punto de vista sindrómico la infección por virus del herpes-6 produce fiebre y exantema cutáneo, que en las formas graves puede asociarse a mielosupresión, hepatitis, neumonitis y encefalitis45,47. Sin embargo, los factores de riesgo para esta grave infección son poco conocidos y difíciles de prevenir. Así, la incidencia de primoinfección por virus del herpes-6 en sujetos seronegativos es baja y, por lo tanto, la indicación de la monitorización mediante determinación de ADN plasmático es, como mínimo, controvertida48.
Las manifestaciones clínicas por efecto directo del virus ya sea en forma de reactivación o primoinfección por virus herpes-7, virus de Epstein-Barr y virus del herpes-8 son menos conocidas y probablemente sus efectos más importantes sean los indirectos (inducción de rechazo agudo, síndrome linfoproliferativo postrasplante y sarcoma de Kaposi, respectivamente) y serán tratados en una revisión posterior.
Infección por el poliomavirus humano. Nefropatía asociada a virus BK
La nefropatía asociada a la infección por el virus BK es una infección característica del trasplante renal, aunque puede aparecer con mucha menor frecuencia en otros trasplantes de órgano sólido. Los humanos somos los huéspedes naturales de Polyomavirus hominis tipo 1 y 2, virus ADN del género polyomavirus y familia polyomaviridae, también llamados BK y JC, respectivamente, nombre tomado de las iniciales de los pacientes en que fue aislado por primera vez a principio de la década de 1970. El poliomavirus humano tipo 1 (BK) fue descrito por primera vez a principios de la década de 1970. Tras la infección por el virus BK durante la infancia, éste queda acantonado en las células del urotelio49. Entre los 5 y los 9 años de edad, la seroprevalencia de virus BK es superior al 90%50. En situaciones de disminución de la función inmunitaria, el virus BK puede replicar de forma transitoria o persistente, condicionando cambios citopáticos en el urotelio e induciendo viruria (eliminación urinaria de células decoy con características inclusiones virales intranucleares, viriones o proteínas virales)51. Finalmente, el virus BK puede condicionar alteraciones histopatológicas características condicionando la nefropatía del injerto por virus BK. En fases precoces se pueden observar células dispersas con inclusiones de virus BK con un parénquima normal y más adelante se podrán encontrar 3 grados de afectación (A, B y C) en función del grado de inflamación y de fibrosis túbulo-intersticial51. Hablaremos pues de infección por virus BK cuando observemos exposición al virus (en estado replicativo o no replicativo), de replicación de virus BK cuando exista evidencia de replicación viral (ya sea detectando virus infectivos, viriones, proteínas estructurales, ADN extracelular y alteraciones citológicas o histológicas) y de enfermedad por virus BK cuando exista evidencia histológica de patología tisular asociada a virus BK52.
En un estudio en pacientes con trasplante renal, a 120 semanas del trasplante, la probabilidad de detectar células decoy en orina fue de 30%, la probabilidad de viremia del 13% y la probabilidad de nefropatía del injerto del 8%53. La detección de células decoy en orina tiene un valor predictivo negativo para nefropatía asociada a virus BK del 100%; sin embargo, su valor predictivo positivo es tan sólo del 29%52. De esta forma, para el diagnóstico de esta patología se aconseja la monitorización de la citología urinaria o la detección de ADN plasmático de virus BK de forma trimestral hasta el segundo año y posteriormente anual. En los casos en que la detección sea positiva se aconseja la monitorización de la carga viral del virus BK en plasma y orina cada 2-4 semanas. Cuando existan 3 detecciones mensuales positivas de células decoy, una carga viral plasmática superior a 104 copias en un período de 3 semanas o una carga viral urinaria superior a 107 copias en exámenes repetidos estará indicada la biopsia renal50. La incidencia de nefropatía asociada a virus BK en pacientes con trasplante doble de riñón y páncreas oscila entre un 2,9 y un 7,5%53,54. En estos pacientes, la incidencia de pérdida del injerto renal es similar a la de la nefropatía por virus BK en pacientes con trasplante renal único, mientras que la función del injerto pancreático no suele verse afectada55. En pacientes con trasplante pancreático aislado puede existir nefropatía por virus BK sobre riñones propios aunque probablemente este fenómeno es muy infrecuente56.
La evolución de la nefropatía asociada a poliomavirus es mala, con un 60% promedio de pérdida del injerto57. En presencia de ADN urinario para virus BK superior a 107 copias y/o ADN plasmático superior a 104 copias y con una biopsia indicativa de nefropatía asociada a BK o en presencia de deterioro de la función renal con biopsia renal normal (con ausencia de signos de rechazo agudo), la primera medida terapéutica es la reducción de la inmunosupresión57. Sin embargo, dicha reducción no siempre consigue disminuir la replicación viral, siendo en estos casos necesario el uso de fármacos. Entre los fármacos que han mostrado actividad frente al virus BK destaca el cidofovir, activo frente al poliomavirus pero muy nefrotóxico. El cidofovir suele controlar la replicación viral, aunque en muchos casos reaparece al finalizar el tratamiento58. Otros fármacos como leflunomida o fluoroquinolonas pueden ser eficaces aunque no existen estudios aleatorizados que avalen su uso58.
Infección fúngica invasora
Candida
La infección invasiva por Candida spp. puede ser un problema emergente en el trasplante de órgano sólido. En la cohorte RESITRA, un 5% de las bacteriemias/funguemias de los trasplantados renales y un 12% de los pancreáticos fueron producidos por Candida spp., de las cuales (en el total de la cohorte) algo más del 45% fueron C. glabrata o C. krusei59. Cuando en el paciente con trasplante pancreático se utiliza la profilaxis con fluconazol como protocolo, la infección invasiva por Candida spp. es menos frecuente31. Hay que destacar que el uso de inmunosupresores potentes como el alemtuzumab podría incrementar la frecuencia de infecciones invasivas en este grupo de pacientes60. Una situación frecuente en el trasplantado renal o pancreático es la candiduria, cuyos factores de riesgo de aparición son similares al paciente no trasplantado, y que confieren un peor pronóstico del paciente a pesar del tratamiento61.
Criptococo
La infección por Cryptococcus neoformans es una grave complicación del TOS con una mortalidad algo mayor del 40% en las series más antiguas, que ha descendido al 14% en la serie más reciente62,63. El órgano más frecuentemente afectado es el sistema nervioso central (mayoritariamente en forma de meningitis a líquido claro) y casi una cuarta parte de los pacientes tienen afectación de varios órganos, con afectación pulmonar en un 25%62. Otras localizaciones son piel y tejidos blandos y afectación osteoarticular. En los pacientes con trasplante renal se ha descrito la asociación entre el síndrome de reconstitución inmune con el tratamiento y una mayor incidencia de pérdida del injerto por rechazo64. El esquema inmunosupresor es también un factor pronóstico, teniendo menor mortalidad los pacientes en tratamiento con inhibidores de la calcineurina en comparación con los pacientes que recibían azatioprina o micofenolato63. El tratamiento de elección en pacientes con afectación del sistema nervioso central es la combinación de anfotericina B (preferiblemente lipídica para minimizar la toxicidad renal) con flucitosina. En pacientes seleccionados en los que el estado clínico sea muy bueno y tengan afectación de un solo órgano (pulmón, osteoarticular, etc.) sin meningitis, puede plantearse la monoterapia con anfotericina B o fluconazol.
Aspergilosis
La incidencia de aspergilosis invasiva en nuestro medio se cifra, aproximadamente, en un 0,9% de los receptores de un injerto pancreático y un 0,2% de los receptores de un injerto renal, aunque en otras series la incidencia de aspergilosis invasora en receptores de trasplante pancreático fue más alta (4,2%)6,31. Los factores de riesgo asociados al desarrollo de aspergilosis en el receptor de un trasplante renal o pancreático se encuentran resumidos en la tabla 2. La aspergilosis pulmonar invasora es una patología con elevada mortalidad. Las guías terapéuticas elaboradas por GESITRA/MICOMED aconsejan el uso de voriconazol o de una anfotericina lipídica (a dosis de 5 mg/kg/día) como tratamiento inicial, aceptándose el tratamiento antifúngico combinado como rescate en pacientes con mala evolución70. La mortalidad atribuible a aspergilosis en un estudio fue de 43% en los pacientes que reciben monoterapia con anfotericina lipídica frente a un 26% en los pacientes que reciben tratamiento combinado con voriconazol y caspofungina71. En otro estudio que evaluó tratamiento combinado o anfotericina B en dosis altas frente a tratamiento convencional, la diferencia a favor del primero fue estadísticamente significativa72. A pesar de estos datos, son necesarios más estudios para aconsejar el tratamiento antifúngico combinado en el tratamiento inicial de estos pacientes.
Infección parasitaria
Toxoplasmosis
La infección por T. gondii en el paciente con trasplante de órgano sólido presenta una elevada mortalidad. En una serie de 6 casos de toxoplasmosis en trasplantados renales, la mortalidad fue de un 64,5%73. Clínicamente se suele manifestar en forma de alteración neurológica focal secundaria a abscesos cerebrales, aunque se han descrito formas diseminadas con neumonitis y afectación multiorgánica. El tratamiento de elección es la combinación de sulfadiazina (ajustada a la función renal) y pirimetamina. Actualmente la infección por T. gondii en el paciente con trasplante renal y pancreático es muy infrecuente debido a la profilaxis universal con cotrimoxazol durante los primeros 6 meses del trasplante.
Leishmaniasis
La leishmaniasis visceral no es una complicación frecuente en el paciente trasplantado. El número de casos más elevado de leishmaniasis visceral se ha comunicado en receptores de trasplante renal, aunque esto es probablemente debido a que es el trasplante más frecuentemente realizado. Más de un 80% de los casos de leishmaniasis en trasplantados consultan por fiebre. En muchas ocasiones están ausentes las alteraciones hematológicas y las visceromegalias típicas de la infección por lo que será necesario un alto índice de sospecha para hacer el diagnóstico. La rentabilidad del aspirado de médula ósea en estos pacientes es de un 85%. El tratamiento de elección en la actualidad es anfotericina B liposomal, consiguiéndose unos índices de curación del 80% de los casos74.
Conclusiones
A pesar de los progresos en la prevención, diagnóstico y tratamiento, las infecciones desempeñan un papel muy importante en la supervivencia del injerto y del paciente de los receptores de un trasplante renal y/o pancreático. Los esquemas de profilaxis actuales han conseguido disminuir mucho la incidencia de ciertas infecciones. Sin embargo, han aparecido patógenos emergentes como bacterias multirresistentes o el poliomavirus humano que se han convertido en un reto para optimizar el manejo del paciente con trasplante renal o pancreático. El conocimiento de la patología infecciosa asociada al trasplante y su cronología permitirá al clínico optimizar el manejo y tratamiento de este grupo de pacientes inmunodeprimidos.
Correspondencia:
Dr. C. Cervera.
Servicio de Enfermedades Infecciosas. Hospital Clínic de Barcelona. IDIBAPS.
Villarroel, 170. 08036 Barcelona. España.
Correo electrónico: ccervera@clinic.ub.es
Manuscrito recibido el 16-2-2007; aceptado el 19-2-2007.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.