Introducción
A mediados de la década de 1990, las infecciones hospitalarias producidas por Acinetobacter spp. aumentaron de forma considerable en los hospitales españoles 1. Este fenómeno se detectó especialmente entre los pacientes ingresados en los Servicios o unidades de cuidados intensivos (UCI), donde en los últimos 10 años Acinetobacter spp. ha conseguido un importante protagonismo entre los microorganismos productores de infecciones relacionadas con dispositivos invasivos 2. Por el contrario, en otros países la importancia de Acinetobacter spp. entre los patógenos responsables de infecciones nosocomiales detectadas en UCI no ha experimentado el mismo crecimiento 3.
Las razones que justifican este incremento en nuestro país no están claras. Aunque se trata de un patógeno con una gran capacidad para sobrevivir en las condiciones más adversas, su distribución ha sido poco homogénea entre los hospitales españoles, incluso entre los hospitales de una misma ciudad. Mientras que en algunos de ellos, Acinetobacter spp. se ha presentado de forma epidémica, y después ha permanecido durante años como una endemia con elevadas tasas de colonización o infección, en otros hospitales su presencia es anecdótica y se limita a pacientes que provienen de otros hospitales, de centros geriátricos o a pacientes crónicos con ingresos múltiples en diferentes hospitales 4.
Por otro lado, se ha cuestionado el impacto que tienen las infecciones por Acinetobacter spp. en la evolución de los pacientes. Mientras que algunos las asocian con una mayor mortalidad y morbilidad 5,6, otros, por el contrario, consideran que es un marcador de gravedad pero sin influencia en el pronóstico 7. La rápida aparición de resistencias a los antibióticos empleados con más frecuencia ha condicionado la necesidad de utilizar otros antibióticos o asociaciones de antibióticos que muestran, in vitro, concentraciones inhibitorias mínimas adecuadas 8,9.
El objetivo de este estudio ha sido cuantificar la importancia de las infecciones por Acinetobacter spp. en pacientes críticos ingresados en UCI, así como identificar los factores de riesgo que facilitan su desarrollo, determinar la evolución de la resistencia a imipenem (IMP) y conocer su impacto en la evolución de los pacientes que las presentan.
Método
Se trata de un estudio prospectivo, observacional y multicéntrico. Se ha incluido a los pacientes ingresados en las UCI participantes en el Estudio Nacional de Vigilancia de Infección Nosocomial (ENVIN) durante 1 o 2 meses desde el año 1997 hasta el año 2003. En este estudio se han controlado de forma continua a los pacientes ingresados durante más de 24 h, con seguimiento hasta el alta de UCI o hasta un máximo de 60 días.
En todos los pacientes evaluados se recogieron variables demográficas, enfermedad de base, instrumentaciones realizadas (intubación y ventilación mecánica, sonda uretral, catéteres venosos centrales y catéteres arteriales), días de estancia en UCI y situación clínica en el momento del alta. La variable "días de estancia en UCI" corresponde a la estancia total de los pacientes en dicha unidad.
Los enfermos fueron clasificados de acuerdo con la enfermedad de base en coronarios, quirúrgicos, traumáticos y médicos. Se consideraron pacientes coronarios aquellos cuyo motivo de ingreso fue un síndrome isquémico agudo como angina o infarto de miocardio. Los pacientes traumáticos incluían a aquellos cuyo motivo de ingreso eran lesiones agudas producidas por un traumatismo. Con respecto a los pacientes quirúrgicos, su motivo de ingreso fue el control postoperatorio de una intervención programada. Finalmente, los pacientes médicos tenían un motivo de ingreso que no era ninguno de los anteriores, y se incluía a enfermos que ingresaron después de una intervención quirúrgica no programada.
La gravedad de los pacientes se valoró mediante la puntuación del sistema APACHE II 10 y se consideró la necesidad de cirugía urgente, definida como la necesidad de intervención quirúrgica no programada, o electiva, antes o durante la estancia en UCI. La mortalidad cruda se definió como aquella que se produjo durante la estancia en UCI por cualquier motivo.
Infecciones estudiadas
Se han identificado aquellas infecciones relacionadas de forma directa con dispositivos y que se asocian con una mayor morbilidad y mortalidad entre los pacientes críticos: neumonías relacionadas con ventilación mecánica (N-VM), infecciones urinarias relacionadas con sonda uretral (IU-SU), bacteriemias primarias (BP) y relacionadas con catéteres vasculares (BP-CV) y bacteriemias secundarias (BS). Los criterios utilizados para definir estas infecciones fueron los publicados por los Center for Disease Control and Prevention (CDC) 11. Se consideró como bacteriemia primaria la presencia de cultivos positivos en sangre sin foco conocido de infección, y en este estudio se incluyeron de forma conjunta, para el cálculo de tasas, con las BP-CV. Las bacteriemias secundarias se consideraron de forma independiente.
Las infecciones nosocomiales fueron diagnosticadas por los médicos responsables de los enfermos y documentadas como tales en la historia clínica de los pacientes. Los médicos encargados de la vigilancia de la infección nosocomial fueron médicos especialistas en medicina intensiva, con especial interés y formación en las enfermedades infecciosas. Estos médicos registraron de forma prospectiva las infecciones, pero en la mayoría de los casos no intervinieron de forma directa en su diagnóstico.
Para el diagnóstico etiológico fueron aceptados los criterios utilizados por cada UCI participante, siguiendo la normativa propuesta por el CDC 12. En el caso de las N-VM, las técnicas empleadas en el diagnóstico etiológico se clasificaron en invasivas y no invasivas dependiendo de la utilización de fibrobroncoscopia y/o de biopsias pulmonares. En los casos en los que fue posible se llegó a la identificación de género y especie, para lo cual se utilizaron los métodos disponibles en cada uno de los hospitales participantes. La susceptibilidad de los patógenos identificados como responsables de las infecciones a los distintos antibióticos se realizó siguiendo las sucesivas especificaciones (método y valores) del National Committee for Clinical Laboratory Standards (NCCLS) 13.
Atendiendo a la presencia de una infección relacionada con dispositivos invasivos y su etiología, se clasificó a los pacientes en una de las siguientes categorías: a) paciente sin infección: cuando durante la estancia en UCI no se detectó ninguna de las consideradas en este estudio; b) paciente con infección por Acinetobacter spp.: cuando un paciente tuvo una o más de las infecciones controladas debidas a un Acinetobacter spp.: independientemente de que tuviera otras infecciones por otros microorganismos, y c) paciente con una infección por otros microorganismos: cuando un paciente tuvo una o más infecciones, con etiología distinta a Acinetobacter spp.
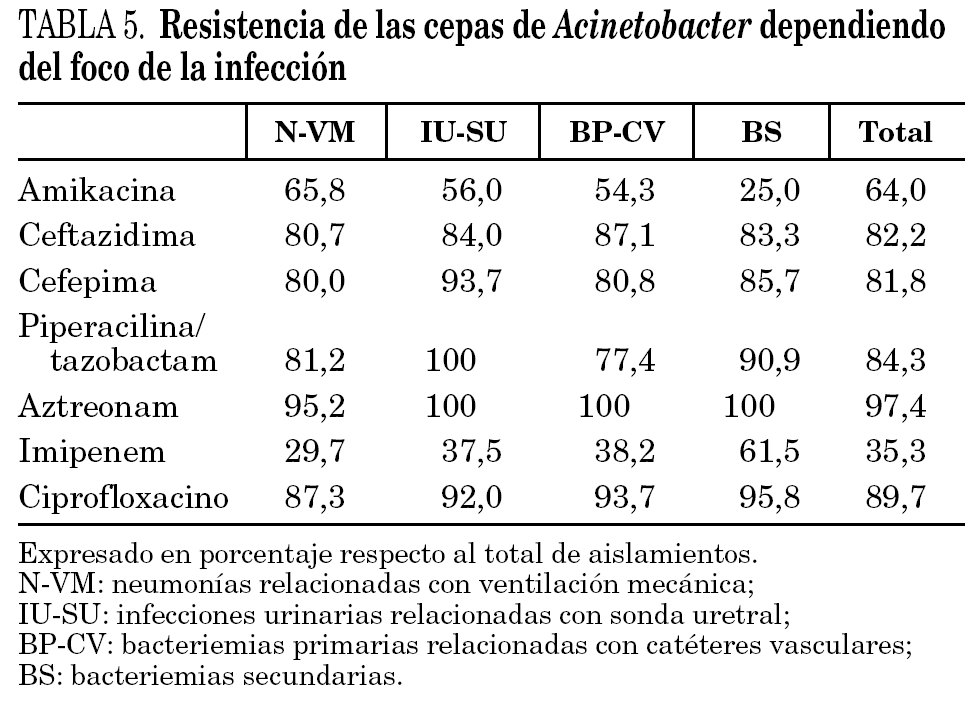
Los pacientes con infecciones por Acinetobacter spp. se diferenciaron, dependiendo de su sensibilidad frente a IMP, en sensibles o resistentes. Las bacterias con sensibilidad intermedia a dicho antibiótico se han clasificado como resistentes.
Medidas de incidencia
Para determinar el número de pacientes con una o más infecciones por Acinetobacter spp. se calculó la tasa de incidencia, dividiendo el número de pacientes con estas infecciones por el número total de pacientes de riesgo, expresándolo en porcentajes. Para determinar el número total de infecciones por Acinetobacter spp. se calculó la incidencia acumulada dividiendo el número de infecciones por el total de pacientes de riesgo, y también se expresó en porcentajes. La densidad de incidencia de estas infecciones por días de estancia en UCI se calculó dividiendo el número de infecciones por el número total de pacientes/día, y se expresó en infecciones por 1.000 días de estancia de pacientes en UCI.
Análisis estadístico
La recogida de datos se realizó de forma prospectiva utilizando la aplicación informática ENVIN-UCI, en formato Access'97, analizando los datos mediante el paquete de programas estadísticos BMDP 1990 (Statistical Software Inc.). Las variables cualitativas se describen mediante la distribución de porcentajes de cada una de las categorías. Las variables cuantitativas se describen con la media y la desviación estándar cuando siguen una distribución normal; con la mediana, valor mínimo y máximo en caso contrario. El estudio de la asociación de variables cualitativas se realizó mediante la prueba de la ji cuadrado. La comparación de medias de muestras independientes se hizo mediante las pruebas t de Student o U de Mann Withney, según que la variable tuviera, o no, una distribución normal. Para ajustar por los factores de confusión, se realizó una regresión logística, donde la variable dependiente era la infección por Acinetobacter spp. frente a la infección por otros microorganismos, y las independientes eran aquellas que habían resultado significativas en el análisis bivariante. Para identificar los factores relacionados con la presencia de una infección por Acinetobacter spp. resistente a IMP, se realizó una regresión logística en la que las variables independientes fueron las que resultaron significativas en el análisis bivariante. Los resultados se presentan mediante la odds ratio (OR) y su intervalo de confianza (IC) del 95%. El grado de significación estadística aceptado fue del 5% (p < 0,05).
Resultados
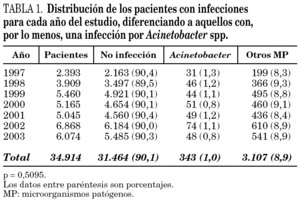
Se controló a 34.914 pacientes, que ocuparon cama en UCI un total de 259.181 días; de todos ellos, 3.450 (9,9%) adquirieron 5.599 infecciones nosocomiales durante su estancia en la unidad (1,6 infecciones por paciente con infección). En 343 pacientes (9,9%) se identificaron 406 infecciones en las que uno de los microorganismos responsables fue un Acinetobacter spp. La tasa de pacientes con infección adquirida en UCI producida por un Acinetobacter fue de un caso por 100 pacientes ingresados en UCI, la incidencia acumulada fue de 1,2 episodios de infección por 100 pacientes y la densidad de incidencia fue de 1,6 episodios de infección por 1.000 pacientes/día.
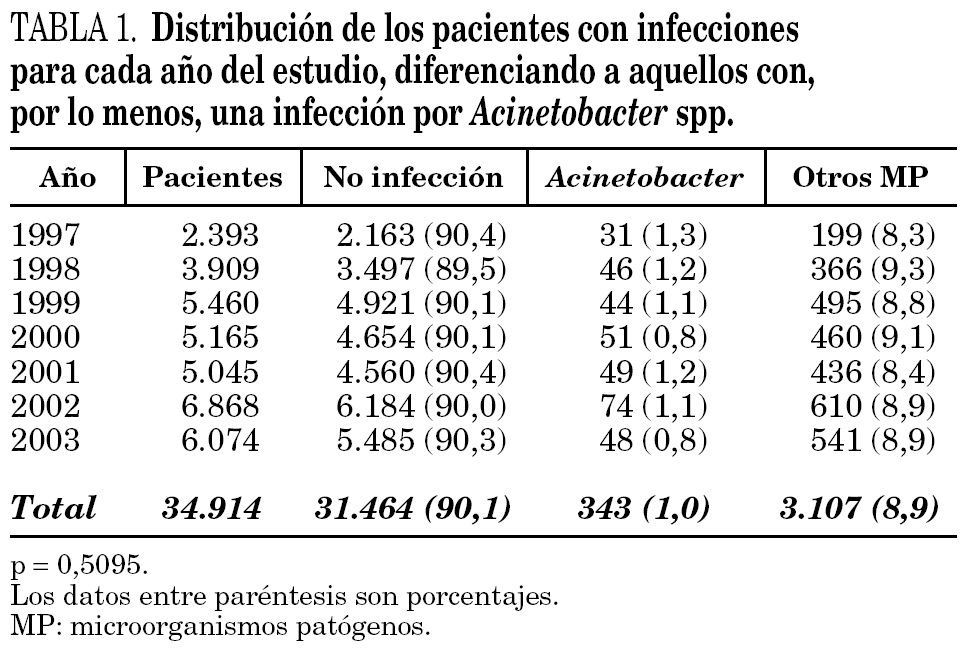
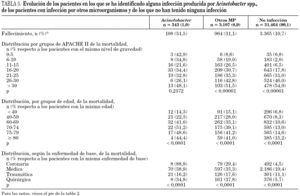
En la tabla 1 se incluye la distribución de los pacientes con infecciones para cada año del estudio, diferenciando a aquellos con una o más infecciones por Acinetobacter spp. Las tasas anuales han oscilado entre 0,8 y 1,3 por 100 pacientes, sin que existan diferencias significativas entre ellas (p = 0,5095).
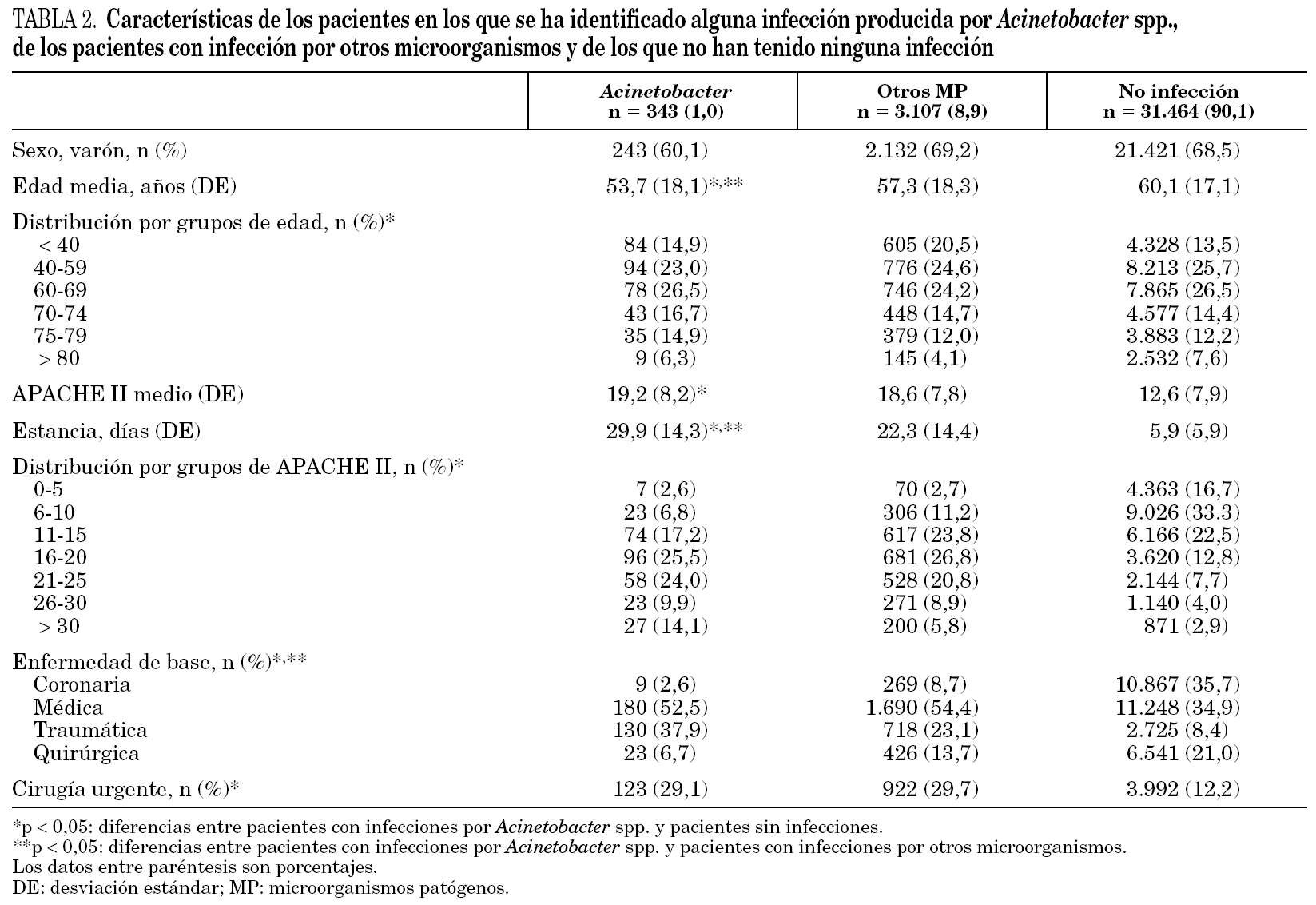
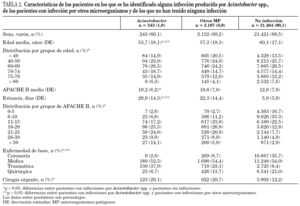
En la tabla 2 se incluyen las características de los pacientes con alguna infección producida por Acinetobacter spp. de forma comparativa con las de aquellas que han tenido infección por otros microorganismos y con los que no ha tenido ninguna infección. Cuando se compara con los pacientes que han tenido infecciones por otros microorganismos, destaca la menor edad media (53,7 años frente a 57,3 años; p < 0,05), la mayor estancia global en UCI (29,9 días frente a 22,3 días; p < 0,05) y el predominio en pacientes traumáticos (38,0% frente a 23,1%; p < 0,001). Tras realizar un análisis multivariante, las variables que influyen significativamente en la aparición de un Acinetobacter spp. en una infección relacionada con dispositivos fueron la enfermedad de base médica (OR: 2,47; IC 95%: 1,24-4,91) o traumática (OR: 4,40; IC 95%: 2,20-8,80) y la estancia en UCI (OR: 1,03; IC 95%: 1,02-1,04).
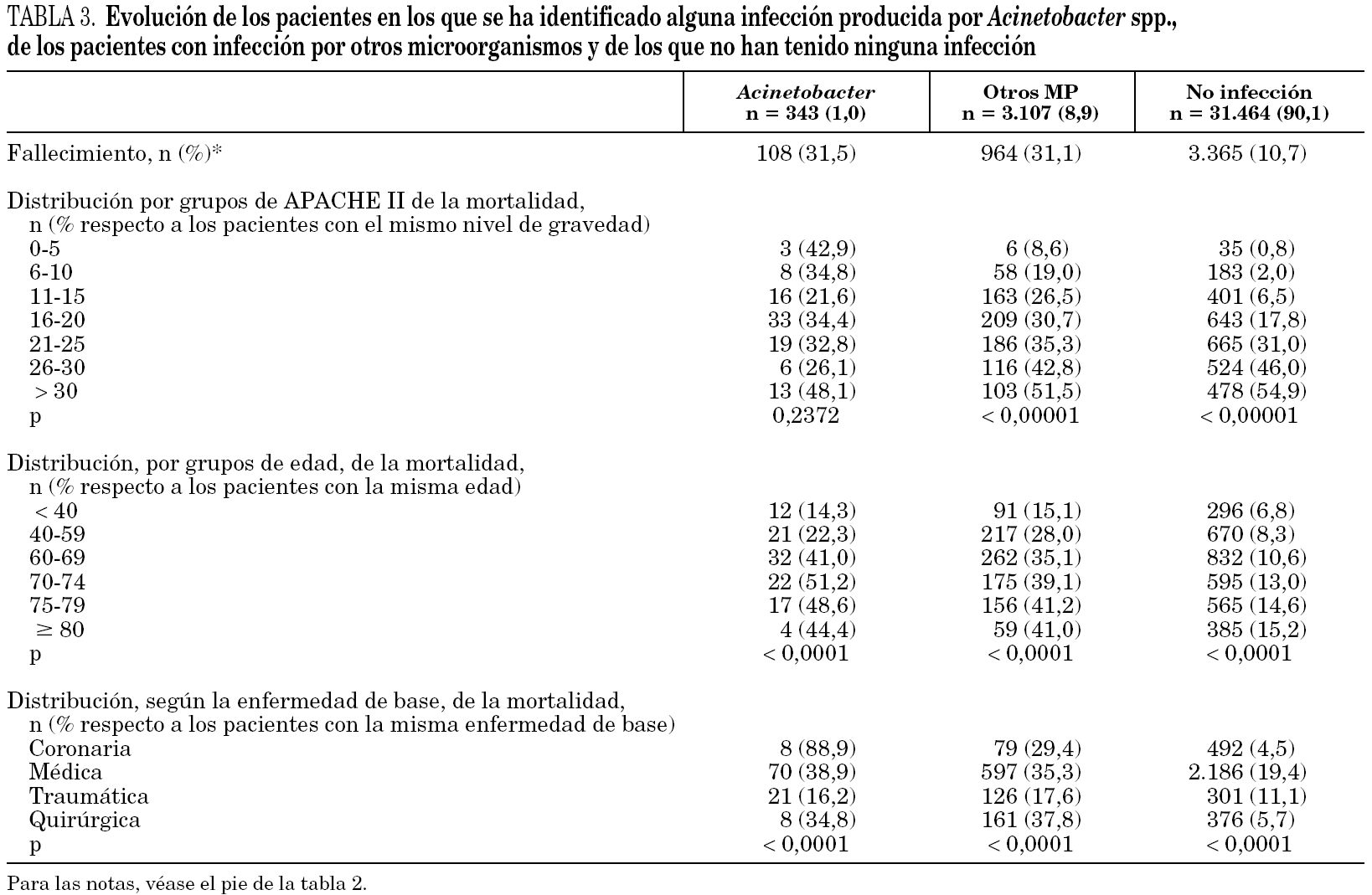
La evolución de los pacientes se incluye en la tabla 3, donde se destaca que no hubo diferencias en la mortalidad global intra-UCI entre los pacientes con infecciones, por Acinetobacter spp. (31,5%) o por otros microorganismos (31,1%), aunque en ambos casos fue significativamente mayor que la de los pacientes sin infecciones (10,7%). La mortalidad en estos últimos y en los infectados por otros microorganismos varía de forma significativa dependiendo del nivel de gravedad (APACHE II), la edad y la enfermedad de base; por el contrario, en el grupo de pacientes con infecciones por Acinetobacter spp. la mortalidad es independiente de la gravedad (tabla 3).
En 1.958 pacientes (5,6%) se identificaron 2.624 N-VM y en 247 de estos pacientes (12,6%) se aisló Acinetobacter spp. en algún caso. Los pacientes con N-VM por Acinetobacter spp. tuvieron una estancia en UCI más prolongada (29,0 días frente a 23,6 días; p < 0,05), predominando en aquellos con enfermedad de base traumática (40,7% frente a 28,2%; p < 0,001). No existieron diferencias en la mortalidad con respecto a las N-VM producidas por otros microorganismos (33,2 % frente a 34,3%; p = 0,7854).
En 1.047 pacientes (3,0%) se identificaron 1.198 IU-SU y en 43 pacientes (4,1%) se aisló Acinetobacter spp. Los pacientes con infección urinaria por Acinetobacter spp. tuvieron estancias en UCI más prolongadas (36,5 días frente a 25,0 días; p < 0,05) y un mayor nivel de gravedad (APACHE II: 21,6 % frente a 18,2%; p < 0,05), predominando en el sexo masculino (72,1 % frente a 53,8%; p < 0,05), pero no hubo diferencias en la evolución (mortalidad del 20,9% frente a 25,3%; p = 0,6403).
En 988 pacientes (2,8%) se diagnosticaron 1.203 BP o B-CV y en 58 pacientes (5,9%) se aisló un Acinetobacter spp. Los pacientes con BP o B-CV por Acinetobacter spp. tuvieron estancias en UCI más prolongadas (30,4 días frente a 25,8 días; p < 0,05), sin diferencias en la mortalidad con respecto a las BP o B-CV producidas por otros microorganismos (29,3 % frente a 31,0%; p = 0,9056).
Finalmente, en 484 pacientes (1,4%) se identificaron 574 BS, que en 34 pacientes (7,0%) se debieron a un Acinetobacter spp. Estas bacteriemias se presentaron en pacientes más graves (APACHE II: 22,9 frente a 19,4; p < 0,05), del sexo femenino (52,9 % frente a 33,5%; p = 0,00349) y con enfermedad de base traumática (29,4 % frente a 15,6%; p = 0,0562). No hubo diferencias en la mortalidad con respecto a las BP o B-CV producidas por otros microorganismos (41,2 % frente a 40,7%; p = 0,9535).
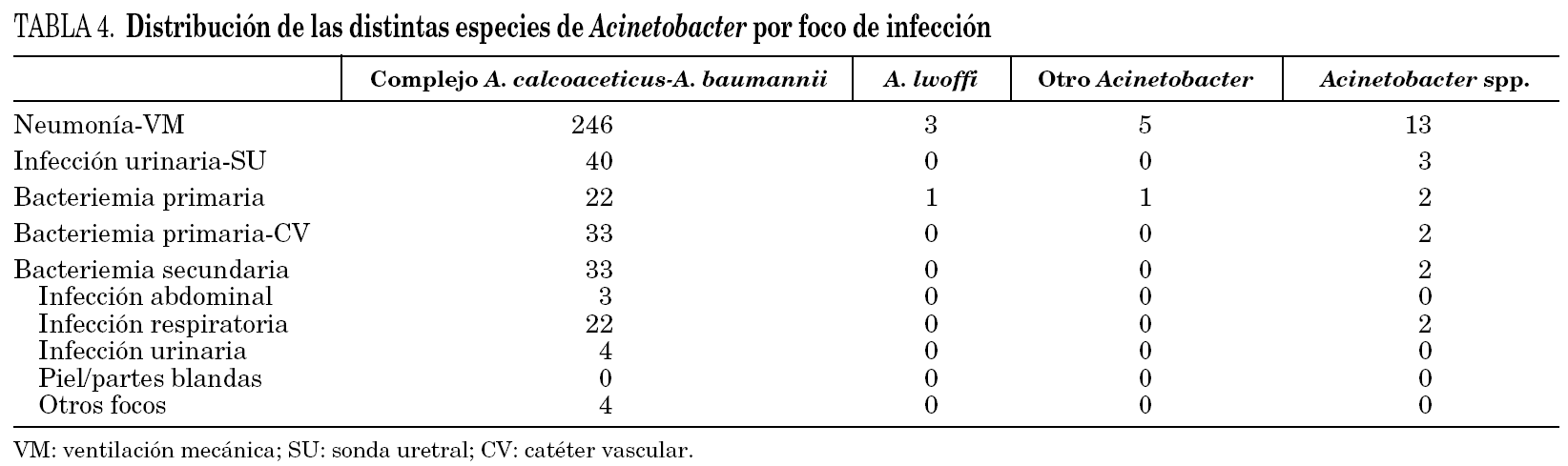
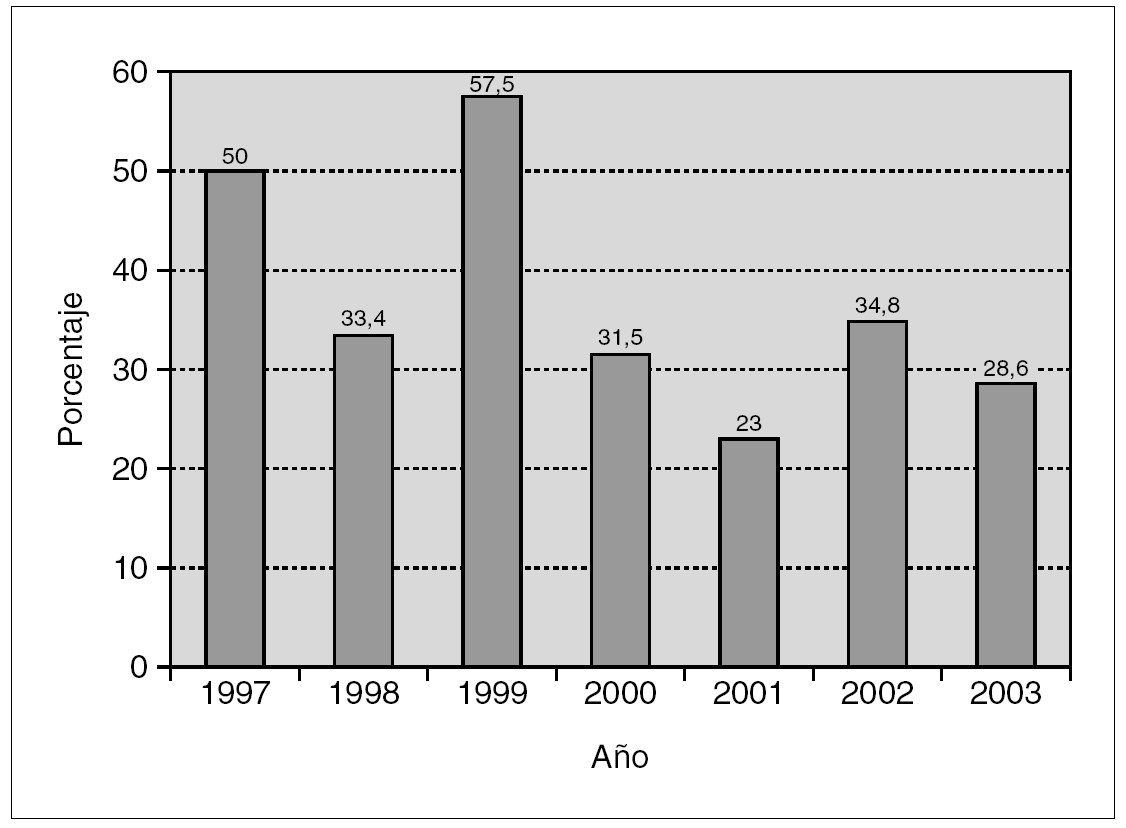
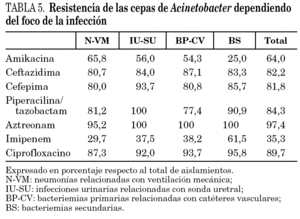
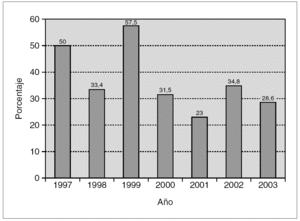
Los 406 aislamientos de Acinetobacter se identificaron a nivel de especie como complejo A. calcoaceticus-A. baumannii en 374 ocasiones (92,1%), A. lwoffi en 4 (1%) y como otros Acinetobacter en 6 casos (1,5%). En 22 ocasiones (5,4%) no se llegó a la identificación de la especie. En la tabla 4 se incluye su distribución por focos de infección. En 242 de estos aislamientos se realizaron estudios de sensibilidad (221 en A. baumannii, tres en A. calcoaceticus, dos en A. lwoffi, uno en A. haemolyticus y 15 en Acinetobacter spp.), y 85 de ellos (35,3%) fueron resistentes a IMP (tabla 5). En la figura 1 se incluye la evolución de los aislamientos resistentes a IMP a lo largo de los años. En el análisis bivariante no se han encontrado diferencias en las variables estudiadas entre los pacientes con cepas de Acinetobacter resistentes o sensibles a IMP. Asimismo, no se han detectado diferencias en la mortalidad intra-UCI (33,3 % frente a 30,0%; p = 0,7283) entre los pacientes con cepas resistentes y sensibles a IMP.
Figura 1. Evolución de los aislados de Acinetobacter spp. resistentes a imipenem en las infecciones relacionadas con dispositivos en pacientes ingresados en unidades de cuidados intensivos (expresado en porcentaje respecto al total de aislamientos de Acinetobacter spp.).
Discusión
Una de las principales aportaciones de nuestro estudio ha sido identificar a alguna especie de Acinetobacter como responsable de infecciones adquiridas en UCI en uno de cada 10 pacientes que desarrollan una infección relacionada con dispositivos invasivos. Las infecciones por este agente patógeno se han centrado especialmente en las N-VM.
Estos datos concuerdan con diferentes estudios epidemiológicos realizados en pacientes críticos en España. Así, en el estudio EPINE 1 con respecto a las infecciones nosocomiales de pacientes ingresados en UCI, en la década de 1990, se ha demostrado un incremento de los aislamientos de las diversas especies de Acinetobacter desde 3,7 (año 1990) hasta 10,7% (año 1999). En el estudio de prevalencia EPIIC 14, las diferentes especies de Acinetobacter ocuparon el quinto lugar entre los microorganismos responsables de infecciones nosocomiales en las UCI europeas. Por el contrario, los estudios epidemiológicos realizados por el National Nosocomial Infections Surveillance (NNIS) en Estados Unidos atribuyen un escaso protagonismo a las infecciones producidas por Acinetobacter, que alcanzan el 6% de los aislados en N-VM, el 1% de los aislados en infecciones urinarias y el 2% de los aislados en sangre 3,15. Estos valores son la mitad de los detectados en las UCI españolas.
Las razones de los cambios epidemiológicos entre diferentes países no están bien aclaradas, aunque es posible que factores estructurales y funcionales influyan en el mayor protagonismo de las infecciones por Acinetobacter spp. en los hospitales españoles. En un estudio (no publicado) se han comparado las características estructurales y funcionales de las UCI españolas dependiendo de la presencia, o no, de una tasa elevada de infecciones por Acinetobacter spp. 16. La presencia de deficiencias estructurales (ausencia de barreras físicas entre las camas, ausencia de sistemas de ventilación independiente, baja relación entre enfermeras/camas de UCI) y de problemas funcionales (ausencia de protocolos terapéuticos con antibióticos, presencia de estudiantes pre y posgrado) fueron factores con diferencias significativas entre las UCI con y sin problemas con Acinetobacter spp. 16.
Los factores de riesgo para la selección de Acinetobacter spp. se identificaron a partir de la descripción de brotes epidémicos y la realización de estudios de casos-controles 17-22. Se demostró la presencia de reservorios ambientales de estos microorganismos en respiradores mecánicos 17-20, colchones 21, humidificadores 22 y transductores de presión 19; se describieron las cadenas epidemiológicas en las que participaban los trabajadores sanitarios (transmisión cruzada) 17 y se identificaron pacientes o Servicios en los que el riesgo era mayor (UCI, quemados, recién nacidos) 17,22. Más recientemente, otros estudios han identificado otros factores, como son la utilización de antibióticos de amplio espectro (en especial cefalosporinas de tercera generación) 2,23-26, la presencia de infecciones previas 27 o el nivel de gravedad (mayor APACHE II) 27,28; y del mismo modo, identificaron reservorios en el tubo digestivo de los propios pacientes 29, en productos de la sangre 30 o en habitaciones de hidroterapia 30. Se demostró, asimismo, que el riesgo de colonización o/e infección por Acinetobacter spp. aumentaba en relación con la duración de la exposición a los factores de riesgo 19,21,23-31. En nuestro estudio, todos los pacientes eran portadores de uno o varios dispositivos invasivos y no se han podido analizar los antibióticos recibidos previamente a la aparición de la infección. No obstante, han podido identificarse como factores favorecedores de Acinetobacter spp. la patología de base médica o traumática y la duración de la estancia en UCI. Este último factor, seleccionado en la mayoría de estudios, permite afirmar que la estancia en esta unidad es el elemento fundamental para que se produzca una infección por Acinetobacter spp., relacionada con dispositivos invasivos.
En nuestro estudio, la mortalidad de los pacientes con infecciones por Acinetobacter spp. fue similar a la de los pacientes con infecciones producidas por otros microorganismos fuera cual fuera la localización de la infección, sin embargo fue muy superior a la de los pacientes que no desarrollaron infección alguna. La mortalidad atribuida a las infecciones por Acinetobacter spp. a partir de estudios de casos-controles oscila en torno al 25% 23,27,31; no obstante, otros estudios no han encontrado diferencias cuando los controles se seleccionan por el nivel de gravedad y la estancia previa a la aparición de la infección 7,32. Al analizar los diferentes factores que pueden influir en la evolución se ha identificado la influencia de la gravedad, de la edad y de la enfermedad de base en la mortalidad de los pacientes con infecciones por otros microorganismos al igual que en aquellos sin infecciones. Por el contrario, la mortalidad en los enfermos con infecciones por Acinetobacter spp. no se ha relacionado con la gravedad al ingreso en UCI, aunque esto podría relacionarse con el menor número de pacientes en el grupo de infecciones por Acinetobacter.
La resistencia de estos microorganismos identificados en nuestro estudio se mantiene elevada frente a la mayoría de antibióticos activos a priori, incluido el IMP. Estos datos coinciden con un reciente estudio multicéntrico español en el que se estudia la diversidad clonal y la sensibilidad a los diferentes antibióticos de A. baumannii9. En dicho estudio, el 41,2% de las cepas estudiadas fueron resistentes a IMP y además se identificaron 79 clones diferentes, lo cual indica la importante variabilidad entre los hospitales dependiendo del clon predominante. Este aspecto es fundamental para la elección de los antibióticos empíricos pues variarán dependiendo de la sensibilidad del clon dominante en cada UCI u hospital. En los casos de resistencia a IMP se han propuesto tratamientos alternativos basados en estudios in vitro con monoterapia (polimixina B, minociclina, sulbactam, rifampicina, doxiciclina) o con combinaciones de varios de ellos, aunque las evidencias clínicas de su eficacia son escasas. En modelos experimentales con ratones y conejos se ha demostrado la eficacia de la rifampicina, la doxiciclina y el sulbactam, mientras que la colistina no ha mejorado los resultados en el modelo de neumonía en ratones 33. No existen estudios aleatorizados con diferentes pautas terapéuticas en infecciones por A. baumannii resistente a IMP. Otros estudios no controlados sugieren que la ampicilina-sulbactam, la doxiciclina o la minociclina y la colistina pueden ser una alternativa aceptable para el tratamiento de las infecciones por Acinetobacter spp. resistentes a IMP 34-37. En este escenario son necesarios nuevos antibióticos, con actividad específica frente a las diversas especies de Acinetobacter, incluidas aquellas con resistencia a IMP. Uno de los nuevos antibióticos que en un plazo de tiempo relativamente corto va a formar parte del arsenal terapéutico hospitalario es la tigeciclina, representante de una nueva clase de antibióticos, las glicilciclinas, que añade a su amplio espectro frente a microorganismos grampositivos, gramnegativos, aerobios y anaerobios, una excelente actividad frente a microorganismos cada vez más problemáticos como Staphylococcus aureus resistente a meticilina, microorganismos gramnegativos portadores de betalactamasas de espectro extendido y A. baumannii multirresistente, incluidos los resistentes a IMP 38,39.
En síntesis, en nuestro estudio se ha demostrado el protagonismo de Acinetobacter spp. entre las infecciones más frecuentes y graves de pacientes críticos ingresados en UCI y se han identificado los factores de riesgo que permiten sospechar su presencia en una infección. La mortalidad es elevada e igual a la de los pacientes con infecciones por otros microorganismos, por lo que hay que considerarlo como un patógeno de elevada virulencia y plantear su cobertura empírica de forma precoz en aquellas UCI y situaciones clínicas en las que sea posible su presencia.
*Este estudio ha sido realizado en parte con la colaboración de los laboratorios Aventis (base de datos) y Wyeth, España (análisis de datos Acinetobacter spp.).