Mycobacterium simiae es una micobacteria ambiental de crecimiento lento, fotocromógena, descrita por primera vez en 1965. Se asocia raramente a infecciones humanas, posiblemente por su limitada patogenicidad, principalmente a infección pulmonar en pacientes inmunocompetentes de edad avanzada con enfermedad pulmonar subyacente, e infección diseminada en pacientes jóvenes inmunodeprimidos con sida. El cultivo microbiológico es necesario para confirmar la sospecha clínica, y las técnicas de secuenciación genética son indispensables para identificar la especie. El tratamiento de las infecciones por M. simiae es complicado por su multirresistencia a los fármacos antituberculosos y por la falta de correlación de los datos de sensibilidad in vitro con la respuesta in vivo. El tratamiento adecuado aún está por definir, pero debe incluir claritromicina asociada a otros antimicrobianos, como moxifloxacino y cotrimoxazol. Es posible que las infecciones por M. simiae estén infradiagnosticadas.
Mycobacterium simiae is a slow-growing photochromogenic environmental mycobacterium, first described in 1965. Rarely associated with human infections, possibly due to its limited pathogenicity, it mainly produces lung infection in immunocompetent elderly patients with underlying lung disease, and in disseminated infections in immunosuppressed young patients with AIDS. A microbiological culture is needed to confirm the clinical suspicion, and genetic sequencing techniques are essential to correctly identify the species. Treating M. simiae infections is complicated, owing to the multiple resistance to tuberculous drugs and the lack of correlation between in vitro susceptibility data and in vivo response. Proper treatment is yet to be defined, but must include clarithromycin combined with other antimicrobials such as moxifloxacin and cotrimoxazole. It is possible that M. simiae infections are undiagnosed.
Actualmente se reconocen varias especies de micobacterias no tuberculosas como causa de enfermedad en el ser humano, y su frecuencia ha experimentado un incremento significativo en los últimos años debido al aumento de pacientes inmunocomprometidos y, en parte, al avance significativo de los métodos de identificación taxonómica1–4. Estas micobacterias son ubicuas en la naturaleza y su papel como patógenas o colonizadoras es controvertido. A diferencia de Mycobacterium tuberculosis, estas no suelen transmitirse de persona a persona y en muchas ocasiones no tienen significado clínico. Entre ellas se encuentra Mycobacterium simiae, que en algunas áreas geográficas ha llegado a ser la segunda especie aislada entre las micobacterias no tuberculosas, después del complejo M. avium, y la predominante en muestras respiratorias1.
M. simiae fue descrita en 1965 como una nueva micobacteria aislada de monos salvajes de las especies Macacus rhesus y Cercopithecus ethiops, importados por Hungría desde India, que dieron la prueba de la tuberculina negativa5. Posteriormente, se examinaron 69 monos recién importados y se volvió a aislar de diversos órganos esta misma especie en 33 animales6. En 1971 se comunicó en Cuba el aislamiento de una nueva especie de micobacteria, denominada Mycobacterium habana, a partir de pacientes con enfermedad pulmonar7, la cual se comprobó que estaba relacionada bioquímicamente con el serotipo 1 de M. simiae8–10.
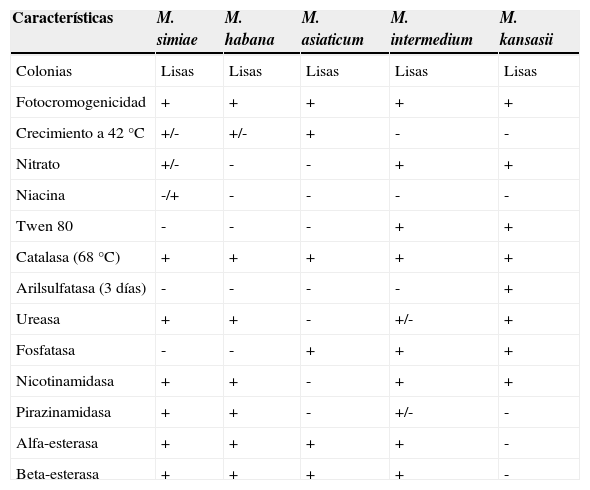
M. simiae se clasifica filogenéticamente en el mismo grupo que otras micobacterias atípicas tales como M. triplex, M. genavense, M. heidelbergense y M. lentiflavum11. Es una micobacteria de crecimiento lento que origina colonias lisas, débilmente fotocromógenas después de exposición prolongada a la luz. Su temperatura óptima de crecimiento es 37°C, pero puede crecer en un rango de temperaturas de 20-40°C10. Incluso puede comportarse como termófila, al igual que M. xenopi y el complejo M. avium, y sobrevivir y desarrollarse a una temperatura de 45°C12. El rango de pH adecuado para su crecimiento es de 5,5 a 7,513. Esta especie posee unas características bioquímicas específicas que la diferencian de otras micobacterias de crecimiento lento fotocromógenas, y es la única micobacteria no tuberculosa que puede producir niacina (tabla 1). Según las características de cultivo, el comportamiento bioquímico y por seroaglutinación, las cepas de M. simiae se pueden clasificar en 2 subespecies: las cepas del serotipo 1 producen ureasa y son variables en la producción de nicotinamidasa y pirazinamidasa, mientras que las del serotipo 2 solamente producen ureasa8,10.
Características fenotípicas y bioquímicas de Mycobacterium simiae y otras micobacterias de crecimiento lento fotocromógenas
| Características | M. simiae | M. habana | M. asiaticum | M. intermedium | M. kansasii |
|---|---|---|---|---|---|
| Colonias | Lisas | Lisas | Lisas | Lisas | Lisas |
| Fotocromogenicidad | + | + | + | + | + |
| Crecimiento a 42°C | +/- | +/- | + | - | - |
| Nitrato | +/- | - | - | + | + |
| Niacina | -/+ | - | - | - | - |
| Twen 80 | - | - | - | + | + |
| Catalasa (68°C) | + | + | + | + | + |
| Arilsulfatasa (3 días) | - | - | - | - | + |
| Ureasa | + | + | - | +/- | + |
| Fosfatasa | - | - | + | + | + |
| Nicotinamidasa | + | + | - | + | + |
| Pirazinamidasa | + | + | - | +/- | - |
| Alfa-esterasa | + | + | + | + | - |
| Beta-esterasa | + | + | + | + | - |
M. simiae se encuentra ubicua en la naturaleza y se ha aislado a partir de animales domésticos y salvajes, y de diversas fuentes ambientales como suelo, musgo, leche, alimentos y, sobre todo, del agua14–19, incluso del agua de consumo público, y de equipos médicos y quirúrgicos en brotes de pseudoinfección hospitalaria por agua del grifo contaminada20–22.
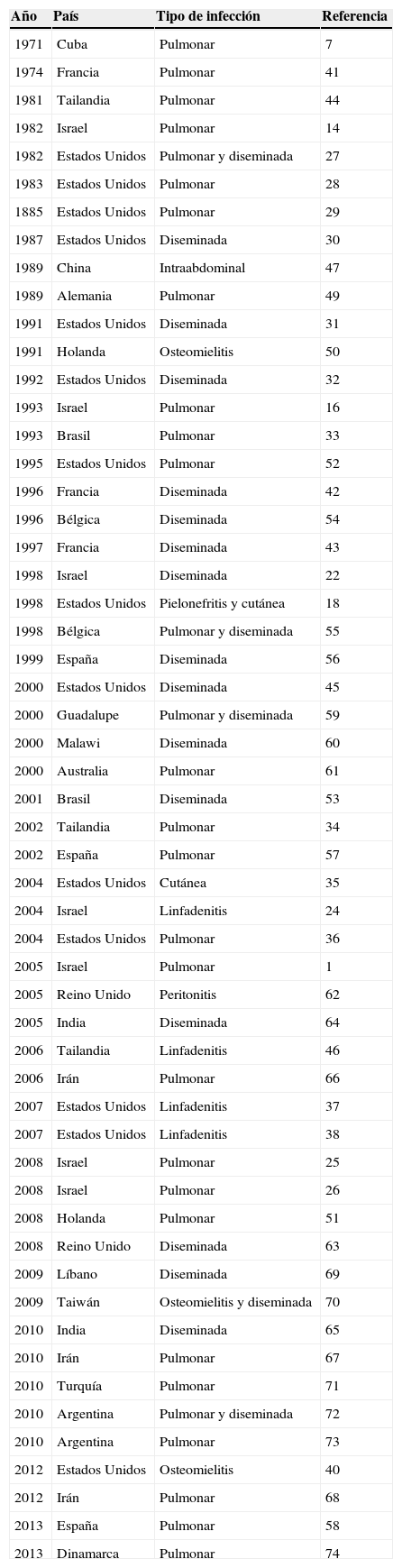
Desde el punto de vista epidemiológico M. simiae se localizó en un principio en 3 áreas geográficas: Israel1,14,16,23–26, Cuba7 y el suroeste de los Estados Unidos, principalmente Texas, Arizona y Nuevo Méjico18,27–40. No obstante, hasta la fecha, se ha descrito en varios países del mundo: Francia41–43, Tailandia44–46, China47, Alemania48,49, Holanda50,51, Brasil52,53, Bélgica54,55, España56–58, Guadalupe (Francia)59, Malawi60, Australia61, Reino Unido62,63, India64,65, Irán66–68, Líbano69, Taiwán70, Turquía71, Argentina72,73 y Dinamarca74 (tabla 2).
Descripción de aislamientos de Mycobacterium simiae de interés clínico en la literatura
| Año | País | Tipo de infección | Referencia |
|---|---|---|---|
| 1971 | Cuba | Pulmonar | 7 |
| 1974 | Francia | Pulmonar | 41 |
| 1981 | Tailandia | Pulmonar | 44 |
| 1982 | Israel | Pulmonar | 14 |
| 1982 | Estados Unidos | Pulmonar y diseminada | 27 |
| 1983 | Estados Unidos | Pulmonar | 28 |
| 1885 | Estados Unidos | Pulmonar | 29 |
| 1987 | Estados Unidos | Diseminada | 30 |
| 1989 | China | Intraabdominal | 47 |
| 1989 | Alemania | Pulmonar | 49 |
| 1991 | Estados Unidos | Diseminada | 31 |
| 1991 | Holanda | Osteomielitis | 50 |
| 1992 | Estados Unidos | Diseminada | 32 |
| 1993 | Israel | Pulmonar | 16 |
| 1993 | Brasil | Pulmonar | 33 |
| 1995 | Estados Unidos | Pulmonar | 52 |
| 1996 | Francia | Diseminada | 42 |
| 1996 | Bélgica | Diseminada | 54 |
| 1997 | Francia | Diseminada | 43 |
| 1998 | Israel | Diseminada | 22 |
| 1998 | Estados Unidos | Pielonefritis y cutánea | 18 |
| 1998 | Bélgica | Pulmonar y diseminada | 55 |
| 1999 | España | Diseminada | 56 |
| 2000 | Estados Unidos | Diseminada | 45 |
| 2000 | Guadalupe | Pulmonar y diseminada | 59 |
| 2000 | Malawi | Diseminada | 60 |
| 2000 | Australia | Pulmonar | 61 |
| 2001 | Brasil | Diseminada | 53 |
| 2002 | Tailandia | Pulmonar | 34 |
| 2002 | España | Pulmonar | 57 |
| 2004 | Estados Unidos | Cutánea | 35 |
| 2004 | Israel | Linfadenitis | 24 |
| 2004 | Estados Unidos | Pulmonar | 36 |
| 2005 | Israel | Pulmonar | 1 |
| 2005 | Reino Unido | Peritonitis | 62 |
| 2005 | India | Diseminada | 64 |
| 2006 | Tailandia | Linfadenitis | 46 |
| 2006 | Irán | Pulmonar | 66 |
| 2007 | Estados Unidos | Linfadenitis | 37 |
| 2007 | Estados Unidos | Linfadenitis | 38 |
| 2008 | Israel | Pulmonar | 25 |
| 2008 | Israel | Pulmonar | 26 |
| 2008 | Holanda | Pulmonar | 51 |
| 2008 | Reino Unido | Diseminada | 63 |
| 2009 | Líbano | Diseminada | 69 |
| 2009 | Taiwán | Osteomielitis y diseminada | 70 |
| 2010 | India | Diseminada | 65 |
| 2010 | Irán | Pulmonar | 67 |
| 2010 | Turquía | Pulmonar | 71 |
| 2010 | Argentina | Pulmonar y diseminada | 72 |
| 2010 | Argentina | Pulmonar | 73 |
| 2012 | Estados Unidos | Osteomielitis | 40 |
| 2012 | Irán | Pulmonar | 68 |
| 2013 | España | Pulmonar | 58 |
| 2013 | Dinamarca | Pulmonar | 74 |
Actualmente se considera a M. simiae un patógeno oportunista para animales y humanos, y en los últimos años se ha registrado un incremento en la frecuencia de aislamientos clínicos. Suele ser resistente a los fármacos antituberculosos de primera línea, y muchas cepas también lo son a otros antimicrobianos de uso habitual en el tratamiento de las micobacteriosis75.
El propósito de este trabajo es revisar los aspectos epidemiológicos, clínicos y microbiológicos de las infecciones por M. simiae, considerando las dificultades en cuanto a su diagnóstico y tratamiento.
Infecciones por Mycobacterium simiaeM. simiae es una micobacteria ambiental raramente asociada a enfermedad en humanos, posiblemente por su limitada patogenicidad. Aunque su hábitat natural y el mecanismo de transmisión a animales y seres humanos no están aún claramente establecidos, se sugiere que, al igual que otras micobacterias no tuberculosas, ingresa en el organismo por inhalación de aerosoles o ingestión a partir del agua, de otras fuentes ambientales y de animales y personas infectadas15,69,76,77. M. simiae coloniza el tracto respiratorio y el intestino, donde puede ser erradicada o multiplicarse y causar infección, dependiendo del estado inmunitario del huésped14,28,65,78–81. Se han descrito también brotes de pseudoinfección hospitalaria por agua del grifo contaminada21,22, porque M. simiae, al igual que muchas micobacterias no tuberculosas, contamina el agua y forma biopelículas que promueven su crecimiento y la protegen parcialmente de la acción de desinfectantes como cloro, glutaraldehído, formaldehído y derivados mercuriales12,82,83.
Es muy difícil valorar la implicación de M. simiae en un proceso infeccioso, dada su ubicuidad. Un aislamiento clínico solamente supone una colonización en muchas ocasiones. Se acepta que un paciente con enfermedad debe cumplir una serie de criterios establecidos que incluyen: sintomatología respiratoria, radiografía o tomografía axial computarizada de tórax anormales y aislamiento de la micobacteria en al menos 2 muestras respiratorias recolectadas en diferentes días, o si existe compromiso extrapulmonar o multiorgánico, el aislamiento en al menos una muestra de tejido o fluido normalmente estéril. Una encuesta a nivel nacional del Centro para el control y la prevención de enfermedades de Atlanta (CDC), concluyó que el 21% de los aislamientos de M. simiae representaba verdadera infección84, aunque en estudios posteriores, utilizando criterios diagnósticos más estrictos, se estimó que solamente en un 8-10% de los pacientes con cultivos positivos para M. simiae se podría considerar a esta micobacteria como responsable de la infección; en un 15% de casos sería probable que estuviera relacionado con la misma, y hasta en un 75% de ocasiones se trataría simplemente de una colonización18,23,33.
El espectro clínico de la infección por M. simiae, pues, todavía no es bien conocido, pero desde hace tiempo se reconoce a M. simiae como agente etiológico de micobacteriosis, particularmente en pacientes con factores predisponentes como tuberculosis pulmonar previa, silicosis, fibrosis quística, diálisis peritoneal, tratamiento con corticoides y, sobre todo, inmunodeficiencia, particularmente por VIH25,51,62,85,86. La enfermedad pulmonar y la infección diseminada son las más frecuentes. La enfermedad pulmonar suele ocurrir en pacientes de edad avanzada y factores pulmonares predisponentes, mientras que la infección diseminada, por el contrario, acontece en pacientes jóvenes con sida evolucionado. Solamente en ocasiones se ha implicado a M. simiae en otros tipos de infecciones: infección intraabdominal47, osteomielitis40,50,70, pielonefritis18, infección cutánea18,35, linfadenitis en la edad infantil24,37,38,46 y peritonitis62 (tabla 2).
Enfermedad pulmonar por Mycobacterium simiaeM. simiae se aísla con frecuencia como colonizador en muestras respiratorias de pacientes con lesiones pulmonares preexistentes, especialmente en áreas donde el microorganismo es prevalente14,18, pero también en enfermedad pulmonar de curso crónico con manifestaciones clínicas y radiológicas compatibles con tuberculosis. La enfermedad pulmonar ha sido descrita cronológicamente en 16 países: Cuba7, Francia41, Tailandia34,44, Israel1,14,16,25,26, Estados Unidos27–29,36,52, Alemania49, Brasil33, Bélgica55, Guadalupe (Francia)56, Australia61, España57,58, Irán66,68, Holanda51, Turquía71, Argentina72,73 y Dinamarca74 (tabla 2).
La enfermedad pulmonar ocurre, principalmente, en pacientes inmunocompetentes de edad avanzada (edad media aproximada de 60 años) y deterioro pulmonar por tuberculosis previa, silicosis o fibrosis quística4,18. La infección en la edad pediátrica es rara y se ha asociado a inmunodeficiencia73. No existen diferencias significativas en relación con el sexo, pero hay autores que describen una mayor incidencia en mujeres25,51, lo cual es poco común en las infecciones por micobacterias no tuberculosas. La enfermedad pulmonar obstructiva crónica (EPOC) y las bronquiectasias podrían ser factores predisponentes habituales; también el tabaquismo pero no la infección por VIH, lo que supone importantes implicaciones diagnósticas y terapéuticas, dada la mayor asociación de la infección de VIH con M. tuberculosis18,25,51,68,72,87. Se ha descrito infección pulmonar por M. simiae en pacientes infectados por el VIH con terapia antirretroviral de gran actividad (TARGA) y síndrome inflamatorio de reconstitución inmune (SIRI)58, y en pacientes con trasplante de pulmón especialmente susceptibles a la infección pulmonar por micobacterias no tuberculosas39,74. Un factor de riesgo importante puede ser la residencia en una determinada zona geográfica donde M. simiae sea más prevalente, como sucede en Israel y en el suroeste de Estados Unidos. Con frecuencia, los pacientes presentan enfermedades concomitantes y debilitantes como diabetes mellitus, cardiopatía isquémica y neoplasias malignas sólidas o hematológicas25,68.
La American Thoracic Society y la Infectious Diseases Society of America (ATS/IDSA) publicaron en el año 2007 un documento en el que se especifican los criterios clínicos y microbiológicos recomendados para el diagnóstico de la enfermedad pulmonar por micobacterias no tuberculosas (tabla 3)3. Aunque estos criterios están diseñados para el complejo M. avium, y para M. kansasii y M. abscessus, son los mismos que hay que aplicar para valorar la infección respiratoria por M. simiae, a pesar de que con ello se sobrevaloran las infecciones pulmonares por la indulgencia de los criterios microbiológicos. Aplicando estas recomendaciones se estima que solamente sería valorable un 30% de los aislamientos de muestras respiratorias, al igual que sucede con otras micobacterias no tuberculosas51,84. Para seleccionar mejor los pacientes que deberían recibir tratamiento antimicrobiano en la enfermedad pulmonar por M. simiae, y con el fin de evitar efectos adversos y costes innecesarios, se ha sugerido aumentar el número de cultivos positivos requeridos para el diagnóstico y precisar la confirmación histológica de la infección18,51.
Criterios clínicos y microbiológicos para el diagnóstico de enfermedad pulmonar por micobacterias no tuberculosas, según la American Thoracic Society y la Infectious Diseases Society of America (ATS/IDSA)
| Criterios clínicos (se deben cumplir ambos) |
| Síntomas pulmonares, lesiones nodulares o cavitadas en la radiografía de tórax, o tomografía axial computarizada con bronquiectasia multifocal con múltiples nódulos pequeños |
| Exclusión de otros diagnósticos apropiados |
| Criterios microbiológicos |
| Cultivo positivo de 2 muestras de esputo recogidas en días diferentes, o cultivo positivo de una muestra de secreciones obtenidas por broncoscopia (lavado broncoalveolar), o biopsia pulmonar con histopatología compatible (inflamación granulomatosa o presencia de bacilos ácido-alcohol resistentes) |
| Consulta con expertos cuando se trata de una micobacteria no tuberculosa infrecuente y generalmente contaminante ambiental |
| Seguimiento de los pacientes con sospecha de enfermedad respiratoria por una micobacteria no tuberculosa hasta establecer el diagnóstico definitivo o excluirlo |
| El diagnóstico de enfermedad pulmonar por una micobacteria no tuberculosa no precisa siempre la instauración de una terapia, cuya decisión debe basarse en el potencial riesgo o beneficio para cada paciente |
Fuente: Griffith et al.3.
Los síntomas clínicos más comunes en los pacientes con enfermedad pulmonar por M. simiae son tos productiva, disnea y malestar general con pérdida de peso, astenia y sudoración nocturna; a veces se observa hemoptisis y fiebre moderada. Los pacientes pueden presentar también derrame pleural y linfadenopatías. En la radiografía de tórax muestra infiltrados pulmonares y lesiones nodulares o cavitadas de predominio en los lóbulos inferiores y el lóbulo medio. En la tomografía axial computarizada suelen aparecer bronquiectasias multifocales con múltiples nódulos pequeños bilaterales y lesiones cavitadas uni o bilaterales. El estudio histológico evidencia inflamación granulomatosa o inespecífica18,25,26,51,68.
Es posible que la enfermedad pulmonar por M. simiae esté infradiagnosticada por las dificultades para identificar taxonómicamente esta especie, o que esté sobreestimada al aplicar los criterios diagnósticos de la ATS/IDSA. Para mejorar y concretar estos criterios son necesarios más estudios de series de casos.
Infección diseminada por Mycobacterium simiaeEn 1987 M. simiae fue implicado por primera vez en infección diseminada en pacientes con sida30; posteriormente, se han comunicado casos ocasionales de infección diseminada en este grupo de pacientes en varios países: Estados Unidos30–32,45, Francia42,43, Bélgica54,55, Israel22, España56, Guadalupe (Francia)59, Malawi60, Brasil53, India64,65, Reino Unido63 y Argentina72; la diseminación en pacientes inmunocompetentes es inusual27,69,70.
La infección diseminada es menos frecuente que la infección respiratoria y suele ocurrir en pacientes jóvenes (edad media aproximada de 35 años) con sida avanzado. En cuanto al sexo no existe un claro predominio en ninguno de ellos, pero hay autores que encuentran mayor prevalencia en hombres34,72.
La presentación de la infección diseminada por M. simiae se asemeja, en gran medida, a la producida por el complejo M. avium. Los principales síntomas y signos son la fiebre, escalofríos y debilidad, con o sin diarrea. Los pacientes suelen presentar una enfermedad definitoria de sida, un recuento de CD4 inferior a 50cél/mm3 y fiebre persistente sin foco localizado, con dificultad respiratoria y pérdida de peso. Algunos autores refieren infección diseminada mixta por M. simiae y el complejo M. avium23,27,30,31, y otros sitúan la infección en el contexto de la aparición de SIRI provocado por la TARGA63. La mortalidad en estos pacientes es alta a pesar de la instauración de tratamiento. Los pacientes responden mal a los fármacos antituberculosos habituales y mueren a los 6-8 meses del diagnóstico si no se les administra un tratamiento que incluya claritromicina, etambutol y fluoroquinolonas34,72.
Diagnóstico microbiológico de las infecciones por Mycobacterium simiaeEl diagnóstico clínico de infección por M. simiae es complicado y lento por lo infrecuente de esta etiología y porque la clínica es a menudo inespecífica. Para establecer el diagnóstico clínico es necesaria la confirmación microbiológica. No obstante, deben aplicarse rigurosos criterios para valorar cada aislamiento, ya que se trata de una micobacteria ambiental.
M. simiae puede aislarse de diversas muestras clínicas: secreciones respiratorias, sangre, médula ósea, orina, heces, piel y tejidos blandos, adenopatías, hueso y líquido cefalorraquídeo. En la infección pulmonar se aísla del esputo, del lavado broncoalveolar y de la biopsia pulmonar.
La tinción de Ziehl-Neelsen directa suele ser negativa en un 80% o más de las muestras. La positividad en muestras respiratorias se asocia significativamente con el cumplimiento de los criterios diagnósticos de la ATS/IDSA21,51. El cultivo microbiológico en el medio sólido de Löwenstein-Jensen tarda 2-6 semanas en mostrar colonias apreciables, pero resulta positivo mucho antes en el medio líquido de Middlebrook37,51,56. En muestras sanguíneas se aísla directamente de los frascos de hemocultivo para micobacterias88.
La identificación de M. simiae mediante métodos convencionales es dificultosa y puede conducir a confusión con otras especies similares, especialmente con M. avium-intracellulare, M. flavescens o M. scrofulaceum18. La prueba de la niacina puede ser positiva en algunas cepas, lo que puede llevar a una identificación errónea como M. tuberculosis, sobre todo en las colonias de pocos días de crecimiento que aún no han pigmentado8,37,89. En medio sólido crece formando colonias lisas, de color crema, amarillas tras exposición prolongada a la luz (fotocromógenas). Algunas cepas pueden crecer a 42°C. No hidroliza el tween 80; no produce nitratorreductasa ni arilsulfatasa ni fosfatasa; produce catalasa a 68°C, ureasa, nicotinamidasa, pirazinamidasa, alfa-esterasa y beta-esterasa.
Para asegurar una identificación correcta se ha recurrido al análisis del patrón de ácidos grasos, obtenido mediante cromatografía en capa fina y cromatografía gas-líquido de alta resolución (HPLC)52,54,90, pero estas técnicas no diferencian a M. simiae de algunas especies relacionadas, que presentan el mismo patrón lipídico, como son: M. genavense, M. lentiflavum y M. triplex18,91,92. También resulta de gran utilidad el empleo de la espectroscopia de masas con ionización por desorción con láser, asistida por una matriz y analizador de tiempo de vuelo (matrix-assisted laser desorption ionization time-of-flight [MALDI-TOF])93. Los métodos moleculares son, sin duda, los más idóneos. Las técnicas INNO-LiPA Mycobacteria v2 (Innogenetics, Bélgica) y Genotype Mycobacteria AS (HAIN Lifesciences, Alemania), basadas en una amplificación por reacción en cadena de la polimerasa (PCR) de la región espaciadora 16S-23S del ARN ribosómico, seguida de una hibridación reversa, son muy rentables51,94. Pero las técnicas de secuenciación genética han demostrado ser las de mayor fiabilidad para caracterizar taxonómicamente todas las nuevas especies de micobacterias no tuberculosas, incluida M. simiae11,67. La identificación mediante secuenciación de los genes que codifican el ARN ribosómico 16S y la proteína de shock térmico de 65 KDa (hsp65) es la recomendada; el análisis de los productos de amplificación por PCR y el análisis de los fragmentos de restricción (PRA) de un segmento del gen hsp65 permite llegar a diferenciar M. simiae de otras especies relacionadas filogenéticamente2,21,53,67,91,95,96. La tipificación molecular por electroforesis en gel de campo pulsado (PFGE) es igualmente de gran utilidad para la caracterización epidemiológica de brotes de infección21.
La sensibilidad in vitro de M. simiae se investiga por el mismo método que para otras micobacterias no tuberculosas, el de microdilución en medio líquido, siguiendo las recomendaciones del Clinical and Laboratory Standards Institute (CLSI)97. Este método permite determinar las concentraciones mínimas inhibitorias (CMI) frente a claritromicina, ciprofloxacina, moxifloxacina, cotrimoxazol, amikacina, linezolid y rifabutina.
Tratamiento de las infecciones por Mycobacterium simiaeEl tratamiento de las infecciones por M. simiae presenta grandes dificultades por la multirresistencia de esta micobacteria a los antimicrobianos eficaces para M. tuberculosis y la falta de correlación de los datos de sensibilidad in vitro con la respuesta in vivo4,42,68. Esta particularidad es común a muchas micobacterias no tuberculosas y determina la importancia de identificar correctamente las diferentes especies de este grupo implicadas en casos de infección, así como de realizar estudios de sensibilidad in vitro para instaurar la terapia antimicrobiana más apropiada98. En el caso de M. simiae la identificación a nivel de especie es fundamental, especialmente cuando la enfermedad se presenta en pacientes gravemente inmunodeprimidos, en los que puede tener una evolución rápida y fatal.
En M. simiae se ha descrito resistencia in vitro a los antituberculosos de primera línea (estreptomicina, isoniazida, rifampicina, etambutol, pirazinamida) y a rifabutina y capreomicina, y algún grado de sensibilidad a etionamida, protionamida, clofazimida, cicloserina, amikacina, cotrimoxazol, claritromicina y ciprofloxacino. La realidad, sin embargo, es que se han detectado altos índices de resistencia a claritromicina (hasta un 84%), ciprofloxacino (hasta un 72%) y protionamida (hasta un 24%)21,34,35,42,56,57,65,68.
Hay pocos datos sobre el tratamiento efectivo para las infecciones por esta especie tan resistente a los antimicrobianos. Es fundamental realizar un tratamiento combinado con varios fármacos y por un tiempo prolongado. Los nuevos macrólidos, las fluoroquinolonas, el etambutol, la clofazimina y los aminoglucósidos constituyen la base del tratamiento. Algunas cepas son sensibles in vitro a cotrimoxazol y linezolid, por lo que pueden utilizarse también para el tratamiento combinado, así como telitromicina, quinupristina y dalfopristina. Se han recomendado regímenes terapéuticos similares a los empleados para el complejo M. avium, que incluyan claritrominica, etambutol y rifabutina, ya que aún está por definir un tratamiento preciso específico. Las guías actuales recomiendan considerar tanto a M. simiae como a M. kansasii en cuanto a la realización de pruebas de sensibilidad97.
Probablemente, el tratamiento debe modificarse de acuerdo con los resultados del estudio de sensibilidad de cada aislamiento, pero se debe contemplar el empleo de claritromicina porque la experiencia clínica ha demostrado su efectividad, aunque nunca en monoterapia, sino asociada a otros antimicrobianos como etambutol y fluoroquinolonas3,4,18,23,58,68,73,99,100. La fluoroquinolona más reciente, moxifloxacino, parece tener actividad incluso frente a las cepas de M. simiae resistentes a ciprofloxacino72, por lo que recientemente se ha recomendado un tratamiento que incluya claritromicina, moxifloxacino y cotrimoxazol3, sin estar todavía definidas las pautas y la duración del tratamiento. Cuando se considera administrar un tratamiento la edad del paciente y las enfermedades concomitantes desempeñan un papel importante a la hora de decidir una actuación. Una de las dificultades más preponderantes es establecer quién debe recibir tratamiento. Los criterios de la ATS/IDSA y otras sociedades científicas indican la necesidad de aislamientos múltiples antes de tratar, pero en la práctica es habitual plantearse cómo manejar a pacientes con sintomatología y sin criterios estrictos de tratamiento. En los pacientes con enfermedad diseminada y sida se ha descrito éxito terapéutico con la TARGA combinada con un régimen de claritromicina, etambutol y ciprofloxacino58,63. El tiempo de tratamiento varía de 6-12 meses, según la respuesta clínica y bacteriológica.
La eficacia del tratamiento suele ser limitada. En pacientes con enfermedad pulmonar se ha referido una mortalidad del 17% en Holanda51 y hasta del 74% en Argentina72, y muchos de estos pacientes suelen ser diagnosticados erróneamente de tuberculosis multirresistente y tratados sin éxito4,68,69. Por otra parte, en la infección diseminada en pacientes con sida es primordial conocer con prontitud la implicación de M. simiae, porque ello supone un cambio de actitud terapéutica. Insistimos en que al ser esta especie especialmente resistente a los fármacos antituberculosos, su correcta identificación taxonómica permitirá valorar su trascendencia clínica, y el estudio de sensibilidad podrá orientar para instaurar una pauta terapéutica adecuada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.