La epidemiologia de la infección por Clostridium difficile ha sufrido importantes cambios en la última década, tanto en Estados Unidos como en Europa, con un incremento del número y severidad de los casos, peor respuesta clínica a los tratamientos habituales y mayor porcentaje de recaídas. Estos cambios fueron atribuidos a la aparición y diseminación de una cepa epidémica conocida como cepa B1/NAP1/027 que se convirtió en endémica en determinadas áreas, aunque también han sido descritos otros clones epidémicos (pe: los pertenecientes al ribotipo 078). Ante esta situación, las guías de diagnóstico y tratamiento de la enfermedad han sido recientemente actualizadas y nuevos métodos diagnósticos han sido implementados. El objetivo de esta revisión es presentar una revisión sobre la situación actual de la infección producida por Clostridium difficile, su patogenia, los métodos diagnósticos existentes, las opciones de tratamiento y las medidas de prevención y control de casos.
The epidemiology of Clostridium difficile infections (CDIs) has dramatically changed over the last decade in both North America and Europe, and it has become more frequent, more severe, more refractory to standard therapy, and more likely to relapse. These changes have been associated with the emergence of a “hypervirulent” strain known as BI/NAP1/027 which has become endemic in some areas, although, other hypervirulent genotypes (e.g. PCR ribotype 078) have also been described. To reduce the incidence of CDIs, the diagnostic guidelines on diagnosis and treatment methods have been recently updated. The aim of this review is to highlight the recent epidemiological data on CDIs and to provide an overview of the pathogenicity of the infection, diagnostic approaches, old and new treatment options, and current knowledge of infection control measures.
Clostridium difficile es un bacilo grampositivo esporulado, anaerobio estricto, asociado por primera vez a enfermedad en humanos en 1978, al identificarse como agente causal de la colitis seudomembranosa1,2. Causa una infección del colon que se manifiesta como un cuadro diarreico que aparece frecuentemente tras el uso de antimicrobianos y la consiguiente alteración de la flora de este órgano2. Estudios realizados en Estados Unidos, en Canadá y en Europa han demostrado un importante aumento de la incidencia de los casos de diarrea asociada a C.difficile (DACD) desde finales de los años noventa, convirtiéndose en una importante causa de morbilidad y mortalidad1,3-5. Actualmente C.difficile es la principal causa de diarrea en pacientes adultos hospitalizados, aunque también se han descrito episodios a nivel comunitario1. El objetivo de este artículo es presentar una revisión sobre la situación actual de la infección producida por C.difficile.
EpidemiologíaC.difficile forma parte de la flora fecal normal en el 1-3% de los residentes de la comunidad y en más del 20% de los adultos hospitalizados2,4. Se encuentra en las heces de pacientes sintomáticos y asintomáticos y el contagio se produce, a menudo, dentro del hospital en un entorno contaminado por esporas, por lo que el riesgo aumenta en proporción a la duración de la hospitalización2,4. Es común que los recién nacidos sanos sean portadores asintomáticos de C.difficile en heces, con tasas que rebasan el 50% en los 6primeros meses de vida, pero es rara la enfermedad en esta población, probablemente porque su intestino no expresa los receptores para la toxina2. C.difficile afecta especialmente a pacientes mayores de 65años (tasas de incidencia de hasta 228casos/100.000habitantes) internados en hospitales y centros geriátricos, en quienes, debido a la coexistencia de diferentes comorbilidades, el consumo de antibióticos es muy elevado1,2,4. También se han descrito brotes de DACD que afectan a grupos de población considerados como de riesgo bajo (jóvenes de la comunidad, puérperas, niños mayores de 2años, etc.)1.
Desde el punto de vista epidemiológico se han producido cambios importantes desde finales de los años noventa en la incidencia de la enfermedad producida por C.difficile. Entre los años 2000 y 2005 se duplicaron los casos de DACD en los hospitales estadounidenses de agudos6, y algunos hospitales de Montreal (Quebec) reportaron tasas 4veces superiores en comparación con las encontradas en el año 20007. Estos cambios fueron atribuidos a la aparición y la diseminación de una cepa epidémica conocida como cepa B1/NAP1/027 (por presentar el patrón de restricción [REA] tipo B1, el patrón de campo pulsado NAP1, pertenecer al ribotipo 027 y tener, además, el toxinotipoiii), que se encontró en Estados Unidos, en Canadá y en algunos países europeos, como el Reino Unido, Bélgica, Alemania y Holanda1,5,8. Este clon de C.difficile B1/NAP1/027 se estudió en profundidad, observando que presentaba una mayor virulencia, asociada a la expresión de la toxina binaria y a la mutación en el gen regulador tcdC, y mostraba además resistencia a fluoroquinolonas5. La diseminación de esta cepa epidémica condicionó un incremento del número de fracasos terapéuticos y una mayor mortalidad asociada a esta patología (del 6 al 14% de los casos a los 30días, aunque puede alcanzar el 30% en los casos de megacolon tóxico)1,7. De todos modos, el incremento de las infecciones por C.difficile no puede atribuirse solo a este clon, ya que en Europa, dependiendo del país, se han descrito otros, como los pertenecientes a los ribotipos 001, 053 y 106, o el 078, que posee un mecanismo similar de hiperproducción de toxinas y, por tanto, también es capaz de producir brotes de la enfermedad9-11. En España existen pocos datos sobre los ribotipos de C.difficile circulantes. En el contexto de un estudio realizado durante el año 2009 en la ciudad de Barcelona en el que participaron 17hospitales, se realizó el ribotipado de 147 cepas y se observaron 48 ribotipos diferentes, siendo los más comunes el 241 (26%), el 126 (18%) y el 078 (7%), sin que se detectara ningún 027 (datos propios, no publicados).
Patogenia de la diarrea asociada a Clostridium difficileLa infección por C.difficile es consecuencia de la ingestión de esporas de C.difficile toxigénico que resisten la acción del ácido gástrico, germinan en el intestino delgado y colonizan el colon, donde elaboran diversas toxinas que inician una serie de fenómenos que culminan con la pérdida de la función de barrera que poseen las células epiteliales, la aparición de diarrea y la formación de seudomembranas2. Estas seudomembranas se manifiestan como placas amarillo-blanquecinas de 1-2mm de diámetro que al evolucionar la enfermedad se unen hasta confluir en toda la pared del colon. En el estudio microscópico las seudomembranas contienen leucocitos necróticos, fibrina, moco y restos celulares, y la mucosa subyacente está infiltrada por neutrófilos.
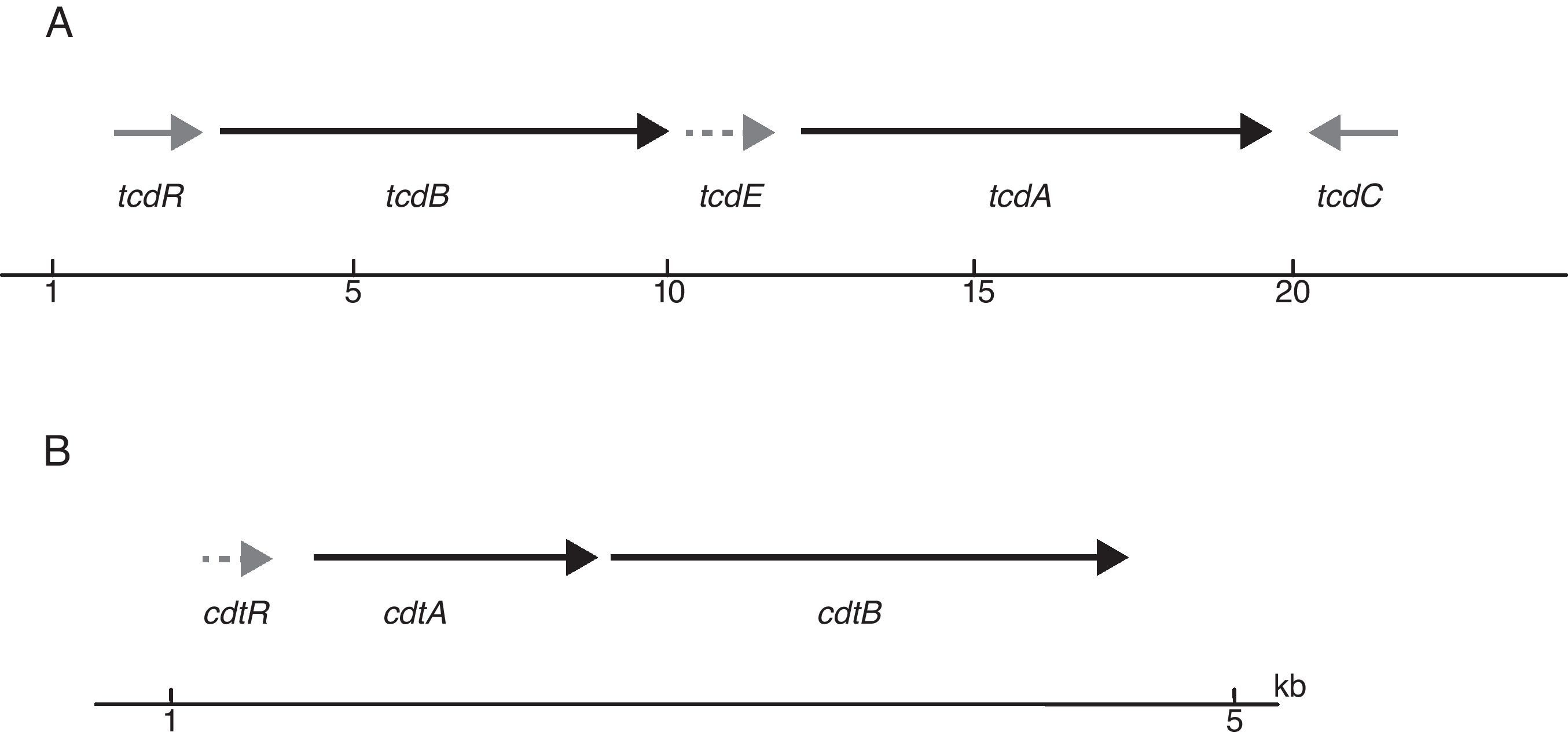
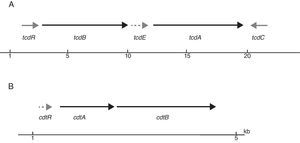
Todas las cepas de C.difficile toxigénico presentan un locus de patogenicidad (PaLoc) que mide unos 19,6kb. Este locus está formado por 5genes (tcdA, tcdB, tcdC, tcdE y tcdR) (fig. 1). Los genes tcdA y tcdB codifican dos toxinas TcdA y TcdB12 (toxinas A y B, respectivamente), ambas responsables de la patogenicidad de C.difficile. El gen tcdR actúa como regulador positivo de la expresión de tcdA y tcdB, mientras que tcdC actúa como regulador negativo, evitando la expresión de todo el PaLoc. Finalmente, tcdE codifica una holina que se encargara de hacer poros en la membrana citoplasmática que permite la liberación de las toxinas12. Tanto TcdA como TcdB son citotoxinas con actividad glucosiltransferasa, causando la interrupción de las fibras de actina del citoesqueleto que resulta en una disminución de la resistencia transepitelial, la acumulación de líquido y la destrucción del epitelio intestinal11,13. Su mecanismo de acción aún no está del todo dilucidado. Las toxinas, tras unirse a sus receptores, son introducidas en las células diana mediante endocitosis. Dentro de estos endosomas, en un ambiente ácido, ocurre la digestión autoproteolítica por la que la región N-terminal (con el dominio catalítico) se separa del resto de la toxina. Al parecer solo esta región catalítica es la que será liberada al citosol y ejercerá su función incorporando glucosa a determinadas guanosin trifosfatasas (GTPasas) como las proteínas Rho y Rac, entre otras. Estas GTPasas se encargan, entre otras cosas, de la regulación de determinados procesos de señalización que están implicados en funciones relacionadas con el mantenimiento de la barrera epitelial y las interacciones intercelulares (formación del citoesqueleto), además de intervenir en la fagocitosis, la producción de citoquinas, etc. Fruto de todo este proceso, las células epiteliales se desestructuran separándose entre ellas e incluso muriendo y, por lo tanto, facilitando la migración de neutrófilos hacia el intestino y contribuyendo a la respuesta inflamatoria típica de la colitis14. Finalmente, cabe mencionar que, además, TcdA estimula la liberación del factor de necrosis tumoral de macrófagos activados, así como la producción de citocinas14.
A) Esquema del locus de patogenicidad (PaLoc) que contiene los genes que codifican las 2 toxinas tcdA y tcdB (flechas negras), los genes reguladores tcdR y tcdC (flechas grises) y la holina tcdE (flecha punteada). B) Región que codifica la transferasa de Clostridium difficile, también conocida como toxina binaria.
Además del mencionado PaLoc, algunas cepas de C.difficile son portadoras de una transferasa (C.difficile transferase: CDT) denominada también toxina binaria, formada por 2subunidades (CDTa y CDTb), que está implicada en una mayor toxicidad de la cepa. Los genes que codifican esta toxina se encuentran en el locus Cdt (CdtLoc) detallado en la figura 1. El mecanismo patogénico de dicha toxina aún no está del todo dilucidado, pero parece que interviene incrementando la adhesibilidad de las cepas de C.difficile y además actúa a nivel del citoesqueleto de la célula provocando una mayor pérdida de líquidos12. Así, las cepas portadoras de toxina binaria se han asociado a una mayor virulencia15.
C.difficile presenta, además, muchos otros factores de patogenicidad, como algunas proteínas de superficie implicadas en su adhesión y estimulación del proceso inflamatorio, u otras implicadas en la unión a las células epiteliales intestinales y cuya expresión se ve afectada por determinados antibióticos como la ampicilina y la clindamicina, pero sin duda todas ellas son de menor interés que las mencionadas previamente12,16.
Inicialmente se pensaba que los individuos colonizados por C.difficile estaban expuestos a un mayor riesgo de presentar diarrea, pero el resultado de diferentes estudios prospectivos han demostrado que los pacientes colonizados en realidad tienen un riesgo menor de presentar la enfermedad17. Tras la exposición del individuo a C.difficile toxigénico, la respuesta de anticuerpos IgG en el suero a la toxinaA de C.difficile por parte del hospedador es el factor que determina qué pacientes presentarán diarrea y cuáles serán únicamente portadores asintomáticos18. Las concentraciones de IgG frente a la toxinaA de C.difficile serán más elevadas en personas que se tornan portadores asintomáticos que en las que presentan diarrea, y en los pacientes que presentan diarrea un mayor valor de antitoxina A se correlaciona con un menor peligro de que reaparezca la enfermedad17,18.
Factores de riesgo de la aparición de diarrea asociada a Clostridium difficileEl objetivo de un gran número de los trabajos realizados hasta la fecha ha sido identificar y analizar los diferentes factores de riesgo asociados a la aparición de DACD. Así, se conoce que el consumo reciente de antibióticos, la edad superior a 65años, la estancia hospitalaria prolongada, la mayor severidad de la enfermedad de base del paciente, el uso de nutrición enteral por sonda nasogástrica, el padecer una enfermedad inflamatoria intestinal, el recibir tratamiento con quimioterapia o el haber presentado un episodio previo de DACD son factores de riesgo asociados a esta entidad1,2,4. Existen datos no concluyentes respecto al posible efecto favorecedor de los laxantes, los antiinflamatorios no esteroideos y los fármacos inhibidores de las bombas de protones1,19.
La infección suele ocurrir después de la administración de antibióticos en el 90% de los casos1,2. La clindamicina, la ampicilina y las cefalosporinas de tercera generación fueron los primeros antibióticos relacionados con la DACD, mientras que las fluoroquinolonas son los fármacos más recientemente implicados en los brotes epidémicos nosocomiales4,20. Sin embargo, todos los antibióticos —y especialmente los de acción anaerobicida— presentan riesgo de desencadenar la enfermedad por C.difficile4,21. El riesgo aumenta cuando se combinan diferentes antibióticos y con tratamientos más prolongados1,4,21. También se ha descrito colitis seudomembranosa sin relación con los antibióticos y tras la administración de quimioterapia u otros inmunosupresores1,4.
Manifestaciones clínicasEl cuadro clínico es amplio y puede variar desde el portador asintomático a los casos de enfermedad fulminante2,4. La diarrea, síntoma fundamental, suele aparecer coincidiendo con un tratamiento antibiótico, aunque puede hacerlo semanas después de su retirada, e incluso en ocasiones no existe este antecedente2,4,18. Las heces casi nunca muestran sangre aunque sí mucosidad, y su consistencia va de blanda o no forme hasta acuosa o mucosa19. Los signos clínicos y de laboratorio son fiebre, dolor abdominal, leucocitosis importante, hipoalbuminemia y aumento de la proteína C reactiva2,18,19. La infección grave puede cursar con íleo adinámico (identificado en las radiografías de abdomen o tomografía computarizada), se interrumpe la expulsión de heces y esto motiva que a menudo no se considere la posibilidad de que el paciente presente una DACD2,18,19,22. Un dato que orienta hacia la presencia de la enfermedad es la leucocitosis no explicada (superior a 15.000×109células/l) con aparición de neutrófilos no segmentados19. Los enfermos en esta situación están expuestos a un elevado riesgo de complicaciones, como perforación intestinal y megacolon tóxico que puede evolucionar a sepsis grave y fallecimiento del paciente2,18,19.
Una vez solucionado el episodio inicial, la diarrea por C.difficile puede reaparecer en el 15-30% de los casos tras el primer episodio, y esta recaída puede manifestarse como un cuadro clínico severo asociado a íleo o perforación intestinal hasta en el 11% de los casos1,4. Los pacientes con una primera recurrencia tienen altas posibilidades (33-60%) de padecer nuevas recurrencias19,22,23. Generalmente las recaídas ocurren durante el primer mes tras el tratamiento, aunque pueden observarse hasta transcurridos más de 4meses19,22,24. Son más frecuentes en pacientes mayores de 65años y en los que siguen hospitalizados después del episodio inicial de DACD23,24. Otros factores de riesgo relacionados con la aparición de recurrencias son la persistencia de la alteración de la flora del colon (p.ej., por continuar la administración de tratamiento antibiótico durante y/o después del episodio), la gravedad del episodio inicial, la respuesta inmune inadecuada frente a la toxinaA de C.difficile, el haber sufrido episodios previos de la enfermedad, polimorfismos en el gen promotor de la interleucina8 o continuar con la administración de medicación antiácida concomitante1,23,24. Las recidivas de la enfermedad pueden ser causadas por la misma cepa inicial de C.difficile o por una nueva cepa18,24. La recaídas por la misma cepa suelen producirse en los primeros 10-14días tras la suspensión del tratamiento dirigido frente a C.difficile, aunque se han descrito hasta 4 meses después, y se cree que son debidas a la germinación de esporas acantonadas de C.difficile y no por el desarrollo de resistencias bacterianas al tratamiento antibiótico utilizado23,24. Las reinfecciones suelen ser más tardías (sobre las 4semanas después de haber suspendido el tratamiento) y se deben a reexposición del paciente que permanece en un entorno hospitalario y en el que persisten los factores de riesgo que motivaron el episodio inicial24. El diagnóstico precoz y el tratamiento adecuado de esta patología, especialmente en el caso de recidivas, son de extraordinaria importancia para mejorar el pronóstico de la enfermedad.
DiagnósticoEl diagnóstico se basa en una combinación de criterios clínicos y datos de laboratorio: a)diarrea (3evacuaciones o más diarias durante más de 24h) sin otra causa identificable; además, b)evidenciar la presencia de las toxinasA y/o B en heces, o c)la identificación de seudomembranas en el colon mediante visión directa por colonoscopia. La visualización endoscópica de seudomembranas en la luz del colon, aunque es patognomónica, no se utiliza por el riesgo de perforación2. La presencia de seudomembranas refleja una forma más avanzada de la enfermedad y se identifica solo en el 50% de los sujetos con DACD; por tanto, la negatividad de la colonoscopia no descarta la presencia de enfermedad por C.difficile19.
El diagnóstico diferencial de la DACD se realizará con otras entidades que cursen con síntomas intestinales (colitis isquémica) y con diarrea asociada a otros fármacos como antiácidos, laxantes o citostáticos. La adquisición de otras gastroenteritis bacterianas es poco frecuente en el entorno hospitalario y suelen presentarse como brote epidémico a partir de alimentos infectados y transmitirse de paciente a paciente por contacto directo o indirecto. También se han descrito brotes de diarrea nosocomial por norovirus durante el invierno y por adenovirus de los serogrupos 40 y 41 en niños menores de 2años y en pacientes inmunodeprimidos (trasplantados de médula ósea).
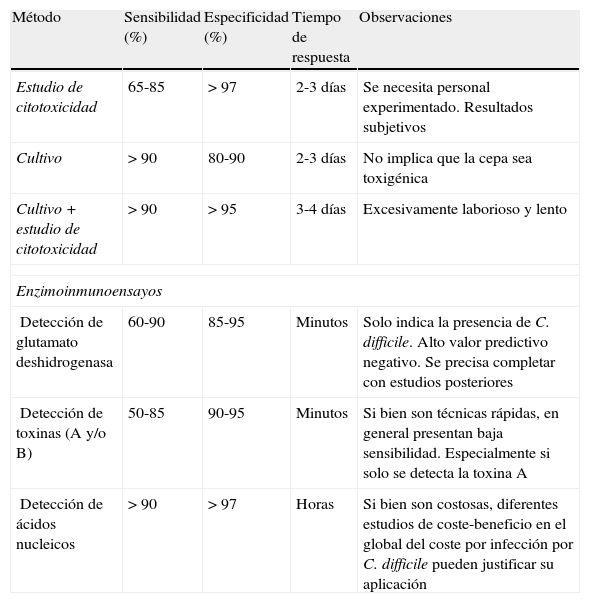
El método de referencia para el diagnóstico de DACD son los estudios de la citotoxicidad de las heces en cultivo celular25. Esta prueba consiste en inocular un filtrado de las heces en diferentes líneas celulares, siendo la más utilizada la de fibroblastos humanos (MRC5). Si en las heces —y por lo tanto en el filtrado— hay toxinas (principalmente TcdB), a las 48 o 72h se observará un efecto citopático en las células. Esta es una técnica sensible aunque poco específica, dado que la toxicidad también se puede observar por otros factores no relacionados con las toxinas de C.difficile. La especificidad de este efecto citopático se incrementará realizando la neutralización con antitoxinas específicas25. Este método, si bien es considerado como el de referencia, tiene menor sensibilidad que el aislamiento de C.difficile por cultivo26. Para el aislamiento de C.difficile a partir de las heces se dispone de medios selectivos como el agar fructosa-cicloserina-cefoxitina (agar CCFA), medios cromogénicos como ChromID™ C.difficile (bioMérieux) y medios no selectivos (agar Brucella o el agar Schaeldler enriquecidos con 5% de sangre de carnero, vitaminaK y hemina), todos ellos obviamente incubados en anaerobiosis entre 48 y 72h. Independientemente del medio utilizado y con el fin de incrementar la sensibilidad, se puede hacer un pretratamiento con alcohol absoluto, homogeneizando volúmenes iguales de muestra durante 30-60min, o mediante choque térmico de 10min a 80°C25. Las colonias de C.difficile en los medios mencionados suelen ser de unos 4mm de diámetro, circulares, generalmente lisas, y además hacen un olor muy característico a heces de caballo debido a la producción de p-cresol. En la tinción de Gram de estas colonias se observan bacilos grampositivos que pueden presentar esporas ovales subterminales. Posteriormente se confirmará la identificación mediante pruebas bioquímicas como la L-prolina aminopeptidasa o la detección de glutamato deshidrogenasa25. Como se ha comentado, el cultivo incrementa la sensibilidad pero tiene poca especificidad debido a la presencia de cepas de C.difficile no toxigénicas. Por esto, una vez se ha aislado C.difficile se debe confirmar que se trata de una cepa toxigénica mediante estudio de citotoxicidad. Si bien el uso combinado del cultivo y el estudio de citotoxicidad presentan una elevada sensibilidad y especificidad, adolecen de un considerable retraso a la hora de obtener resultados (hasta 4días). Es por ello que se han desarrollado una gran variedad de técnicas que intentan agilizar este proceso (tabla 1).
Aproximaciones metodológicas al diagnóstico de la infección por Clostridium difficile toxigénico
| Método | Sensibilidad (%) | Especificidad (%) | Tiempo de respuesta | Observaciones |
| Estudio de citotoxicidad | 65-85 | > 97 | 2-3 días | Se necesita personal experimentado. Resultados subjetivos |
| Cultivo | > 90 | 80-90 | 2-3 días | No implica que la cepa sea toxigénica |
| Cultivo+estudio de citotoxicidad | > 90 | > 95 | 3-4 días | Excesivamente laborioso y lento |
| Enzimoinmunoensayos | ||||
| Detección de glutamato deshidrogenasa | 60-90 | 85-95 | Minutos | Solo indica la presencia de C.difficile. Alto valor predictivo negativo. Se precisa completar con estudios posteriores |
| Detección de toxinas (A y/o B) | 50-85 | 90-95 | Minutos | Si bien son técnicas rápidas, en general presentan baja sensibilidad. Especialmente si solo se detecta la toxina A |
| Detección de ácidos nucleicos | > 90 | > 97 | Horas | Si bien son costosas, diferentes estudios de coste-beneficio en el global del coste por infección por C.difficile pueden justificar su aplicación |
Estos métodos alternativos al cultivo y disponibles actualmente se pueden agrupar en los que se basan en métodos inmunoenzimáticos (EIA) y que evidencian la presencia de estructuras de C.difficile y/o de sus toxinas, y la detección de secuencias nucleotídicas específicas de C.difficile y/o de los genes que codifican sus toxinas.
Técnicas inmunoenzimáticasLos primeros ensayos que se diseñaron, hace ya más de 25años, iban dirigidos a la detección de la TcdA. Tras la detección de cepas toxigénicas que no producían TcdA y sí TcdB, todos los preparados comerciales se basaron en la detección de TcdB y algunos, además, de TcdA. En general, todas las técnicas comerciales basadas en EIA presentan una baja sensibilidad y no se consideran muy buenas alternativas27,28. Planche et al.27 y Eastwood et al.28 realizaron una exhaustiva revisión de la literatura para establecer la utilidad de las técnicas de EIA para la detección de toxinas de C.difficile, y concluyeron que si bien presentaban en general una buena especificidad, prácticamente todas presentaban una baja sensibilidad, por debajo de lo que consideraban aceptable (90%), aunque con una gran variabilidad dependiendo del estudio (tabla 1). Sin duda, la utilización de estas técnicas ha sido muy extensa por ser económicas y fáciles de aplicar en la rutina de la mayoría de laboratorios, además de dar resultados en menos de una hora. Sin embargo, su baja sensibilidad ha llevado a plantearse la necesidad de realizar varios estudios en un mismo paciente cuando los resultados eran negativos y se tenía una elevada sospecha clínica, aunque no se ha llegado a ningún consenso al respecto29. Ante esta falta de sensibilidad, la complejidad de los métodos de referencia, la necesidad de disponer de resultados rápidos y las cuestiones económicas ligadas no solo a la metodología sino también a la complejidad clínica (aislamiento, tratamiento, difusión, etc.) que conlleva, se han venido planteando últimamente un gran número de algoritmos diagnósticos basados en una primera técnica rápida lo más sensible posible, seguida de una segunda o tercera técnica más específica.
Dado que, como se ha mencionado, la detección de TcdA y/o TcdB no presentan una buena sensibilidad, se ha propuesto como técnica de cribado la detección de glutamato deshidrogenasa (GDH)30. La GDH es una enzima de la pared celular de C.difficile que se produce en mucha mayor cantidad que las toxinas31. Es por ello que su sensibilidad y el valor predictivo negativo (VPN) son muy altos. Es una técnica poco específica, dado que la GDH se encuentra tanto en cepas toxigénicas como en cepas no toxigénicas, por lo que un resultado positivo ha de confirmarse por detección de las toxinas26,30,31. Así, se planteó realizar un cribado inicial a través de la detección de la GDH y, en caso de resultados positivos, proceder a otras pruebas como el cultivo o la detección del efecto citopático26,29-32. Dado que esto retrasaba considerablemente el diagnóstico, también se planteó el uso de las técnicas de EIA para detectar las toxinas, pudiéndose detectar a la vez GDH y TcdA y/o TcdB. En este caso, dada la buena sensibilidad y el elevado VPN de la GDH, los negativos se descartan y, dada la elevada especificidad de la detección de toxina, si la GDH y las TcdA y/o TcdB son positivas se consideran positivas para C.difficile toxigénico, requiriéndose solo alguna otra técnica para estudiar las muestras positivas solo para GDH o TcdA y/o TcdB26,27,29-32. Cabe destacar que la sensibilidad de cada técnica de EIA parece que puede variar en función del ribotipo de C.difficile predominante26,33,34. Así, por ejemplo, la prueba de la GDH parece presentar una mejor sensibilidad para cepas del ribotipo 027 que para el resto de ribotipos33,34.
Técnicas basadas en la detección de ácidos nucleicosLa baja sensibilidad de las técnicas de EIA para detectar las toxinas y la necesidad de generar resultados rápidos han motivado el desarrollo de diferentes preparados comerciales basados en la detección de los genes que codifican las toxinas de C.difficile. Si bien estas técnicas moleculares presentan una muy buena sensibilidad, también tienen inconvenientes. Uno sin duda es el precio, que en una población con una baja prevalencia de infección puede ser elevado, y otro es que detectan el gen y no la toxina. Esto, unido a su excelente sensibilidad, ha motivado una discusión sobre la especificidad de estas pruebas, dado que detectan portadores asintomáticos34-36. En este sentido hay autores que sugieren estudios mediante PCR cuantitativa para correlacionar la carga bacteriana y la producción de toxina. Para ello se basan en que las muestras que resultaron negativas para la detección de la toxina (bien por EIA o por estudios de citotoxicidad) presentaban entre 10 y 104 menos C.difficile que las positivas (calculados mediante la PCR cuantitativa). Lo que no hay duda es que estas técnicas aportan un elevado valor predictivo negativo35,36. Los diferentes preparados comerciales disponibles en el mercado, si bien presentan todos ellos las características mencionadas, se diferencian en cuanto a la información que dan y a la manipulación requerida. Mientras unos detectan solo el gen tcdA, otros exploran el gen tcdB y el tcdA; además, otros exploran otras toxinas como la binaria y/o alteraciones en la región reguladora de la expresión de las toxinas. Finalmente, cabe mencionar que otros preparados permiten detectar la resistencia a fluoroquinolonas además de precisar la mutación del tcdC. Otro aspecto a tener en cuenta, como se ha mencionado, es la manipulación requerida y la experiencia necesaria por parte del personal del laboratorio.
Tras repasar los diferentes sistemas disponibles para la detección de C.difficile, queda por definir cuál es el mejor para ser aplicado en la rutina diagnóstica de los laboratorios de microbiología. La selección de uno u otro método para conseguir la máxima sensibilidad y especificidad con el mínimo coste y la mayor rapidez es un punto sujeto a amplias discusiones y sobre el cual no existe una recomendación única26,29-32,34-38. Cada servicio hace su propia aproximación utilizando uno o varios sistemas en función de su disponibilidad, infraestructura, presupuesto, etc. En un estudio de 2011 se evidencia que el 95% de 103 centros españoles utilizan técnicas de EIA, siendo esta la única herramienta en el 80% de los centros39. El 10% de los centros combinan la detección de toxina por EIA y el cultivo39, el 16% de los centros realizan estudios de citotoxicidad en cultivo celular, y solo el 2% utilizan en su algoritmo diagnóstico la PCR39.
En el servicio de microbiología del Hospital de la Santa Creu i Sant Pau se realizó un estudio económico comparando 3algoritmos diagnósticos diferentes: a)utilización de un único sistema de EIA para detectar TcdA y TcdB; b)detección de GDH y toxinas (TcdA y TcdB) y, en los casos discrepantes, realizar detección de ácidos nucleicos (XpertC.difficile Cepheid GeneXpert [Cepheid]), y c)utilizar únicamente técnicas moleculares (XpertC.difficile Cepheid GeneXpert) directamente a todas las muestras. Para este cálculo se partió de un supuesto de 1.000muestras anuales con un 5% de positivas, que se corresponde con la experiencia del centro. Se tuvo en cuenta la sensibilidad de la/s prueba/s (76, 83 y 95%, respectivamente) y, por lo tanto, el coste de los falsos negativos (pruebas adicionales, días de hospitalización, tratamiento); la especificidad (93, 97 y 96%, respectivamente); se consideró el coste de tratamientos innecesarios, y finalmente se consideró el tiempo de personal requerido y su coste. El resultado fue de 41.447€ para la detección de toxinas por EIA, de 33.334€ usando el sistema GeneXpert y de 28.141€ usando el algoritmo con GDH+toxinas por EIA y GeneXpert en los casos discrepantes. No se ha tenido en cuenta la posible repetición del estudio en muestras negativas para EIA, dado que las recomendaciones actuales son de no procesar más de una muestra por paciente12,19,26,32. Sin duda los valores y los costes estipulados son discutibles, así como el coste del reactivo, pero en cualquier caso pone en evidencia que la introducción de las técnicas moleculares, si bien incrementa el presupuesto del servicio de microbiología, puede representar un ahorro sanitario global. Son pocos los estudios que hayan tenido en cuenta todos estos aspectos al calcular los costes de las técnicas moleculares37,40.
Finalmente, cabe mencionar que quizás en un futuro relativamente cercano podamos utilizar otras técnicas, como la espectrometría de masas (MALDI-TOF-MS), para la detección de toxinas de C.difficile41.
Resumiendo los diferentes algoritmos publicados12,19,26,31-35,38,40, independientemente del preparado comercial utilizado, los podríamos agrupar en los siguientes:
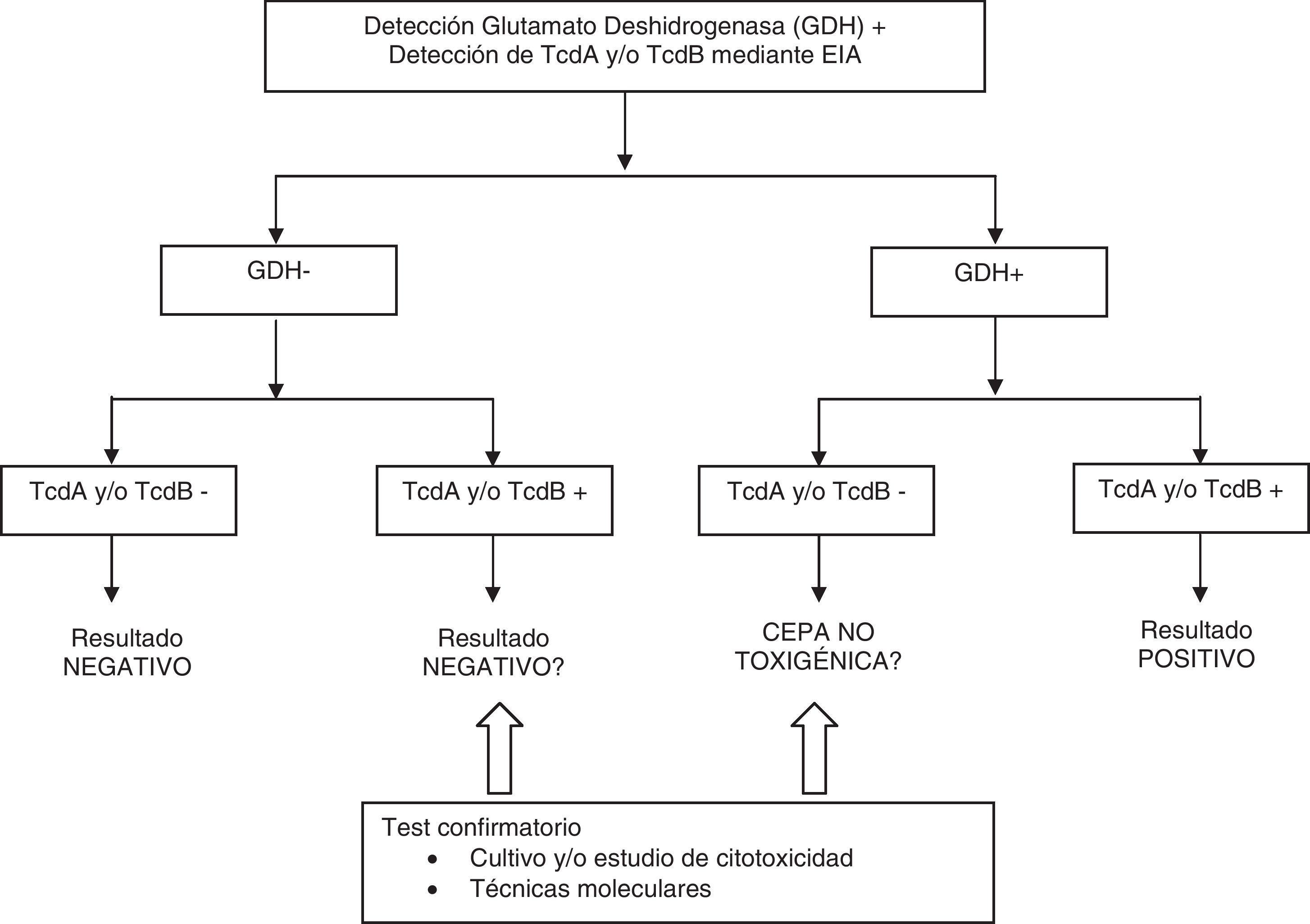
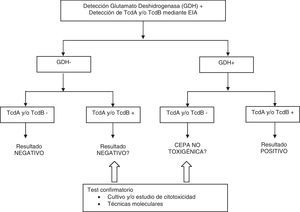
En general, todos los algoritmos propuestos en la literatura, incluidos los recomendados por la Sociedad Americana de Epidemiología Hospitalaria (SHEA)19 y la Sociedad Europea de Enfermedades Infecciosas y Microbiología clínica (ESCMID)32, sugieren hacer el diagnóstico en 2 o 3escalones (fig. 2). En una primera instancia se determina la presencia de GDH mediante EIA. Esta se puede realizar a la vez que la detección de TcdA y/o TcdB mediante EIA, o bien realizar la detección de toxina en una segunda fase. Si es negativo para GDH y/o toxinas, se da un resultado final negativo. Si da positivo para GDH y para alguna toxina, se informa como positivo. Finalmente, en las positivas solo para GDH o para las toxinas se debe realizar un test confirmatorio. Este test puede ser el cultivo y/o el estudio de la citotoxicidad. Dado que esta confirmación es laboriosa y lenta, se ha sugerido aplicar técnicas moleculares como confirmatorias12,26,31,37
Alternativamente se puede hacer la determinación de la GDH y confirmar la prueba positiva con técnicas moleculares o estudiar directamente las heces con técnicas moleculares12,37.
Las técnicas moleculares, además de aportar rapidez y sensibilidad al diagnóstico de la infección por C.difficile, nos permiten realizar estudios epidemiológicos. Estos adquirieron cierta relevancia al detectarse determinadas cepas de C.difficile con mayor virulencia, como son las pertenecientes al ribotipo 027.
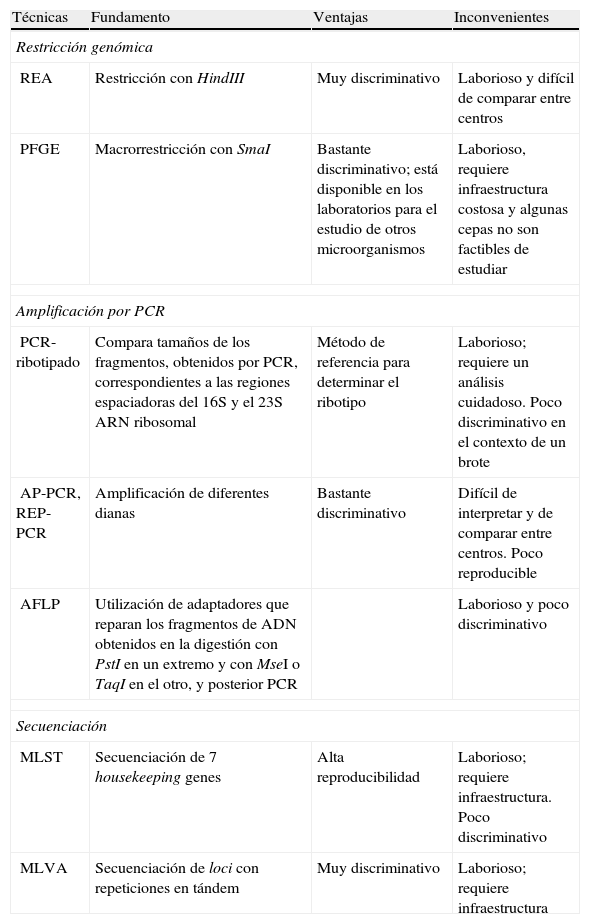
Para los estudios de epidemiología molecular de C.difficile existen varias técnicas que, en función de los objetivos que nos planteemos (estudiar un brote, estudios evolutivos,etc.), se aplicarán unas u otras11,16,19,42,43. Las técnicas más frecuentemente utilizadas en estudios epidemiológicos se detallan en la tabla 2. Algunas se basan en el estudio de los fragmentos obtenidos tras restricción genómica, como la restricción de todo el genoma con enzimas de moderada frecuencia de corte (REA) que generan unos patrones de bandas muy discriminativos pero difíciles de interpretar. Otras utilizan enzimas de baja frecuencia de corte, macrorrestricción genómica, y que al generar fragmentos muy grandes de ADN se requiere, para su análisis, un gel de electroforesis en campo pulsado (PFGE).
Técnicas moleculares para estudios epidemiológicos
| Técnicas | Fundamento | Ventajas | Inconvenientes |
| Restricción genómica | |||
| REA | Restricción con HindIII | Muy discriminativo | Laborioso y difícil de comparar entre centros |
| PFGE | Macrorrestricción con SmaI | Bastante discriminativo; está disponible en los laboratorios para el estudio de otros microorganismos | Laborioso, requiere infraestructura costosa y algunas cepas no son factibles de estudiar |
| Amplificación por PCR | |||
| PCR-ribotipado | Compara tamaños de los fragmentos, obtenidos por PCR, correspondientes a las regiones espaciadoras del 16S y el 23S ARN ribosomal | Método de referencia para determinar el ribotipo | Laborioso; requiere un análisis cuidadoso. Poco discriminativo en el contexto de un brote |
| AP-PCR, REP-PCR | Amplificación de diferentes dianas | Bastante discriminativo | Difícil de interpretar y de comparar entre centros. Poco reproducible |
| AFLP | Utilización de adaptadores que reparan los fragmentos de ADN obtenidos en la digestión con PstI en un extremo y con MseI o TaqI en el otro, y posterior PCR | Laborioso y poco discriminativo | |
| Secuenciación | |||
| MLST | Secuenciación de 7 housekeeping genes | Alta reproducibilidad | Laborioso; requiere infraestructura. Poco discriminativo |
| MLVA | Secuenciación de loci con repeticiones en tándem | Muy discriminativo | Laborioso; requiere infraestructura |
AFLP: polimorfismo en la longitud de los fragmentos de restricción amplificados; AP-PCR: PCR con iniciadores arbitrarios; MLST: Multilocus sequence typing; MLVA: Multiple-locus variable number of tandem repeat analysis; PFGE: macrorrestricción genómica y electroforesis en campo pulsado; REA: enzimas de restricción de moderada frecuencia de corte; REP-PCR: PCR con iniciadores de determinadas regiones repetidas.
Otras técnicas se basan en la PCR, como son la PCR-ribotipado, que consiste en comparar los tamaños de los fragmentos, obtenidos por PCR, correspondientes a las regiones espaciadoras del 16S y el 23S ARN ribosomal. El patrón de bandas obtenido define un ribotipo determinado que es fácilmente comparable entre centros. Para ello se puede utilizar la web http://webribo.ages.at. Este método es el más utilizado en Europa11,19,42. Otras técnicas basadas en la PCR son las que utilizan iniciadores arbitrarios (AP-PCR), iniciadores de determinadas regiones repetidas (REP-PCR), o las que analizan el polimorfismo en la longitud de los fragmentos de restricción amplificados (AFLP). Estas últimas técnicas han sido poco utilizadas para C.difficile11,16,19.
Finalmente encontramos las técnicas basadas en la secuenciación de determinadas regiones, como el Multilocus sequence typing (MLST), y el estudio de regiones repetidas en tándem, Multiple-locus variable number of tandem repeat analysis (MLVA).
El MLST consiste en la secuenciación de 7genes relativamente conservados en C.difficile (housekeeping genes) y generar una secuencia numérica en función del alelo detectado para cada gen. Esto permite que los resultados sean fácilmente comparables entre centros, pero es una técnica poco discriminativa y se utiliza solo para estudios con fines evolutivos7,34. Por el contrario, el MLVA es una técnica mucho más discriminativa que permite estudiar brotes. Esta técnica se basa en la amplificación y secuenciación de determinados loci que presentan secuencias repetidas en tándem, de tal forma que, para cada loci, en función del número de repeticiones que se detectan se les asigna un número. Esto, al igual que en el caso del MLST, genera un código numérico que es fácilmente comparable entre centros11,16,42.
Algunos autores han comparado las diferentes técnicas y han concluido que si bien todas son capaces de detectar brotes, el REA y el MLVA parecen ser los más discriminatorios, mientras que el MLST es el menos discriminativo y se utilizaría únicamente en estudios con fines evolutivos19,44,45. El PFGE es la técnica más ampliamente empleada para estudios epidemiológicos de diferentes microorganismos, pero su utilidad en C.difficile se ve limitada por el hecho de que algunas cepas se autolisan y no se pueden estudiar16.
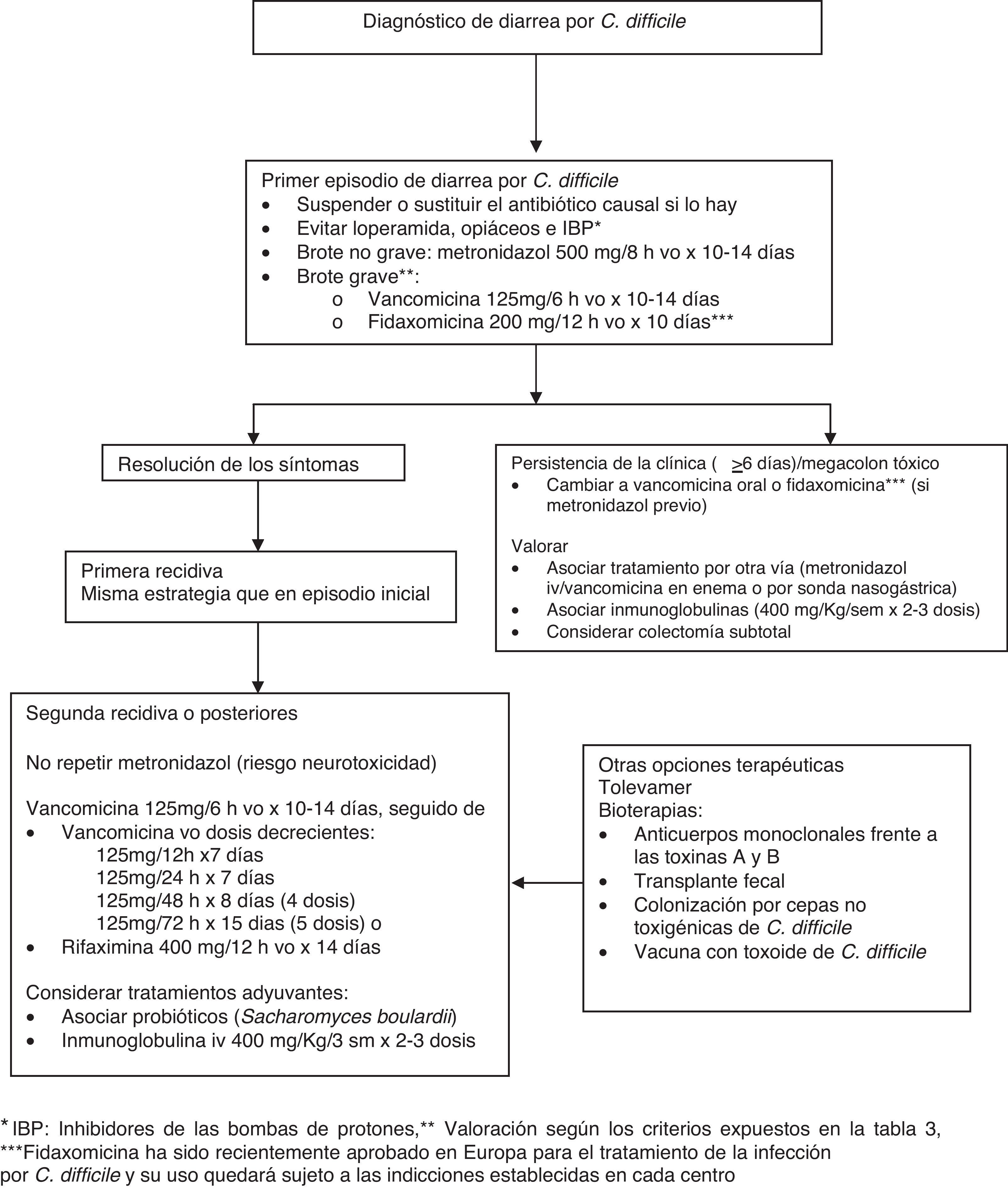
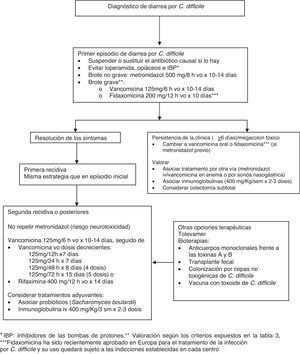
Tratamiento de la diarrea asociada a Clostridium difficile (fig. 3)El portador asintomático no requiere tratamiento, y no está indicado someter a pruebas diagnósticas a individuos asintomáticos excepto con fines epidemiológicos19,22. Siempre que sea posible, se recomienda suprimir el antibiótico desencadenante o sustituirlo por otro con menor efecto anaerobicida como primer paso del tratamiento de la DACD, ya que un porcentaje de pacientes afectos de formas leves responden a esta medida18,19,22. Otras medidas básicas del tratamiento de la DACD incluyen la hidratación del paciente y evitar el empleo de opiáceos y de fármacos inhibidores del peristaltismo intestinal, los cuales ocultan los síntomas y pueden empeorar la enfermedad19,22. Aunque existe controversia respecto al papel de los inhibidores de las bombas de protones como factor de riesgo y de evolución desfavorable, parece prudente evitar su uso si no existe una clara indicación1,19.
C.difficile es sensible in vitro al metronidazol y a la vancomicina, los antibióticos de elección en el tratamiento de la DACD, y presenta una sensibilidad variable a otros antimicrobianos1. Destacamos el incremento de la resistencia de C.difficile a las fluoroquinolonas (ciprofloxacino, levofloxacino o moxifloxacino), que se ha incrementado de forma general tanto en las cepas hipervirulentas epidémicas (B1/NAP1/027) como en las no epidémicas de otros ribotipos20,21.
El tratamiento empírico es apropiado si la sospecha clínica de enfermedad por C.difficile es alta, aunque dada la disponibilidad y la rapidez de las técnicas diagnósticas existentes en la actualidad, esta situación es poco frecuente. Pese a que el metronidazol, por vía oral, ha sido el tratamiento de primera línea recomendado por los CDC y por la Sociedad Americana de Enfermedades Infecciosas, la vancomicina oral es el tratamiento aprobado por la FDA2,19,22,46. La elección de uno u otro antibiótico ha sido estudiada en diferentes trabajos considerando aspectos como el coste, la posibilidad de generar resistencias de otros microorganismos a estos antimicrobianos o la diferente tasa de respuesta clínica, de recidivas postratamiento y de negativización de la toxina en heces. Estos fármacos, en particular la vancomicina, deben administrarse por vía oral (v.o.) 19,22. Diferentes estudios observacionales realizados en el contexto de los brotes epidémicos de DACD descritos en Estados Unidos y Canadá sugieren que han disminuido las tasas de respuesta al metronidazol1,18,47 y que la respuesta clínica a la vancomicina es superior a la respuesta al metronidazol en el caso de enfermedad grave48. A partir de estas observaciones, las recomendaciones de tratamiento se basan en una estratificación inicial de la gravedad de la enfermedad en base a criterios clínicos y analíticos (tabla 3), en función de la cual se escoge el tratamiento antibiótico más adecuado. En las formas no graves el metronidazol (500mg/8h v.o. durante 10-14días) es el tratamiento de elección18,19,22. En las formas graves (leucocitosis >15.000células/mm3, aumento de la creatinina ≥1,5 veces el valor basal, lactato sérico >2,5mmol/l, temperatura >38,5¿C y más de 10deposiciones diarreicas diarias) vancomicina (125mg/6h v.o.) es el tratamiento indicado18,19,22. En caso de íleo o intolerancia a la vía oral, se aconseja asociar metronidazol por vía intravenosa y considerar la administración de vancomicina por sonda nasogástrica y/o en enema18,19,22. El tiempo promedio de resolución de la diarrea es de 2 a 4días, pero la respuesta al metronidazol puede ser más lenta, por lo que no se debe considerar fracaso terapéutico hasta que los antibióticos se han administrado por lo menos durante 6días19,22. Se recomienda que el tratamiento se administre durante 10-14días, aunque en los individuos que responden con lentitud podría ser necesario prolongarlo19,22. Si la evolución no es favorable, se puede considerar la administración de gammaglobulinas a dosis de 400mg/kg, y debe valorarse la práctica de una colectomía subtotal18,19,22. Aunque se han utilizado diferentes dosis de vancomicina oral en el tratamiento de la DACD, no se han demostrado diferencias estadísticamente significativas en cuanto a la tasa de curación al comparar la utilización de dosis altas de vancomicina con las habituales (500mg/6h v.o. vs. 125mg/6h v.o.), por lo que no están indicadas22. Solo en el caso de que se administre vancomicina por sonda nasogástrica en un paciente con íleo podría justificarse un aumento de la dosis en un intento de alcanzar suficiente concentración del fármaco en la luz del colon22.
Criterios de gravedad de la enfermedad por Clostridium difficile
| Síntomas y signos clínicos y analíticos de colitis severa por C.difficile |
| Requerimiento de ingreso en una unidad de cuidados intensivos |
| La presencia de al menos 2 de los siguientes factores: |
| Edad superior a 70 años |
| Leucocitosis superior a 15.000células/mm3 |
| Desviación a la izquierda marcada (neutrófilos segmentados >20% del recuento de leucocitos) |
| Aumento de la creatinina ≥1,5 veces el valor basal |
| Lactato sérico >2,5mmol/l |
| Temperatura >38,5°C |
| Más de 10 deposiciones diarreicas diarias |
| Presencia de íleo paralítico o signos de peritonitis |
| Albúmina <2,5mg/dl |
| Evidencia de colitis en el examen mediante tomografía computarizada |
En la primera recidiva, el resultado de la repetición del tratamiento con metronidazol no es inferior al de la administración de vancomicina, por lo que se aconseja utilizar el mismo esquema terapéutico que en el episodio inicial18,19,22. No existe un tratamiento estándar para las recidivas múltiples, pero los tratamientos largos o repetidos con metronidazol se deben evitar debido a su potencial neurotoxicidad, y por ello las opciones terapéuticas más utilizadas hasta el momento incluyen la utilización a partir de la segunda recidiva de vancomicina oral durante 14 días, seguida de: a)dosis decrecientes de vancomicina durante 4-6semanas; b)administración de una dosis de vancomicina cada tercer día durante 4 a 6 semanas, o c)tratamiento secuencial de rifaximina 400mg/12h v.o. durante 2 semanas18,19,22,46.
Otras opciones terapéuticas utilizadas o en vías de desarrollo incluyen la utilización de otros antibióticos con actividad frente C.difficile, intentar restaurar la flora del colon alterada, favorecer la eliminación de la toxinas de C.difficile o favorecer la respuesta inmune del individuo mediante inmunización ya sea pasiva o activa19,22,46,47.
Respecto a los tratamientos con otros antibióticos, existen experiencias limitadas con el uso del ácido fusídico, la bacitracina o la nitazoxamida por v.o., aunque globalmente han mostrado ser menos efectivas que la vancomicina debido principalmente al desarrollo de resistencias y, por tanto, a la aparición de recidivas posteriores19,22,46,47. En el caso de enfermedad grave existen experiencias limitadas con el uso de la tigeciclina, que ofrece la posibilidad de utilización por vía intravenosa46,47. Recientemente ha sido comercializado un nuevo antibiótico para el tratamiento de la enfermedad por C.difficile llamado fidaxomicina. Se trata de un antibiótico macrocíclico no absorbible que actúa inhibiendo la ARN polimerasa bacteriana y que presenta una excelente actividad bactericida in vitro49. Alcanza altas concentraciones a nivel fecal y prácticamente indetectables en plasma, y no se ha descrito aparición de resistencias al fármaco49. La fidaxomicina ofrece la ventaja, respecto a otros tratamientos antibióticos, de respetar la flora del colon, ya que no tiene actividad frente a otras bacterias integrantes de la misma como bacilos gramnegativos tanto anaerobios facultativos como estrictos, y de ser capaz de inhibir la esporulación de C.difficile, por lo que su utilización se asocia a un menor índice de recurrencias49. Los estudios faseiii publicados en los que se compara fidaxomicina (200mg/12h durante 10días v.o.) vs. vancomicina (125mg/6h durante 10 días v.o.) han demostrado la no inferioridad de la fidaxomicina en cuanto a las tasas de curación al finalizar el tratamiento y la superioridad de respuesta global de la fidaxomicina a los 28 días de finalizado, debido a una reducción de las tasas de recurrencia50,51. Este beneficio se ha demostrado en los pacientes no infectados por la cepa NAP151. La fidaxomicina también ha demostrado superioridad respecto a la vancomicina en cuanto a la prevención de una segunda recurrencia de la enfermedad en los pacientes que ya han presentado un primer episodio52 y en los que deben continuar algún tratamiento antibiótico no dirigido frente a C.difficile50,52. Sin duda el coste de la fidaxomicina (1.500€ un tratamiento de 10días) será una limitación a su prescripción, por lo que será necesaria una cuidadosa evaluación de su indicación en nuestros hospitales.
En cuanto a los intentos de restaurar la flora del colon alterada de los pacientes con infección por C.difficile, los métodos utilizados incluyen la administración de vancomicina seguida de la utilización de la levadura Saccharomyces boulardii, la administración de bacterias fecales en enema (trasplante fecal) o la colonización intencional del paciente con una cepa no productora de toxinas de C.difficile, método todavía en estudio19,22,46,47.
Otra estrategia terapéutica estudiada se basa en favorecer la eliminación de la toxinas de C.difficile mediante la utilización de resinas de intercambio iónico como colestiramina o mediante la utilización de un polímero aniónico llamado tolevamer que, pese a haber demostrado menor eficacia en cuanto a respuesta, puede aportar beneficio en cuanto a la reducción de las recidivas19,22,46,47.
Finalmente, una estrategia prometedora se basa en favorecer la respuesta inmune del individuo ya sea mediante inmunización pasiva o activa. Se hallan en estudios faseiii la utilización de un anticuerpo monoclonal frente a la toxinaA y B y la elaboración de una vacuna con toxoide de C.difficile19,22,46,47.
PronósticoLa mortalidad atribuida a DACD, que previamente era de entre el 0,6 y el 1,5% de los pacientes, ha alcanzado el 6,9% en los brotes epidémicos recientes y se incrementa de forma progresiva con la edad1,46. La mortalidad es prácticamente nula en los pacientes con sintomatología leve, y aunque la mayoría de los pacientes se recuperan, como ya se ha mencionado con anterioridad, las recurrencias son comunes1. Entre el 0,4 y el 3,6% de los pacientes con infección por C.difficile precisarán cirugía, y la mortalidad en este grupo se eleva al 30-50%1.
Prevención y control de casosNo se recomienda realizar pruebas de confirmación de curación en individuos asintomáticos tratados, porque muchos siguen teniendo el microorganismo y la toxina después de que haya cesado la diarrea y los resultados de la prueba no tienen relación con la reaparición de la enfermedad19,22.
Las estrategias para la prevención de la DACD son de 2tipos: las dirigidas a prevenir la transmisión del microorganismo al paciente y las encaminadas a reducir el riesgo de DACD si se transmite el microorganismo4. El contagio por C.difficile tiene fuentes exógenas, a menudo dentro del hospital, y el microorganismo es transportado por las heces de enfermos sintomáticos y asintomáticos1. Las esporas del microorganismo se encuentran en superficies ambientales (en las que el microorganismo puede persistir hasta 5meses) y en las manos del personal sanitario que no se las lava adecuadamente1. La detección precoz de los casos, el establecimiento de medidas de la transmisión de tipo de contacto de los pacientes hasta la resolución de la diarrea, la higiene de las manos con agua y jabón (las soluciones alcohólicas no eliminan las esporas de C.difficile), así como una política activa de uso racional de los antibióticos, son puntos clave para evitar la enfermedad y su transmisión en las instituciones sanitarias1,2,4,19,22.
Dado que el uso de la terapia antimicrobiana es el factor de riesgo aislado más importante, el uso racional del tratamiento antibiótico puede ser una medida efectiva para prevenir la aparición de la enfermedad, así como la identificación de los pacientes de riesgo y el diagnóstico precoz de la enfermedad1,4,19. Una vez aparece, la DACD tiene un elevado riesgo de transmisión, ya que C.difficile es un bacilo formador de esporas. Los mayores problemas se plantean en los hospitales y en las residencias, donde la prevención de casos secundarios se basará en la aplicación de las normas generales de control de las infecciones nosocomiales de transmisión por contacto1,4,19,22. Estas consisten en colocar a estos pacientes en habitaciones individuales; el uso de bata y de guantes, y el lavado de las manos tras el contacto con los pacientes, tanto por parte del personal sanitario como por sus visitas; la utilización de equipamiento exclusivo para estos pacientes y de cuñas desechables, y la desinfección exhaustiva de la habitación tras el alta utilizando un esporicida tipo lejía, ya que el alcohol no es efectivo1,4,19,22.
FinanciaciónLos autores de este trabajo reciben financiación parcial como investigadores del Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III, Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Nota: Sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion.