Introducción
El trasplante ha constituido en la medicina moderna la consecución de una quimera: la sustitución de un órgano enfermo por otro sano. La práctica diaria a veces no nos hace ser conscientes de lo que esto significa pero constituye para el médico, y sobre todo para el paciente, una ventana de esperanza y la única vía de salida a una enfermedad terminal y habitualmente fatal.
Esta recompensa no se consigue fácilmente y sólo es posible si se logra evitar uno de los mecanismos más eficaces de los que disponen los seres vivos para sobrevivir: el reconocimiento de lo extraño y la defensa frente al mismo.
Inmunología y trasplante
Una de las características más importantes del sistema inmunitario es su especificidad, derivada de receptores muy discriminativos como son los receptores de los linfocitos T (TCR) y las inmunoglobulinas 1.
La principal estrategia del sistema inmunitario consiste en reconocer estructuras extrañas y expandir los linfocitos que posean receptores específicos para esas estructuras. El resultado de esta expansión linfocitaria ocurre a varios niveles. Por un lado están los linfocitos T colaboradores (T helper o TH), que facilitan la expansión clonal, la respuesta inflamatoria y colaboran en la producción de inmunoglobulinas; por otro lado están los los linfocitos B, que producen inmunoglobulinas; y, finalmente, los linfocitos citotóxicos (CTL), que tienen la capacidad de destruir otras células por citotoxicidad directa. Además de los CTL, que requieren un reconocimiento previo del antígeno por los los receptores de los linfocitos T, puede existir una actividad citotóxica natural (NK, natural killer) que no requiere de dicho reconocimiento 2.
Para que los TCR reconozcan las estructuras extrañas, éstas deben serles presentadas en soportes determinados. Los antígenos extracelulares son presentados por las células dendríticas sobre las moléculas HLA-II. Los antígenos intracelulares son presentados en la membrana, tras su digestión intracitoplasmática, sobre las moléculas HLA-I.
Tanto las moléculas HLA-I como las HLA-II son polimórficas y son diferentes de unos individuos a otros. Las moléculas HLA-I están presentes en muchas células y se hallan codificadas por los loci A, B y C. Las moléculas HLA-II se encuentran en macrófagos, células dendríticas, linfocitos B y algunos endotelios y están codificas en los loci DR, DQ y DP. Cada locus puede ocuparse por multitud de alelos que confieren proteínas antigénicamente diferentes 3. Los loci se identifican por letras y los alelos por números.
La respuesta inmunológica ante el injerto
La respuesta desencadenada por los antígenos HLA tiene dos componentes, el celular y el humoral. La respuesta celular ocurre habitualmente, es difícil de monitorizar y bastante sensible a los inmunosupresores convencionales. La respuesta humoral se pone de manifiesto sólo en la cuarta parte de los pacientes, es fácilmente monitorizable y se inhibe poco por los inmunosupresores convencionales.
El reconocimiento alogénico se produce en los ganglios linfáticos del receptor y puede ser un reconocimiento directo, moléculas HLA del injerto presentadas sobre las células dendríticas del donante, o indirecto, péptidos extracelulares presentados por las células de dendríticas del receptor sobre moléculas HLA del receptor 4.
Como se ha mencionado anteriormente, tras la presentación los linfocitos son activados. Además de los linfocitos B y los linfocitos T citotóxicos, la activación de los linfocitos T colaboradores puede ocasionar dos tipos celulares: TH1, los primeros en ser activados y secretan mayoritariamente interleucina 2 (IL-2) e interferón gamma (IFN-γ), y los TH2, de activación más tardía y secretan mayoritariamente IL-4, IL-5, IL-6 e IL-10 (tabla 1).
Para que se produzca esta activación de forma definitiva y eficaz es necesario que el linfocito T reciba una segunda señal, generalmente a través de CD28. Es esta segunda señal activadora la que determina a qué estadio evolucionará el linfocito T: a) activación y proliferación, b) anergia o incapacidad para responder a nuevos estímulos, o c) autodestrucción por apoptosis.
Mecanismos humorales del rechazo
En el caso de que un receptor posea en el momento del implante aloanticuerpos contra el donante, se produce una reacción aguda con microtrombosis y necrosis celular denominada rechazo hiperagudo. Esta complicación puede prevenirse mediante la realización de una prueba cruzada antes del trasplante (cross-match). Un cross-match positivo contraindica un trasplante renal, cardíaco, pulmonar o pancreático. Sin embargo, el trasplante hepático es poco sensible al rechazo hiperagudo, por lo que no se requiere la realización de una prueba cruzada antes del mismo, e incluso el trasplante de hígado puede proteger de aloanticuerpos frente a otros injertos simultáneos debido a su capacidad de liberar moléculas HLA solubles bloqueadoras de los anticuerpos.
Por otro lado, la aparición de anticuerpos tras el trasplante, en los primeros meses, se asocia a un rechazo vascular, habitualmente corticorresistente. En general estos anticuerpos son bastante resistentes a los inmunosupresores, aunque se postula que la combinación de tacrolimus y micofenolato inhibe la producción de anticuerpos 5. Se han asociado los anticuerpos con el rechazo crónico mediante la lesión endotelial por activación del complemento o movilizar moléculas HLA en la membrana endotelial 5.
Mecanismos celulares del rechazo
Es prácticamente de aparición universal y difícil de monitorizar. El órgano injertado se puede ver atacado por 3 tipos de mecanismos celulares 6: a) linfocitos T citotóxicos, b) citotoxicidad celular dependiente de anticuerpos (ADCC), y c) actividad citotóxica natural o NK.
Interleucinas, moléculas de adhesión y quimocinas y su relación con el rechazo
Los linfocitos T colaboradores TH1 colaboran en la expansión clonal y la citotoxicidad celular y lo hacen mediante la expresión de IL-2 e IFN-γ. Por otro lado, los linfocitos colaboradores TH2 tienen más relación con la producción de inmunoglobulinas y con la memoria inmunológica y secretan IL-4, IL-5, IL-6 e IL-10. Ambas poblaciones están sometidas a un autocontrol en su expresión celular (tabla 1).
En ausencia de inmunosupresión, el rechazo es mediado por mecanismos TH1 ligados a IL-2 e IFN-γ7. El IFN-γ es un potente inductor de la expresión de HLA-I y en los casos de infección viral facilita la acción de los linfocitos citotóxicos sobre las células infectadas. En el trasplante produce un efecto de retroalimentación positivo (potenciador) 8; este efecto también se ha observado en infecciones por citomegalovirus (CMV) y es uno de los mecanismos que se han implicado para relacionar las infecciones por CMV y el rechazo 9.
Cuando los injertos son tolerados predominan las interleucinas TH2, fundamentalmente IL-4 e IL-10 10,11, aunque existen datos controvertidos en este aspecto y ninguna de las dos se asocia definitivamente a tolerancia y sí a una respuesta alogénica de baja intensidad 12.
En el rechazo también influyen la expresión de moléculas de adhesión (p. ej., factor de activación linfocitario [LFA-1], molécula de adhesión intercelular [ICAM-1]) inducidas por interleucinas (principalmente IFN-γ, factor de necrosis tumoral alfa [TNF-α] e IL-1). Estas moléculas de adhesión facilitan la acumulación de células inflamatorias y también pueden ser inducidas por agentes infecciosos virales o bacterianos. Existen algunas estrategias para evitar el rechazo en base al bloqueo de moléculas de adhesión, como la utilización de anticuerpos anti-LFA-1 y la utilización de nucleótidos antisentido para ICAM-1, entre otros 13.
Las quimiocinas son unas proteínas que controlan la quimiotaxis y activación de neutrófilos, macrófagos, linfocitos T y células NK a determinados territorios 14. Existen diferentes tipos con diferentes funciones: MIP-1 alfa/CCL3, RANTES/CCL5, MIG/CXCL9... En el trasplante las quimiocinas participan en diferentes fases: en la acumulación de neutrófilos en el postrasplante inmediato, en la infiltración del injerto por linfocitos T, macrófagos y células NK y facilitando la infiltración del injerto por macrófagos en el rechazo crónico. También, algunos bloqueantes de las quimiocinas han sido utilizados con éxito para evitar el rechazo 15.
Rechazo crónico
El rechazo crónico o disfunción crónica del injerto tiene un origen multifactorial y ocurre como consecuencia del engrosamiento de la pared vascular y el consiguiente defecto de perfusión del injerto.
Existen diferentes circunstancias que se han asociado con un mayor riesgo de rechazo crónico, algunas con mayor relación que otras, y entre ellas están: número y severidad de los rechazos agudos, mala cumplimentación de la terapia inmunosupresora, la compatibilidad HLA, hipertensión, hiperlipemia, la presencia de aloantígenos y la infección por CMV entre otros. No obstante el rechazo crónico parece ser el punto final de un proceso complejo cuyos auténticos mecanismos no están suficientemente claros 16,17.
Inmunosupresores: mecanismos de acción e infecciones asociadas
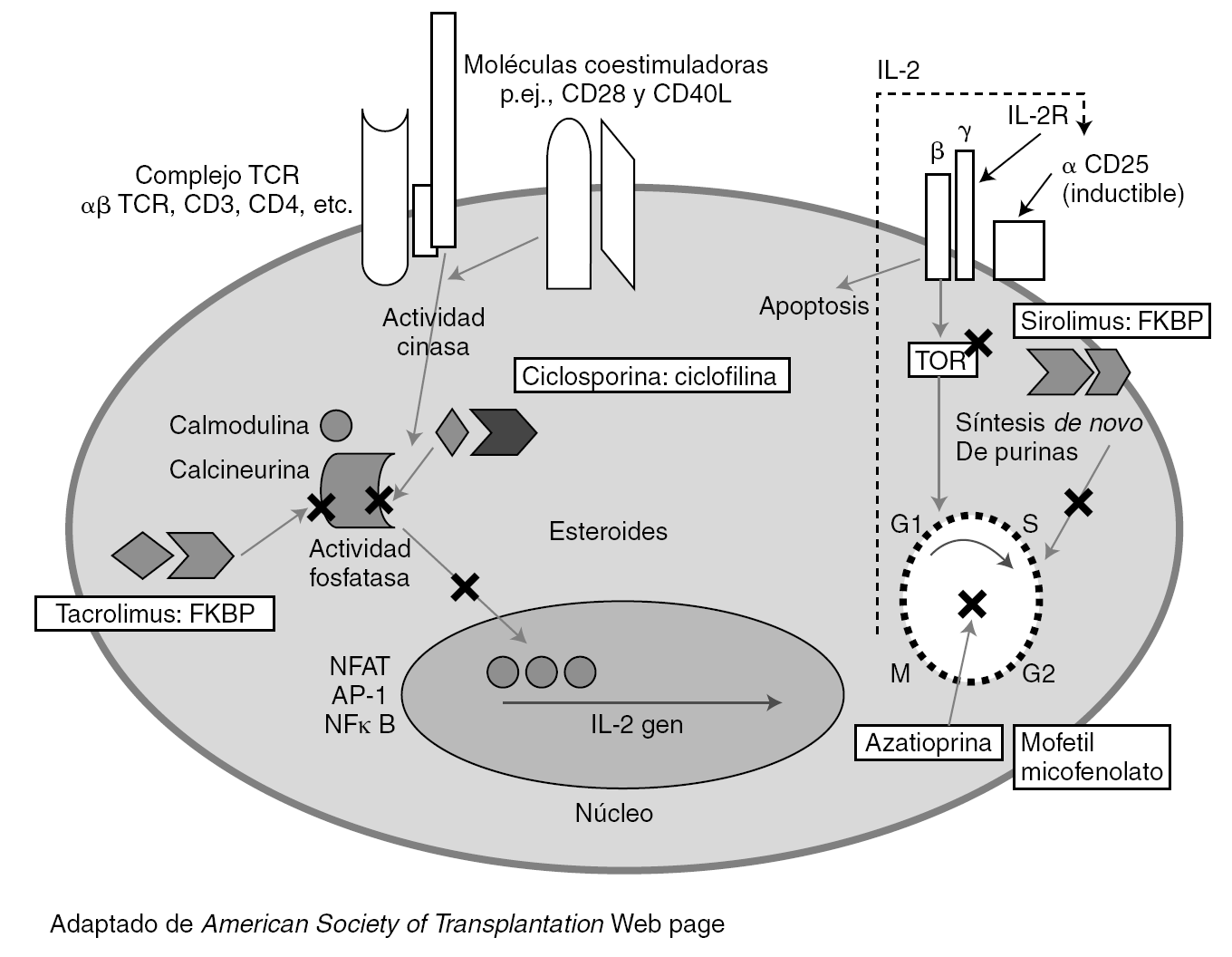
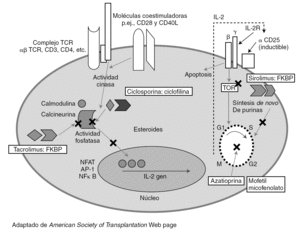
El desarrollo de regímenes de inmunosupresión eficaces se ha basado en el conocimiento de los mecanismos inmunes implicados en el rechazo del injerto. Los linfocitos T tienen un papel principal en los eventos inmunes precoces que ocurren después de la exposición al injerto (fig. 1).
Figura 1. Lugares de acción de los agentes inmunosupresores de mantenimiento.
La activación y proliferación de la célula T requiere al menos tres señales mediadas por la interacción con los aloantígenos. En la figura 1 se indica el lugar de actuación de los principales fármacos inmunosupresores utilizados en el trasplante. Las células presentadoras de antígenos (APC) de origen en el donante o el receptor migran a las áreas de células T de los órganos linfáticos secundarios. Estas células T generalmente circulan entre los tejidos linfoides. Las APC presentan los antígenos del donante a las células T naive y de memoria. Las células T son activadas y tienen una expansión clonal y una diferenciación para expresar funciones efectoras. El antígeno estimula los TCR (señal 1) y la formación de sinapsis. Los CD80 (B7-1) y CD86 (B7-2) de las células APC se unen a CD28 de la célula T para producir la señal 2.
Estas señales activan las tres vías de transducción de señal: vía calcio-calcineurina, vía de la MAP cinasa (mitogen-activated protein) y la vía de la NFκB cinasa, que activan los factores de transcripción nuclear de las células T activadas (NFAT), activando respectivamente proteína 1 (AP-1) y NFκB. Esto produce la expresión de CD-154 (que activa la APC), la cadena alfa del receptor de IL-2 (CD25) y la IL-2.
La señal 3 es inducida por citocinas como IL-2 y otros factores de crecimiento y lleva a la progresión del ciclo celular. Los receptores para un número de citocinas (IL-2, IL-4, 7, 15 y 21) comparten la cadena común a, que se une a la JAK3. La IL-2 y la IL-15 liberan señales de crecimiento a través de la vía de la PI3 cinasa y de la vía de la diana molecular de rapamicina (mTOR), que inicia el ciclo celular. Los linfocitos requieren la síntesis de nucleótidos de purina y pirimidina para la replicación, regulado por la dihidrorotate deshidrogenasa (DHODH) y la iosina monofosfato deshidrogenasa (IMPDH).
La señal 4 es la muerte celular programada (apoptosis). Después las células T regulan la actividad de las células B produciendo una combinación de episodios humorales y celulares que pueden llevar a un rechazo agudo o crónico durante la evolución postrasplante.
Los regímenes de inmunosupresión utilizados en el trasplante de órganos pueden ser clasificados como de inducción, mantenimiento o rescate. La inmunosupresión de inducción es una profilaxis del rechazo relativamente intensa que se utiliza en el momento del trasplante basado en la observación empírica que se requiere una inmunosupresión más potente para prevenir el rechazo agudo inicial. Es una pauta potente que no se puede mantener en el tiempo por sus efectos tóxicos. Las pautas de mantenimiento son de menor potencia pero permite su uso más prolongado (menores efectos secundarios). Los tratamientos de rescate son similares a los de inducción en cuanto a su intensidad y potencia pero difieren en que son aplicados en respuesta a un episodio de rechazo.
La mayoría de los programas de trasplante emplean regímenes de inducción de alguna manera. Estas estrategias incluyen dosis altas de fármacos de mantenimiento (bolos de corticoides, ciclosporina intravenosa), o incluyen fármacos específicos de inducción (anticuerpos o proteínas de fusión).
Terapias de inducción
Dos factores contribuyen a los requerimientos de la inmunosupresión de inducción: a) la alta proporción de precursores de células T donante-específico presente en la mayoría de los receptores, y b) la asociación del trasplante con el daño tisular 18.
Muchos aspectos lesivos del trasplante como el daño endotelial, isquemia y reperfusión, herida quirúrgica del receptor, y el daño al donante o la muerte cerebral producen un impacto en la intensidad de la respuesta inmunitaria, incrementando la frecuencia de precursores efectores mediante la disminución del umbral de activación de células T, mejorando la eficiencia en la presentación del antígeno y aumentando el paso de células hacia el órgano y sus ganglios linfáticos.
En las terapias de inducción se puede actuar a diferentes niveles de la respuesta inmunitaria inicial tras el trasplante:
1.Disminuyendo la proporción de precursores de células T.
2.Disminuyendo la eficacia de presentación de antígenos.
3.Alterando el umbral de activación.
4.Disminuyendo el tráfico celular.
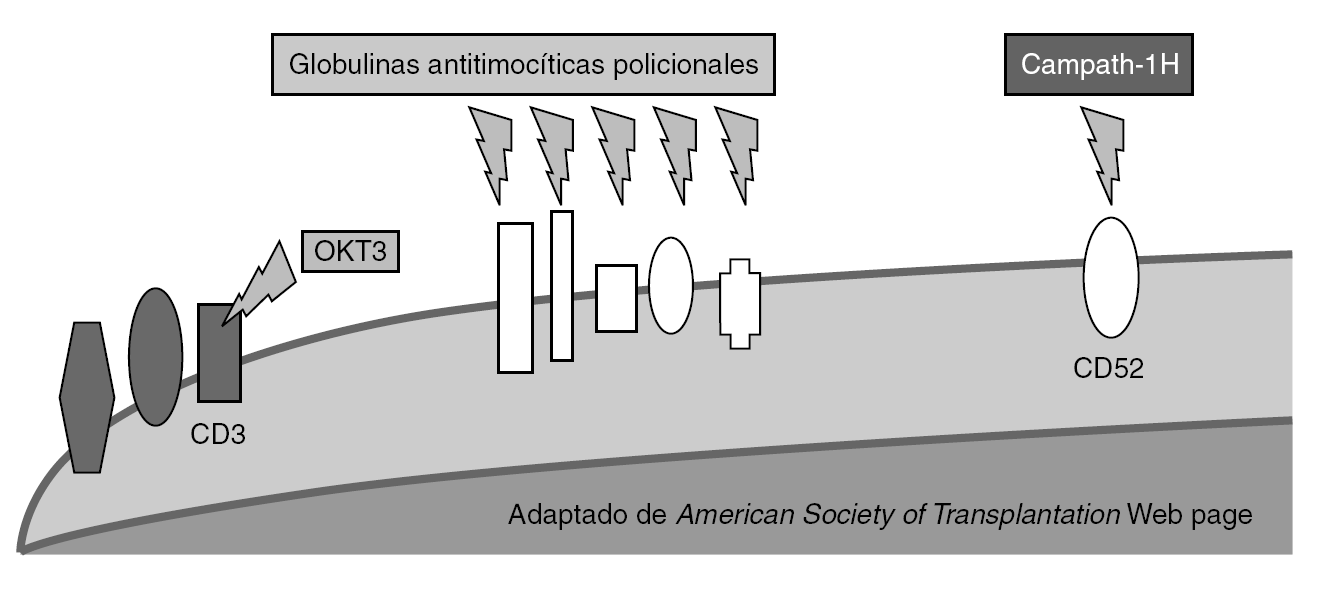
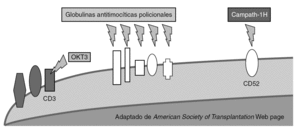
Disminución de la proporción de precursores de células T (fig. 2)
Figura 2. Mecanismo de acción de los anticuerpos deplecionadores de linfocitos.
El número de precursores puede ser reducido de manera no específica mediante agentes de inducción deplecionadores de linfocitos. Entre estos se encuentra las preparaciones policlonales de antilinfocitos T y antitimocitos (timoglobulina [ATG-R], ATGAM, ATG-Fresenius [ATG-F]) y las preparaciones monoclonales específicos frente a determinantes comunes linfocitarios como CD3 (OKT3), CD52 (alentuzumab) y CD25 (daclizumab y basiliximab). Recientemente, se ha observado que no se produce una depleción uniforme de los linfocitos T. Específicamente, las células T con fenotipo de memoria son menos sensibles a la depleción mediada por anticuerpos que las células naive.
OKT3. Fue el primer anticuerpo monoclonal aprobado. Es un anticuerpo murino específico frente a CD3 humano. El OKT3 se une al CD3 causando la internalización del TCR y la activación simultánea de células T y su depleción, con bloqueo de la proliferación y la diferenciación. Su mecanismo de acción induce un síndrome de liberación de citocinas (IL-2, IL-6, TNF-α e IFN-γ) que estimulan la producción de leucotrienos, prostaglandinas y endoperoxidasas que se manifiestan en fiebre, hipotensión, vasoespasmo coronario, aumento de la permeabilidad capilar pulmonar y alteraciones de la musculatura lisa de bronquios y tubo digestivo. Los signos y síntomas aparecen en la primera hora tras la administración de la primera o segunda dosis, pudiendo ir desde manifestaciones más leves a casos severos. Su uso se ha asociado a un incremento de las infecciones virales del grupo herpes durante su administración 19,20 así como fúngicas y bacterianas, estando aconsejado la utilización de pautas de profilaxis durante su administración. OKT3 demostró ser eficaz como agente de inducción en el trasplante renal, hepático y cardíaco cuando se combinaba con otros agentes inmunosupresores de mantenimiento, particularmente en pacientes sensibilizados. Con la mejora en la técnica y en la inmunosupresión su papel en el trasplante hepático ha desaparecido. Su uso ha descendido en los últimos años, debido a sus efectos secundarios.
Anticuerpos policlonales. Las preparaciones de anticuerpos heterólogos son derivados de animales inmunizados. Han mostrado mediar la depleción de células T y se han utilizado en terapias de inducción y de rescate. Sus propiedades antirrechazo pueden ser también por otros mecanismos diferentes a la depleción, como el bloqueo de la coestimulación, la modulación de las moléculas de adhesión y la depleción de células B. Tres preparados se utilizan en la inducción: dos preparados de anticuerpos derivados del conejo (ATG-R y ATG-F) y uno equino (ATGAM). Los efectos adversos descritos incluyen enfermedad del suero (6%), leucopenia, especialmente con rATG (20-50%), reacciones relacionadas con la infusión (70%), aumento de las infecciones y neoplasias postrasplante. Los anticuerpos policlonales no han demostrado su utilidad en el trasplante hepático. La mayoría de los ensayos están diseñados para demostrar la eficacia de pautas cuádruples que incluyen anticuerpos policlonales junto a pautas triples de mantenimiento. Estas pautas cuádruples, reducen la tasa de rechazo agudo pero llevan asociada un incremento de la morbilidad infecciosa 21,22. En el grupo de ATG, las incidencia de leucopenia, trombocitopenia, enfermedad del suero, fiebre e infección por CMV son significativamente altos.
Alemtuzumab. Es un agente que combina los beneficios de los anticuerpos monoclonales con el efecto prolongado y las capacidades de depleción de los preparados policlonales. Es un anticuerpo monoclonal humanizado anti-CD52 específico. Depleciona rápidamente los linfocitos que expresan CD52 (linfocitos T más que B) a nivel central y periférico. Entre sus efectos secundarios se encuentran los relacionados con la infusión (primeras semanas), mielosupresión y el riesgo de infecciones oportunistas por linfopenia (CD4 y CD8), con recuperación lenta de recuentos (1 año). Por ello, es preciso utilizar profilaxis frente a algunas infecciones oportunistas relacionada con el descenso de CD4. Estudios preliminares han demostrado permitir la reducción de los requerimientos de tratamientos de mantenimiento sin aumento aparente en las complicaciones infecciosas o neoplásicas en diferentes trasplantes de órgano sólido comparado con controles históricos 23-26. En un estudio utilizando alemtuzumab como inducción en receptores de trasplante pancreático, se comunicó una frecuencia de 6,6% de infección fúngica invasiva en estos pacientes, sugiriendo la posibilidad de efecto favorecedor de IFI tras el uso de alemtuzumab 27.
Anticuerpos específicos anti-CD25 (daclizumab y basiliximab). El CD25 es el receptor de alta afinidad de IL-2, que activa el linfocito T. Dos preparados monoclonales de anticuerpos monoclonales específicos anti-CD25, el daclizumab (Zenapax) es un anticuerpo humanizado y el basiliximab (Simulect) es un anticuerpo quimérico. Su mecanismo de acción produce un bloqueo de la función del linfocito mediante el bloqueo del efecto de IL-2 sobre su receptor, influenciando negativamente la señal 3. No producen depleción de linfocitos. Ambos anticuerpos han demostrado la reducción de incidencia de rechazo agudo celular comparado con los corticoides cuando se han usado en pacientes con doble o triple pauta de inmunosupresión en trasplante renal, hepático, cardíaco o islotes. Estudios recientes han demostrado resultados similares cuando se compara basiliximab con ATGAM en inducción y también ha demostrado su eficacia en pautas libres de esteroides en trasplante renal y hepático 28. Ensayos aleatorizados han demostrado que la adicción a una terapia basada en un inhibidor de la calcineurina reduce el riesgo de rechazo agudo en los primeros 6 meses. Cuando se compara con placebo, a un año, no hay diferencias en la incidencia de infección o neoplasias. Cuando se comparan con otros anticuerpos, no hay diferencias en los efectos del tratamiento pero producen menos efectos adversos 29.
En un estudio realizado de daclizumab en trasplante cardíaco, se observó aumento del número de muerte por infecciones cuando se administraba de manera conjunta con tratamiento citolíticos 30.
Eficacia en la activación de la presentación de antígenos
La presentación de antígenos naive se inicia generalmente a través de las células presentadoras de antígeno (APC) activadas. La movilización de las APC puede ser limitada mediante una buena técnica de preservación. Los corticoides también pueden disminuir la movilización de APC. Los preparados de anticuerpos policlonales limitan la función de las APC interrumpiendo la sinapsis APC-linfocito mediante anticuerpos antiadhesión y MHC-específicas. La función de la APC se ve aumentada por la moléculas de coestimulación. Los agentes que actúan a ese nivel también afectan a la presentación de antígenos.
En la década pasada ha aparecido un interés por las vías de coestimulación como diana de la manipulación inmune. Estos agentes reducen la eficacia de la presentación de antígenos y aumenta el umbral de activación de los linfocitos T naive. El interés clínico se basa en la utilización en estrategias de reducción de calcineurínicos. Existen fármacos que interfieren en una de las dos vías principales. Uno son los anticuerpos humanizados específicos de CD154 (hu5c8 y IDEC-131), aunque estudios iniciales mostraron escasa eficacia y riesgo tromboembólico con el uso de hu5c8. Otros son dos agentes específicos para moléculas B7, uno es un cocktail de anticuerpos específicos humanizados frente a CD80 y CD86 y otro que es una proteína de fusión específica del dominio B7 de CTLA4 (Belatacept) que inhibe la coestimulación a través de CD28. Actualmente se encuentra en ensayos fase III 31.
Modificación del umbral de activación
La mayoría de los agentes inmunosupresores actúan a este nivel. Los inhibidores de calcineurina, los anticuerpos anti-TCR (limitando la unión a TCR o la señal de transducción), los inhibidores de TOR, los antagonistas de receptores de IL-2 (limitan los efectos de las ciotocinas activadas), los glucocorticoides y los antagonistas de la coestimulación (disminuyen la unión a CD28).
Tráfico celular
Los glucocorticoides y la mayoría de los preparados policlonales antilinfocíticos tienen actividad antiadhesión. Un nuevo fármaco, el FTY720, que es un agonista del receptor de la esfingosina-1-fosfato, molécula crítica en la regulación de la sensibilidad a las chemoquinas.
Terapias de mantenimiento
Los inmunosupresores utilizados para prevenir el rechazo del injerto, interfieren en diferentes lugares de la cascada de activación de los linfocitos T y B.
1.La ciclosporina (CSA) y tacrolimus (TAC) inhibe la transcripción de citocinas.
2.La azatioprina (AZA) y el mofetil micofenolato (MMF) inhiben la síntesis de nucleótidos.
3.Inhibidores del TOR: sirolimus o rapamicina y everolimus, inhiben la transducción de la señal de factores de crecimiento.
Inhibidores de la calcineurina: tacrolimus y ciclosporina
El mecanismo de acción de los inhibidores de la calcineurina es bloqueando a nivel intracelular en los linfocitos T las señales responsables de la producción de citocinas. No consiguen inhibir por completo la producción de citocinas, sino que reducen su producción.
Aunque CSA y TAC dependen de diferentes mediadores intracelulares para conseguir su acción, la diana es la misma (la calcineurina). Estos fármacos deben unirse a unas proteínas intermediarias para realizar su acción.
Para la CSA, la proteína intermediaria se llama ciclofilina y está presente normalmente en el citoplasma. En presencia de Ca++ intracelular y de otra molécula llamada calmodulina, el complejo ciclofilina-CSA se une al sitio activo de la calcineurina. Esto hace que la calcineurina no pueda desfosforilar al factor nuclear de células T activadas (NFAT), que no puede entrar al núcleo, no siendo posible su unión a los promotores de citocinas y alterando la producción de citocinas.
Tacrolimus actúa de manera similar, pero su mediador intracelular es una molécula llamada FKBP-12. Cuando TAC se une a FKBP-12 en presencia de calmodulina y calcio, el complejo TAC-FKB12 se une al sitio activo de la calcineurina. El efecto sobre NFAT es el mismo que CSA, inhibiendo la producción de citocinas. TAC es ×10-100 veces más potente que ciclosporina y parece que limita la producción de algunas citocinas que no se ven afectadas por CSA.
CSA es un polipéptido cíclico que consta de 11 aminoácidos y es el principal producto del hongo Tolypocladium inflatum. El perfil farmacocinético de CSA se ve afectado por varios factores debido a su liposolubilidad: disfunción renal y hepática, bilirrubina elevada, contenido de grasa corporal. También la edad influye en el aclaramiento. La vía preferida de administración es la oral. Si el paciente no puede tolerar la vía oral, se puede usar intravenoso a un tercio de la dosis oral. La dosis inicial es de 5-6 mg/kg de peso y se administra entre 4 y 12 h preoperatorio. La dosis inicial es de 5-6 mg/kg/día. Puede dividirse en 2-3 dosis al día. La forma intravenosa tiene riesgo aumentado de nefrotoxicidad y la vía intravenosa sólo debe emplearse cuando haya contraindicación o intolerancia de la oral. La dosis debe individualizarse de acuerdo a las concentraciones de sangre o plasma y el aclaramiento de creatinina. Presenta una alta variabilidad interpaciente e intrapaciente, por el perfil de absorción y eliminación. La monitorización de las concentraciones plasmáticas es necesaria para mantener rango terapéutico, con el mínimo riesgo de efectos adversos. La CSA tiene potencial interacción medicamentosa por su metabolismo hepático a través del citocromo CYP450 A, vía utilizada por diferentes fármacos en su metabolización. Entre sus efectos adversos, destaca la nefrotoxicidad, con una disminución del aclaramiento de creatinina, elevación de la creatinina sérica y un desproporcionado incremento de nitrógeno ureico en sangre, con volumen de orina y reabsorción de sodio conservado. Es característica la hiperpotasemia y la hipertensión. La hiperuricemia y la acidosis tubular tipo IV también pueden producirse. Los mecanismos propuestos de la nefrotoxicidad de la CSA son: toxicidad glomerular y la alteración de la hemodinámica renal. También puede producir toxicidad hepática, caracterizada por elevaciones de las transaminasas séricas. Suele ser dosis-dependiente y revierte con la disminución de la dosis de CSA. Otros efectos adversos en la toxicidad neurológica, con temblor, parestesia, debilidad muscular y crisis. Las pautas triples que incluyen CSA permiten utilizar dosis más bajas, disminuyendo su perfil de toxicidad.
Tacrolimus es un macrólido producido por Streptomyces tsukubaensis. El mecanismo de acción es similar a la ciclosporina, aunque es 10-100 veces más potente. El TAC fue aprobado por la Food and Drug Administration (FDA) para la profilaxis del rechazo agudo en el trasplante hepático en 1995 y del renal en 1997. La incidencia y severidad de los episodios de rechazo agudo tanto en riñón como en hígado se reducen con los tratamientos basados en TAC como inmunosupresor mayor. Puede administrarse por vía intravenosa u oral, aunque se recomienda utilizar la vía oral en cuanto sea posible. Es necesaria la monitorización terapéutica para ajuste de dosis en rangos terapéuticos y evitar toxicidades. Los efectos adversos son similares a los descritos en la ciclosporina. En un metaanálisis reciente que compara TAC contra CSA como pauta de inmunosupresión primaria en el trasplante renal, muestra que a un año, TAC es superior que CSA mejorando la supervivencia del injerto y previniendo el rechazo agudo, pero aumenta la incidencia de diabetes postrasplante, y los efectos neurológicos y gastrointestinales. No se encontraron diferencias en cuanto a la frecuencia de infección o neoplasia 32. En otro artículo que revisan las complicaciones infecciosas asociadas a agentes inhibidores de calcineurina, la frecuencia y el espectro de infecciones no se modifica por el tipo de IC elegido. Algunos estudios que utilizan TAC-MMF se han descrito una mayor incidencia de nefropatía por virus BK 33.
Azatioprina y mofetil micofenolato
La azatioprina es un antagonista de las purinas, que interfiere en la síntesis de ácidos nucleicos durante la expansión clonal de las células produciendo una disminución de la síntesis de ADN y de las moléculas precursoras. La azatioprina es activa después de su conversión a 6-mercaptopurina in vivo. Sus principales efectos adversos son la toxicidad hematológica, a nivel medular, con leucopenia, anemia macrocítica y trombocitopenia. Estos efectos son dosis-dependiente y son más severos en los pacientes con insuficiencia renal. También, a dosis altas, ocurren efectos a nivel digestivo, con náuseas, diarrea y anorexia. Se han descrito ulceraciones de las mucosas a nivel oral y esofágico. Puede producirse toxicidad hepática, con elevación de bilirrubina y enzimas hepáticas. Otros son la fiebre, exantema, miopatía y pancreatitis.
Mofetil micofenolato es un antimetabolito que inhibe de manera reversible la enzima IMPDH, una enzima que limita la síntesis de novo de purinas, evita la proliferación de células T y B e inhibe la producción de anticuerpos. Varios ensayos clínicos han demostrado que el MMF es más seguro y eficaz comparado con AZA cuando se combina para la prevención del rechazo agudo en el trasplante renal o/y en otros órganos. Los principales efectos adversos son de intolerancia a nivel digestivo, como náuseas, vómitos y diarrea. Respecto al riesgo aumentado de infección principalmente por CMV, estudios iniciales realizados en trasplante renal sugirieron un incremento de la tasa de infección por CMV en pacientes con MMF (dosis de 3 mg/día) 34. Otros grupos ha descrito una mayor incidencia de enfermedad y de afectación de tracto gastrointestinal por CMV (esofagitis, gastritis) el grupo MMF 35. Estudios posteriores en trasplantados renales no han encontrado esta asociación de MMF e infección por CMV con dosis inferiores (2 mg/día) 36,37.
Inhibidores de TOR (I-TOR)
Son una nueva clase de agentes inmunosupresores que actúan inhibiendo la serina-treonina cinasa de mamíferos (mTOR). Son dos, el sirolimus (SRL rapamicina) y el everolimus (ERL). Estos fármacos son complemento de los inhibidores de la calcineurina, ya que no la bloquean y no tienen efectos vasomotores a nivel renal. Además, pueden ser complementarios de los inhibidores del IL-2-R.
Sirolimus es un macrólido producido por Streptomyces hygroscopicus y de estructura similar a TAC. Es aproximadamente 27 veces más potente que TAC en modelos animales. Actúa uniéndose a mTOR, haciendo la enzima no eficaz para la vía de activación y que inhibe efectivamente la proliferación de células T. El bloqueo de mTOR disminuye la respuesta a la señal 2 de coestimulación durante la transición de G0 a G1. La administración es por vía oral. La administración conjunta de CSA y sirolimus aumenta de la absorción de este último, por lo que se aconseja tomarlo 4 h después de CSA. Entre sus efectos adversos destaca el aumento de colesterol y triglicéridos y alteración de la curación de la herida por inhibición de la elaboración de factores de crecimiento en respuesta a daño tisular, efecto que se ve potenciado al combinarse con CE 38,39. Los principales beneficios son permitir pautas con reducción de dosis o eliminación de CSA. Algunos ensayos han comunicado que la retirada de CSA en pacientes que reciben sirolimus y corticoides mejora la función renal sin incrementar el riesgo de rechazo 39.
En un metaanálisis reciente realizado en trasplante renal I-TOR han sido evaluados en cuatro diferentes algoritmos de tratamiento inmunosupresor: como sustituto de calcineurínicos y antimetabolitos, en combinación a dosis altas y bajas de calcineurínicos y con dosis variable con calcineurínicos. En general, los end-points subrogados de supervivencia del injerto son favorables a I-TOR (menor riesgo de rechazo agudo y mayor tasa de filtrado glomerular) y en los end-points subrogados de evolución de pacientes son peores para I-TOR (supresión medular y alteraciones del perfil lipídico). Cuando I-TOR reemplaza a los antimetabolitos, se reduce el rechazo agudo y la infección por CMV, aumentando la hipercolesterolemia 40.
Infección oportunista y trasplante
El factor específico que más contribuye al riesgo de infección en los pacientes trasplantados es el protocolo inmunosupresor utilizado 41. Como se ha analizado en el apartado anterior y a pesar de la diversidad de fármacos existentes, estamos lejos de encontrar un equilibrio inmunosupresor adecuado que prevenga el rechazo y, a la vez, preserve la capacidad del sistema inmunitario en la lucha contra la infección (fig. 3).
Figura 3. Origen de la infección en el trasplante.
Cronología de la infección postrasplante
Observamos un claro patrón cronológico, a pesar de los cambios observados en los diferentes regímenes inmunosupresores. Clásicamente, desde Rubin, se han considerado 3 períodos: a) precoz (primer mes): predominio infección nosocomial; b) intermedio (2-6 meses): predominio de la infección oportunista; c) tardío (más de 6 meses) progresiva disminución de la inmunosupresión y del riesgo derivado de infección 42. El mayor riesgo de infección no es por tanto genérico, sino específico y varía en función del momento. Aquellas infecciones que denominamos oportunistas (generalmente microorganismos intracelulares) y que precisan preferentemente de los mecanismos de inmunidad celular, se presentan durante el período de mayor inmunosupresión, entre el segundo y el sexto mes. En los pacientes en los que se hace necesario por rechazos repetidos una mayor inmunosupresión este período de tiempo puede ser mayor. En la tabla 2 se muestran los microorganismos más frecuentemente implicados en estas infecciones oportunistas.
Origen de las infecciones oportunistas en el paciente trasplantado
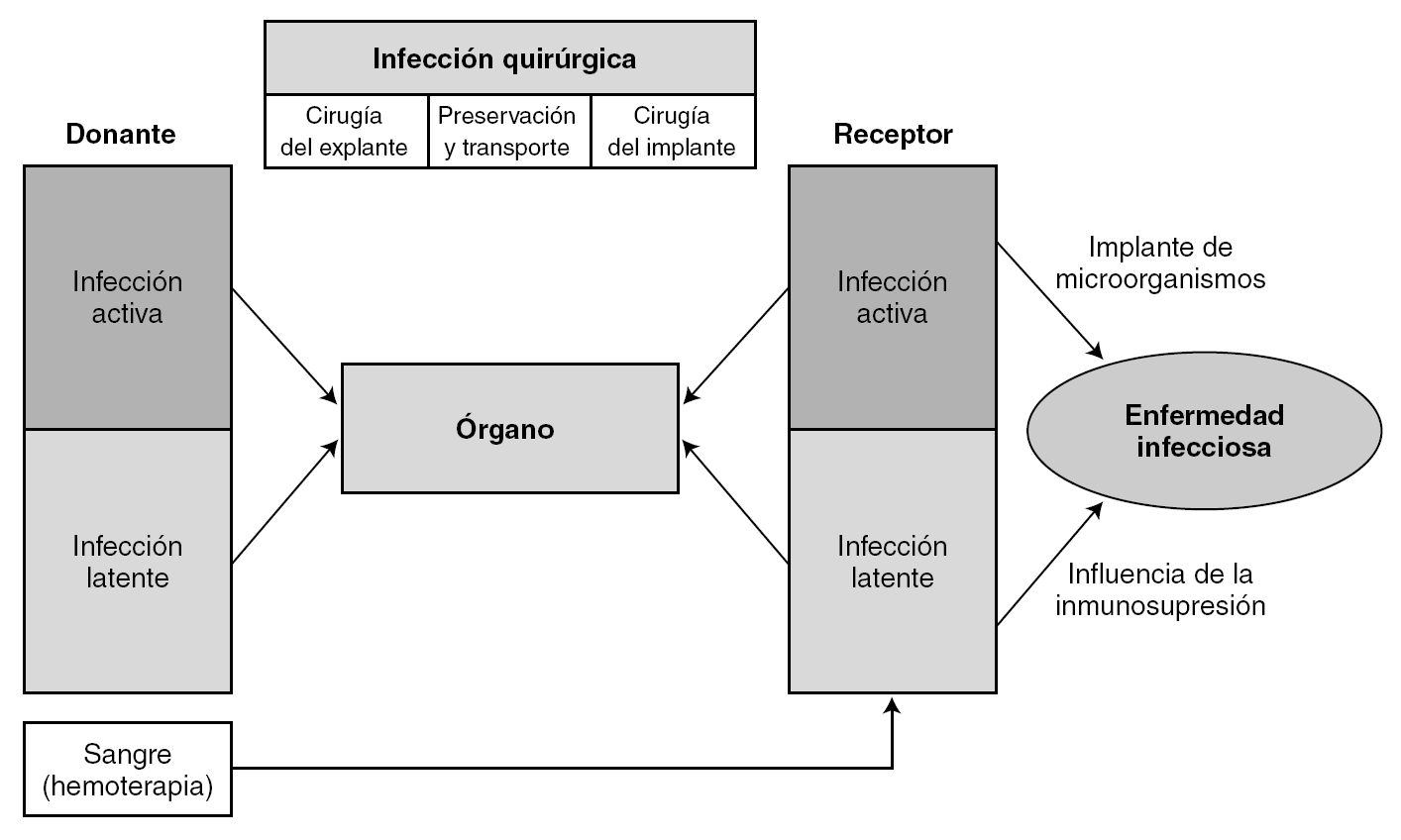
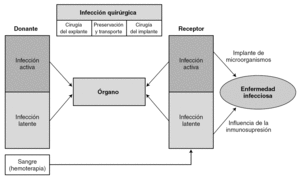
Los microorganismos oportunistas proceden frecuentemente de la reactivación endógena de infecciones latentes (resultan ineficaces en ellas medidas de barrera). También pueden tener un origen exógeno (medio ambiente físico, desde otros seres humanos, o ser transmitido por el órgano trasplantado o por los derivados hemáticos). Por todo ello, no resulta fácil establecer el origen de la infección que se presenta tras el trasplante. En la figura 4 se esquematiza el posible origen de la infección.
Figura 4. Origen de la infección en el trasplante.
Podemos reconocer tres mecanismos de adquisición de estas infecciones latentes 43: a) primoinfección, en los pacientes seronegativos que reciben órganos (o transfusiones) con infección latente y que pueden desencadenar los cuadros clínicos más graves; b) reactivación de la infección latente, en pacientes seropositivos, o c) sobreinfección del receptor seropositivo, que recibe un órgano de un donante también seropositivo.
Infecciones oportunistas frecuentes en el trasplante de órgano sólido
Infecciones virales
Las infecciones virales son muy frecuentes en estos pacientes. Además, pueden favorecer la aparición de rechazo o disfunción del injerto, de otras infecciones y de neoplasias. En general tienen un curso más agresivo que en la población general.
Citomegalovirus. Es la infección viral más frecuente en los pacientes trasplantados. Un 60-90% de los pacientes se encuentran infectados, y en ausencia de profilaxis, 25-50% presentarán enfermedad clínica. La infección por CMV ocasiona en el receptor efectos directos e indirectos. Los efectos directos incluyen el síndrome viral (fiebre, síntomas constitucionales como debilidad, mialgias y artralgias y cierto grado de leucopenia o trombocitopenia) y la enfermedad por CMV (en la que se pueden ver afectados diversos órganos, tales como pulmón, tracto gastrointestinal, hígado, sistema nervioso central, corazón, riñón, retina, páncreas, etc., aunque frecuentemente se afecta el órgano trasplantado). Los efectos indirectos son aquellos producidos por las propiedades inmunomoduladoras del virus que condicionan un aumento de la incidencia de otras infecciones oportunistas, la disminución de la supervivencia del injerto y la del paciente. En el manejo/prevención de esta infección se ha utilizado la profilaxis y el tratamiento anticipado sin que haya sido posible establecerse claramente la superioridad de una u otra 44. Con las medidas de profilaxis en los primeros meses, se ha observado una tendencia a la aparición más tardía de las manifestaciones clínicas 45.
Virus de Epstein-Barr. Tiene un un papel patogénico primordial en los síndromes linfoproliferativos postrasplante (SLPT). Entre ellos encontramos desde formas benignas autolimitadas de proliferación policlonal de células B, hasta el desarrollo de proliferaciones monoclonales malignas. Se debe vigilar estrechamente a los receptores seronegativos de un donante seropositivo con vistas a un diagnóstico precoz, aunque no disponemos de medidas profilácticas específicas 46. El tratamiento no está bien definido y los antivirales no se han mostrado efectivos. Estudios recientes han abierto nuevas posibilidades terapéuticas con rituximab (anticuerpos monoclonales anti-CD20) y anti-IL-6.
Virus varicela-zóster. La forma de presentación más frecuente en trasplantados adultos es por reactivación del virus latente, presentándose con afectación de varios dermatomas o en forma diseminada. La primoinfección es más frecuente en el trasplante pediátrico y se asocia a las formas clínicas graves de la enfermedad (neumonitis, hepatitis o encefalitis) 47. Hoy podemos plantear la vacunación pretrasplante de los candidatos seronegativos. Los pacientes trasplantados en quienes se sospeche exposición al virus, deben recibir profilaxis con inmunoglobulinas específicas y/o antivirales.
Otros virus herpes. La infección por virus herpes simple es frecuente y generalmente debida a reactivación. En general causa lesiones leves oro-labiales o genitales. En raras ocasiones la enfermedad se disemina produciendo esofagitis, hepatitis, neumonitis o encefalitis. La infección por virus herpes 6 (VHH-6) y virus herpes 7 (VHH-7), parece comportarse de forma parecida a CMV en cuanto a efectos directos e indirectos. En concreto en la infección por VHH-6 se han descrito cuadros febriles, neumonitis, hepatitis, encefalitis y mielotoxicidad 48.
El virus herpes-8 (VHH-8) es el causante del sarcoma de Kaposi, linfoma de cavidades y enfermedad de Castleman multicéntrica. La incidencia del sarcoma de Kaposi postrasplante oscila entre el 0,5-5%, en función de la seroprevalencia geográfica de infección por el VHH-8. Las lesiones se limitan a la piel en el 20 al 75% de los pacientes. Cuando la enfermedad es diseminada, puede afectar el injerto, nódulos linfáticos, tracto gastrointestinal y pulmones.
Infecciones respiratorias por virus. La infección por virus respiratorios en el paciente trasplantado es común. No disponemos de buenos métodos de diagnóstico y tratamiento para ellos.
Virus de la hepatitis B y C. Los problemas clínicos de la infección por los virus de la hepatitis en el trasplante son complejos y en conjunto representan la primera indicación de trasplante hepático. En concreto en el caso de la hepatitis por VHC la recurrencia tras el trasplante hepático es la regla y su curso más acelerado 49. Existen esquemas de profilaxis/tratamiento con antivirales o interferón, con resultados variables. En trasplante de otros órganos (no hepáticos) la información aún es más limitada aunque también tiene una progresión más acelerada.
Virus BK. Es un miembro de la familia de los poliomavirus al igual que el virus JC y ha sido recientemente implicado como causante de nefropatía del injerto renal 50. La enfermedad se limita primariamente al riñón injertado y tracto urinario de receptores de trasplante renal. Su relación con la aparición de los nuevos inmunosupresores más potentes necesita ser mejor estudiada.
Virus de la inmunodeficiencia humana (VIH). Hoy debido al éxito del tratamiento antirretroviral combinado (TARGA), no constituye una contraindicación para el trasplante. La experiencia obtenida hasta este momento en trasplantes realizados en pacientes VIH+, con buen control terapéutico con TARGA ha sido exitosa 51. Las tasas de supervivencia son similares a las del resto de pacientes y sin progresión de la infección por el VIH, siendo un problema el manejo las interacciones entre los antirretrovirales y los inmunosupresores.
Infecciones bacterianas
Las infecciones bacterianas son globalmente las más frecuentes tras el trasplante. Tienen habitualmente una aparición precoz y están relacionadas con la cirugía y/o la estancia en la unidad de cuidados intensivos (UCI), pero no directamente con la inmunosupresión farmacológica.
Por otra parte, los pacientes sometidos a trasplante tienen un mayor riesgo de presentar determinadas infecciones por bacterias oportunistas como Listeria spp., Rhodococcus spp. o Nocardia spp. Legionella 41. El diagnóstico es más complicado que en la población general, porque las manifestaciones clínicas pueden estar atenuadas y los diagnósticos diferenciales son más extensos. La mortalidad es más elevada. Es imprescindible la obtención de muestras adecuadas para la identificación del agente etiológico.
Tuberculosis. La tuberculosis plantea problemas particulares en esta población. Tiene una incidencia 20-74 veces mayor que en la población general, y puede alcanzar una elevada mortalidad (30%). Suele aparecer de forma tardía y es común la presentación extrapulmonar 52. La coinfección con otros patógenos no es inusual. La mayor dificultad es el tratamiento debido a la interferencia importante que ejerce la rifampicina en el metabolismo de los fármacos inmunosupresores, produciendo una reducción sustancial en los niveles séricos de inhibidores de la calcineurina que se ha relacionado con rechazo grave del injerto.
Infecciones fúngicas
Las infecciones fúngicas en el trasplante son una complicación infrecuente pero grave. Ocurren en el 5-20% de los pacientes según el tipo de trasplante 53. La mortalidad asociada a las micosis invasoras es muy elevada. Varía con el tipo de hongo, el órgano trasplantado y la localización y extensión de la enfermedad, pudiendo alcanzar al 80% de los casos. La mayoría de las infecciones por hongos ocurren en los primeros 6 meses y están producidas por Candida (35-91%) o Aspergillus spp. (9-52%). Cryptococcus neoformans y otros hongos filamentosos completan el espectro de infección fúngica. El diagnóstico de estas infecciones es aún un reto importante y el inicio de la terapia antifúngica intensiva precoz, son esenciales para lograr la curación. El tratamiento no es sencillo, porque se requiere una terapia prolongada en pacientes con inmunosupresión, existiendo la posibilidad de interacciones y toxicidad medicamentosa 54.
El uso generalizado de profilaxis con trimetoprima/sulfametoxazol en el paciente trasplantado ha erradicado prácticamente la neumonía por Pneumocystis jiroveci 55.
Infecciones por parásitos
Las infecciones parasitarias en los pacientes trasplantados se relacionan con factores de riesgo epidemiológicos, como áreas geográficas específicas y transmisión por vectores. Su incidencia en casos comunicados ha aumentado en los últimos años debido al incremento del fenómeno migratorio y los viajes internacionales.
Toxoplasmosis. T. gondii es un parásito de distribución mundial, con tasas de seroprevalencia que varían del 5 al 70%. Los pacientes más frecuentemente afectados son los trasplantados cardíacos. En los casos de riesgo D+ R se debe recibir profilaxis.
Leishmaniasis. En los pacientes trasplantados puede presentarse como enfermedad diseminada. Es uno de los diagnósticos diferenciales en pacientes con fiebre de origen desconocido que provengan de zonas endémicas. Tanto el diagnóstico como el tratamiento son similares a los de los pacientes inmunocompetentes 56.
Paludismo. Además de la infección en receptores de áreas endémicas de malaria, se ha descrito transmisión de la enfermedad a través del donante. Debe por tanto sospecharse en receptores con síndrome febril agudo que hayan estado en zonas endémicas y descartarse en donantes. La fiebre es el síntoma más frecuente, aunque no sigue un patrón clásico de periodicidad. El diagnóstico y el tratamiento no son diferentes a los que se realizan en pacientes inmunocompetentes 56.
Estrongiloidiasis. La estrongiloidiasis en los pacientes trasplantados tiene un comportamiento similar al de otros pacientes inmunocomprometidos. La infección asintomática puede convertirse en enfermedad diseminada o en síndrome de hiperinfección. Es más frecuente durante los primeros meses postrasplante. En pacientes con riesgo específico debe realizarse un cribado activo de la infección 57.
Infección y trasplante: direcciones futuras
En el horizonte aparece la necesidad de reducir los efectos secundarios y la toxicidad de los protocolos inmunosupresores actuales. Es preciso modular la inmunosupresión haciendo cada vez tratamientos más selectivos e individualizados y por ello, con menor riesgo de infección. Todo ello conllevará cambios en el esquema cronológico de aparición de las infecciones oportunistas.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.
ANEXO
1.Una de las siguientes citocinas no se relaciona con la respuesta TH2:
a)IL-2.
b)IL-4.
c)IL-5.
d)IL-6.
e)IL-10.
2.En uno de los siguientes trasplantes no es necesario realizar la prueba cruzada (cross-match):
a)Trasplante de riñón.
b)Trasplante de corazón.
c)Trasplante de hígado.
d)Trasplante de páncreas.
e)En todos los anteriores.
3.¿Qué mecanismos están implicados en el rechazo?
a)Mecanismos humorales.
b)Mecanismos celulares.
c)Moléculas de adhesión.
d)Quimiocinas.
e)Todos los anteriores.
4.Uno de los siguientes inmunosupresores no actúa a nivel de la activación de presentación de antígenos:
a)OKT3.
b)ATGAM.
c)Alentuzumab.
d)Ciclosporina.
e)Daclizumab.
5.El principal efecto secundario de los fármacos calcineurínicos es:
a)La tolerancia digestiva.
b)La mielotoxicidad.
c)La insuficiencia renal.
d)La fotosensibilidad.
e)La cardiotoxicidad.
6.Cuál de los siguientes inmunosupresores actúa inhibiendo la enzima IMPDH:
a)Ciclosporina.
b)Tacrolimus.
c)Azatioprina.
d)Sirolimus.
e)Mofetil micofenolato.
7.Habitualmente, el período de inmunosupresión máxima y de mayor riesgo de infección oportunista
tras el trasplante de un órgano sólido es:
a)Primer mes postrasplante.
b)Siempre persiste el riesgo.
c)2-6 mes postrasplante.
d)A partir del 6.º mes.
e)A partir del 12.º mes.
8.Con respecto a la infección oportunista en el trasplante todas son falsas excepto una:
a)Dada su gravedad suelen tener manifestaciones clínicas muy floridas.
b)Lo habitual es realizar tratamientos empíricos.
c)La toxicidad de los fármacos es menor.
d)La serología tiene escaso valor en el diagnóstico de la infección.
e)No se dan coinfecciones.
9.¿Cuál de los siguientes no es un factor de riesgo para el desarrollo de un SLPT?
a)Elevados niveles de viremia por VEB.
b)Edad avanzada.
c)Niveles elevados de inmunosupresión.
d)Trasplante de órgano de donante seropositivo a receptor seronegativo.
e)Todos son factores de riesgo.
10.El diagnóstico de un síndrome linfoproliferativo postrasplante se hace por:
a)Técnicas de PCR para el virus de Epstein-Barr (VEB).
b)Técnica ELISPOT cuantitativo de células T VEB específicas.
c)PCR para el gen que transcribe el VEB.
d)Anatomo-patológico.
e)Todas las anteriores.
Correspondencia:
Dr. J. Fortún
Servicio de Enfermedades Infecciosas. Hospital Ramón y Cajal.
Ctra. Colmenar, km 9,100. 28034 Madrid. España.
Correo electrónico: fortun@mi.madritel.es
Manuscrito recibido el 29-11-2006; aceptado el 29-11-2006.