Introducción
Enfuvirtida es el primer fármaco, y hasta la fecha el único disponible, de una nueva familia de antirretrovirales (ARV), los inhibidores de la fusión 1. Sus características químicas, su mecanismo y lugar de acción, así como su vía de administración son diferentes de los de otras familias de ARV, lo que le confiere un perfil único en cuanto a farmacología, eficacia terapéutica, resistencias y tolerancia. La posibilidad de utilización de este nuevo fármaco ha suscitado un extraordinario interés entre la comunidad científica y entre las personas que lo reciben o pueden ser candidatas a recibirlo. Recientemente se han publicado algunas excelentes revisiones 2-6 y un documento de consenso 7 sobre el tratamiento con enfuvirtida.
A pesar de disponer de mucha información científica, existen todavía dudas respecto a la administración crónica de un fármaco relativamente nuevo, caro y por vía subcutánea, de manera que habitualmente se utiliza en fases muy tardías de la infección por el virus de la inmunodeficiencia humana (VIH) cuando su eficacia puede verse comprometida. El presente documento recoge la opinión de 247 expertos en el tratamiento de la infección por el VIH en España y el consenso alcanzado sobre la administración de enfuvirtida en la práctica clínica, así como sobre diferentes aspectos que pueden facilitar o dificultar el uso óptimo y más eficiente de este fármaco.
Metodología
La escasez de información objetiva sobre el papel de enfuvirtida en la práctica clínica habitual, así como las posibles actitudes y recelos que pueden dificultar su uso adecuado, aconsejó la elección de una metodología centrada fundamentalmente en la opinión de expertos. Para disminuir en lo posible el sesgo de opinión se incluyó en la discusión a un número elevado de médicos que atienden a personas infectadas por el VIH en España.
Tres de los autores (ER, SM y PV) fueron los promotores y coordinadores del estudio. Seleccionaron a 20 médicos de reconocido prestigio en el tratamiento de personas con infección por el VIH, representantes de las diferentes áreas geográficas de España. Los coordinadores recopilaron la información científica sobre enfuvirtida e inhibidores de la fusión disponible hasta marzo de 2005 en español y en inglés (publicaciones desde 1998, obtenidas a través de PubMed y comunicaciones en congresos científicos desde 2000) sobre enfuvirtida y diseñaron un cuestionario-guión con los aspectos más relevantes del tratamiento con este medicamento. Invitaron a los médicos seleccionados a participar en la elaboración definitiva del guión de trabajo con el material indicado y a que actuaran como moderadores de una serie de reuniones locales de consenso realizadas en su área geográfica, para lo cual se realizaron tres reuniones regionales entre coordinadores y moderadores. Así mismo, se seleccionaron a tres médicos con experiencia en el tratamiento de pacientes infectados por el VIH para que actuaran como redactores y elaboraran un acta de cada una de las reuniones.
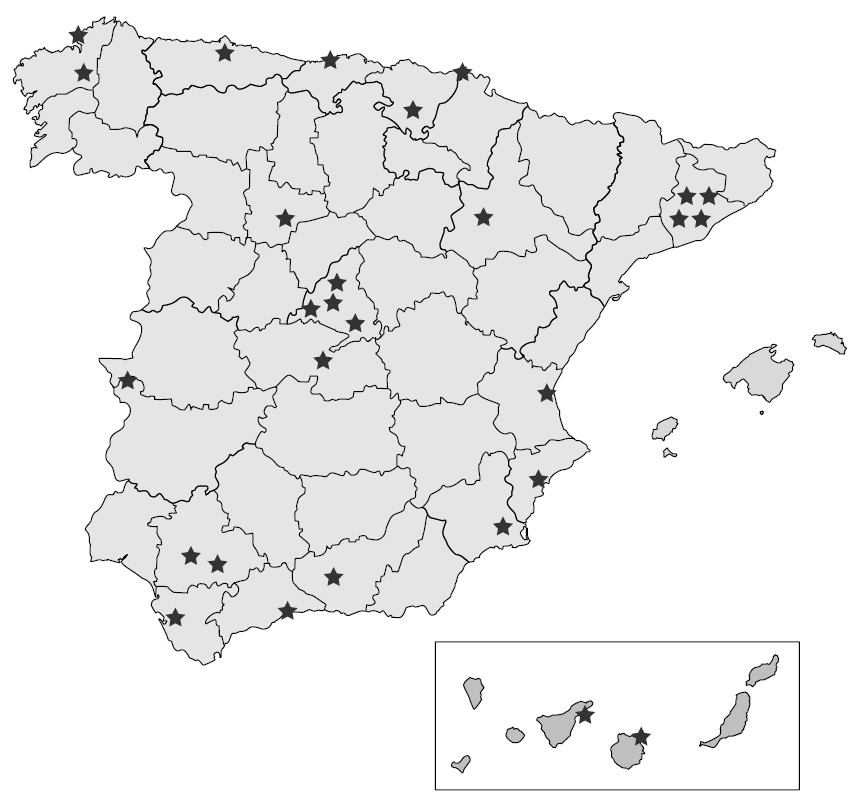
Se convocaron 28 reuniones locales, con 247 médicos participantes (6 a 12 médicos en cada una). Estas reuniones se celebraron entre mayo y septiembre de 2005, en horario de tarde, con una duración media de 4 h. La figura 1 muestra la distribución geográfica de las reuniones locales. Cada uno de los médicos participantes había recibido previamente un extenso dossier con la información científica sobre enfuvirtida y al inicio de cada reunión el moderador resumió esta información con la proyección de 30 diapositivas comunes a todas las reuniones. A continuación se discutieron los aspectos más relevantes relacionados con el uso de enfuvirtida, siguiendo el guión común preestablecido. Tras cada reunión, el redactor asistente elaboró un acta con la opinión de los participantes, la cual se remitió a los coordinadores tras ser aprobada por el moderador.
Figura 1. Distribución geográfica de las 28 reuniones locales de consenso en las que participaron 247 médicos.
Los redactores, los moderadores y los coordinadores se reunieron en octubre de 2005 para poner en común las opiniones expresadas en las reuniones de consenso locales, intentando encontrar aquellos puntos que reflejaran el consenso de los médicos participantes, así como los aspectos en los que existían dudas, falta de datos o desacuerdo. El documento final fue escrito por los tres coordinadores y revisado y aprobado por todos los médicos participantes en las reuniones.
El documento se ha redactado dividido en dos partes. En la primera se revisan las características de enfuvirtida (potencia, eficacia, adherencia e impacto sobre la calidad de vida, resistencia y seguridad) y se incluyen las opiniones de los expertos sobre las mismas. En la segunda parte, se establecen recomendaciones de consenso para optimizar el uso de enfuvirtida en la práctica clínica. Las recomendaciones y opiniones de consenso alcanzadas se han categorizado según el grado de evidencia científica en la que se apoyan. La tabla 1 muestra la clasificación de los grados de evidencia y de las recomendaciones utilizada en el documento.
Características de enfuvirtida
Potencia
La administración de 90 mg/12 h de enfuvirtida durante 14 días por vía intravenosa 8 o subcutánea 9 produjo un descenso de la carga viral (CV) de 1,96 y de 1,6 log10, respectivamente. Con los análogos de nucleósidos/nucleótidos actualmente disponibles administrados en monoterapia se produce un descenso de la CV que oscila entre 0,76 y 1,60 log10 y con los inhibidores de la proteasa (IP) un descenso entre 1,27 y 1,73 log10.
También puede dar una idea de la potencia de enfuvirtida el rápido descenso de la CV observado en los estudios TORO. A la semana de tratamiento los pacientes que recibieron enfuvirtida presentaron un descenso de la CV superior a 1 log10.
Consenso:
* Enfuvirtida es un fármaco muy potente per se, con una potencia intrínseca similar a la de los ARV más potentes (grados de evidencia Ib, IIb).
Eficacia y factores pronósticos de respuesta
Los dos estudios fundamentales para conocer la eficacia de enfuvirtida son los estudios TORO 1 10 y TORO 2 11, con el análisis conjunto de ambos 12 y múltiples subanálisis presentados en congresos científicos. Se incluyeron 995 pacientes con infección por VIH muy avanzada, en situación de fracaso virológico y que habían fracasado frente a las tres familias de ARV. Se aleatorizaron (2:1) para recibir un tratamiento optimizado (TO), constituido por 3 a 5 ARV de acuerdo al genotipado y al historial terapéutico previo, asociado a enfuvirtida frente a TO solo (grupo control). A las 48 semanas de tratamiento tanto el descenso de la CV (1,48 log10 frente a 0,63 log10), como el porcentaje de pacientes con un descenso de la CV > 1 log10 (37,4% frente a 17,1%), con CV < 400 copias/ml (30,4% frente a 12%) o con CV < 50 copias/ml (18,3% frente a 7,8%) fue significativamente superior en los pacientes que recibieron enfuvirtida. El incremento de linfocitos CD4 también fue significativamente más elevado en los pacientes tratados con enfuvirtida (91 cél./μl frente a 45 cél./μl).
Los estudios RESIST 1 y RESIST 2 son dos ensayos clínicos fase III que incluyeron cerca de 1.500 pacientes que habían fracasado a las tres familias convencionales de ARV. Comparan la eficacia y seguridad de un TO con tipranavir potenciado frente a TO con otro IP potenciado comparador (IPC). La aleatorización fue 1:1 y el 20,5% de pacientes recibieron enfuvirtida, formando parte del TO. Se dispone de resultados a las 48 semanas y globalmente y en todos los subgrupos analizados tipranavir resultó más eficaz que el IPC. Los pacientes que recibieron enfuvirtida estaban más inmunodeprimidos y presentaban una CV más elevada, a pesar de lo cual el tratamiento fue más eficaz cuando se administró enfuvirtida. El porcentaje de pacientes con CV < 50 copias/ml fue del 36% en los pacientes sin tratamiento previo (naive) a enfuvirtida que recibieron tipranavir y enfuvirtida, del 20% en los que recibieron tipranavir sin enfuvirtida, del 14% en los que recibieron IPC y enfuvirtida y del 10% en los que recibieron IPC sin enfuvirtida. El beneficio de eficacia con enfuvirtida fue independiente del número de mutaciones basales a los IP 13.
Los estudios POWER 1 y POWER 2 son dos ensayos clínicos fase IIb que comparan la eficacia y tolerancia de diferentes dosis de TMC114 (darunavir) potenciado con ritonavir frente a la de un IPC, asociados ambos a un TO 14,15. El 48% de pacientes recibieron enfuvirtida formando parte del tratamiento optimizado. Disponemos de resultados preliminares de 110 pacientes seguidos hasta la semana 24. TMC114 resultó considerablemente más eficaz que el IPC con un marcado aumento de su eficacia cuando se asoció a enfuvirtida. El porcentaje de pacientes con CV < 50 copias/ml fue del 67% (n = 27) en los pacientes naive a enfuvirtida que recibieron TMC-114 y enfuvirtida, del 37% (n = 27) en los que recibieron TMC-114 sin enfuvirtida, del 16% (n = 39) en los que recibieron IPC y enfuvirtida y del 8% (n = 25) en los que recibieron IPC sin enfuvirtida. Es preciso comprobar si estos resultados siguen cumpliéndose a las 48 semanas.
En los estudios TORO se identificaron 4 factores independientes relacionados con una mejor respuesta virológica al tratamiento con enfuvirtida: cifra basal de linfocitos CD4 > 100 cél./μl (odds ratio [OR] = 2,1), CV basal < 5 log10 (OR = 1,8), número de fármacos ARV previos ≤10 (OR = 2,4) y número de fármacos activos en el nuevo tratamiento ≥2 (OR = 2,3). El porcentaje de pacientes que presentaron una CV < 400 copias/ml a las 48 semanas de tratamiento fue 11% sin ningún factor de buen pronóstico, 20% con un factor, 42% con dos factores, 56% con tres factores y 67% con cuatro factores 16,17. La respuesta virológica e inmunológica a enfuvirtida a las 12 semanas de tratamiento fue predictiva de la evolución virológica e inmunológica a las semanas 24, 48 y 96. De los pacientes que presentaron un descenso de la CV ≥1 log a la semana 12, el 61% presentaron una CV < 400 copias/ml a la semana 48, comparado con solo un 2% en los pacientes sin respuesta virológica la semana 12 18.
Consenso:
* Enfuvirtida es un fármaco muy eficaz en el tratamiento de rescate de pacientes infectados por el VIH que han fracasado a múltiples tratamientos previos (Ib).
* Los factores pronósticos de respuesta virológica descritos en los estudios TORO son obvios y comunes a otros fármacos ARV, y deben utilizarse para seleccionar el mejor escenario posible de uso de enfuvirtida (IV).
* El conocimiento de los factores pronósticos nos confirma la realidad actual: enfuvirtida suele utilizarse cuando tiene menos probabilidades de éxito (IV).
* El factor pronóstico más importante es la disponibilidad de al menos otro fármaco plenamente activo, además de enfuvirtida (IV).
* La disponibilidad de nuevos medicamentos como tipranavir o TMC-114 puede incrementar notablemente la eficacia del tratamiento con enfuvirtida en pacientes con múltiples fracasos virológicos previos (IIb).
Adherencia e impacto sobre la calidad de vida
La adherencia a enfuvirtida y al resto del tratamiento antirretroviral (TAR) en los estudios TORO resultó satisfactoria, sin diferencias entre los pacientes con antecedentes de uso de drogas por vía parenteral y los que no tenían este antecedente 19. Hasta la semana 48, el 84% de pacientes refirieron una adherencia mayor al 95% y el 90% una adherencia superior al 90%. Una adherencia a enfuvirtida superior al 95% se asoció a una mayor probabilidad de presentar CV < 400 copias/ml y a un mayor incremento de linfocitos CD4. Otros estudios han confirmado la elevada adherencia al TAR de los pacientes que reciben enfuvirtida 20.
La calidad de vida relacionada con la salud, medida con el cuestionario MOS-HIV, mejoró significativamente en los pacientes de los estudios TORO que recibieron enfuvirtida con respecto a los del grupo control 21. La mejora de la mayoría de escalas (salud general, salud mental, energía-astenia, calidad de vida) fue significativamente superior con enfuvirtida. La única escala con mejores resultados en el grupo control fue el de relaciones sociales, sin que la diferencia fuera estadísticamente significativa. La magnitud de la mejoría de las escalas de calidad de vida se relacionó con la respuesta inmunovirológica 22.
En un subanálisis de los estudios TORO se comprobó que el 70% de pacientes que recibieron enfuvirtida, refirieron que el tratamiento tenía escasa o nula repercusión sobre las actividades generales de la vida cotidiana (trabajo, sueño, vida social), a las 8, 24 y 48 semanas. Un 90% indicaron que enfuvirtida tenía escasa o nula repercusión en las actividades básicas (cuidados personales, comidas, etc.). La autoadministración de enfuvirtida fue calificada de fácil o muy fácil por el 65% de pacientes y de neutral (ni fácil, ni difícil) por el 20%. De los 52 pacientes (9%) que calificaron como difícil la autoadministración del fármaco la semana 8, el 42% la calificaron como neutral o fácil la semana 48 23.
Consenso:
* El tratamiento con enfuvirtida se administra a una población seleccionada y comprometida con su enfermedad, por lo que la adherencia suele ser buena (IV).
* El factor de riesgo para la infección por el VIH no influye sobre la adherencia al tratamiento. Los ex adictos a drogas por vía parenteral que han superado su adicción son tan buenos candidatos a enfuvirtida como las personas que han adquirido la infección por otra vía (III).
* Aunque la adherencia al tratamiento con enfuvirtida es buena y los abandonos son infrecuentes, los pacientes manifiestan a menudo su deseo de disponer de tratamientos orales alternativos al uso de enfuvirtida, así como la posibilidad de realizar suspensiones temporales del tratamiento (IV).
* El tratamiento con enfuvirtida no repercute negativamente sobre la mayoría de actividades de la vida cotidiana, pero sí puede afectar algunas actividades sociales, como son los viajes (III).
Resistencias
Actividad de enfuvirtida sobre virus resistentes a otros fármacos
La concentración inhibitoria 50 (CI50) de enfuvirtida frente a cepas salvajes del VIH oscila entre menos de 0,001 y 7,53 μg/ml 2,24,25. La respuesta virológica no se relaciona con las amplias diferencias observadas en la sensibilidad basal del virus, que dependen del método de determinación y de diferencias individuales. No se han identificado virus resistentes con mala respuesta virológica en pacientes que no han recibido previamente enfuvirtida 26. Aunque en un estudio se han observado ligeras diferencias según el tropismo del virus por los correceptores (CCR5, CXCR4 o dual) 24, la sensibilidad a enfuvirtida es independiente del mismo 27, Los virus con diferentes grados de resistencia a una, dos o las tres clases de ARV mantienen la misma sensibilidad a enfuvirtida que las cepas salvajes del virus 28.
Las mutaciones de resistencia en las posiciones 36-45 de HR1 producen una disminución de la capacidad replicativa del virus, de manera que las variantes resistentes seleccionadas desaparecen en pocos meses tras la suspensión del tratamiento (4 meses en el estudio TRI-003), con reversión al virus salvaje 4,29.
Consenso:
* No existen resistencias cruzadas entre enfuvirtida y los otros ARV disponibles (IIa).
* La sensibilidad del virus no depende de su tropismo por los correceptores (IIa).
* Enfuvirtida es plenamente activo frente a cepas multirresistentes en pacientes en cualquier estadio de la enfermedad (Ib).
Posibilidades de selección de mutantes resistentes
La aparición de mutaciones a nivel del gen que codifica la glicoproteína gp41 (dominio HR1, posiciones 36-45) determina resistencia a enfuvirtida y los virus aislados en pacientes con fracaso virológico a enfuvirtida contienen frecuentemente mutaciones en las posiciones G36D/S, I37V, V38A/M, Q39R y N43D 30-33. La selección de mutantes resistentes se produce rápidamente (2-4 semanas) en los pacientes que no responden al tratamiento. Otros estudios han mostrado que la resistencia a enfuvirtida puede ser más compleja con mutaciones en otras zonas de HR1 y también en HR2 34,35.
Consenso:
* Enfuvirtida es un fármaco de baja barrera genética, con una importante disminución de la susceptibilidad al fármaco cuando se seleccionan una o dos mutaciones de resistencia (IIa).
* En situaciones de monoterapia, real o encubierta, y de fracaso virológico la aparición de resistencias a enfuvirtida es rápida. La mayoría de pacientes en situación de fracaso virológico durante varios meses tendrán virus resistentes (IIb).
Seguridad
Los principales datos de tolerancia y seguridad de enfuvirtida se han obtenido del análisis conjunto de los estudios TORO 1 y TORO 2 36.
Reacciones locales
Las reacciones en lugar de la inyección son los efectos secundarios más frecuentemente asociados al uso de enfuvirtida 36-38. En los estudios TORO, el 98% de pacientes presentaron en alguna ocasión algún tipo de reacción cutánea en el sitio de inyección 36. En la mayoría de casos las lesiones eran de intensidad leve o moderada. Los signos y síntomas locales más frecuentes son las molestias o el dolor (96%), el eritema (91%), la induración (90%), los nódulos o los quistes (80%), el prurito (65%) y los hematomas o equimosis (52%) 36. A pesar de esta elevada incidencia, en los estudios TORO, solamente el 4,4% de pacientes precisaron suspender el medicamento por reacciones locales hasta las 48 semanas de tratamiento y el 7,2% hasta las 96 semanas.
En un estudio reciente el riesgo de presentar reacciones locales de moderadas a graves fue significativamente menor en los pacientes que tenían una mayor cantidad total de grasa en las extremidades en la visita basal 38.
Consenso:
* El único efecto adverso destacable y atribuible a enfuvirtida son las reacciones locales en el lugar de la inyección (Ib).
* Las reacciones locales constituyen uno de los principales motivos del recelo a la prescripción de enfuvirtida. Incomodan al paciente y al médico (IV).
* Las lesiones locales son objetivas, pero la importancia que se les da es muy subjetiva, variando considerablemente la vivencia de un paciente a otro. La ayuda psicológica puede ser importante en algunos casos (IV).
* Aunque las reacciones locales pueden aparecer durante todo el tiempo de tratamiento con enfuvirtida, suelen ser más importantes y tener una mayor repercusión clínica y psicológica al principio del mismo. Con el tiempo, los pacientes suelen mejorar la técnica de administración, toleran mejor las reacciones locales y relativizan su importancia (III).
* La administración de enfuvirtida es más problemática en pacientes con lipoatrofia, los cuales presentan reacciones locales más frecuentes y relevantes (IIb).
Tolerabilidad sistémica
En los estudios TORO el porcentaje de pacientes que suspendió el TAR por toxicidad hasta la semana 48 fue similar en los que recibieron enfuvirtida más TO y en los que sólo recibieron TO. Si excluimos las reacciones locales, la incidencia global de efectos adversos de cualquier gravedad atribuibles al tratamiento fue significativamente más elevada en los que no recibieron enfuvirtida (149,9 episodios por 100 personas-año) que en los que lo recibieron (100,9 episodios por 100 personas-año). La mayoría de efectos adversos que suelen asociarse a los tratamientos de rescate que reciben los pacientes que han presentado varios fracasos terapéuticos previos (diarrea, náuseas, vómitos, astenia), resultaron significativamente más frecuentes en aquellos que no recibieron enfuvirtida 36. La incidencia de lipodistrofia (4,7% frente a 6,8%) y de ginecomastia (1,3% frente a 2,5%) fue similar en los pacientes que recibieron enfuvirtida y en los del grupo control. En un subgrupo de pacientes de ambos grupos se realizó un estudio de la distribución de la de la grasa corporal mediante densitometría por rayos X (DEXA) y tomografía computarizada (TC), sin observar ninguna modificación en su distribución asociada con el uso de enfuvirtida 41.
Aparte de las reacciones locales en el lugar de la inyección, los dos únicos efectos adversos con una frecuencia superior a 5 casos por 100 personas-año que resultaron más frecuentes en el grupo de enfuvirtida que en el grupo control fueron neumonía (RR 10,8) y linfadenopatías (RR 5,7). Durante el tratamiento con enfuvirtida, 45 pacientes presentaron una neumonía (6,7 por 100 personas-año). La etiología fue principalmente bacteriana y la aparición de neumonías se repartió a lo largo de todo el período de tratamiento de los pacientes. La mayoría de pacientes con neumonía tenían una cifra de linfocitos CD4 muy baja y presentaban factores predisponentes tales como tabaquismo, patología respiratoria o uso de drogas parenterales. Solamente uno de los pacientes del grupo control que nunca recibieron enfuvirtida presentó una neumonía (0,6 por 100 personas-año). La incidencia de neumonía en los pacientes tratados con enfuvirtida fue la esperada en los pacientes con infección por VIH con características similares, mientras que resultó inesperablemente baja en los pacientes que no recibieron enfuvirtida 36. En otros estudios no se ha observado una incidencia elevada de neumonía en los pacientes tratados con enfuvirtida 9,37-40. Las adenopatías de los pacientes tratados con enfuvirtida no tuvieron relevancia clínica y ningún paciente suspendió el tratamiento por este suceso. Menos del 1% de los pacientes incluidos en los estudios TORO que recibieron enfuvirtida presentaron reacciones de hipersensibilidad atribuibles al fármaco. Se ha descrito el caso de una paciente con hipersensibilidad sistémica importante por enfuvirtida en la cual la aplicación de un protocolo de desensibilización rápida permitió continuar el tratamiento, sin reaparición de la hipersensibilidad 42.
El seguimiento de los pacientes incluidos en los estudio TORO hasta las 96 semanas confirmó la excelente tolerancia sistémica de enfuvirtida, sin que aparecieran nuevos efectos adversos inesperados y sin que se observara un aumento de la incidencia de neumonía a lo largo del segundo año de tratamiento 43.
Consenso:
* La administración de enfuvirtida no se asocia a efectos adversos sistémicos tales como diarrea, náuseas, vómitos, astenia, etc., que aparecen frecuentemente con otros ARV (Ib).
* Las reacciones de hipersensibilidad a enfuvirtida son excepcionales (Ib).
* A diferencia de otros ARV, el tratamiento con enfuvirtida no se asocia a alteraciones en el perfil lipídico, no incrementa el riesgo cardiovascular, no produce toxicidad mitocondrial ni lipodistrofia y no es hepatotóxico (Ib, IIb y III).
* A pesar de la mayor incidencia de neumonías observada en los estudios TORO (Ia), entre los facultativos no existe la percepción de que la administración de enfuvirtida incremente el riesgo de neumonía (IV).
Interacciones farmacocinéticas
Enfuvirtida es un péptido y su metabolismo depende de la vía catabólica de las proteínas. No es ni sustrato, ni inhibidor, ni inductor del sistema enzimático del citocromo P-450, ni de la glicoproteína P 44,45. No se han observado interacciones significativas entre enfuvirtida y ninguno de los siguientes fármacos: rifampicina (600 mg/día) 46, ritonavir (200 mg dos veces al día) o saquinavir/ritonavir (1.000/100 mg dos veces al día)47. Por su mecanismo de acción y metabolismo no cabe esperar interacciones farmacocinéticas con otros fármacos que puedan utilizar los pacientes con infección por el VIH (AN, tenofovir, NN, IP, metadona, etc.) 44,45.
Consenso:
* No existen interacciones clínicamente significativas con ninguno de los otros fármacos, ARV o no, que habitualmente reciben los pacientes con infección por el VIH (II, III y IV).
Poblaciones especiales
Enfuvirtida se ha administrado en algunas mujeres embarazadas, pero todavía no disponemos de estudios donde se analice adecuadamente la eficacia y seguridad del fármaco en el embarazo 48. Estudios en animales utilizando dosis hasta 27 veces mayores que las utilizadas en humanos no han mostrado toxicidad en el feto ni alteraciones en la fertilidad. Se clasifica pues dentro de la categoría B del embarazo. No se conocen las concentraciones de enfuvirtida en la leche humana durante la lactancia, pero estudios con isótopos radiactivos en animales muestran que el fármaco o algún metabolito se excretan a la leche 6.
La experiencia clínica con enfuvirtida en niños y adolescentes es escasa. Se ha aprobado a dosis de 2 mg/kg/12 h (máximo 90 mg por dosis) y la eficacia y tolerancia parece similar a la que se observa en adultos, siendo las reacciones locales en el lugar de inyección los efectos adversos más frecuentes. Durante las primeras 24 semanas de tratamiento alrededor del 80% de niños presentaron reacciones locales ligeras a moderadas, mientras que a partir de las 24 semanas estas reacciones locales sólo se observaron en el 33% de niños que continuaron el tratamiento. Las lesiones locales más frecuentes fueron induración (68%), eritema (61%) y nódulos o quistes (46%). Ningún niño o adolescente abandonó el tratamiento por toxicidad local. A parte de las reacciones locales, la tolerancia a enfuvirtida fue buena. Únicamente 2 niños abandonaron el tratamiento por efectos adversos sistémicos y dos por aversión a las inyecciones 49-51.
Consenso:
* Enfuvirtida se puede administrar en el embarazo, siguiendo las indicaciones generales de utilización del fármaco (IV).
* En niños, las reacciones locales constituyen el principal obstáculo para la adherencia, especialmente en aquéllos con estadios más avanzados de la enfermedad (IV).
Recomendaciones para la optimización del uso de enfuvirtida
Utilización de enfuvirtida en la práctica clínica
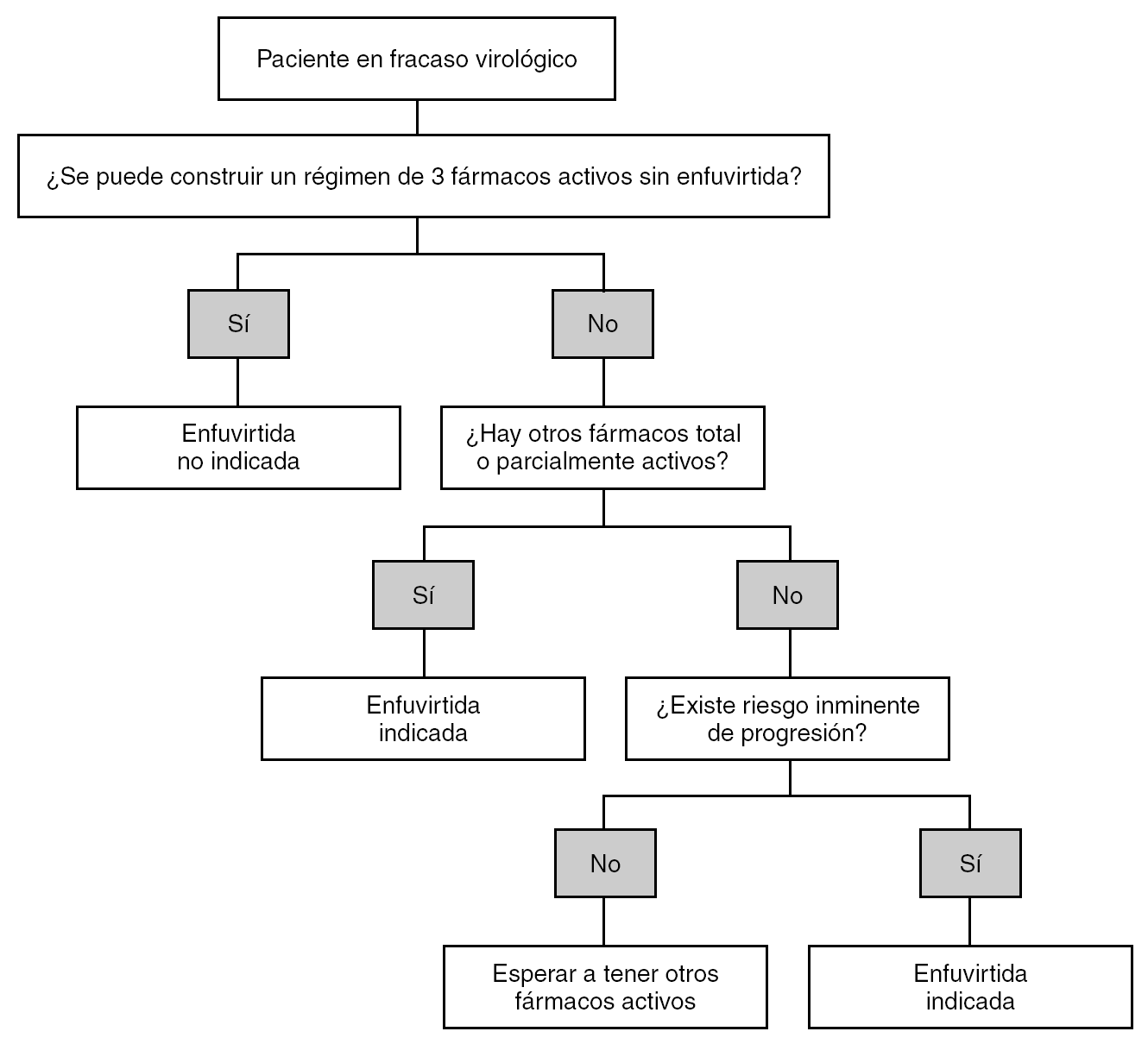
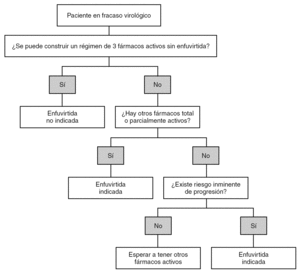
El uso de enfuvirtida en la práctica clínica se ha visto limitado por algunas de sus características. La vía de administración parenteral y el elevado precio han condicionado que el fármaco se utilice muy tardíamente, de manera habitual cuando no existen otras opciones terapéuticas. Existe conciencia entre los médicos de que este uso tardío impide el mayor aprovechamiento de enfuvirtida y obliga a elaborar criterios que permitan su utilización con el máximo de beneficio para el paciente (fig. 2).
Figura 2. Esquema de las indicaciones de tratamiento con enfuvirtida en pacientes con fracaso virológico.
En un primer escenario clínico se incluyen los pacientes que, tras uno o más fracasos previos y habiendo desarrollado resistencia a fármacos ARV, tienen en la opinión de su médico posibilidades razonables de alcanzar CV indetectable y este es el objetivo. En esta situación, existe unanimidad en considerar que enfuvirtida debería utilizarse siempre que su presencia sea necesaria para garantizar la supresión virológica, o, dicho de otra manera, cuando en ausencia de enfuvirtida no pueda construirse un régimen de 3 fármacos completamente activos. La actividad de los fármacos ARV puede establecerse en base a la historia farmacológica, mediante estudios de resistencia o, idealmente, con una combinación de ambos. Aunque la realización de los estudios de resistencia es altamente recomendable, la ausencia de los mismos no supone una contraindicación absoluta para el uso de enfuvirtida. En algunas situaciones en las cuales no es posible disponer del estudio de resistencias la historia clínica y farmacológica permitirán decidir la indicación de enfuvirtida.
La decisión de iniciar enfuvirtida en pacientes con fracasos terapéuticos previos no depende tanto de cuántas líneas han sido utilizadas, sino del número de fármacos que mantienen actividad. Hay pacientes en los que se pueden seleccionar resistencia a las tres familias de fármacos tras el primer o segundo fracaso y, en otros casos, esto puede no ocurrir hasta varias líneas de tratamiento posteriores. Algunos pacientes pueden incluso haberse infectado por una cepa con múltiples resistencias. Parece útil, por tanto, pensar en enfuvirtida ante cualquier cambio de TAR en que pueda contribuir a mejorar la posibilidad de respuesta virológica.
Del mismo modo, se obvia también los términos precoz o tardío al referirse al uso de enfuvirtida. No se trata de la precocidad del uso del fármaco, sino de la oportunidad de lograr la indetectabilidad de la CV. Según las características individuales, se llevará a cabo más o menos rápidamente en el curso de la historia del TAR de un paciente. Existe, sin embargo, preocupación por el hecho de que el uso más precoz del fármaco pudiera condicionar algunos aspectos de la calidad de vida en el paciente. En este sentido, algunos médicos sugieren una estrategia de inducción-mantenimiento con enfuvirtida, de modo que podría incluirse el fármaco inicialmente y retirarlo después tras un período de meses de CV indetectable, siempre y cuando los restantes fármacos de la combinación nos brinden suficientes garantías de eficacia en esta situación clínica. No hay datos, sin embargo, sobre la utilidad de esta estrategia y se esperan los resultados de ensayos clínicos actualmente en marcha para poder establecer recomendaciones al respecto.
En un segundo escenario clínico se consideran los pacientes que, a juicio de su médico, tienen escasas posibilidades de lograr la supresión completa de la replicación viral. En esta situación, la indicación de enfuvirtida debe considerar fundamentalmente el riesgo de progresión clínica a corto plazo que tiene el paciente. Si el riesgo es elevado (p. ej., si tiene diagnóstico previo de sida, el recuento de CD4 es inferior a 100-150 cél./μl o tiene una CV > 100.000 copias/ml) debe proporcionarse enfuvirtida junto con la optimización del resto de fármacos, aún a riesgo de realizar monoterapia encubierta. Como se ha comentado previamente, los estudios TORO mostraron que enfuvirtida podía proporcionar mejoría inmunológica significativa aún cuando se acompañara de uno o ningún fármaco activo. Esta situación constituye una responsabilidad médica y ética que no puede verse afectada por condicionantes económicos o de otro tipo. Afortunadamente, con la disponibilidad de nuevos fármacos (tipranavir, TMC-114) esta situación cada vez es más excepcional. Por el contrario, si el riesgo estimado de progresión clínica a corto plazo es bajo (recuento de CD4 > 300-350 cél./μl, estable, sin diagnóstico previo de sida y CV < 100.000 copias/ml), y enfuvirtida es el único fármaco activo parece sensato esperar a la incorporación de nuevos fármacos que pudieran mostrar actividad.
Consenso:
* Es necesario evitar demoras injustificadas en la utilización de enfuvirtida y administrar el fármaco en pacientes con posibilidades razonables de éxito (B).
* El uso de enfuvirtida no está indicado en los pacientes en los que se puede confeccionar un tratamiento óptimo con otros 3 fármacos ARV plenamente eficaces (C).
* La administración de enfuvirtida cuando no existen factores de buen pronóstico, sobre todo, cuando no disponemos de ningún otro fármaco activo, dependerá de la situación inmunovirológica del paciente. En general se recomienda esperar a disponer de al menos otro fármaco plenamente activo, pero en situaciones de enfermedad avanzada, con riesgo importante de presentar enfermedades oportunistas está indicado el uso de enfuvirtida asociado a la mejor combinación posible de otros ARV para intentar mejorar la inmunodepresión y disminuir el riesgo de evolución clínica de la enfermedad (C).
* No existe acuerdo sobre la necesidad de realizar estudios de resistencia a enfuvirtida si se produce un fracaso virológico, dado que la experiencia clínica todavía es insuficiente.
Predicción de la respuesta a enfuvirtida
Consenso:
* La posibilidad de predecir la respuesta a la semana 12 constituye una herramienta útil para aumentar la motivación y aceptación del tratamiento (C).
* La falta de respuesta virológica a las 12 semanas no es motivo suficiente para suspender enfuvirtida. Deberá reevaluarse el tratamiento teniendo en cuenta la situación clínica e inmunológica del paciente y las posibles causas de falta de respuesta virológica (C).
Interrupción del tratamiento
La decisión de interrumpir el tratamiento con enfuvirtida debe ser individualizada. En general, se acepta que la ausencia de respuesta virológica no debe ser motivo suficiente para la retirada del fármaco si se está obteniendo respuesta inmunológica y estabilización o franca mejoría clínica. Muchos médicos coinciden en observaciones acerca de aumentos considerables en el recuento de linfocitos CD4, descenso de enfermedades oportunistas y mejoría del estado general en pacientes en los cuales no se ha obtenido una respuesta virológica adecuada. Los criterios de suspensión deben, por tanto, incluir con mayor énfasis que para otros fármacos, parámetros virológicos, inmunológicos y clínicos, especialmente en pacientes sin otras opciones terapéuticas disponibles.
Se ha sugerido reiniciar el tratamiento con enfuvirtida tras una suspensión previa del mismo por ausencia de respuesta. Esta propuesta se fundamenta en la observación de la recuperación de la sensibilidad a enfuvirtida pocas semanas tras la suspensión del fármaco en pacientes en los que previamente se había demostrado resistencia. Si bien se considera una opción atractiva para pacientes con pocas alternativas terapéuticas, la ausencia de datos que demuestren la validez de la estrategia impide alcanzar ningún acuerdo a este respecto. Existe unanimidad, por otro lado, en cuanto a la posibilidad de reutilizar enfuvirtida en pacientes en los que se interrumpió la administración del fármaco por cansancio del paciente y que vuelven a necesitarlo.
Consenso:
* Aunque la presencia de mutaciones apoyaría la retirada del fármaco, la indicación de retirarlo dependerá de la situación clínica y de las opciones terapéuticas que tenga el paciente (C).
* No hay acuerdo en la necesidad de retirar enfuvirtida en los pacientes con fracaso virológico prolongado y resistencia al fármaco si se observa algún beneficio clínico o inmunológico.
* No hay datos suficientes sobre la posibilidad de reutilizar enfuvirtida asociado a nuevos fármacos si se han desarrollado resistencias o fracaso previo. La rápida desaparición de las mutaciones al suprimirlo, abre la posibilidad de reciclarlo, aunque es probable que, como ocurre con otros fármacos, las mutaciones queden almacenadas y reaparezcan al readministrarlo (C).
Otras indicaciones para enfuvirtida
Además de los pacientes en fracaso terapéutico, las características de enfuvirtida lo hacen potencial candidato a ser utilizado en otras situaciones clínicas.
Enfuvirtida carece de interacciones significativas con otros medicamentos. Esta propiedad lo hace un fármaco atractivo para ser utilizado en situaciones en las que es difícil construir un régimen ARV eficaz a causa de las interacciones. Se incluyen entre ellas los pacientes con tuberculosis que precisan el inicio inmediato de TAR (especialmente si acontece en pacientes con fracasos previos) o pacientes candidatos o sometidos a trasplante de órgano sólido, siempre que se garantice un TAR eficaz después del trasplante.
La ausencia de toxicidad cruzada con otros fármacos ARV permite su uso en pacientes que han desarrollado toxicidad sistémica grave que impide la construcción de un régimen supresivo.
Las características farmacológicas de enfuvirtida pueden también hacer aconsejable su uso en algunas situaciones particulares. Los pacientes con insuficiencia hepática grave que no pueden utilizar IP potenciados con ritonavir, ni otros fármacos, pueden beneficiarse de su administración. La administración parenteral de enfuvirtida permite su utilización en pacientes que no toleran o tienen dificultad temporal para el tratamiento oral.
En casos excepcionales de pacientes que han sufrido exposición accidental con riesgo elevado de transmisión de la infección con un paciente infectado por un virus multirresistente, enfuvirtida puede ser la única oportunidad para ser utilizada como profilaxis postexposición. Debe advertirse, sin embargo, de la eventualidad de positivizar los estudios de laboratorio que detectan anticuerpos frente a las proteínas de la envoltura (ELISA habitualmente utilizado para el diagnóstico de la infección por VIH).
Se admite, sin embargo, la escasa experiencia publicada en estas indicaciones y la necesidad de crear un registro de pacientes tratados con enfuvirtida en éstas y otras situaciones clínicas poco frecuentes que permita extraer conclusiones válidas para la práctica clínica.
Consenso:
* La ausencia de interacciones con fármacos de uso común en pacientes con VIH y otras características de enfuvirtida permitiría la utilización de enfuvirtida en situaciones especiales, como trasplantes de órganos sólidos, quimioterapia, tuberculosis, etc. (C).
Calidad de vida y adherencia
Consenso:
* Es muy importante una preparación adecuada del paciente, que incluye aspectos psicológicos de mentalización para el tratamiento, incorporando el tratamiento a su rutina diaria y reservando un tiempo para ello, junto con un buen adiestramiento sobre la técnica de autoinyección del medicamento (C).
* A pesar de la inconveniencia que supone la administración subcutánea de enfuvirtida, la calidad de vida de los pacientes mejora. Esta mejoría está en función de la recuperación inmunológica y la mejoría del estado general. La adherencia se refuerza en pacientes con pocas opciones terapéuticas al constatar un buen control inmunovirológico de su enfermedad (B, C).
* La percepción del médico sobre la influencia sobre calidad de vida que va a tener el fármaco, influye claramente en la indicación del mismo. A menudo son más reacios los médicos en prescribir enfuvirtida que los pacientes en aceptar el tratamiento. Cuando se considere que el tratamiento está indicado médicamente, debe proponerse dicho tratamiento para que el paciente tome su propia decisión (C).
Toxicidad local
Consenso:
* No disponemos de un método infalible que permita evitar la aparición de reacciones locales, pero una serie de medidas ayudan a disminuir su incidencia y gravedad (B).
* El adiestramiento del paciente para la correcta administración del medicamento y una adecuada rotación de las zonas de punción es un proceso esencial para conseguir los resultados deseados. El papel de enfermería es fundamental para el adiestramiento inicial y el estrecho seguimiento del paciente, que ayudará a mejorar la adherencia y la repercusión de las reacciones locales (B, C).
* Algunas medidas terapéuticas, locales o generales, pueden ser necesarias cuando aparecen reacciones locales de consideración. Así, pueden ser útiles la aplicación de frío (lesiones agudas inflamatorias) o calor (lesiones subagudas o crónicas), los anestésicos (p. ej., lidocaína) o antiinflamatorios (p. ej., ibuprofeno o salicilatos) tópicos, o los analgésicos-antiinflamatorios orales, dependiendo de la gravedad y características de las lesiones (B).
Toxicidad sistémica
Consenso:
* Aunque existen dudas sobre la implicación de la administración de enfuvirtida en el aumento de la incidencia de neumonías, existe consenso en estar alerta e informar al paciente ante la posibilidad de presentar neumonías bacterianas mientras se encuentre tratamiento con enfuvirtida, hasta disponer de más datos de los aportados por los estudios TORO (A,C).
Participantes en el documento de consenso español sobre el uso adecuado de enfuvirtida
Coordinadores: Santiago Moreno, Esteban Ribera, Pompeyo Viciana.
Moderadores locales: Antonio Antela, Piedad Arazo, José Ramón Arribas, Manel Cervantes, Pere Domingo, Santiago Echevarría, Juan Flores, Adela Francés, Juan Luis Gómez Sirvent, Juan González, José Hernández Quero, Fernando Lozano, Josep Mallolas, Agustín Muñoz, Antonio Ocampo, Joaquín Portilla, Federico Pulido, Antonio Rivero, Jesús Santos, Vicente Soriano.
Redactores médicos: Concepción Cepeda (Hospital 12 de Octubre, Madrid), Rosario Mata (Hospital Virgen del Rocío, Sevilla), José Moltó (Hospital Germans Trias i Pujol, Badalona. Barcelona).
Participantes en las reuniones de consenso: Vicente Abril (Hospital General de Valencia), Koldo Aguirrebengoa (Hospital de Cruces, Baracaldo, Bilbao), Federico Alcácer (Hospital Clínico de Valencia), Remedios Alemán (Hospital Universitario de Canarias, Tenerife), Carlos Alonso (Hospital Sant Joan de Reus, Tarragona), María del Mar Alonso Socas (Hospital Universitario de Canarias, Tenerife), Hortensia Álvarez (Hospital Arquitecto Marcide, Ferrol, A Coruña), Ander Andia (Hospital Santiago Apóstol, Vitoria), José Manuel Antúnez (Hospital Carlos Haya, Málaga), Ana Arizcorreta (Hospital Puerta del Mar, Cádiz), Alberto Arranz Caso (Hospital Príncipe de Asturias, Alcalá de Henares, Madrid), Julio Arrizabalaga (Hospital de Donostia, San Sebastián), Isabel Arrobas (Hospital Perpetuo Socorro, Badajoz), Víctor Asensi (Hospital Central de Asturias, Oviedo), Ángel Asorey (Hospital Meixoeiro, Vigo), Cándido Ayensa (Hospital de Txagorritxu, Vitoria), Carlos Azuaje (Hospital Vall d'Hebron, Barcelona), Pablo Bachiller (Hospital Río Hortega, Valladolid), José Emilio Ballester (Hospital General de Valencia), Josu Baraia (Hospital de Basurto, Bilbao), M.ª Jesús Barberá (Hospital Príncipes de España, L'Hospitalet de Llobregat, Barcelona), José Barberá (Hospital General La Mancha Centro, Alcázar de San Juan, Ciudad Real), Pablo Barreiro (Hospital Carlos III, Madrid), Carlos Barros (Hospital de Móstoles, Madrid), Julia Barroso (Hospital de Txagorritxu, Vitoria), Pilar Barrufet (Hospital de Mataró, Barcelona), Miguel Ángel Berdún (Hospital General San Jorge, Huesca), José Luis Blanco (Hospital Clínic, Barcelona), Rosa Blázquez (Hospital Morales Meseguer, Murcia), Jorge Boado Lama (Hospital General de la Palma, Tenerife), Vicente Boix (Hospital General de Alicante), Anna Bonjoch (Hospital Germans Trias i Pujol, Badalona, Barcelona), Luis Caminal (Hospital Central de Asturias, Oviedo), Victoriano Cárcaba (Hospital Valle del Nalón, Langreo, Asturias), Miguel Ángel Cárdenes (Hospital Dr. Negrín, Las Palmas), Jorge Carmena (Hospital Doctor Peset, Valencia), Isabel Carpena (Hospital Morales Meseguer, Murcia), José Antonio Cartón (Hospital Central de Asturias, Oviedo), José Luis Casado (Hospital Ramón y Cajal, Madrid), Manuel Castaños (Hospital Carlos Haya, Málaga), Miguel Cervero (Hospital Severo Ochoa, Madrid), Bonaventura Clotet (Hospital Germans Trias i Pujol, Badalona, Barcelona), Juan de Dios Colmenero (Hospital Carlos Haya, Málaga), Antonio Collado Remacho (Hospital Torrecárdenas, Almería), Jaime Cosín (Hospital Gregorio Marañón, Madrid), Maria José Crusells (Hospital Clínico Lozano Blesa, Zaragoza), Fernando Cuadra (Hospital Virgen de la Salud, Toledo), José María Cuadrado (Hospital Universitario de San Juan, Alicante), Josep Cucurull (Hospital de Figueres, Girona), Ángel Chocarro (Hospital Virgen de La Concha, Zamora), Belén de la Fuente (Hospital Cabueñes, Gijón), Julián de la Torre (Hospital Provincial Reina Sofía, Córdoba), Javier de la Torre Lima (Hospital Costa del Sol, Marbella, Málaga), Julio de Miguel (Hospital Príncipe de Asturias, Alcalá de Henares, Madrid), Jordi de Otero (Hospital de Manacor, Barcelona), Miguel Alberto de Zárraga (Hospital San Agustín, Avilés, Oviedo), Elisabeth Deig (Hospital de Granollers, Barcelona), Alfonso del Arco (Hospital Costa del Sol, Marbella, Málaga), José Ignacio del Pino (Hospital General de Elda, Alicante), Miguel Ángel del Pozo (Hospital Clínico de Valladolid), Julio Diz (Complejo Hospitalario de Pontevedra), Fernando Dronda (Hospital Ramón y Cajal, Madrid), Carlos Dueñas (Hospital General Yagüe, Burgos), Javier Ena (Hospital de la Marina Baixa, Villajoyosa, Alicante), Francisco Javier Espinosa (Hospital Morales Meseguer, Murcia), Vicente Estrada (Hospital Clínico San Carlos, Madrid), Vicenç Falcó (Hospital Vall d'Hebron, Barcelona), Carmen Fariñas García (Hospital Marqués de Valdecilla, Santander), Pedro Fernández (Hospital Can Misses, Ibiza), Ricardo Fernández (Complejo Hospitalario Cristal Piñor, Orense), Marta Fernández-Ayala Novo (Hospital Comarcal de Laredo, Cantabria), Elena Ferrer (Hospital Príncipes de España, L'Hospitalet de Llobregat, Barcelona), Concepción Figueras (Hospital Vall d'Hebron, Barcelona), Lluis Force (Hospital de Mataró, Barcelona), Claudia Fortuny (Hospital San Juan de Dios, Barcelona), Aurelio Fuertes (Hospital Clínico de Salamanca), Montse Fuster (Hospital de Sant Pau, Barcelona), Dani Fuster (Hospital Germán Trias i Pujol, Badalona, Barcelona), Juan Carlos Gainzarain (Hospital Santiago de Vitoria), Carlos Galera (Hospital Virgen de la Arrixaca, El Palmar, Murcia), Pepa Galindo Puerto (Hospital Clínico de Valencia), Francisco Galo (Hospital Sierrallana, Cantabria), Miguel García Deltoro (Hospital General de Valencia), Isidra García García (Hospital Virgen de la Concha, Zamora), Daniel García Palomo (Hospital Marqués de Valdecilla, Santander), Juan Manuel García-Lechuz (Hospital Gregorio Marañón, Madrid), Gabriel Gaspar (Hospital Universitario de Getafe), José M.ª Gatell (Hospital Clínic, Barcelona), Paloma Gijón (Hospital Gregorio Marañón, Madrid), Josune Goikoetxea (Hospital de Cruces, Baracaldo, Bilbao), Carmen Rosa González Fernández (Hospital Comarcal de Laredo, Cantabria), Isabel González Guilabert (Hospital Clínico de Valladolid), Luis González López (Hospital de Ceuta), Alicia González Mena (Hospital del Mar, Barcelona), Miguel Górgolas (Fundación Jiménez Díaz, Madrid), Rafael Granados (Hospital Dr. Negrín, Las Palmas), Joan Gregori (Hospital Vega Baja, Orihuela, Alicante), Ana Guelar (Hospital del Mar, Barcelona), Víctor Gutiérrez Rave (Hospital Santa Ana de Motril, Granada), Félix Gutiérrez Rodero (Hospital General de Elche, Alicante), Marcelino Hayek (Hospital Nuestra Señora de La Candelaria, Tenerife), José Juan Hernández Burruezo (Hospital Ciudad de Jaén), Carmen Hinojosa (Hospital Clínico de Valladolid), Juan Pablo Horcajada (Hospital Marqués de Valdecilla, Santander), José Antonio Iribarren (Hospital de Donostia, San Sebastián), Rafael Izquierdo (Centro Penitenciario Madrid VI, Aranjuez, Madrid), Francisco Jiménez Oñate (Hospital Carlos Haya, Málaga), Javier Juega (Hospital Juan Canalejo, A Coruña), Rafael Jurado Jiménez (Hospital Provincial Reina Sofía, Córdoba), José M. Kindelan (Hospital Provincial Reina Sofía, Córdoba), Hernando Knobel (Hospital del Mar, Barcelona), Pablo Labarga (Hospital San Millán-San Pedro, Logroño), José Lacruz (Hospital Universitario La Fe, Valencia), Santiago Letona (Hospital Clínico Lozano Blesa, Zaragoza), Manuel Linares Feria (Hospital Nuestra Señora de la Candelaria, Tenerife), José Lluch (Hospital General de Lanzarote), Jaime Locutura (Hospital General de Yagüe, Burgos), María José López (Hospital Xeral de Calde, Lugo), José López Aldeguer (Hospital Universitario La Fe, Valencia), Juan Carlos López Bernaldo de Quirós (Hospital Universitario Gregorio Marañón, Madrid), Luis Fernando López Cortés (Hospital Virgen del Rocío, Sevilla), Vicente López Cupido (Hospital Perpetuo Socorro, Badajoz), Manuel López Gómez (Hospital Universitario Virgen de las Nieves, Granada), Miguel Ángel López Ruz (Hospital Virgen de las Nieves, Granada), Juan Francisco Lorenzo (Hospital General Yagüe, Burgos), Alicia Lorenzo Hernández (Hospital La Paz, Madrid), Josep María Llibre (Hospital de Calella, Barcelona), Juan Macías Sánchez (Hospital de Valme, Sevilla), Andrés Marco (Centro Penitenciario La Modelo, Barcelona), Fernando Marcos Sánchez (Hospital Nuestra Señora del Prado, Talavera de la Reina, Toledo), Jorge Marín (Hospital de Osuna, Sevilla), Manuel Márquez Solero (Hospital Virgen de la Victoria, Málaga), Carlos Martín Ruiz (Hospital Virgen de la Montaña, Cáceres), María Ángeles Martínez (Hospital Universitario San Cecilio, Granada), Pedro Martínez Avilés (Hospital Marina Alta, Denia, Alicante), Esteban Martínez Chamorro (Hospital Clínic, Barcelona), Onofre J Martínez Madrid (Hospital Santa María del Rosell, Cartagena, Murcia), Pedro Antonio Martínez Sánchez (Centro Penitenciario Ocaña 2, Toledo), Angels Masabeu (Hospital de Palamós, Girona), Miguel Medina de León (Hospital de Mérida, Badajoz), José Luis Menéndez Caro (Hospital San Agustín, Avilés, Asturias), M.ª Dolores Merino (Hospital Juan Ramón Jiménez, Huelva), Máximo Miguélez (Hospital Nuestra Señora de la Candelaria, Tenerife), Carlos Mínguez (Hospital General de Castellón), Pilar Miralles (Hospital Gregorio Marañón, Madrid), Lluís Moner (Hospital Residencia San Camilo, Sant Pere de Ribes, Barcelona), Luis Morano (Hospital Meixoeiro, Vigo), Ana Moreno (Hospital Ramón y Cajal, Madrid), Victoria Moreno Celda (Hospital Carlos III, Madrid), Víctor Moreno Cuerda (Hospital 12 de Octubre, Madrid), Alfonso Moreno Torrico (Hospital Central de Asturias, Oviedo), José Luis Mostaza (Hospital Virgen Blanca, León), Miguel Ángel Muniaín (Hospital Virgen Macarena, Sevilla), Gema Muñiz (Hospital Virgen de la Salud, Toledo), Leopoldo Muñoz (Hospital San Cecilio, Granada), Pepa Muñoz (Hospital de Basurto, Bilbao), Eugenia Negredo (Hospital Germans Trias i Pujol, Badalona, Barcelona), Nieves Nogales (Hospital Don Benito-Villanueva, Badajoz), Enrique Nuño (Hospital Comarcal de Axarquía, Málaga), Imma Ocaña (Hospital Vall d'Hebron, Barcelona), Rafael Ojea de Castro (Complejo Hospitalario de Pontevedra), Francisco Orihuela (Hospital Carlos Haya, Málaga), Enrique Ortega (Hospital General de Valencia), Amat Ortí (Hospital Verge de la Cinta, Tortosa, Tarragona), Belén Padilla (Hospital Gregorio Marañón, Madrid), Rosario Palacios (Hospital Clínico Virgen de la Victoria, Málaga), Jorge Parra (Hospital San Cecilio, Granada), Javier Pascua Molina (Hospital San Pedro de Alcántara, Cáceres), Juan Pasquau (Hospital Virgen de las Nieves, Granada), Francisco Pasquau (Hospital de la Marina Baixa, Villajoyosa, Alicante), Antoni Payeras (Hospital Son Llatzer, Palma de Mallorca), José Domingo Pedreira Andrade (Hospital Juan Canalejo, A Coruña), Enric Pedrol (Hospital de Granollers, Barcelona), Joaquín Peraire (Hospital Joan XXIII, Tarragona), Susi Pérez Elías (Hospital Ramón y Cajal, Madrid), Eugenio Pérez Guzmán (Hospital Puerta del Mar, Cádiz), Juan Antonio Pineda Vergara (Hospital de Valme, Sevilla), Daniel Podzamczer (Hospital Príncipes de España, L'Hospitalet de Llobregat, Barcelona), Joseba Portu (Hospital Txagorritxu, Vitoria), Arturo Prieto Martínez (Hospital Clínico Universitario, Santiago de Compostela), Caridad Redondo Sánchez (Hospital Universitario Virgen de la Arrixaca, Murcia), Carmen Ricart (Hospital Dr. Peset, Valencia), Víctor Roca (Hospital Clínico San Carlos, Madrid), Jesús Rodríguez (Hospital Virgen Macarena, Sevilla), Francisco Rodríguez (Hospital de Donostia, San Sebastián), Raúl Rodríguez (Hospital Santa María Made, Orense), Eduardo Rodríguez de Castro (Hospital de Menorca), Luis Rodríguez Félix (Hospital de Jerez, Cádiz), Ricardo Rodríguez Real (Complejo Hospitalario de Pontevedra), Pablo Roig (Hospital de San Juan, Alicante), Manuel Rubio (Hospital Arnau de Vilanova, Lleida), Rafael Rubio (Hospital 12 de Octubre, Madrid), María Teresa Rubio (Hospital Reina Sofía, Tudela, Navarra), Maria Antonia Sambeat (Hospital de Sant Pau, Barcelona), Jesús Benjamín Sánchez del Río (Hospital Central de Asturias, Oviedo), Fausto Sánchez Montero (Hospital Virgen de la Montaña, Cáceres), Jacinto Sánchez Navarro (Hospital Río Carrión, Palencia), Miguel Santín (Hospital Príncipes de España, L'Hospitalet de Llobregat, Barcelona), Ignacio Santos (Hospital de La Princesa, Madrid), Jesús Sanz (Hospital de La Princesa, Madrid), José Sanz Moreno (Hospital Príncipe de Asturias, Alcalá de Henares, Madrid), María Antonia Sepúlveda (Hospital Virgen de la Salud, Toledo), Regino Serrano (Hospital de Getafe, Madrid), Julio Sola Boneta (Hospital de Navarra, Pamplona), Pere Soler (Hospital Vall d'Hebron, Barcelona), Ignacio Tárraga (Hospital General, Albacete), Ramón Teira (Hospital Comarcal de Laredo, Cantabria), Paco Tellez (Hospital de la Línea de la Concepción, Cádiz), María Jesús Téllez (Hospital Clínico San Carlos, Madrid), Alberto Terrón (Hospital de Jerez, Cádiz), Rafael Torres Perea (Hospital Severo Ochoa, Madrid), Manuel Torres Tortosa (Hospital Punta de Europa, Algeciras, Cádiz), Jordi Usó (Hospital General de Castellón), Eulalia Valencia (Hospital Carlos III, Madrid), Francisco J. Vera Méndez (Hospital Santa María del Rosell, Cartagena, Murcia), Antonio Vergara (Hospital de Puerto Real, Cádiz), Rogelio Vicente (Hospital Dr. Peset, Valencia), Consuelo Vilades (Hospital Joan XXIII, Tarragona), Josep Vilaró (Hospital de Vic, Barcelona), Miguel Ángel Von Wichmann (Hospital Donostia, San Sebastián), José María Zarzalejos (Hospital Dr. Negrín, Las Palmas).
Conflicto de intereses
Los autores han realizado asesorías o han recibido ayudas para investigación o docencia en relación a la infección por el VIH de los siguientes laboratorios farmacéuticos:
Esteban Ribera de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Janssen-Cilag, Merck, Pfizer, Roche Farma y Schering Plough.
Santiago Moreno de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Janssen-Cilag, Merck, Pfizer, Roche Farma y Schering Plough.
Pompeyo Viciana de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Merck, Pfizer, Roche Farma.
Santiago Echevarría de Abbott, Bristol-Myers-Squibb, Roche Farma y Schering-Plough.
Adela Francés de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Merck y Roche Farma.
Juan Luis Gómez Sirvent de Abbott, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline y Roche Farma.
Juan González de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline y Roche Farma.
José Hernández Quero de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Merck, Pfizer y Roche Farma
Fernando Lozano de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline y Roche Farma.
Josep Mallolas de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, y Roche Farma.
Agustín Muñoz de Bristol-Myers-Squibb, Gilead, GlaxoSmithKline y Roche Farma.
Antonio Ocampo de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Merck, Pfizer y Roche Farma.
Joaquín Portilla de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Merck, Pfizer, Roche Farma y Schering Plough.
Federico Pulido de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Janssen-Cilag, Pfizer y Roche Farma.
Antonio Rivero de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Merck, Pfizer y Roche Farma.
Jesús Santos de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline y Roche Farma.
Vicente Soriano de Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Roche Farma y Schering-Plough.
Antonio Antela de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead Sciences, GlaxoSmithKline, Pfizer, Roche Farma y Schering Plough.
José Ramón Arribas de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Janssen-Cilag, Merck, Pfizer y Roche Farma.
Manel Cervantes de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline y Roche Farma.
Pere Domingo de Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb, Gilead, GlaxoSmithKline, Janssen-Cilag, Merck, Roche Farma y Schering-Plough.
Agradecimientos
Los autores agradecen a Roche Farma S.A. la financiación de las reuniones de consenso.
Nota: Las opiniones expresadas son las de los participantes, sin que el patrocinador de las reuniones haya intervenido en modo alguno en la elaboración del documento.
Correspondencia:
Dr. E. Ribera.
Servicio de Enfermedades Infecciosas. Hospital Universitario Vall d'Hebron.
P.º Vall d'Hebron, 119-129. 08035 Barcelona. España.
Correo electrónico: eribera@vhebron.net
Manuscrito recibido el 1-4-2006; aceptado el 6-10-2006.