Métodos
Para la realización de esta Guía se han consultado las siguientes fuentes bibliográficas:
Bases de datos bibliográficas:
* Medline-PubMed. En: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi
* Cochrane Database. En: http://www.cochrane.org/reviews/clibintro.htm
Libros de texto:
* Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas and Bennett's principle and practice of infectious diseases. 6.ª ed. Vol 2. Philadelphia: Churchill Livingstone, 2005.
* Auxina V, Moreno S. Tratado SEIMC de enfermedades infecciosas y microbiología clínica. Editorial Panamericana 2006.
Procedimientos microbiológicos de la SEIMC:
* Procedimientos en Microbiología Clínica. Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Editores: Cercenado E y Cantón R. Disponible en: http://www.seimc.org/protocolos/microbiologia1.
Las palabras clave utilizadas para la búsqueda en las bases de datos bibliográficas han sido: bacteremia, bacteraemia, bacteriemia, septicemia, fungemia, bloodstream infections, Staphylococcus aureus y Pseudomonas aeruginosa entre otras.
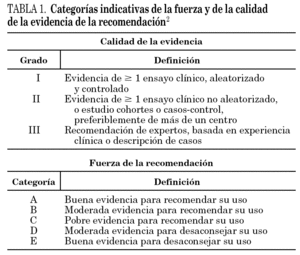
Las recomendaciones realizadas se han calificado de acuerdo con la clasificación de los grados de evidencia científica vigentes 2 (tabla 1).
Sección 1. EPIDEMIOLOGÍA Y ETIOLOGÍA DE LA BACTERIEMIA
Introducción
En las últimas décadas se ha producido un profundo cambio en la epidemiología, la etiología y las características clínicas de las bacteriemias. La incidencia de la bacteriemia en la población general se ha incrementado en un 8,7% anual, pasando de 83 a 240 episodios por cada 100.000 habitantes entre los años 1979 y 2000 3. Este cambio ha sido paralelo a los avances médicos, a la aparición de diferentes tipos de huéspedes y al desarrollo de nuevos antimicrobianos.
En esta sección revisaremos la incidencia, la etiología, el origen y la mortalidad de las bacteriemias, siguiendo una aproximación clínica basada en preguntas clave que deben contestarse ante un paciente con sospecha de bacteriemia:
1. ¿Tiene el paciente criterios diagnósticos de sepsis grave o de shock séptico?
2. ¿Cuál es el lugar de adquisición de la bacteriemia?
3. ¿Tiene el paciente alguna enfermedad subyacente?
4. ¿Cuál es el foco de origen de la bacteriemia?
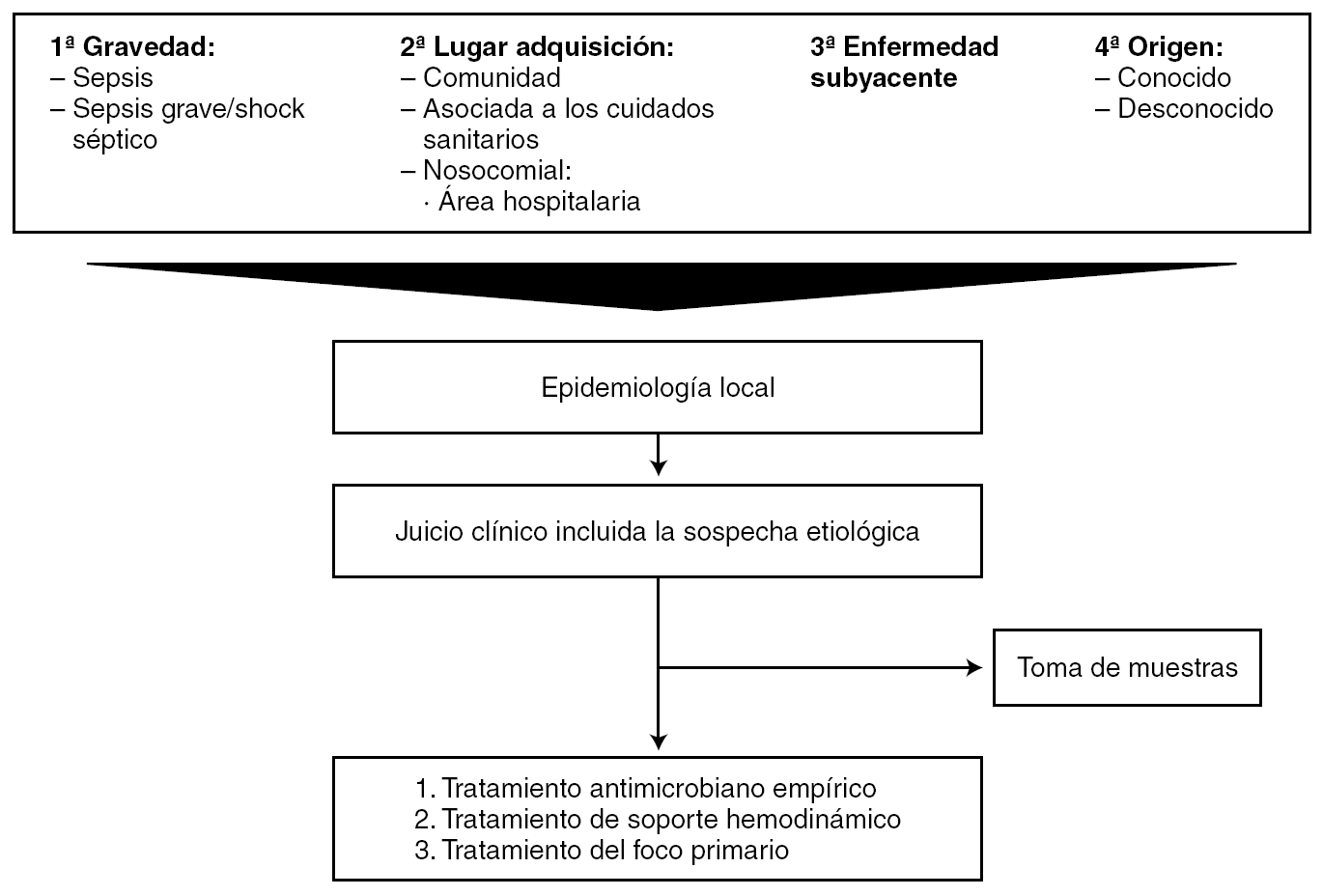
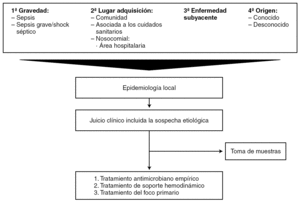
La respuesta correcta a estas preguntas, junto al conocimiento de la epidemiología local, permitirán establecer el juicio clínico, incluida la etiología más probable de la bacteriemia, y recomendar el tratamiento más apropiado, como se muestra en la figura 1.
Figura 1. Evaluación clínica del paciente con sospecha de bacteriemia (v. texto para más detalles).
Clasificación de la bacteriemia según el lugar de adquisición
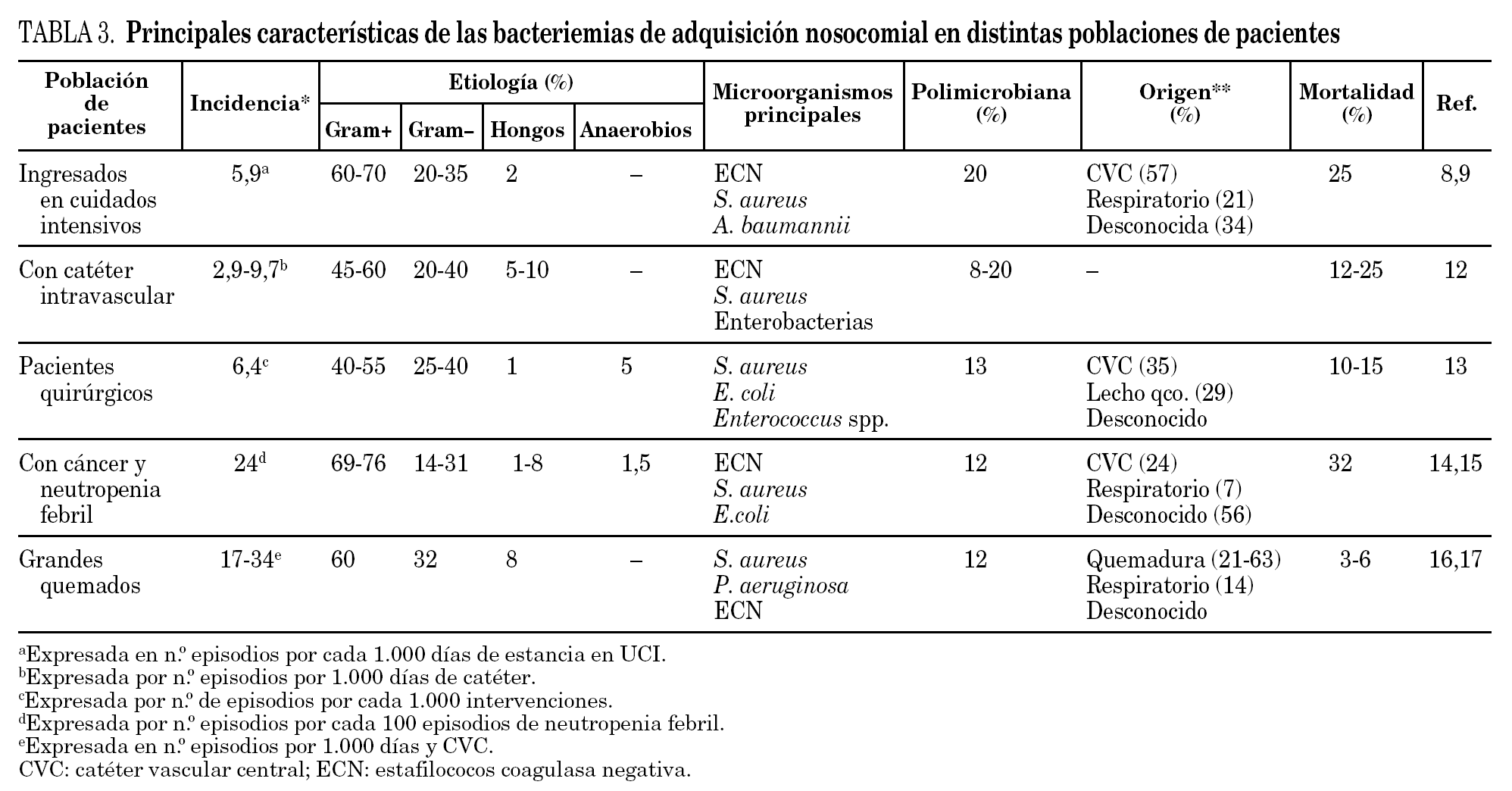
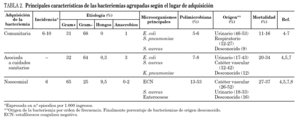
Se recomienda clasificar la bacteriemia según el lugar de adquisición en bacteriemia de adquisición comunitaria, bacteriemia asociada a los cuidados sanitarios y bacteriemia de adquisición nosocomial 4 (BIII). Las principales características de las bacteriemias según el lugar de adquisición se exponen en la tabla 2.
Bacteriemia de adquisición en la comunidad
La bacteriemia comunitaria es aquella que tiene su origen en la comunidad y es detectada dentro de las primeras 48 h de hospitalización, no mediando durante ese período ninguna actividad asistencial que pueda haberla inducido. En la actualidad, entre el 36-50% de las bacteriemias son de origen comunitario 4,5 aunque la incidencia real de la bacteriemia comunitaria es desconocida, podemos obtener una aproximación al considerar que la incidencia de bacteriemia en un servicio de urgencias hospitalarias es de 0,99/1.000 pacientes atendidos, y de 10,3 episodios /1.000 pacientes ingresados 6.
La etiología de las bacteriemias de adquisición comunitaria con criterios estrictos muestra un predominio de las bacterias gramnegativas (68%) sobre las grampositivas (31%). Por microorganismos son los más comunes Escherichia coli (49%), Streptococcus pneumoniae (9%) y Staphylococcus aureus (7%) (tabla 2). Les siguen a distancia, Salmonella no-typhi (4%), y Neisseria meningitidis (2,5%) 4,6. En determinados grupos de pacientes la etiología de la bacteriemia comunitaria tiene particularidades propias que serán analizadas más adelante.
El origen más frecuente de la bacteriemia es la infección del tracto urinario (46-53%), seguido de la neumonía (12-27%) y de la infección intraabdominal (4-9%). Aproximadamente el 9% son de origen desconocido 4,7.
La mortalidad cruda de la bacteriemia adquirida en la comunidad varía entre el 11-16% 4,5,7. La gravedad de la situación clínica al diagnóstico es el factor pronóstico más importante. La mortalidad de los pacientes con sepsis es del 4% mientras que la de los pacientes con sepsis grave y con shock séptico es del 32 y 78%, respectivamente. La diabetes mellitus fue un factor independiente de mal pronóstico en un estudio 6.
A los problemas de resistencia ya conocidos de los microorganismos característicos de la comunidad han venido a sumarse la aparición de bacteriemias por E. coli productor de betalactamasas de espectro extendido (BLEE) y por S.aureus resistentes a meticilina (SARM) que describiremos en la Sección 3.
Bacteriemia asociada a cuidados sanitarios
En esta categoría se incluyen las bacteriemias secundarias a un procedimiento diagnóstico o terapéutico realizado de forma ambulatoria, las bacteriemias en pacientes ambulatorios portadores de sondas urinarias y catéteres intravenosos (CV), las bacteriemias en pacientes en hemodiálisis crónica y en diálisis peritoneal y las bacteriemias en pacientes ingresados en residencias de ancianos y en centros de larga estancia 4. Con esta reciente clasificación el 39% de las bacteriemias hasta ahora consideradas como comunitarias serían reclasificadas como asociadas a cuidados sanitarios ya que como veremos, son más parecidas a las de adquisición nosocomial 4,5,7.
Etiológicamente predominan las bacterias gramnegativas (64%) y por microorganismos son E. coli (25%), S. aureus (15%) y Klebsiella pneumoniae (9%) los que con mayor frecuencia causan bacteriemia (tabla 2). La proporción de SARM es elevada (19-32%), especialmente en los pacientes procedentes de centros de larga estancia 4,5,7. Las bacteriemias del grupo Proteus-Morganella-Providencia, relacionadas con focos de origen en tracto urinario (sondas vesicales) y piel o tejidos blandos (úlceras de decúbito) son también frecuentes 4.
La mortalidad oscila entre el 20 y el 24% 4,6.
Bacteriemia nosocomial
La incidencia de la bacteriemia nosocomial se estima en 6 episodios/1.000 ingresos 8. Las bacterias grampositivas son las predominantes (65%), y por microorganismos, estafilococos coagulasa negativa (ECN) (31%), S. aureus (20%) y Enterococcus spp. (9%) son los más comunes 4,7,8 (tabla 2).
La etiología y el patrón de sensibilidad de las bacteriemias nosocomiales muestran grandes diferencias entre centros e incluso entre áreas de un mismo hospital, por lo que el conocimiento de la epidemiología local es imprescindible para la selección del tratamiento antimicrobiano empírico. Se recomienda que, en cada centro, el Servicio de Microbiología realice y distribuya informes estratificados por áreas y por servicios del hospital, con la frecuencia y la sensibilidad de los microorganismos aislados en los hemocultivos (BIII).
El origen más común de la bacteriemia nosocomial es el CV (14-52%), seguido de la infección del tracto urinario (18-39%), la neumonía (10-16%), y la infección intraabdominal (9-13%). La bacteriemia es de origen desconocido en el 16% de los casos.
La mortalidad global es del 27-37% con amplias diferencias según la etiología que van desde el 21% para los pacientes con bacteriemia por ECN hasta el 39% para la bacteriemia por Pseudomonas aeruginosa y Candida spp. 4,7,8.
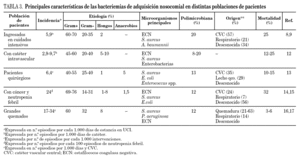
Las bacteriemias de adquisición nosocomial afectan a diferentes poblaciones de pacientes con características propias que se detallan a continuación y, se exponen en la tabla 3.
Bacteriemia en pacientes ingresados en cuidados intensivos
La incidencia de bacteriemia es muy elevada en estos pacientes. Predominan los cocos grampositivos, como ECN (36-47%), S. aureus (13-16%), y Enterococcus spp. (8-10%). Entre las bacterias gramnegativas destacan microorganismos multirresistentes como Acinetobacter baumannii (6%), Enterobacter spp. (5%) y P. aeruginosa (4-5%). La tasa de de candidemia se encuentra en el 2-9% 8,9.
Los factores de riesgo para la bacteriemia por SARM en esta población de pacientes son el estado de portador nasal de SARM y la presencia de CV 10,11. El origen más común de la bacteriemia es el CV (57%), seguido del respiratorio (21%), intraabdominal (10%) y urinario (5%) 9.
Bacteriemia en pacientes con catéter vascular
Según los datos del sistema de vigilancia de infección nosocomial de Estados Unidos (NNIS) la incidencia de bacteriemia relacionada con CV oscila entre 2,9 y 9,7 episodios/1.000 días de CV. Los CV centrales (CVC) originan el 75% de estas bacteriemias, y constituyen el factor de riesgo más importante de la candidemia nosocomial.
En el perfil microbiológico de la bacteriemia relacionada con catéter destacan los ECN (~ 30%), seguidos de S. aureus (18-20%), enterobacterias (~ 15%), P. aeruginosa (8-10%) y Candida spp. (5-7%) 12.
Bacteriemia en pacientes quirúrgicos
La incidencia y la etiología de la bacteriemia postoperatoria dependen principalmente del tipo de cirugía y de su localización. Se estima que la incidencia es de 5,4 episodios/ 1.000 ingresos en servicios quirúrgicos y de 6,4/1.000 intervenciones.
Los agentes etiológicos más frecuentes son los ECN (16%), seguidos de S. aureus (15%), E. coli (11%), especies de Pseudomonas (9,5%), Enterococcus (7%), anaerobios (5%) y Candida (1%). La etiología es polimicrobiana en el 13% de los casos.
La herida quirúrgica es el segundo origen más frecuente de la bacteriemia tras el CVC. El 9% de los pacientes con infección de la herida quirúrgica desarrollan bacteriemia, en ellos el hecho de que ésta esté causada por S. aureus es el principal factor de riesgo para el desarrollo de bacteriemia 13.
Bacteriemia en pacientes con cáncer y neutropenia posquimioterapia
La incidencia de bacteriemia alcanza hasta el 24% de los episodios de neutropenia febril posquimioterapia y está directamente relacionada con la intensidad y con la duración de la neutropenia 14.
La etiología de las bacteriemias en estos pacientes muestra un predominio creciente de las bacterias grampositivas (62% en 1995 y 76% en 2000) sobre las gramnegativas, mientras que las bacterias anaerobias estrictas permanecen estables (3%) y los hongos alcanzan en algunas series hasta el 8% de los aislamientos.
El origen de la bacteriemia es con frecuencia desconocido 14,15.
Bacteriemia en grandes quemados
La incidencia de la bacteriemia es muy elevada, especialmente la bacteriemia primaria que alcanza cifras de 17 a 34 episodios/1.000 días de CVC 16,17. Tras la escarectomía de la quemadura la bacteriemia transitoria es tan frecuente que aparece en el 30% de los procedimientos cuando se realizan después de los primeros 10 días y en el 100% cuando la superficie quemada supera el 80%. En cambio la bacteriemia es infrecuente cuando la extensión de la quemadura es inferior al 40%.
S. aureus (24%), P. aeruginosa (18%), Acinetobacter spp. (14%), ECN (12%) y Candida spp. (8%) son las etiologías más comunes.
El origen principal de la bacteriemia es la quemadura y el CV. La mortalidad atribuible a la bacteriemia en estos pacientes es baja, entre el 3-6%, seguramente en relación con el predominio de bacteriemias relacionadas con el CV 16,17.
Bacteriemia en pacientes con enfermedad subyacente
Las bacteriemias en este grupo de pacientes están determinadas por la enfermedad subyacente y por eso han sido incluidas bajo este epígrafe. A los factores de riesgo de bacteriemia producidos por la enfermedad subyacente se suman los riesgos de la infección nosocomial y los relacionados con la asistencia sanitaria que con frecuencia requieren.
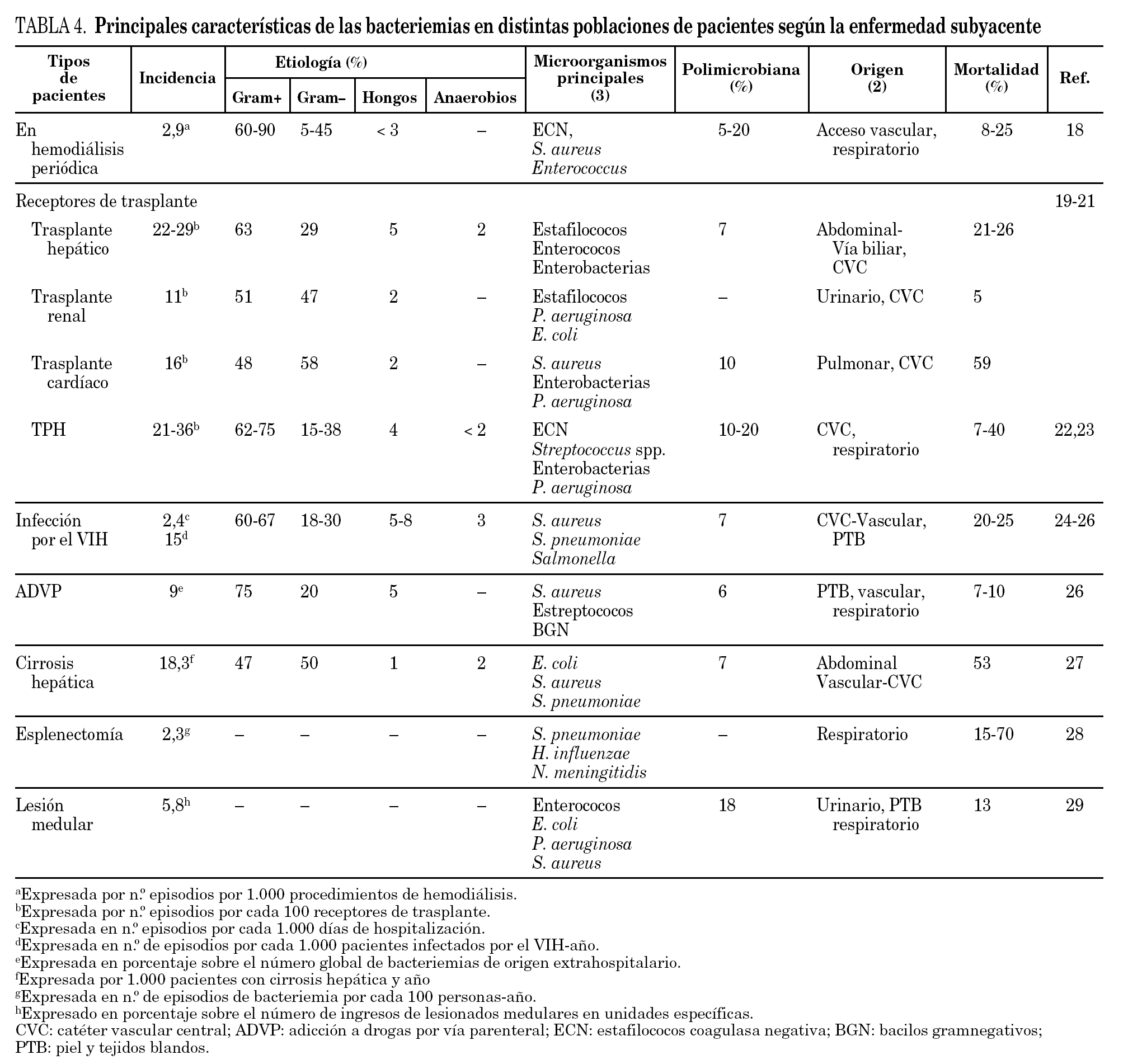
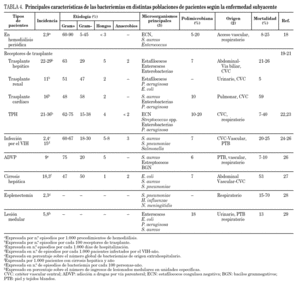
Las principales características de las bacteriemias estratificadas según las distintas enfermedades subyacentes se detallan a continuación y se resumen en la tabla 4.
Bacteriemias en pacientes en hemodiálisis periódica
La incidencia varía dependiendo del tipo de acceso vascular para la hemodiálisis, que es el origen más común de la bacteriemia. El riesgo de bacteriemia es siete veces superior cuando la hemodiálisis se realiza a través de un catéter vascular que de una fístula arteriovenosa. La incidencia global de bacteriemia es de 1,2 episodios/1.000 días o 2,9/1.000 hemodiálisis.
En la etiología predominan las bacterias grampositivas (60-90%) y por microorganismos los ECN (10-45%), seguidos de S. aureus (3-40%), y Enterococcus spp. (2-20%). La mortalidad oscila entre el 8-25% 18.
Bacteriemias en receptores de trasplante de órgano sólido y de progenitores hematopoyéticos
Las bacteriemias en los receptores de trasplante de órgano están determinadas por el tipo de órgano trasplantado, por la función del mismo y por el período postrasplante. La frecuencia de bacteriemia es mayor en el trasplante hepático (22-29%), seguida del cardíaco (16%) y del renal (12%) 19-21. El 50% de las bacteriemias ocurren durante el primer mes postrasplante y presentan un patrón nosocomial.
Predominan ligeramente los cocos grampositivos (44-62%). S. aureus se aísla en el 12% de las bacteriemias en el trasplante hepático y en el 13% en el trasplante cardíaco y P. aeruginosa en el 4% en el trasplante hepático y 10% en el cardíaco 20,21. El órgano trasplantado es el principal origen de la bacteriemia. El tracto urinario en el trasplante renal, la vía biliar en el hepático, el pulmón en el pulmonar y también en el cardíaco. La bacteriemia por S. aureus es un factor de riesgo independiente de mortalidad en el trasplante hepático 21. Pasados los primeros 6-12 meses postrasplante, en los receptores con buena función del injerto, la epidemiología de la bacteriemia se asemeja a la de la población general.
En los receptores de trasplante de progenitores hematopoyéticos (TPH) el período de neutropenia y la enfermedad del injerto contra el huésped (EICH) son los principales factores de riesgo de bacteriemia. La incidencia de bacteriemia es de 21-36 episodios/100 pacientes con TPH. La densidad de incidencia es de 14 episodios/1.000 días de neutropenia.
Predominan las bacterias grampositivas (62-75%) sobre las gramnegativas (15-38%). Los microorganismos más frecuentes son especies de ECN (19-57%), estreptococos, especialmente del grupo S. viridans (8-30%), E. coli (8-13%), otras enterobacterias (3-13%), S. aureus (3-6%) y P. aeruginosa (3-5%). La frecuencia de Candida spp. se ha reducido con la generalización de la profilaxis entre los alo-TPH. En la fase tardía posprendimiento (> 100 días post-TPH) la bacteriemia suele estar causada por microorganismos capsulados, como S. pneumoniae y Haemophilus influenzae, y en estrecha relación con la EICH 22,23.
Bacteriemias en pacientes con infección por el VIH
La introducción del tratamiento antirretroviral de gran eficacia en 1996 modificó las principales características de la bacteriemia en los pacientes infectados por el virus de la inmunodeficiencia humana (VIH). Ahora la bacteriemia es de predominio nosocomial y la etiología muestra una reducción progresiva de las bacterias gramnegativas y de las micobacterias, y un incremento de las grampositivas. Aunque en los pacientes con linfocitos CD4 por debajo de 50 cél./μl predominan las bacteriemias por Salmonella spp. y por P. aeruginosa 24. La etiología de la bacteriemia en los países pobres es muy diferente con predominio de Salmonella spp., S. pneumoniae y Mycobacterium tuberculosis 25.
Bacteriemias en otras poblaciones de pacientes
Las principales características de las bacteriemias en los pacientes con adicción a drogas por vía parenteral 26, cirrosis hepática 27, esplenectomía 28, y lesión medular 29 se muestran en la tabla 4. El riesgo de bacteriemia en los pacientes con cirrosis hepática es 14 veces mayor que el de la población general 27.
Sección 2. EVALUACIÓN CLÍNICA: DESDE LA SOSPECHA HASTA LA CONFIRMACIÓN DE LA BACTERIEMIA
Sospecha clínica de bacteriemia
La rentabilidad de los hemocultivos en pacientes adultos varía entre el 2 y el 20% 6. En general y dada la relevancia clínica, terapéutica y pronóstica de la bacteriemia y la frecuente inespecificidad de los datos clínicos, se justifica un bajo índice de sospecha para solicitar hemocultivos teniendo en cuenta que la frecuencia de bacteriemia aumenta en relación a la gravedad del cuadro clínico, así es del 17-31% en los pacientes con sepsis y del 25-53% con sepsis grave o shock séptico 31,35.
Se recomienda clasificar la gravedad clínica inicial del paciente con sospecha de bacteriemia de acuerdo con los criterios internacionales en sepsis, sepsis grave y shock séptico (BII) (tabla 5) 36.
En la tabla 6 se recogen diferentes variables clínicas y analíticas predictoras de bacteriemia, aunque ninguna de ellas por sí sola tiene suficiente capacidad para discriminar entre los pacientes con y sin bacteriemia 30-32. La utilidad de la procalcitonina, en la predicción de la bacteriemia tampoco ha sido demostrada 33.
Los resultados de un estudio reciente sobre la capacidad de predicción de un programa informático (TREAT system) se han mostrado prometedores: se identificaron con precisión a los pacientes con bajo y con alto riesgo de bacteriemia (< 2,5% y > 25%, respectivamente), que representaban el 30% de los pacientes con sepsis 34.
Particularidades de las indicaciones de hemocultivos en distintas poblaciones de pacientes
En pacientes críticos está indicada la realización de hemocultivos ante todo paciente con fiebre de nueva aparición, aunque los hallazgos clínicos no sean muy sugerentes de infección. Lo mismo se aplica a los pacientes con neutropenia posquimioterapia y con inmunodepresión significativa (p. ej., receptores de trasplante, infección por VIH con linfocitos CD4 < 200 cél./μl, tratamiento con esteroides u otros inmunosupresores, y pacientes con hemopatías malignas o asplenia) 37,38.
En pacientes con sospecha de infección de CV deben realizarse hemocultivos. Para el diagnóstico de la infección de los CV difícilmente sustituibles o en los que puede considerarse su conservación, es útil la toma de una muestra de sangre por punción de vena periférica y otra a través del CV para realización de hemocultivos cuantitativos o cualitativos con monitorización continua del tiempo de crecimiento (AII) 39.
En pacientes con neumonía de adquisición comunitaria que ingresan en el hospital se recomienda la realización sistemática de hemocultivos 40. En los pacientes con pielonefritis aguda que ingresan en el hospital también se recomienda la realización de hemocultivos. Por el contrario en los pacientes con pielonefritis aguda no complicada que se atienden de forma ambulatoria, los hemocultivos, aunque frecuentemente positivos (25%) no añaden información relevante comparados con el urocultivo, por lo que se sugiere que no es necesaria su realización sistemática 41.
En pacientes ancianos debe considerarse la posibilidad de bacteriemia ante síntomas o signos inespecíficos como letargia, confusión, incontinencia, caídas, dolor abdominal o vómitos, aún en ausencia de fiebre, pues hasta un 15% de estos pacientes con bacteriemia puede estar afebril 42.
Se recomienda realizar hemocultivos antes de iniciar el tratamiento antimicrobiano en todo paciente con sepsis e infección de órgano o sistema (BIII); con sepsis grave o shock séptico (AII); con sospecha de endocarditis, de brucelosis o de fiebre tifoidea (AII); con sepsis y neutropenia o inmunosupresión relevante, o senilidad (AII).
Valoración clínica de los pacientes con sospecha de bacteriemia
La valoración clínica de los pacientes con sospecha de bacteriemia, esquematizada en la figura 1, requiere la integración de los síntomas y de los signos de la evaluación clínica con los datos de las pruebas complementarias como se detalla a continuación.
Evaluación clínica
Pacientes con sospecha de bacteriemia adquirida en la comunidad
Anamnesis. Deben recogerse los datos significativos del cuadro clínico como posibles factores desencadenantes, forma de inicio (aguda o insidiosa), duración, temperatura más alta, presencia de tiritonas, síntomas focales, tratamiento realizado y evolución. En los ancianos deben investigarse cambios en el estado mental, caídas, incontinencia o vómitos.
Así mismo deben recogerse los antecedentes personales de interés (enfermedades crónicas, presencia de cardiopatía predisponente para endocarditis, tratamiento habitual, procedimientos médicos recientes, uso de drogas parenterales, etc.) y los antimicrobianos que se hayan tomado en los últimos meses. En los pacientes con enfermedades potencialmente asociadas a inmunodepresión, debe recogerse la situación de dicha enfermedad.
Finalmente, interesan datos epidemiológicos: en relación con posibles factores de riesgo para zoonosis, picaduras, viajes, vacunaciones, lugar de trabajo y costumbres de ocio.
Exploración. Desde el punto de vista clínico, es prioritario establecer la gravedad del paciente (tabla 5), mediante la evaluación de las manifestaciones clínicas de la bacteriemia y de sus complicaciones. Para ello, deben registrarse las constantes vitales (presión arterial, temperatura, frecuencias cardíaca y respiratoria) y el nivel de conciencia. En los pacientes que ingresen debe medirse la diuresis y ajustar la frecuencia de registro de las constantes vitales a la gravedad clínica (AII). La exploración física debe ser completa, buscando la presencia de lesiones cutáneas o mucosas, y de signos de afectación específica de órganos 36. En los pacientes con sospecha de candidemia se aconseja la realización de examen del fondo de ojo dilatado 43.
Pacientes con sospecha de bacteriemia asociada con la asistencia sanitaria
En estos pacientes además de lo anteriormente señalado, es de especial interés conocer si la bacteriemia tiene relación con la atención sanitaria: hospitalización domiciliaria en el último mes, ingresos en los últimos 3 meses, diálisis en el último mes, o residencia en centros sociosanitarios 4,7.
Pacientes con sospecha de bacteriemia de adquisición nosocomial
Anamnesis. En estos pacientes es necesario recoger la duración de la hospitalización, los procedimientos invasivos realizados y, el tiempo transcurrido entre los mismos y la aparición de la clínica. En pacientes con CV, los días que lleva colocado el catéter, en qué circunstancias se colocó, y su funcionamiento; así como si existen datos de sepsis en relación con la administración de algún preparado intravenoso o con la manipulación del catéter. En pacientes quirúrgicos, si existe aumento de dolor en la herida o síntomas referidos al órgano o espacio intervenido. En los pacientes neutropénicos: la fecha de la administración del último ciclo de quimioterapia y la duración e intensidad de la neutropenia.
Exploración. Debe realizarse la referida para los síndromes comunitarios y además: en pacientes con CV, examen del punto de inserción y del trayecto subcutáneo si lo hay, teniendo en cuenta que los signos de infección en estas localizaciones son muy poco sensibles, pero altamente predictivos de infección de catéter 39. En los pacientes quirúrgicos, exploración de la herida, sin olvidar que una infección de órgano o espacio relacionada con la cirugía es posible aún con una herida de aspecto normal 13. En los pacientes con neutropenia posquimioterapia, debe revisarse la mucosa oral, la piel, el área perianal, y los puntos de punción medular y de catéteres 38.
Pruebas complementarias
Deben realizarse: hemograma completo con recuento diferencial de leucocitos (incluyendo formas inmaduras o cayados) y bioquímica sérica con determinación de glucosa, urea, creatinina, sodio, potasio y albúmina 32. En pacientes con patología hepatobiliar y/o abdominal, está indicado solicitar transaminasas, bilirrubina, fosfatasa alcalina y amilasa. Si se sospecha origen urinario debe realizarse un sedimento de orina o determinación de esterasa leucocitaria. En ancianos, un sedimento sin piuria tiene un elevado valor predictivo negativo de bacteriuria salvo si existe neutropenia 42. En los pacientes con sepsis grave o shock séptico debe solicitarse pH arterial, bicarbonato, lactato y PaO2 y PaCO244. Ante la sospecha de coagulación vascular diseminada, solicitar estudio de coagulación incluyendo productos de degradación de la fibrina o D-dímeros 36.
Debe realizarse una radiografía de tórax a los pacientes con síntomas respiratorios. También se debe realizar radiografía de tórax a los pacientes críticos, neutropénicos, receptores de trasplante y otros inmunodeprimidos con fiebre sin focalidad; y a los inmunocompetentes con fiebre de duración intermedia 57 y con fiebre de origen desconocido.
En pacientes con sospecha específica de infección de órgano se realizarán las pruebas analíticas y de imagen indicadas para su diagnóstico.
Pruebas microbiológicas
Para la extracción de los hemocultivos deben seguirse las recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) 1. En todo paciente con sospecha de bacteriemia y síntomas o signos focales de infección, se recomienda la toma de muestras para el diagnóstico microbiológico antes de iniciar la antibioterapia (BIII) 44. Algunas de estas muestras merecen un comentario específico: en los pacientes con sondaje urinario prolongado es habitual la bacteriuria asintomática que no requiere tratamiento antimicrobiano. Por ello la valoración del resultado del urocultivo siempre, y especialmente en estos pacientes, se debe realizar teniendo en cuenta el conjunto de datos clínicos y complementarios, para evitar tratamientos injustificados.
La colonización por microorganismos nosocomiales es frecuente en pacientes hospitalizados. Por ello la valoración de los resultados de los cultivos de los posibles focos de origen de la bacteriemia debe realizarse siguiendo los criterios diagnósticos de esos focos establecidos por los Centers for Disease Control and Prevention (CDC) 46. En los pacientes neutropénicos con cáncer debe tenerse en cuenta que la expresividad clínica del foco de la infección suele estar atenuada 38. Para el diagnóstico de la infección origen de la bacteriemia, existen recomendaciones específicas a las que remitimos al lector 39,47. En las tablas 2-4 se expone el origen más frecuente de la bacteriemia según el lugar de adquisición de la misma y según las poblaciones de pacientes.
Con la información obtenida de la valoración clínica, las pruebas complementarias y las microbiológicas, junto al conocimiento de la epidemiología de la unidad de ingreso actual o previo del paciente, podrá establecerse con la mayor seguridad posible la sospecha diagnóstica de bacteriemia, la gravedad del paciente, el origen y la etiología de la bacteriemia, y con todo ello elegir el tratamiento más apropiado (AIII) (fig. 1). Diferentes estudios confirman que la consulta a un infectólogo mejora el pronóstico de los pacientes con bacteriemia 48.
Diagnóstico final de la bacteriemia
Clasificación de la bacteriemia según su repercusión clínica
Ante el crecimiento de bacterias en los hemocultivos, debemos considerar las siguientes posibilidades: falsa bacteriemia o bacteriemia verdadera, ésta puede ser transitoria, persistente o de brecha. No hay criterios universalmente aceptados para definir ambas situaciones, por lo que expondremos los más utilizados 1,46, con modificaciones de orientación clínica.
Falsa bacteriemia o contaminación: situación en que se detecta crecimiento en hemocultivos de uno o más microorganismos/bacterias que no estaban causando bacteriemia verdadera. Se debe a contaminación al tomar la muestra o al procesarla.
Bacteriemia verdadera: presencia cierta de microorganismos en la sangre del paciente. Para su diagnóstico deben utilizarse criterios microbiológicos y clínicos. Se considera bacteriemia verdadera cuando: a) un microorganismo que no es una causa habitual de contaminación de hemocultivos, por ejemplo S. aureus, enterobacterias, P. aeruginosa, S. pneumoniae, se aísla en al menos un hemocultivo en un paciente con un cuadro clínico compatible con bacteriemia, o b) un microorganismo que contamina habitualmente los hemocultivos, por ejemplo ECN, estreptococos del grupo viridans, Corynebacterium spp., Bacillus spp., Propionibacterium acnes y algunas especies de Clostridium, se aísla en al menos dos tandas de hemocultivos obtenidos de punciones distintas de vena periférica o de vena periférica y catéter, en un paciente con un cuadro clínico compatible. En las bacteriemias por ECN es aconsejable comprobar que la especie y el antibiotipo de ambos hemocultivos positivos sean idénticos.
Los casos más difíciles de clasificar son aquellos en los que en una sola tanda de hemocultivos tomada de una vena periférica se aísla un microorganismo potencialmente contaminante en un paciente con un cuadro clínico compatible y este es portador de un CV o un dispositivo intravascular. En estos casos es aconsejable repetir los hemocultivos. Algunos aspectos a tener en cuenta: a) si el catéter se retira y en el cultivo semicuantitativo de la punta se aísla el mismo microorganismo, debe tratarse como bacteriemia verdadera; b) si el cuadro clínico desaparece al retirar el catéter y éste no ha sido cultivado, debe considerarse como probable bacteriemia verdadera; c) si el hemocultivo se tomó del catéter, es más probable la contaminación, aunque los hemocultivos deben repetirse, y d) si el cuadro clínico no es sugestivo de infección por estos microorganismos es más probable la contaminación.
La bacteriemia verdadera puede ser transitoria, persistente o de brecha. La bacteriemia transitoria es la que se limita espontáneamente en menos de 8-12 h. La persistente es la que se mantiene a pesar de un tratamiento apropiado, que para la bacteriemia por SARM se ha establecido en 7 días o más 49 y para la bacteriemia por SAMS en 2-4 días o más 50. La bacteriemia de brecha es la que ocurre durante el tratamiento antimicrobiano apropiado y cuando los hemocultivos previos ya eran negativos.
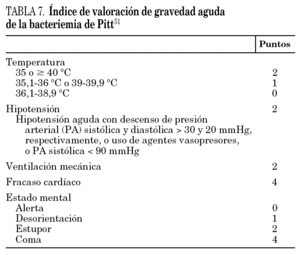
Finalmente se debe realizar una predicción pronóstica, en los pacientes con bacteriemia. Para ello se recomienda la clasificación ya comentada de sepsis, sepsis grave y shock séptico 36. El índice de Pitt (tabla 7) se ha mostrado predictor de mortalidad en varios estudios de bacteriemias por diferentes microorganismos 51,52.
Sección 3. TRATAMIENTO DEL PACIENTE CON BACTERIEMIA
Consideraciones iniciales
La bacteriemia es una situación clínica frecuente, que comporta una elevada mortalidad. Los factores relacionados con una evolución clínica adversa son diversos. Algunos no son modificables, como las características del huésped, la enfermedad subyacente, el origen de la infección o los microorganismos implicados 53. Por el contrario, otros factores pronósticos son claramente modificables, especialmente la administración precoz de antibióticos apropiados, el tratamiento del foco de infección origen de la bacteriemia, o el tratamiento de soporte hemodinámico.
La administración precoz de un antibiótico adecuado disminuye la mortalidad en pacientes con bacteriemia 54. El tratamiento empírico inapropiado (hasta en el 30% de los casos) 55, es más frecuente en las siguientes circunstancias: bacteriemia de adquisición nosocomial, asociada a los cuidados sanitarios, administración previa de antibióticos, ausencia de consulta a un especialista en enfermedades infecciosas y presencia de microorganismos multirresistentes 56.
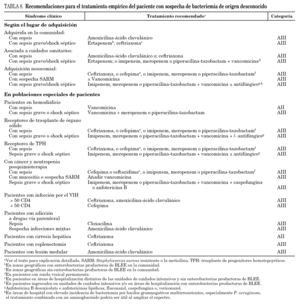
En esta sección se revisa el tratamiento antimicrobiano empírico de la bacteriemia de origen desconocido según el lugar de adquisición y según la enfermedad subyacente del paciente, como se muestra en la tabla 8. Los tratamientos de la bacteriemia con foco primario de infección establecido, neumonía, infección del tracto urinario, infección del CV, endocarditis, etc., se estudian dentro de las infecciones órgano-específicas y escapa a los objetivos de esta guía.
También se analiza el tratamiento dirigido de la bacteriemia por S. aureus y P. aeruginosa por su especial frecuencia y gravedad. Por último, se hace mención al tratamiento de soporte que precisan los pacientes con bacteriemia (tabla 9).
Tratamiento antimicrobiano empírico de la bacteriemia primaria de adquisición comunitaria
Las bacteriemias primarias o de origen desconocido constituyen el 9% de las bacteriemias de adquisición comunitaria (tabla 2). La distribución de los patógenos asociados a esta bacteriemia es relativamente uniforme en las distintas series publicadas, destacando por su frecuencia enterobacterias como E. coli, grampositivos como S. pneumoniae y S. aureus, y un porcentaje menor de infecciones polimicrobianas en ocasiones con anaerobios 4,6.
En cuanto a la sensibilidad de las bacterias causantes de estas bacteriemias de adquisición comunitaria y de origen desconocido, en pacientes sin enfermedad subyacente cabe destacar: a) el incremento progresivo de la resistencia de E. coli a quinolonas, entre el 15-20% 57; b) la aparición de cepas de E. coli productoras de BLEE que constituyen por ahora el 1-2% de los aislados, pero que en un centro de nuestro país son responsables del 15% de las bacteriemias por E. coli 58; c) la ausencia de bacteriemia por SARM comunitario en nuestro medio, aunque se hayan descrito recientemente los primeros casos 59, y d) el nivel de sensibilidad a penicilina de S. pneumoniae mantiene a los betalactámicos como el tratamiento de elección de la bacteriemia por neumococo en los pacientes sin meningitis.
Basándose en estas consideraciones, amoxicilina-ácido clavulánico es un tratamiento empírico apropiado para el paciente con bacteriemia de origen desconocido procedente de la comunidad sin signos de gravedad. En los pacientes con sepsis grave o shock séptico el espectro de actividad del tratamiento antimicrobiano debería incluir E. coli BLEE, y por ello ertapenem, al ser la carbapenema de menor espectro, es el tratamiento empírico recomendado.
En los pacientes con sospecha de bacteriemia por bacilos gramnegativos la combinación de un betalactámico con un aminoglucósido es una recomendación popular. Está basada en dos estudios abiertos que demuestran reducción de la mortalidad con el tratamiento combinado 60,61. Aunque ambos estudios incluyen el tratamiento con aminoglucósidos en el grupo que recibió monoterapia, que es un tratamiento inapropiado de la bacteriemia por bacilos gramnegativos. Un metaanálisis reciente concluye que el tratamiento combinado comparando monoterapia con betalactámicos no ofrece beneficio clínico, ni siquiera en los subgrupos de pacientes con shock séptico por bacilos gramnegativos, por P. aeruginosa, y tampoco por grampositivos y, que por el contrario aumenta la nefrotoxicidad 62. Por estas razones se recomienda evitar el tratamiento combinado con aminoglucósidos en el paciente con sospecha de bacteriemia (DII).
En la tabla 8 se resumen las recomendaciones de tratamiento empírico.
Tratamiento antimicrobiano empírico de la bacteriemia primaria asociada a los cuidados sanitarios
La bacteriemia asociada a los cuidados sanitarios, comprende un grupo muy heterogéneo de pacientes con características propias revisadas en la Sección 1 y en la tabla 2. Entre ellas es necesario destacar: a) S. aureus es una etiología común y con frecuencia es resistente a la meticilina; b) las enterobacterias portadoras de BLEE son más frecuentes que en la comunidad, y c) P. aeruginosa es una causa de bacteriemia que se debe tener en cuenta 4,5. En general, la etiología y la sensibilidad de las bacteriemias en estos pacientes son más parecidas a las nosocomiales que a las comunitarias.
El tratamiento empírico recomendado en los pacientes estables y sin particulares factores de riesgo es amoxicilina-ácido clavulánico o ceftriaxona. En los pacientes con sepsis grave o shock séptico, ertapenem y, si son portadores de sonda vesical permanente, piperacilina-tazobactam o imipenem o meropenem, combinados con vancomicina. No se recomienda el tratamiento combinado con aminoglucósidos por las razones que se han comentado previamente en las bacteriemias adquiridas en la comunidad, y más aún en estos pacientes más vulnerables a la toxicidad renal de los aminoglucósidos por razones de edad, comorbilidad e interacciones con otros fármacos.
En la tabla 8 se resumen las recomendaciones de tratamiento empírico.
Tratamiento antimicrobiano empírico de la bacteriemia primaria de adquisición nosocomial
Las principales características de las bacteriemias de adquisición nosocomial se exponen de forma general en la tabla 2 y de forma detallada por los diferentes tipos de poblaciones de pacientes en la tabla 3. El tratamiento empírico apropiado de estas bacteriemias es más difícil, especialmente las adquiridas en las unidades de cuidados intensivos (UCI), por la mayor frecuencia de bacterias multirresistentes como SARM, enterobacterias productoras de BLEE, e incluso potencialmente panresistentes, como A. baumannii, y P. aeruginosa y, también por la presencia de especies de Candida. En estas circunstancias los informes del Servicio de Microbiología local son imprescindibles para guiar el tratamiento antimicrobiano empírico.
En pacientes con sospecha de bacteriemia nosocomial se recomienda iniciar un tratamiento antibiótico de amplio espectro, especialmente si los signos de infección persisten después de haber retirado el CV. La monoterapia con cefalosporinas de tercera o cuarta generación, es adecuada si la incidencia local de SARM, P. aeruginosa y bacilos gramnegativos multirresistentes es baja. En los pacientes con CVC sin otro foco aparente de infección se recomienda añadir vancomicina al tratamiento inicial. En los pacientes con sepsis grave o shock séptico el tratamiento empírico debe ser más amplio, teniendo en cuenta que debe tener: a) actividad frente a P. aeruginosa, particularmente en los pacientes ingresados en UCI y con foco pulmonar 63; b) actividad frente a las bacterias multirresistentes como A. baumannii, enterobacterias productoras de BLEE y SARM, si forman parte de la epidemiología local, y c) que incluya un antifúngico con actividad frente a Candida spp. en los pacientes con factores de riesgo para esta infección fúngica, que con frecuencia se manifiesta por shock séptico. Los factores de riesgo son: colonización previa por especies de Candida, nutrición parenteral total, CVC, cirugía abdominal, insuficiencia renal y cáncer 43,64,65. En la actualidad anfotericina B desoxicolato, fluconazol, caspofungina y voriconazol han demostrado una eficacia equivalente, aunque con matices, en el tratamiento de la candidemia en pacientes adultos 65-68.
Por ello en estos pacientes con sepsis grave o shock séptico de adquisición nosocomial recomendamos el tratamiento empírico con piperacilina-tazobactam, imipenem o meropenem, más vancomicina y si el paciente tiene los factores de riesgo de candidemia mencionados, un antifúngico. No se recomienda el tratamiento combinado con aminoglucósidos por las razones expuestas previamente. Una excepción a esta recomendación sería en los centros o áreas de hospitalización con bacterias gramnegativas multirresistentes, especialmente P. aeruginosa, en los que el tratamiento combinado con aminoglucósidos podría ser útil al ampliar el espectro de la monoterapia con betalactámicos en los pacientes con sepsis grave o shock séptico.
En la tabla 8 se resumen las recomendaciones de tratamiento empírico en estos pacientes.
Tratamiento antimicrobiano empírico de la bacteriemia primaria en poblaciones especiales de pacientes por su enfermedad subyacente
Las principales características de estas bacteriemias se exponen de en las tablas 3 y 4. Teniéndolas en cuenta se realizan las siguientes recomendaciones terapéuticas y se resumen en la tabla 8.
Pacientes en hemodiálisis
S. aureus sensible a la meticilina y SARM son la etiología principal de la bacteriemia en estos pacientes 18. Si la situación clínica es estable vancomicina es el tratamiento empírico de elección. En caso de sepsis grave o shock séptico, es recomendable ampliar la cobertura frente a bacilos gramnegativos, incluida P. aeruginosa.
Receptores de trasplante de órgano sólido y de progenitores hematopoyéticos
El tratamiento empírico recomendado en los receptores de trasplante con sospecha de bacteriemia de origen desconocido adquirida en la comunidad sería un betalactámico de amplio espectro, ceftriaxona o amoxicilina-ácido clavulánico. En los casos de adquisición nosocomial o, en presencia de neutropenia, el tratamiento debe tener actividad frente a P. aeruginosa. En los pacientes con sepsis grave o shock séptico se recomienda añadir vancomicina y considerar el tratamiento antifúngico con actividad frente a Candida spp.
Pacientes con cáncer y neutropenia secundaria a quimioterapia
Ante la sospecha de sepsis sin foco aparente, sin mucositis importante y con estabilidad clínica, está indicado el tratamiento con un betalactámico con actividad frente a P. aeruginosa como cefepima, piperacilina-tazobactam, imipenem o meropenem. Se recomienda añadir un glicopéptido, preferentemente vancomicina, en presencia de mucositis grave, colonización previa por SARM, infección del CV, y sepsis grave o shock séptico 38. Linezolid es una alternativa a los glicopéptidos en esta indicación. En un estudio aleatorizado de tratamiento empírico en más de 400 pacientes neutropénicos, alcanzó una eficacia similar a la de vancomicina 69.
En general, el tratamiento combinado con aminoglucósidos se desaconseja porque no ha demostrado beneficio frente a la monoterapia e incrementa los efectos adversos 70. En pacientes con sepsis grave o shock séptico además de vancomicina, se recomienda añadir un antifúngico activo frente a Candida spp. 43. Anfotericina B desoxicolato y caspofungina se han comparado en el tratamiento de la candidiasis invasora, incluyendo un reducido número de pacientes neutropénicos, alcanzando una eficacia equivalente 65.
Pacientes con infección por VIH
En los pacientes con infección por VIH con sospecha de bacteriemia comunitaria y con linfocitos CD4 > 50 cél./μl se recomienda amoxicilina-ácido clavulánico o una cefalosporina de amplio espectro como ceftriaxona o cefotaxima. Cuando el recuento de linfocitos CD4 es < 50 cél./μl se recomienda un betalactámico con actividad frente a P. aeruginosa como cefepima.
Adictos a drogas por vía parenteral (ADVP)
En los pacientes con ADVP con sospecha de bacteriemia comunitaria es obligada la cobertura de SASM con cloxacilina. Cuando se sospechen infecciones mixtas con Streptococcus pyogenes e incluso anaerobios y bacilos gramnegativos procedentes de la boca, el tratamiento empírico recomendado es amoxicilina-ácido clavulánico.
Otros grupos de pacientes con enfermedades subyacentes
En los pacientes con cirrosis hepática, en los que E. coli es la etiología más probable 27, el tratamiento empírico recomendado es ceftriaxona o cefotaxima.
En los pacientes con esplenectomía el tratamiento debe ir dirigido hacia las bacterias capsuladas 28, por lo que ceftriaxona o cefotaxima son la mejor elección.
En los pacientes con lesión medular con sospecha de bacteriemia en los que la etiología mixta es frecuente 29, el tratamiento empírico recomendado es amoxicilina-ácido clavulánico.
Las recomendaciones anteriores se resumen en la tabla 8 y como es lógico, deben modificarse en los pacientes con exposición nosocomial.
Tratamiento antimicrobiano dirigido
La confirmación de la bacteriemia con la identificación del microorganismo y la determinación de la sensibilidad a los antimicrobianos está disponible generalmente a las 48-72 h de la extracción de los hemocultivos. Esta información junto con la evolución clínica del paciente son la base para modificar, si es necesario, el tratamiento empírico e indicar el tratamiento antimicrobiano dirigido.
Para la selección del tratamiento antimicrobiano dirigido deben tenerse en cuenta cinco principios básicos: a) el antimicrobiano seleccionado debe ser el más eficaz; b) debe ser el más seguro; c) debe ser el de espectro más reducido; d) debe ser el más fácil de administrar, y e) debe ser el más económico (AIII). Por su especial relevancia clínica revisaremos el tratamiento dirigido de las bacteriemias por S. aureus y por P. aeruginosa (tabla 9).
Tratamiento dirigido de la bacteriemia por S. aureus
Cloxacilina es el tratamiento de elección en la bacteriemia por SASM 71. Algunos expertos recomiendan la adición de gentamicina en las bacteriemias de presentación grave durante los primeros 3-5 días de tratamiento, aunque el beneficio clínico de esta combinación, que incrementa el riesgo de nefrotoxicidad, no se ha demostrado 72. Se recomienda cloxacilina en monoterapia como tratamiento de elección de la bacteriemia por SASM (AI). En los pacientes con alergia no anafiláctica a la penicilina, cefazolina es una buena opción terapéutica y en los pacientes con anafilaxia, vancomicina.
Vancomicina es el tratamiento de elección en la bacteriemia por SARM. No se recomienda la combinación de aminoglucósidos con vancomicina porque no mejoran los resultados en la endocarditis por SARM e incrementan la nefrotoxicidad 72.
Teicoplanina, linezolid y cotrimoxazol son tratamientos alternativos a la vancomicina en el tratamiento de la bacteriemia por SARM. No hay estudios aleatorizados que comparen teicoplanina con vancomicina en la bacteriemia por SARM. En un estudio abierto de bacteriemias por S. aureus las curaciones con teicoplanina alcanzan el 88% (69/78), y están directamente relacionadas con las concentraciones valle (7 mg/l en los que curan frente a 3,9 mg/dl en los que fracasa), por ello se recomiendan que la dosis de teicoplanina sea de 12 mg/kg/i.v./día, para alcanzar niveles valle superiores a 10 mg/l 73.
Cotrimoxazol tiene una eficacia clínica y microbiológica equivalente a vancomicina según datos de un ensayo aleatorizado y doble ciego de infecciones por S. aureus que incluye 38 pacientes con bacteriemia por SARM. La dosis de cotrimoxazol fue de 320/1.600 mg/12 h por vía intravenosa pero los efectos adversos fueron más comunes con cotrimoxazol 74.
Linezolid tiene una eficacia equivalente a vancomicina en el tratamiento de la bacteriemia por SARM según datos procedentes de dos estudios, uno realizado en 22 pacientes con neumonía nosocomial bacteriémica y otro en 43 pacientes con bacteriemia por SARM. La dosis de linezolid fue de 600 mg/12 h por vía intravenosa durante al menos 7 días, continuando con 600 mg/12 h por vía oral 75,76.
Las anteriores recomendaciones se resumen en la tabla 9.
Tratamiento dirigido de la bacteriemia por P. aeruginosa
En la bacteriemia por P. aeruginosa tradicionalmente se recomienda el tratamiento combinado con un antibiótico betalactámico antipseudomónico y un aminoglucósido 77. Esta recomendación está basada en un estudio abierto realizado entre los años 1982 y 1986 en 200 pacientes con bacteriemia por P. aeruginosa que concluye que el tratamiento combinado, un betalactámico más un aminoglucósido, reduce la mortalidad comparado con la monoterapia (27%, 38/143 frente a 47%, 20/43) 61. Pero hay que añadir que en el grupo de pacientes que recibió tratamiento con monoterapia, la mayoría lo hizo con aminoglucósidos. Por ello la conclusión del estudio debería haber sido que en el tratamiento de la bacteriemia por P. aeruginosa la combinación de un betalactámico más un aminoglucósido es más eficaz que un aminoglucósido solo. Se sabe que los aminoglucósidos en monoterapia son un tratamiento inapropiado para las bacteriemias por bacilos gramnegativos 78. Estudios clínicos posteriores sugieren que la monoterapia con betaclactámicos activos frente a P. aeruginosa es tan eficaz como el tratamiento combinado 79, incluso en pacientes con cáncer y neutropenia, y en pacientes con shock y neumonía 80. Por ello se recomienda que el tratamiento dirigido de la bacteriemia por P. aeruginosa se realice con un betalactámico con actividad frente a la misma, ceftazidima, cefepima, aztreonam o piperacilina-tazobactam (AII).
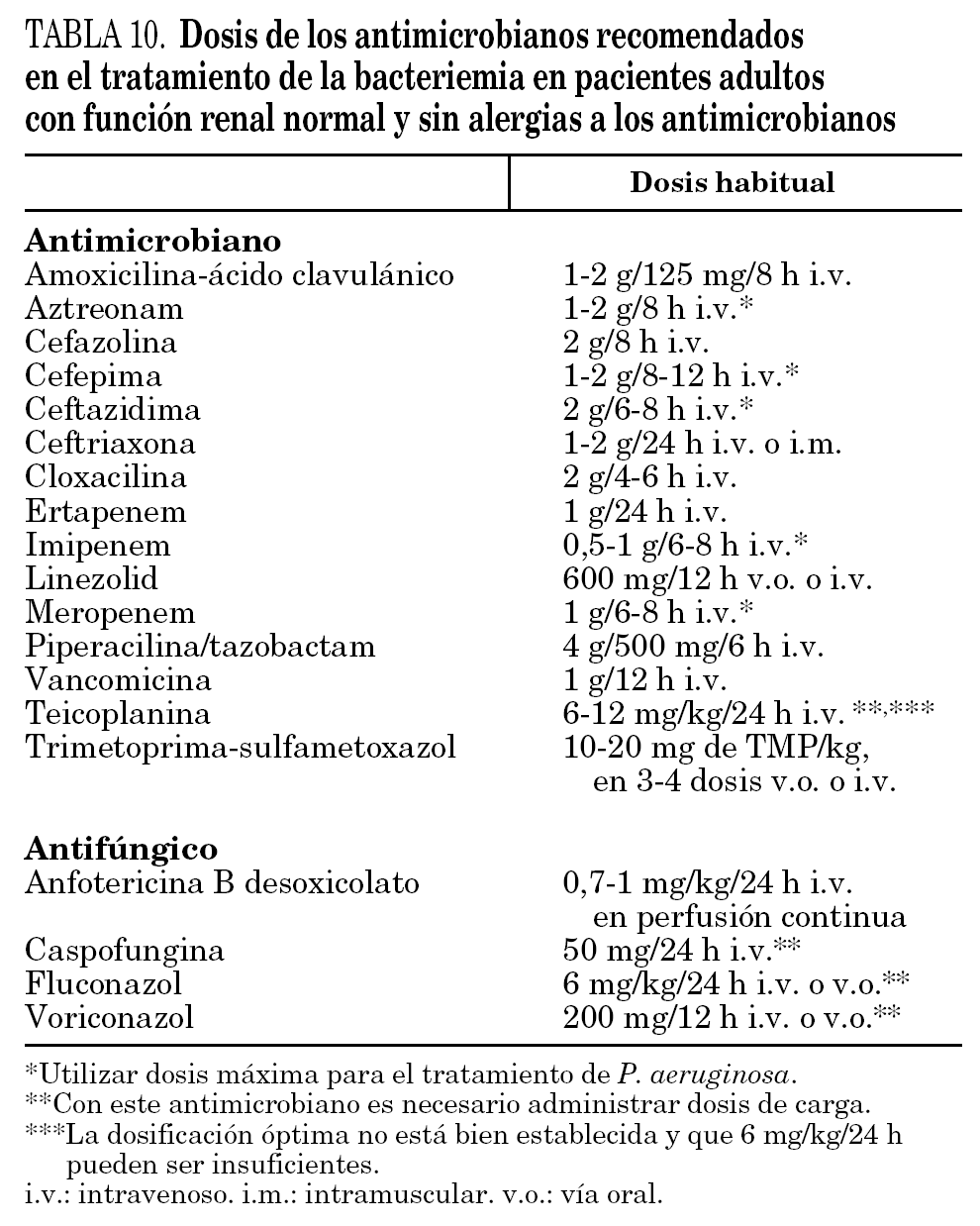
Las anteriores recomendaciones se resumen en la tabla 9. En la tabla 10 se muestran las dosis de los antimicrobianos recomendados para el tratamiento.
Tratamiento de soporte del paciente con sepsis grave o shock séptico
El tratamiento de soporte precoz junto con el tratamiento antimicrobiano apropiado aumenta la supervivencia de los pacientes con sepsis grave o shock séptico 81. Las medidas recomendadas para el tratamiento de soporte de estos pacientes han sido consensuadas por varias sociedades científicas internacionales 44. Las principales recomendaciones se recogen en la tabla 11. Se recomienda establecer protocolos de actuación que aseguren que los pacientes con sepsis grave o shock séptico son atendidos como emergencias médicas comparables al dolor precordial (AI).
Sección 4. SEGUIMIENTO DEL PACIENTE CON BACTERIEMIA
Tras conocer el resultado del hemocultivo y del antibiograma debe ajustarse el tratamiento antimicrobiano inicial según los criterios comentados en el apartado previo, y continuar el seguimiento del paciente mediante la evaluación clínica y microbiológica. La interpretación correcta de los datos clínicos y microbiológicos evolutivos permitirá definir las situaciones de fracaso o de éxito terapéutico y la duración final del tratamiento como se expone a continuación.
Evaluación clínica
A diferencia de lo que ocurre con la neumonía, hay escasos datos acerca del tiempo que transcurre desde el inicio del tratamiento hasta la mejoría clínica en los pacientes con bacteriemia. En la bacteriemia por S. aureus, que es en la que con más detalle se ha estudiado la evolución clínica, la persistencia de la fiebre más allá de 72 h tras el inicio del tratamiento y la persistencia de hemocultivos positivos más allá de las 48-96 h de tratamiento predicen un curso complicado de la misma, definido por la evolución hacia una complicación supurada, la recidiva o la muerte 50.
En general se acepta que los pacientes con bacteriemia deben mejorar en las primeras 48-72 h de tratamiento adecuado, y que la persistencia de la fiebre o la reaparición de la misma o de otros signos o síntomas de respuesta inflamatoria, más allá de 72 h después del inicio del tratamiento deben alertar sobre un posible curso complicado de la bacteriemia.
Del mismo modo, la reaparición de fiebre o signos de sepsis tras la finalización del tratamiento de una bacteriemia implica la necesidad de reevaluar al paciente y descartar una recidiva (ver más adelante) o una complicación supurada. En esta situación está indicado repetir los hemocultivos y solicitar las exploraciones complementarias de acuerdo al contexto clínico. Por ello se recomienda que el diagnóstico de bacteriemia, y sus complicaciones o secuelas, consten en el informe clínico del paciente que la ha padecido (CIII).
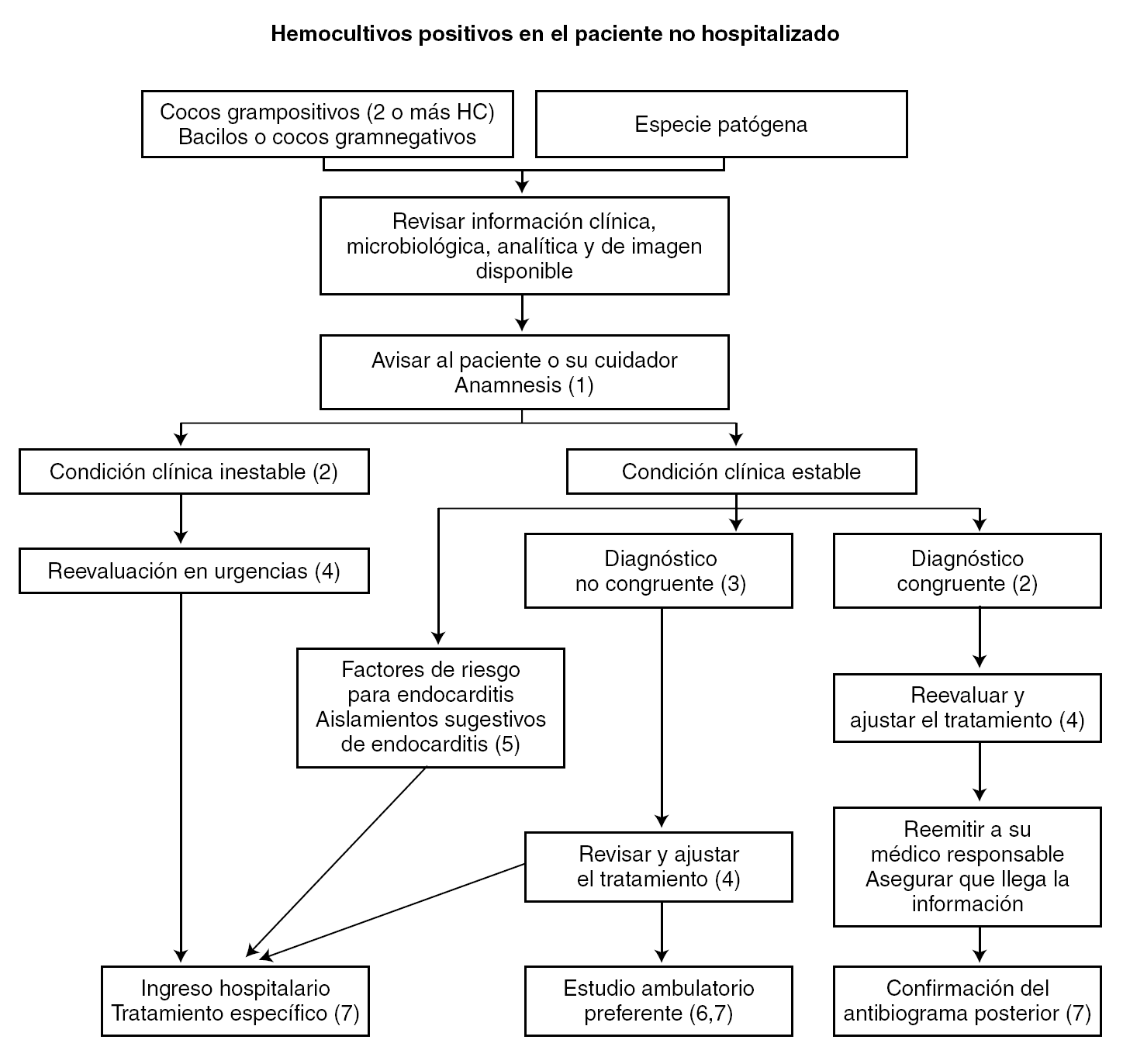
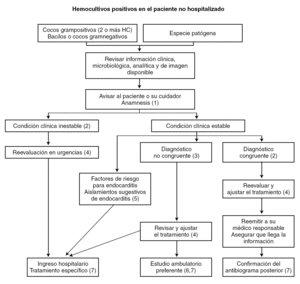
El diagnóstico de bacteriemia se establece en ocasiones a posteriori, en pacientes que han sido dados de alta, la mayoría de las veces desde el servicio de urgencias. Estos pacientes requieren la reevaluación inmediata para conocer su situación clínica y si el diagnóstico y el tratamiento indicados al alta eran apropiados. En la figura 2 se muestra un esquema para la atención a estos pacientes.
Figura 2. Esquema para la atención al paciente con bacteriemia que ha sido dado de alta previamente.
Evaluación microbiológica
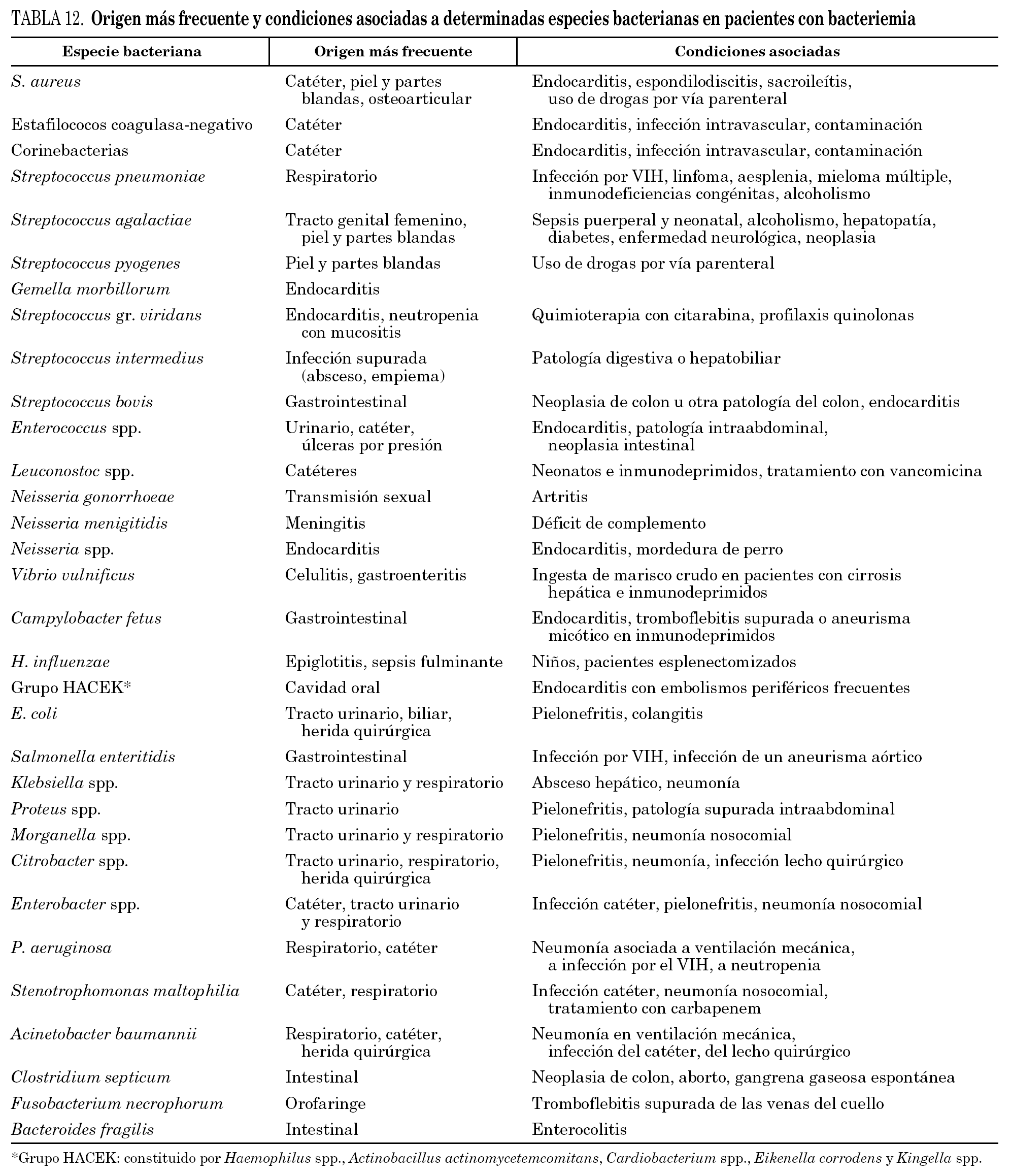
El diagnóstico microbiológico de la bacteriemia proporciona una información de gran utilidad clínica sobre el origen, los factores desencadenantes y las enfermedades subyacentes de la misma. Por ejemplo, la bacteriemia continua por Gemella morbillorum o por enterococo, adquirida en la comunidad, orienta al diagnóstico de endocarditis, mientras que la bacteriemia primaria por Salmonella enteritidis o por neumococo sugiere la infección por el VIH. En la tabla 12 se ofrece una relación, no exhaustiva, del origen y de las condiciones clínicas que se asocian con mayor frecuencia a la bacteriemia por una etiología determinada.
El beneficio de los hemocultivos "de control" para establecer la curación microbiológica de la bacteriemia no se ha demostrado, con excepción de la bacteriemia por S. aureus en la que como se ha mencionado predicen una evolución complicada 50. Se recomienda obtener hemocultivos a las 48-96 h del inicio de tratamiento en las bacteriemias por S. aureus. Por la misma razón se recomienda obtener hemocultivos de control en los pacientes con bacteriemia que permanezcan con fiebre o sin respuesta clínica después de 48-96 h de tratamiento apropiado, en los que reaparezca la fiebre, y en los pacientes con sospecha de endocarditis (AII).
Fracaso microbiológico
El fracaso microbiológico durante el tratamiento de la bacteriemia se define por la bacteriemia persistente y por la bacteriemia de brecha, ambas definidas en la Sección 2 49.
Se define el fracaso microbiológico como la persistencia de hemocultivos positivos a partir de las 48-96 h de tratamiento correcto, dado su valor pronóstico en la bacteriemia por S. aureus 50.
La bacteriemia persistente tiene mayor mortalidad y son factores de riesgo la presencia de CVC, la cirrosis hepática, la etiología polimicrobiana, la etiología por Salmonella spp., y el tratamiento antimicrobiano empírico inapropiado 82. Los factores de riesgo para la bacteriemia persistente por S. aureus son la diabetes, la presencia de lesiones metastásicas y el tratamiento con vancomicina, además del CV 83.
La primera causa de fracaso microbiológico en los pacientes con bacteriemia con tratamiento antimicrobiano apropiado es la persistencia del foco primario de infección que mayoritariamente es el CV. Por ello se recomienda retirar los CVC en los pacientes con bacteriemia persistente, a menos que exista otra causa de la misma (AII). Otros focos de infección causantes de bacteriemia persistente son la tromboflebitis supurada tras la retirada del CV, la infección de un aneurisma de la aorta abdominal, los abscesos y colecciones supuradas intraabdominales y, por supuesto, la endocarditis. La endocarditis debe sospecharse siempre ante bacteriemias primarias persistentes por bacterias de los géneros Staphylococcus, Enterococcus o Streptococcus (especialmente, del grupo viridans).
La dosificación inadecuada del tratamiento antimicrobiano es otra causa de fracaso microbiológico en bacteriemias por bacilos gramnegativos y por cocos grampositivos 84,85. Por lo tanto, ante una bacteriemia persistente, especialmente por bacterias resistentes, es recomendable optimizar el tratamiento antibiótico en términos farmacodinámicos.
El desarrollo de resistencia durante el tratamiento es otra causa de fracaso microbiológico, especialmente en la bacteriemia por E. cloacae cuando se trata con cefalosporinas en monoterapia 86 y, en menor medida, en las bacteriemias por P. aeruginosa tratadas con ciprofloxacino o imipenem en monoterapia y por S. aureus con ciprofloxacino. Por todo ello, es recomendable que el clínico comunique al microbiólogo cuantas discrepancias clínico-microbiológicas observe.
Recidiva
La recidiva es la reaparición de la bacteriemia por la misma cepa bacteriana después de haber finalizado el tratamiento. La recidiva, que debe distinguirse de la reinfección por diferentes cepas de la misma especie, ocurre en menos del 10% de las bacteriemias y es más común en los pacientes con enfermedades subyacentes graves y con bacteriemias complicadas al diagnóstico 87. Sus principales causas son los CV, otros cuerpos extraños intravasculares no retirados, la presencia de colecciones o abscesos no drenados y la duración insuficiente del tratamiento antimicrobiano. La recidiva en la bacteriemia por S. aureus se asocia además al tratamiento con vancomicina y a la hemodiálisis 88. A pesar de la falta de datos sobre la utilidad de los hemocultivos al terminar el tratamiento antimicrobiano de la bacteriemia, se recomienda realizar hemocultivos al finalizar la antibioterapia en los pacientes con bacteriemias complicadas, incluida la endocarditis, y con bacteriemias por S. aureus en hemodiálisis y tratados con vancomicina, para diagnosticar precozmente la recidiva (BIII).
Evaluación del tratamiento
Duración
La duración idónea del tratamiento de las bacteriemias no está definida, como no lo está para gran parte de las infecciones bacterianas que manejamos a diario. En general se recomiendan 7-14 días de tratamiento para las bacteriemias no complicadas (BIII), pero existen muchos matices clínicos que hay que considerar. Es posible que la mayoría de los tratamientos actuales de la bacteriemia sean, en general, más prolongados de lo necesario. Así un estudio abierto sugiere que en las bacteriemias no complicadas en pacientes críticos, 5-6 días de tratamiento antimicrobiano pueden ser suficientes 89.
En las bacteriemias primarias por ECN se recomienda la retirada del CV más 3-7 días de tratamiento antimicrobiano en ausencia de factores de riesgo para endocarditis 39. En algunos pacientes puede ser suficiente con la retirada del catéter (CIII). Para decidir la duración del tratamiento en la bacteriemia por S. aureus es clave descartar endocarditis. Para ello se recomienda realizar una ecocardiografía transesofágica en los pacientes de alto riesgo de endocarditis, situación que incluye entre otros a los pacientes con bacteriemia adquirida en la comunidad, a los portadores de prótesis valvulares y otros dispositivos intracardíacos permanentes, a los pacientes con bacteriemia persistente y a los pacientes con alteraciones recientes de la conducción cardíaca 90. La duración del tratamiento en la bacteriemia no complicada por S. aureus en un paciente sin valvulopatía previa, ni prótesis intravasculares ni osteoarticulares, que está originada en un CV que puede retirarse y con hemocultivos negativos a las 48-96 h de tratamiento, es de 10-14 días 91 (BII). En la bacteriemia no complicada en pacientes con valvulopatía previa, con hemocultivos negativos a las 48-96 h de tratamiento, sin vegetaciones en la ecografía transesofágica practicada a partir del quinto día de tratamiento, y sin evidencia de complicaciones metastásicas en otras localizaciones, la duración del tratamiento antimicrobiano debe ser de un mínimo de 14 días 85 (BII). Finalmente, en la bacteriemia complicada, definida por la presencia de endocarditis infecciosa o de infección en un tejido profundo o de persistencia de la bacteriemia tras 48-96 h de tratamiento antibiótico apropiado, el tratamiento debe tener una duración mínima de 4 semanas 90 (BII).
En la candidemia se recomienda que la duración del tratamiento sea de al menos 14 días a partir del último hemocultivo positivo 43 (BII).
Tratamiento oral y secuencial de la bacteriemia
Es posible que la mayor parte de las bacteriemias no complicadas con evolución favorable puedan ser tratadas por vía oral desde el principio, siempre que el antibiótico empleado tenga buena actividad intrínseca frente al patógeno aislado y elevada biodisponibilidad oral. Los resultados de algunos estudios, con un reducido número de pacientes, así lo sugieren.
En la bacteriemia por S. aureus, fleroxacino más rifampicina oral es tan eficaz como el tratamiento intravenoso 91. En pacientes con pielonefritis bacteriémica, ciprofloxacino oral es tan eficaz como por vía intravenosa 92, del mismo modo que lo fue diritromicina oral en 13 de 14 enfermos con neumonía neumocócica bacteriémica 93.
El tratamiento secuencial en las bacteriemias, aunque es una práctica habitual, es poco conocido. La experiencia publicada incluye un estudio de 18 pacientes con neumonía neumocócica bacteriémica, y otro con bacteriemias diversas tratadas con ciprofloxacino 94,95. En el tratamiento de la candidemia se ha comprobado que el tratamiento con fluconazol o con voriconazol oral a partir del cuarto día es tan eficaz como continuar con anfotericina intravenosa 68.
En pacientes seleccionados, con tolerancia a la vía oral y con alternativas razonables de tratamiento oral en función de los datos del antibiograma, origen de la bacteriemia y farmacocinética de los fármacos, puede realizarse tratamiento secuencial una vez estabilizado el cuadro clínico (CIII). En los pacientes con candidemia se recomienda el tratamiento secuencial con fluconazol oral a partir del cuarto día de tratamiento (AI).
Recomendaciones
Sección 1. Epidemiología y etiología de la bacteriemia
1.Clasificar la bacteriemia según el lugar de adquisición en bacteriemia de adquisición comunitaria, bacteriemia asociada a los cuidados sanitarios y bacteriemia de adquisición nosocomial (BIII).
2.Realizar y distribuir por el Servicio de Microbiología de cada centro informes periódicos estratificados por áreas y por servicios del hospital, con la frecuencia y la sensibilidad de los microorganismos aislados en los hemocultivos (BIII).
Sección 2. Evaluación clínica: desde la sospecha hasta la confirmación de la bacteriemia
1.Clasificar la gravedad clínica inicial del paciente con sospecha de bacteriemia, de acuerdo con los criterios internacionales, en sepsis, sepsis grave y shock séptico (BII).
2.Medir y registrar la presión arterial, frecuencia cardíaca, frecuencia respiratoria, nivel de conciencia y diuresis en todos los pacientes con sospecha de sepsis (AII).
3.Indicar hemocultivos antes de iniciar el tratamiento antimicrobiano en todo paciente con sepsis e infección de órgano o sistema (BIII); con sepsis grave o shock séptico (AII); con sospecha de endocarditis, de brucelosis, o de fiebre tifoidea (AII); con sepsis y neutropenia, o inmunosupresión relevante, o senilidad (AII).
4.Realizar la toma de muestras de los posibles focos de infección en los pacientes con sospecha de bacteriemia secundaria antes de iniciar la antibioterapia (BIII).
5.En los pacientes con catéter vascular difícilmente sustituible y sin signos claros de infección indicar hemocultivos simultáneos por punción percutánea y a través del catéter para realización de hemocultivos cuantitativos o, cualitativos con monitorización continua del tiempo de crecimiento (AII).
6.Valorar el aislamiento de un microorganismo en un hemocultivo integrando las características clínicas y microbiológicas (BII).
7.Elegir el tratamiento antimicrobiano empírico en el paciente con sospecha de bacteriemia tras la realización de un juicio clínico de sospecha que integre los datos de la historia y de la exploración clínica, la información microbiológica y la epidemiología local (AIII).
Sección 3. Tratamiento del paciente con bacteriemia
1.Las recomendaciones para el tratamiento antimicrobiano empírico del paciente con sospecha de bacteriemia de origen desconocido se recogen en la tabla 8.
2.Evitar el tratamiento combinado con aminoglucósidos en los pacientes con sospecha de bacteriemia (DII) salvo en circunstancias especiales.
3.El tratamiento antimicrobiano dirigido debe cumplir cinco principios básicos que por orden de importancia son: el antimicrobiano seleccionado debe ser el más eficaz; el más seguro; el de espectro más reducido; el más fácil de administrar, y el más económico (AIII).
4.Las recomendaciones para el tratamiento dirigido del paciente con bacteriemia por S. aureus se recogen en la tabla 9.
5.Las recomendaciones para el tratamiento dirigido del paciente con bacteriemia por P. aeruginosa se recogen en la tabla 9.
6.Establecer protocolos de actuación que aseguren que los pacientes con sepsis grave o shock séptico son atendidos como emergencias médicas comparables al dolor precordial (AI).
Sección 4. Seguimiento del paciente con bacteriemia
1.Hacer constar el diagnóstico de bacteriemia en el informe clínico de alta (CIII).
2.Indicar hemocultivos de control a las 48-96 h del inicio de tratamiento en las bacteriemias por S. aureus, en los pacientes con bacteriemia por cualquier etiología que permanezcan con fiebre o sin respuesta clínica después de 48-96 h de tratamiento apropiado, y en los pacientes con sospecha de endocarditis (AII).
3.Retirar el catéter venoso central en los pacientes con bacteriemia persistente, a menos que exista otra causa de la misma (AII).
4.La duración del tratamiento antimicrobiano:
a)En la bacteriemia por S. aureus no complicada y sin riesgo de endocarditis es de 10-14 días (BII).
b)En la bacteriemia por S. aureus no complicada en pacientes con valvulopatía previa, con hemocultivos negativos a las 48-96 h de tratamiento, sin vegetaciones en la ecografía transesofágica practicada a partir del quinto día de tratamiento, y sin evidencia de complicaciones metastásicas en otras localizaciones, la duración del tratamiento antimicrobiano debe ser de un mínimo de 14 días (BII).
c)En la bacteriemia complicada por S. aureus la duración del tratamiento antimicrobiano debe ser de un mínimo de 28 días (BII).
d)En la candidemia la duración del tratamiento antifúngico debe ser de al menos 14 días a partir del último hemocultivo positivo (BII), y se recomienda el tratamiento secuencial con fluconazol oral a partir del cuarto día de tratamiento (AI).
e)En la bacteriemia por ECN asociada a catéter vascular en pacientes sin factores de riesgo de endocarditis puede ser suficiente con la retirada del catéter (CIII).
f)En el resto de bacteriemias no complicadas la duración del tratamiento recomendada es de 7-14 días (BIII).
5.En pacientes seleccionados, con tolerancia a la vía oral y con alternativas razonables de tratamiento oral en función de los datos del antibiograma, origen de la bacteriemia y farmacocinética de los fármacos, puede realizarse tratamiento secuencial una vez estabilizado el cuadro clínico (CIII).
Agradecimientos.
A la Dra. Elena Escalante por la revisión de estilo de este documento.
Conflicto de intereses
Dr. JM. Cisneros: asesoría científica para Esteve, Gilead, MSD y Pfizer.
Dr. J. Cobo: asesoría científica para Chiron, MSD, Pfizer y Whyeth.
Dr. M. Pujol: sin conflicto de intereses.
Dr. J. Rodríguez Baño: asesoría científica para Chiron, MSD, Pfizer y Wyeth.
Dr. M. Salavert: asesoría científica para Abbott, Bristol-BMS, Chiron, MSD, Pfizer y Whyeth.
Correspondencia:
Dr. J.M. Cisneros-Herreros.
Servicio de Enfermedades Infecciosas.
Hospital Universitario Virgen del Rocío.
Avda. Manuel Siurot, s/n. 41013 Sevilla. España.
Correo electrónico: cisnerosjm@telefonica.net
Manuscrito recibido el 1-6-2006; aceptado el 3-7-2006.