El tratamiento antirretroviral de alta eficacia ha incrementado la expectativa de vida en los pacientes con infección por el virus de inmunodeficiencia humana (VIH), lo que ha traído consigo un aumento de comorbilidades propias del envejecimiento de la población, como es el caso de la enfermedad pulmonar obstructiva crónica (EPOC). Todo esto conlleva la necesidad de utilizar un mayor número de medicamentos y un aumento en el riesgo de interacciones farmacológicas con los antirretrovirales, especialmente con los inhibidores de la proteasa.
MétodosDescribimos un caso de insuficiencia suprarrenal iatrogénica por interacción entre ritonavir y fluticasona inhalada en un paciente diagnosticado de infección por VIH y EPOC. Posteriormente realizamos una revisión de casos clínicos publicados en adultos en la literatura médica (Medline) hasta diciembre del 2012.
ResultadosEn el periodo estudiado se identificaron 34casos, con una media de edad de 48años. La dosis promedio de ritonavir fue de 187mg/día, mientras que la de fluticasona fue de 866μg/día. El promedio de tiempo de la interacción entre el ritonavir y la fluticasona fue de 8meses. En el 85% de los casos se retiró la fluticasona una vez hecho el diagnóstico de insuficiencia suprarrenal/síndrome de Cushing. El 90% de los pacientes presentó una resolución completa del cuadro clínico con la modificación del tratamiento.
ConclusiónEn los pacientes en tratamiento antirretroviral con un inhibidor de la proteasa potenciado con ritonavir en los que sea preciso el uso de corticoides inhalados, la beclometasona sería la mejor opción terapéutica.
Highly effective antiretroviral treatment has improved the life expectancy of human immunodeficiency virus (HIV) infected patients, but has led to an increase in the comorbidities related to aging, such as the chronic obstructive pulmonary disease (COPD). All this implies the need for a greater number of drugs and an increasing risk of drugs interactions with antiretroviral treatment, particularly protease inhibitors.
MethodsWe report a case of iatrogenic adrenal insufficiency interaction secondary to ritonavir and inhaled fluticasone in an HIV-infected patient with COPD. A review was made of the cases reported in adults in the medical literature (Medline) up to December 2012.
ResultsA total of 34cases were reported. The mean age was 48years. The mean dose of ritonavir was 187mg/day, while the fluticasone dose was 866μg/day. The average time of the interaction between ritonavir and fluticasone was 8months. In 85% of cases fluticasone was discontinued at the time of diagnosis of adrenal insufficiency/Cushing syndrome. Almost all (90%) patients had a complete resolution of the symptoms after changing the treatment.
ConclusionHIV-infected patients on antiretroviral therapy with protease inhibitor boosted with ritonavir which requires the use of inhaled corticosteroids, beclomethasone would be the best treatment option.
En los últimos años, y gracias al tratamiento antirretroviral (TAR) de alta eficacia, la expectativa de vida de los pacientes infectados por el virus de la inmunodeficiencia humana (VIH) ha aumentado de forma considerable. En el momento actual se estima que en Estados Unidos el 30% de los pacientes infectados por el VIH son mayores de 50años, y se calcula que en 2015 esta cifra se encuentre en torno al 50%1. Este incremento en la expectativa de vida conlleva, en muchos casos, el aumento de las comorbilidades propias de este grupo poblacional y el empleo de terapias no relacionadas con el VIH, lo que ocasiona un mayor riesgo de interacciones farmacológicas, especialmente con los inhibidores de la proteasa.
Una de las comorbilidades que es más prevalente en pacientes infectados por el VIH que en los pacientes seronegativos es la enfermedad pulmonar obstructiva crónica (EPOC)2. En estos pacientes una interacción potencialmente grave es la que ocurre entre el ritonavir (RTV) y los corticoides inhalados. Esto se debe a que RTV a dosis bajas tiene un potente efecto inhibidor del citocromo P450 (CYP450) a través de la isoenzima 3A4, lo que provoca un aumento de las concentraciones plasmáticas de otros fármacos que se metabolizan por esta misma vía, como ocurre con la fluticasona inhalada, un fármaco utilizado con frecuencia en los pacientes con EPOC.
Materiales y métodosDescribimos un caso clínico de síndrome de Cushing iatrogénico por la interacción entre RTV y fluticasona inhalada en un paciente diagnosticado de infección por el VIH y EPOC. Posteriormente realizamos una revisión de los casos clínicos publicados en la literatura médica (Medline) hasta diciembre del 2012 que hagan referencia a la asociación insuficiencia suprarrenal/síndrome de Cushing iatrogénico en adultos, secundarios a la interacción entre RTV y fluticasona inhalada.
Descripción del casoPaciente de 75años, exfumador, con un índice acumulado de tabaco de 35paquetes/año y con criterios de EPOC, diagnosticado 10años antes de infección por el VIH(A2). Por toxicidades previas el paciente estaba en TAR con atazanavir 300mg/día, RTV 100mg/día y lamivudina 300mg/día, presentando un buen control inmunológico (CD4 371células/ml) y virológico (<50copias/ml). En mayo de 2012 ingresó por EPOC severa agudizada, precisando al alta oxigenoterapia domiciliaria, salmeterol/fluticasona 25/250μg una inhalación cada 12h, bromuro de tiotropio y salbutamol a demanda. Acude a revisión programada en septiembre de 2012 refiriendo cuadro clínico de astenia, pérdida de peso y edema en miembros inferiores. A la exploración física destacaba discreto edema facial y de miembros inferiores con fóvea. Se realizó una analítica de control que incluía estudio hormonal, destacando: sodio 140mmol/l, potasio 4,5mmol/l, cortisol plasmático a las 8 de la mañana 0,8μg/dl; cortisol plasmático a las 21h 1,7μg/dl, cortisol libre urinario 293μg/24h y ACTH <5pg/ml. El paciente fue diagnosticado de insuficiencia suprarrenal iatrogénica secundaria a la toma de glucocorticoides exógenos. A la vista de los hallazgos se modificó la terapia broncodilatadora retirando la fluticasona inhalada y manteniendo el salmeterol, y se modificó el TAR iniciando raltegravir 400mg cada 12h y atazanavir 300mg cada 12h. Además se pautó hidrocortisona 20mg cada 8h en pauta descendente con mejoría de la sintomatología a los 2meses de ser modificado el tratamiento y con mejoría de los niveles de cortisol plasmático (cortisol a las 8 de la mañana de 10,9μg/dl). Tras la aplicación del algoritmo de causalidad de Karch y Lasagna modificado por Naranjo et al.3, la asociación causal se clasificó como probable.
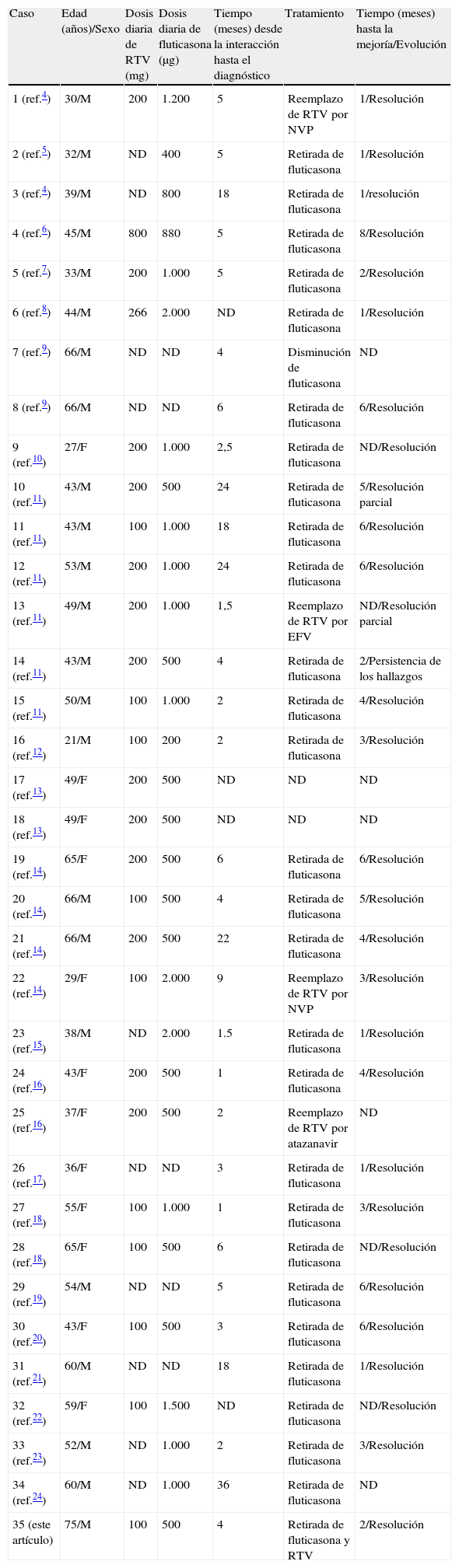
ResultadosEn el periodo analizado se encontraron 21publicaciones4-24 con un total de 34casos que cumplían con los criterios de la búsqueda (35casos incluyendo nuestro caso clínico expuesto). Las principales características de los casos clínicos encontrados se resumen en la tabla 1. La edad media de los pacientes al momento del diagnóstico fue de 48años; el 66% eran hombres. La dosis promedio de RTV fue de 187mg/día (rango de 100 a 800mg/día), mientras que la dosis promedio de la fluticasona fue de 866μg/día (rango de 200 a 2.000μg/día). El tiempo medio entre el inicio de la utilización conjunta de RTV-fluticasona y la presentación del cuadro clínico fue de 8meses (con un rango entre 1 y 36meses). En el 85% de los casos se retiró o se cambió la fluticasona, en el resto de los casos se cambió el inhibidor de la proteasa potenciado por otro antirretroviral. El 90% de los pacientes presentó una resolución completa del cuadro clínico, en un tiempo promedio de 3,5meses (con un rango entre 1 y 8meses) tras la retirada del fármaco (RTV o fluticasona). Ningún paciente falleció como consecuencia de esta interacción.
Características clínicas de los pacientes con insuficiencia suprarrenal/síndrome de Cushing por coadministración de fluticasona-ritonavir
| Caso | Edad (años)/Sexo | Dosis diaria de RTV (mg) | Dosis diaria de fluticasona (μg) | Tiempo (meses) desde la interacción hasta el diagnóstico | Tratamiento | Tiempo (meses) hasta la mejoría/Evolución |
| 1 (ref.4) | 30/M | 200 | 1.200 | 5 | Reemplazo de RTV por NVP | 1/Resolución |
| 2 (ref.5) | 32/M | ND | 400 | 5 | Retirada de fluticasona | 1/Resolución |
| 3 (ref.4) | 39/M | ND | 800 | 18 | Retirada de fluticasona | 1/resolución |
| 4 (ref.6) | 45/M | 800 | 880 | 5 | Retirada de fluticasona | 8/Resolución |
| 5 (ref.7) | 33/M | 200 | 1.000 | 5 | Retirada de fluticasona | 2/Resolución |
| 6 (ref.8) | 44/M | 266 | 2.000 | ND | Retirada de fluticasona | 1/Resolución |
| 7 (ref.9) | 66/M | ND | ND | 4 | Disminución de fluticasona | ND |
| 8 (ref.9) | 66/M | ND | ND | 6 | Retirada de fluticasona | 6/Resolución |
| 9 (ref.10) | 27/F | 200 | 1.000 | 2,5 | Retirada de fluticasona | ND/Resolución |
| 10 (ref.11) | 43/M | 200 | 500 | 24 | Retirada de fluticasona | 5/Resolución parcial |
| 11 (ref.11) | 43/M | 100 | 1.000 | 18 | Retirada de fluticasona | 6/Resolución |
| 12 (ref.11) | 53/M | 200 | 1.000 | 24 | Retirada de fluticasona | 6/Resolución |
| 13 (ref.11) | 49/M | 200 | 1.000 | 1,5 | Reemplazo de RTV por EFV | ND/Resolución parcial |
| 14 (ref.11) | 43/M | 200 | 500 | 4 | Retirada de fluticasona | 2/Persistencia de los hallazgos |
| 15 (ref.11) | 50/M | 100 | 1.000 | 2 | Retirada de fluticasona | 4/Resolución |
| 16 (ref.12) | 21/M | 100 | 200 | 2 | Retirada de fluticasona | 3/Resolución |
| 17 (ref.13) | 49/F | 200 | 500 | ND | ND | ND |
| 18 (ref.13) | 49/F | 200 | 500 | ND | ND | ND |
| 19 (ref.14) | 65/F | 200 | 500 | 6 | Retirada de fluticasona | 6/Resolución |
| 20 (ref.14) | 66/M | 100 | 500 | 4 | Retirada de fluticasona | 5/Resolución |
| 21 (ref.14) | 66/M | 200 | 500 | 22 | Retirada de fluticasona | 4/Resolución |
| 22 (ref.14) | 29/F | 100 | 2.000 | 9 | Reemplazo de RTV por NVP | 3/Resolución |
| 23 (ref.15) | 38/M | ND | 2.000 | 1.5 | Retirada de fluticasona | 1/Resolución |
| 24 (ref.16) | 43/F | 200 | 500 | 1 | Retirada de fluticasona | 4/Resolución |
| 25 (ref.16) | 37/F | 200 | 500 | 2 | Reemplazo de RTV por atazanavir | ND |
| 26 (ref.17) | 36/F | ND | ND | 3 | Retirada de fluticasona | 1/Resolución |
| 27 (ref.18) | 55/F | 100 | 1.000 | 1 | Retirada de fluticasona | 3/Resolución |
| 28 (ref.18) | 65/F | 100 | 500 | 6 | Retirada de fluticasona | ND/Resolución |
| 29 (ref.19) | 54/M | ND | ND | 5 | Retirada de fluticasona | 6/Resolución |
| 30 (ref.20) | 43/F | 100 | 500 | 3 | Retirada de fluticasona | 6/Resolución |
| 31 (ref.21) | 60/M | ND | ND | 18 | Retirada de fluticasona | 1/Resolución |
| 32 (ref.22) | 59/F | 100 | 1.500 | ND | Retirada de fluticasona | ND/Resolución |
| 33 (ref.23) | 52/M | ND | 1.000 | 2 | Retirada de fluticasona | 3/Resolución |
| 34 (ref.24) | 60/M | ND | 1.000 | 36 | Retirada de fluticasona | ND |
| 35 (este artículo) | 75/M | 100 | 500 | 4 | Retirada de fluticasona y RTV | 2/Resolución |
EFV: efavirenz; ND: no determinado; NVP: nevirapina; ref.: referencia bibliográfica; RTV: ritonavir.
La EPOC es una de las patologías crónicas cuya prevalencia se ha visto incrementada entre la población VIH debido a la alta prevalencia de fumadores, de infecciones pulmonares recurrentes, el consumo de diferentes tipos de sustancias psicoestimulantes y el efecto inflamatorio directo que ejerce el propio VIH sobre el sistema respiratorio25. A pesar de que el manejo del EPOC es el mismo, con independencia del estado serológico, los pacientes VIH tienen un elevado riesgo de interacciones farmacológicas. Estas potenciales interacciones pueden pasar desapercibidas, como en el caso de la utilización conjunta de corticoides inhalados (principalmente la fluticasona) y los inhibidores del CYP450 (isoenzima 3A4) como RTV, imidazoles, macrólidos, antagonistas del calcio y amiodarona. En el caso de la fluticasona, esto se debe a que este corticoide, comparado con los demás corticoides inhalados, tiene una mayor capacidad de unión al receptor de corticoides así como una mayor lipofilicidad, lo que se traduce en un mayor volumen de distribución y, por tanto, de mayor acumulación en los tejidos26. Por este motivo, en los pacientes que están recibiendo un tratamiento con RTV se debe realizar una monitorización periódica de los tratamientos que se prescriben, con independencia de la vía de administración (inhalados, colirios…) con el fin de evitar posibles interacciones farmacológicas8. En el caso de los pacientes VIH con EPOC en los que sea necesario el uso conjunto de RTV y corticoides inhalados, se debe optar por utilizar la beclometasona, dado su escaso metabolismo a través del citocromo CYP3A4, y por lo tanto no produce alteraciones significativas del eje hipotálamo-hipófisis-adrenal27. Siempre que se pueda se debe evitar la utilización de fluticasona y de budesonida, ya que se han descrito múltiples casos de Cushing28,29.
Cuando sea preciso utilizar fluticasona, se debe evitar el uso de inhibidores de la proteasa potenciados con RTV. En el caso de que sea inevitable el uso conjunto de RTV y fluticasona, se debe realizar una monitorización periódica del eje hipotálamo-hipófisis-adrenal y estar alerta ante la aparición de signos y/o síntomas que sugieran una posible alteración a este nivel. Es importante recordar que el uso de corticoides inhalados también se asocia a otras complicaciones, como candidiasis orofaríngea y aumento del riesgo de tuberculosis30.
En resumen, y a la vista de la bibliografía consultada, es imprescindible tener en cuenta la potencial interacción entre RTV y fluticasona, y monitorizar a los pacientes de forma estrecha dado que el tiempo necesario para la aparición de la interacción suele ser prolongado (más de 6meses).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.