Rilpivirina (RPV) es un fármaco perteneciente a la familia de los inhibidores no nucleósidos de la transcriptasa inversa (INNTI), con potente actividad antiviral, aprobado para pacientes naïve, con perfil de efectos secundarios diferente a los INNTI de primera generación. Las interacciones farmacológicas producidas por RPV se deben a su efecto sobre el sistema CYP450, es sustrato de CYP3A4 y ligeramente inductor. Además, in vitro es inhibidor de la glucoproteína-P. RPV presenta interacciones farmacológicas clínicamente significativas, entre las que destacan los inhibidores de la proteasa, a excepción de darunavir y lopinavir potenciados, y los INNTI efavirenz y nevirapina. La toma de RPV junto con fármacos que aumentan el pH gástrico, como omeprazol, o los que inducen el CYP3A4, como rifampicina, puede causar reducciones significativas en las concentraciones de RPV y está contraindicada. El uso concomitante de RPV con un inhibidor del CYP3A4, por ejemplo claritromicina, puede provocar aumento de las concentraciones de RPV. Se recomienda la administración de RPV con alimentos para obtener mejor absorción y valores plasmáticos adecuados.
Rilpivirine (RPV) is a nonnucleoside reverse transcriptase inhibitor (NNRTI) that has been approved for use in treatment-naïve patients and which has potent antiviral activity. Its adverse effects profile differs from that of first-generation NNRTs. The pharmacological interactions produced by RPV are due to its effects on the CYP450 system; RPV is a substrate and mild inducer of CYP3A4. Moreover, in vitro, RPV inhibits glycoprotein-P. RPV has clinically significant pharmacological interactions, especially with protease inhibitors (except boosted darunavir and lopinavir) and the NNRTIs efavirenz and nevirapine. Coadministration of RPV with drugs that increase gastric pH, such as omeprazole, or those inducing CYP3A4, such as rifampicin, can significantly reduce RPV concentrations and is contraindicated. The concomitant use of RPV with a CYP3A4 inhibitor (such as clarithromycin) can increase RPV concentrations. Administration of PRV with food is recommended to obtain better absorption and adequate plasma values.
El TMC278 o rilpivirina (RPV) es un nuevo inhibidor de la transcriptasa inversa no análogo de nucleósidos (INNTI), que a la dosis de 25mg ha demostrado no inferioridad respecto a efavirenz con mejor tolerancia y seguridad en pacientes naïve1.
RPV se metaboliza principalmente por el citocromo P450 (en especial por la acción de la enzima CYP3A4, de la que es sustrato y ligeramente inductor) y, por lo tanto, su coadministración con medicamentos que influyen en la actividad del CYP3A4 puede alterar la exposición de la RPV2.
Los fármacos que inducen la actividad del CYP3A4 pueden desencadenar un descenso de las concentraciones de RPV en plasma y potencial pérdida de eficacia terapéutica y, por el contrario, los fármacos que inhiben el CYP3A4 pueden aumentar sus concentraciones plasmáticas. Además, la coadministración de RPV con medicamentos que aumentan el pH gástrico puede afectar su absorción produciendo una disminución de exposición plasmática3.
El objetivo de este artículo es revisar la información disponible de las interacciones de RPV con los distintos fármacos antirretrovirales y con otros que pueda necesitar el paciente, administrados conjuntamente. Queremos destacar que la mayoría de los estudios farmacocinéticos de RPV se han realizado con la dosis de 150mg/24h, muy superior a la aprobada de 25mg, por lo que no es probable que a esta dosis 1 vez al día tenga un efecto clínicamente relevante sobre la exposición de los medicamentos metabolizados por las enzimas del CYP4.
AntiviralesAntirretroviralesInhibidores de la transcriptasa inversa análogos de nucleósidos.En general, no se espera que se produzcan interacciones de relevancia clínica cuando RPV se administre junto a abacavir, emtricitabina (FTC), estavudina, lamivudina, didanosina o zidovudina5.
Se ha valorado la interacción entre RPV y tenofovir (TDF)en un estudio abierto, aleatorizado y de diseño cruzado en 16 voluntarios sanos. Ambos fármacos fueron administrados junto con alimentos. La administración de TDF (300mg c/24 h) no modificó de forma significativa la farmacocinética de RPV (150mg c/24 h). En presencia de RPV, el área bajo la curva (AUC) de TDF aumentó un 24% (los aumentos en la Cmin y Cmax fueron similares). Este aumento se considera que no presenta importancia clínica, por lo que estos fármacos pueden administrarse conjuntamente sin que se requiera ningún ajuste de dosis. La combinación fue bien tolerada6.
Inhibidores de la transcriptasa inversa no análogos de nucleósidos. No se recomienda la administración conjunta de RPV junto a nevirapina (NVP), efavirenz (EFV) o etravirina (ETR). Su combinación con RPV puede disminuir las concentraciones plasmáticas de esta.
Sin embargo, la administración secuencial de EFV y RPV parece ser segura. Un estudio farmacocinético en voluntarios sanos demostró que al administrar de forma secuencial EFV seguido de RPV, el efecto inductor de EFV hace que la Cmin de RPV sea un 25% menor durante aproximadamente 4 semanas7. Mills et al8 realizaron un estudio abierto en 49 pacientes virológicamente suprimidos, que habían estado recibiendo el comprimido único de TDF/FTC/EFV durante un mínimo de 3 meses y cambiaron su tratamiento por intolerancia a EFV a RPV/TDF/FTC. La mediana de CD4 era de 653 células/μl. A las 4 semanas, todos los pacientes mantenían una carga viral indetectable. La combinación RPV/TDF/FTC fue bien tolerada. La mitad de los sujetos presentó valores detectables de EFV 4 semanas después de su suspensión. La Cmin de RPV fue de 55ng/ml a las 2 semanas y de 68–85ng/ml a las 4–12 semanas. Estos resultados confirman que la leve reducción en los valores de RPV debida al EFV remanente en plasma carece de consecuencias clínicas.
Inhibidores de la proteasa.No se dispone de estudios farmacocinéticos con todos los inhibidores de la proteasa (IP); sin embargo, debido al efecto inhibidor del IP sobre el CYP3A4 hay una potencial interacción que puede justificar el ajuste de dosis; así, la administración conjunta de RPV con nelfinavir, atazanavir, saquinavir, fosamprenavir o tipranavir (potenciados o no con ritonavir) puede aumentar las concentraciones plasmáticas de RPV y no es de esperar que RPV afecte a las concentraciones plasmáticas de estos IP. Por ello, y al no disponer de ensayos clínicos que evalúen estas interacciones, se recomienda precaución con la administración conjunta con RPV4.
Con darunavir/ritonavir (DRV/r), que también tiene efecto sobre el CYP3A4, se dispone de estudios farmacocinéticos. Se trata de un estudio abierto, aleatorizado y de diseño cruzado en voluntarios sanos (n=16), que recibieron en 2 sesiones separadas por un período de lavado de 14 días: RPV 150mg 1 vez al día (QD) durante 11 días o DRV/r 800/100mg QD 22 días coadministrado con RPV 150mg QD de los días 12 al 22. Se observó impacto en los valores de RPV, de manera que el AUC de RPV se incrementó en un 79%, la Cmáx 2,3 veces y la Cmin 2,78 veces. Los parámetros farmacocinéticos de DRV/r no se modificaron. Aunque este estudio sugiere que sería necesaria una reducción de dosis de RPV cuando se coadministra junto a DRV/r, dado que la dosis utilizada fue de 150mg, muy superior a la dosis terapéutica aprobada de 25mg, la administración de DRV/r junto a la dosis aprobada de RPV no requiere ajuste de dosis, pues la interacción carece de importancia en la clínica9.
También se dispone de datos farmacocinéticos de la combinación de lopinavir/r (LPV/r) y RPV. Se trata de un estudio abierto de diseño cruzado, en el que 16 voluntarios fueron aleatorizados a 2 ramas: RPV solo durante 10 días o LPV/r durante 20 días, los primeros 10 días solo y los 10 últimos en combinación con RPV (150mg c/24 h). Tras 14 días de período de lavado se invirtió la secuencia. Los fármacos se administraron junto con alimentos. Se observó un incremento de la exposición de RPV (AUC24h) del 52% debido al efecto inhibidor del LPV/r del CYP3A4, la Cmax y Cmin aumentaron un 29 y un 74%, respectivamente. No se observaron cambios en los parámetros farmacocinéticos de LPV/r. Dado que la dosis utilizada de RPV fue de 150mg, muy superior a la dosis terapéutica aprobada de 25mg, no es de esperar interacción con repercusión clínica. Así, cuando estos 2 fármacos se administren conjuntamente no se recomienda ajuste de dosis10.
Inhibidores de integrasa.- -
Raltegravir. No se espera que se produzcan interacciones de relevancia clínica con la administración conjunta de 25mg de RPV 1 vez al día junto a raltegravir 400mg 2 veces al día. En un estudio fase I, abierto, aleatorizado y con diseño cruzado, que evaluó la interacción farmacocinética entre RPV y raltegravir se incluyeron 24 voluntarios sanos que recibieron en una sesión 25mg de RPV al día durante 11 días y en otra sesión recibieron raltegravir 400mg cada 12h durante 4 días, seguidos inmediatamente por la coadministración de 25mg de RPV cada 24h junto a 400mg de raltegravir cada 12h durante 11 días más. Todos los fármacos se administraron con comida. Se determinaron los parámetros farmacocinéticos de RPV, raltegravir y el glucurónido de raltegravir al final de cada tratamiento. Los parámetros farmacocinéticos de RPV no se vieron alterados cuando se coadministró junto a raltegravir. RPV tampoco afectó a la farmacocinética de raltegravir ni de su glucurónido de manera clínicamente significativa, por lo que no se requiere ajuste de dosis11.
- -
Dolutegravir. Los resultados del trabajo realizado por Ford et al12 indican que dolutegravir no presenta interacciones farmacocinéticas importantes con RPV, por lo que pueden asociarse sin que se requiera ajuste de dosis. Se trata de un estudio de fase I, abierto, cruzado, en el que se incluyeron 16 voluntarios sanos que recibieron, en diferentes períodos, dolutegravir 50mg/24h durante 5 días (n=16), RPV 25mg/24h durante 11–12 días, también sola o en combinación con dolutegravir. Los fármacos se tomaron con una comida de moderado contenido en grasa. No se observaron interacciones farmacocinéticas importantes. En presencia de RPV, el AUC, la Cmax y la Cmin de dolutegravir aumentaron un 12, 13 y 22%, respectivamente. Dolutegravir aumentó el AUC, la Cmax y la Cmin de RPV un 6, 10 y 21%. Estos cambios en la farmacocinética no tienen relevancia clínica, por lo que no es necesario ajuste de dosis.
Antagonistas del CCR5. No se dispone de estudios que valoren la farmacocinética de RPV y maraviroc; sin embargo, dadas las vías metabólicas de ambos fármacos, no se espera que haya una interacción medicamentosa clínicamente relevante, por lo que no es necesario ajustar dosis4.
Otros antivirales- -
Ribavirina. No existen datos publicados, aunque no se espera que se produzcan interacciones de relevancia clínica cuando RPV se administre junto a ribavirina4.
- -
Telaprevir. Este fármaco es sustrato e inhibidor potente del CYP3A4, y sustrato e inhibidor de la glucoproteína-P. Kakuda et al13 realizaron un estudio aleatorizado y de diseño cruzado en voluntarios sanos para evaluar la interacción entre el IP del virus de la hepatitis C telaprevir y los antirretrovirales ETR y RPV.Se incluyó a 32 voluntarios sanos que recibieron, en dosis múltiples, ETR 200mg/12h o RPV 25mg/24 h, y telaprevir 750mg/8h solos o en combinación. Las concentraciones de RPV aumentaron en presencia de telaprevir (AUC un 79% mayor, Cmin un 89% mayor y Cmax un 47% mayor). Estos aumentos no fueron relevantes respecto a la prolongación del intervalo QTcF (este aumentó más de 30 ms en 8 voluntarios; sin embargo, los valores permanecieron dentro del intervalo de normalidad). Las concentraciones de telaprevir se redujeron levemente (AUC un 8% menor, Cmin un 13% menor y Cmax un 5% menor). El efecto adverso observado con mayor frecuencia fue el dolor de cabeza. Dado que los cambios observados en los parámetros farmacocinéticos no se consideran clínicamente relevantes, no se recomienda ajuste de dosis al asociar telaprevir con RPV o ETR13.
Carbamacepina, fenobarbital, oxcarbacepina y fenitoína, dado el efecto inductor de las enzimas del CYP3A, podrían reducir de forma importante las concentraciones plasmáticas de RPV comprometiendo su eficacia terapéutica, por lo que no se recomienda su asociación. Como alternativas terapéuticas se podrían considerar las siguientes: amitriptilina o gabapentina para la neuralgia; lamotrigina, gabapentina o vigabatrina para las convulsiones. Ácido valproico es otra alternativa4.
Antifúngicos- -
Anidulafungina. Solo hay información teórica, basada en las vías de eliminación de los fármacos y en su posible efecto sobre el metabolismo de otros fármacos. Anidulafungina no es ni sustrato, ni inductor o inhibidor clínicamente relevante de las isoenzimas del citocromo P450, por lo que es poco probable que tenga efectos clínicamente relevantes sobre fármacos que se metabolizan por esta vía. Su eliminación renal es insignificante. Basándose en estos datos, una interacción con RPV parece poco probable14.
- -
Ketoconazol. Hay potencial interacción que puede justificar un ajuste de dosis. Se ha valorado el efecto de ketoconazol en la farmacocinética de RPV a través de un estudio abierto, aleatorizado y cruzado en 14 voluntarios sanos que recibieron RPV (150mg) y ketoconazol (400mg/día) durante 11 días. Todos los fármacos se tomaron con comida. Dado el efecto inhibitorio de las enzimas del CYP3A del ketoconazol, los parámetros de AUC, Cmax y Cmin de RPV aumentaron un 49, 30 y 76%, respectivamente, cuando se administró con ketoconazol y hubo disminución de los parámetros referentes a ketoconazol (AUC un 24%, Cmin un 66%). Al igual que con otros fármacos, como la dosis utilizada de RPV fue muy superior a la aprobada, se recomienda monitorizar la eficacia del antifúngico azólico cuando se coadministre junto a RPV4.
Con otros antifúngicos azólicos (fluconazol, itraconazol, posaconazol, voriconazol) no se han realizado estudios, pero dado el efecto de estos azoles en el sistema enzimático CYP3A hay una interacción teórica y la administración de RPV junto a estos antifúngicos azólicos puede aumentar las concentraciones plasmáticas de RPV. Al igual que con ketoconazol se recomienda precaución y monitorizar la eficacia antifúngica cuando estos fármacos se administren conjuntamente con RPV.
AntimicrobianosAntimicobacterianos- -
Rifabutina. Crauwels H et al15 estudiaron la interacción entre RPV y rifabutina. Ambos fármacos son sustratos del CYP3A4; rifabutina es, además, inductor de dicha enzima. Se realizó un estudio abierto y aleatorizado, de diseño cruzado, con 3 ramas en 18 voluntarios sanos. Recibieron RPV 150mg/24h y rifabutina 300mg/24h, en monoterapia y en combinación, durante 11 días. Los fármacos fueron administrados tras el desayuno. Se tomaron muestras de RPV, rifabutina y su metabolito 25-O-desacetilrifabutina en el día 11. Rifabutina redujo el AUC24h, la Cmax y la Cmin de RPV un 46, 35 y 49%, respectivamente. RPV no modificó el AUC24h de rifabutina ni de su metabolito. La significativa reducción de la exposición a RPV en presencia de rifabutina se explica como una inducción del CYP3A4 por parte de rifabutina, y es una asociación contraindicada o no recomendada hasta que no se disponga de datos adecuados sobre ajuste de dosis de RPV.
- -
Rifampicina.La asociación con rifampicina está contraindicada. Se realizó un estudio abierto, aleatorizado y cruzado en voluntarios sanos para determinar el efecto de rifampicina en la farmacocinética de RPV. Dieciséis voluntarios sanos recibieron RPV (150mg/día durante 7 o 11 días) + rifampicina (600mg/día durante 7 días). Todos los fármacos se tomaron con comida. Los parámetros AUC, Cmax y Cmin de RPV disminuyeron un 80, 69 y 89%, respectivamente, cuando esta se administró con rifampicina, sin observar cambios en los parámetros farmacocinéticos de rifampicina ni de sus metabolitos. Con estos resultados no debe administrarse la combinación con rifampicina, ya que es probable que conduzca a la pérdida del efecto terapéutico de RPV2.
- -
Rifapentina. No se ha estudiado. Es de esperar descensos significativos en las concentraciones de RPV en plasma por el efecto inductor enzimático del antimicobacteriano, y es una combinación contraindicada por el riesgo de pérdida de eficacia de la RPV4.
No se han realizado estudios con claritromicina, eritromicina ni troleandomicina, pero por el efecto inhibidor de las enzimas del CYP3A4 se espera que desencadenen un aumento de exposición de RPV, por lo que su combinación con este antirretroviral no se recomienda y si se precisa el uso de macrólidos la alternativa sería azitromicina, pues esta no impacta en la vía metabólica de RPV4,16.
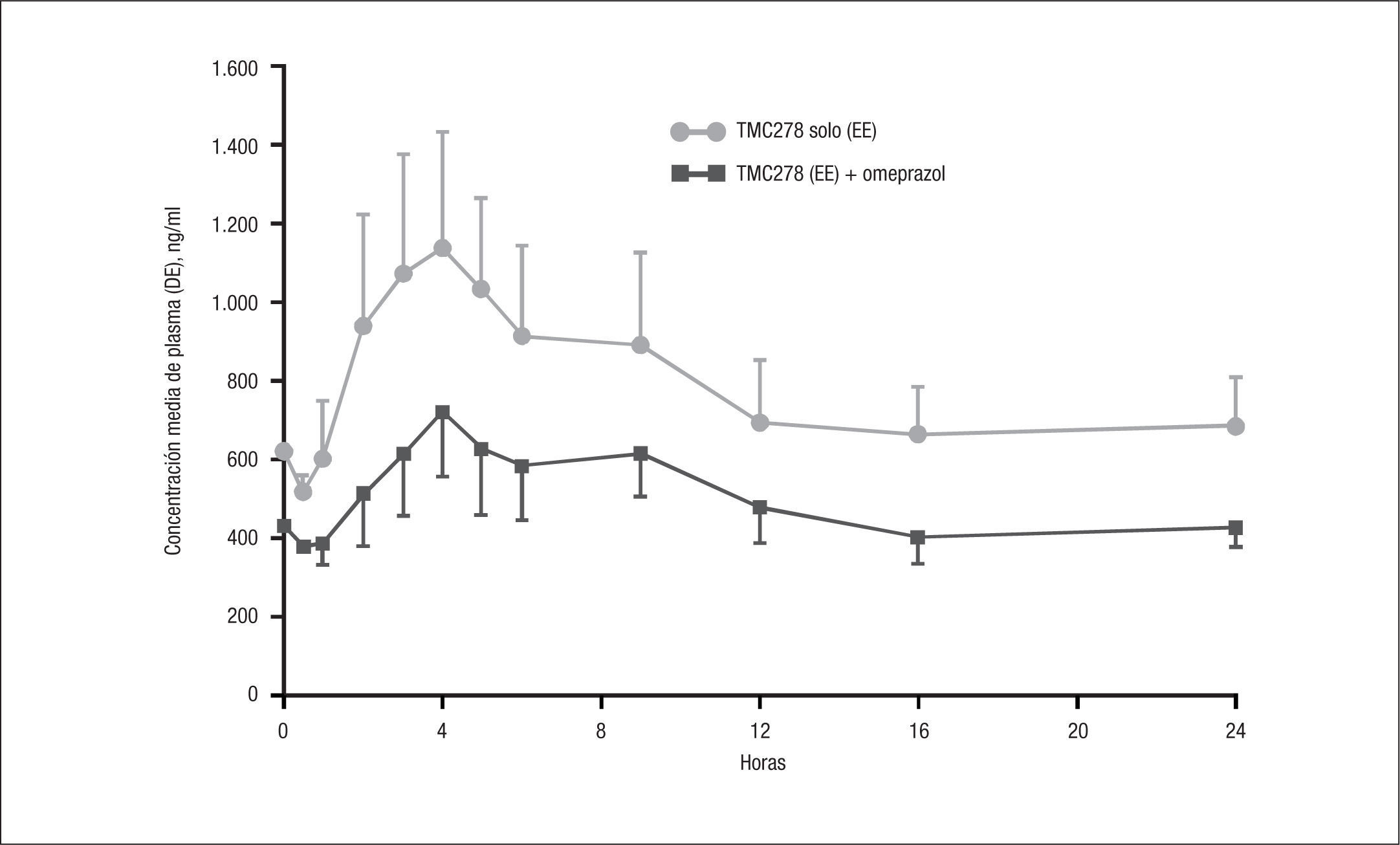
Inhibidores de la bomba de protonesRPV no debe asociarse con inhibidores de la bomba de protones. Crauwels et al17 presentaron los resultados de un estudio abierto, aleatorizado y de diseño cruzado en 16 voluntarios sanos, que recibieron RPV sola 150mg/24h durante 11 días y, tras un período de lavado de 14 días, omeprazol 20mg/24h durante 22 días, asociándolo los últimos 10 días con RPV 150mg/24 h. Los fármacos se administraron después del desayuno. En presencia de omeprazol, el AUC, la Cmax y Cmin de RPV se redujeron un 40, 40 y 33%, respectivamente, que se justifica por disminución de la absorción debido al aumento del pH gástrico (fig. 1). Dado que la dosis de RPV seleccionada para su posterior desarrollo es de 25mg/24h, no se recomienda su asociación con omeprazol. El efecto de RPV sobre omeprazol (reducción del 14% del AUC de omeprazol y aumento leve de la formación de su metabolito OH-omeprazol) carece de importancia clínica y demuestra que el efecto inductor de RPV sobre el CYP2C19 es débil. La combinación fue, en general, bien tolerada.
Perfil farmacocinético de rilpivirina y omeprazol17. DE: derivación estándar; EE: estado estacionario.
Con otros inhibidores de la bomba de protones como lansoprazol, rabeprazol, pantoprazol y esomeprazol no se ha estudiado, aunque no deben administrarse junto con RPV, pues el efecto en el aumento del pH gástrico puede desencadenar una disminución de la absorción de RPV con la correspondiente pérdida de su efecto terapéutico4.
Antagonistas de los receptores H2- -
Famotidina. Los resultados del estudio realizado por Van Heeswijk et al3 confirman que la biodisponibilidad de RPV es dependiente del pH gástrico, y sugieren que la toma separada de RPV y famotidina 40mg (el antirretroviral 4h antes o 12h después de famotidina) previene la reducción de la absorción del antirretroviral, permitiendo así la coadministración de ambos fármacos sin modificación de la dosis. Se trata de un estudio de dosis única, abierto, aleatorizado y de diseño cruzado en 24 voluntarios sanos, que recibieron en 4 ocasiones (separadas cada una por un período de lavado de 14 días) famotidina en diferentes momentos respecto a la RPV. Cuando se administró famotidina 40mg 12h antes de RPV, el AUC del antirretroviral disminuyó un 9% sin modificarse la Cmax y la Cmin. Si se administraba 4h después, el incremento del AUC de RPV fue de un 13% y la Cmax un 21%; estos cambios de farmacocinéticos no se relacionaron con pérdida de la eficacia clínica. Sin embargo, cuando famotidina se administró 2h antes de RPV, los valores de Cmax y AUC de RPV disminuyeron un 85 y 76%, respectivamente. Los parámetros farmacocinéticos de famotidina no se vieron influenciados por RPV. Con estos resultados se recomienda administrar el antagonista H2 12h antes o 4h después de la administración de RPV.
Con ranitidina, nizatidina y cimetidina no se ha estudiado el impacto de la administración conjunta, sin embargo se recomienda precaución cuando se coadministre, ya que el aumento del pH gástrico puede provocar una reducción en las concentraciones plasmáticas de RPV4.
AntiácidosNo se ha estudiado su coadministración con RPV. No obstante se recomienda precaución cuando se utilice RPV junto a antiácidos, ya que las concentraciones plasmáticas de RPV pueden verse reducidas debido a un aumento del pH gástrico. Los antiácidos deberían administrarse al menos 2h antes o 4h después de RPV4.
Analgésicos- -
Metadona. Los resultados de los estudios publicados indican que no se requiere ajuste de dosis inicialmente cuando se añade RPV a un paciente en pauta de mantenimiento con metadona. Se ha investigado la interacción entre RPV y metadona en 13 voluntarios sanos en pauta estable de metadona a una dosis de entre 60 y 150mg diarios. Durante 14 días, los voluntarios recibieron su dosis habitual de metadona y se determinaron las concentraciones de R y S-metadona al final de este período. Se añadió RPV (25mg/24 h) durante 11 días y se analizaron nuevamente ambos isómeros de metadona así como los valores de RPV al final del período. Los fármacos se administraron bajo terapia directamente observada y junto con alimentos. La adición de RPV redujo las concentraciones de R-metadona (isómero activo): el AUC fue un 22% menor (intervalo de confianza del 90%, 9–33 menor), la Cmax disminuyó un 14% y la Cmin un 16%. Las reducciones en S-metadona fueron similares. No se observaron síntomas de abstinencia que obligaran a modificar la dosis de metadona. Las concentraciones de RPV se hallaban dentro de los valores esperados. Aunque la disminución de los metabolitos de metadona no repercute en su eficacia, por precaución se recomienda monitorizar síndrome de abstinencia por si algún paciente requiriera ajuste de dosis18.
- -
Paracetamol. Los resultados de un estudio abierto, aleatorizado y de diseño cruzado en voluntarios sanos sugieren que no es necesario ajuste de dosis cuando se coadministra RPV y paracetamol. En 2 ocasiones separadas por un período de lavado de 14 días se les administraron dosis únicas de paracetamol 500mg antes o después de la administración de RPV 150mg c/24h durante 11 días. Ni el AUC ni la Cmax del paracetamol ni las AUC de sus metabolitos glucurónido y sulfato se vieron significativamente afectados con la dosis de RPV 150mg cada 24h19.
Según los resultados del estudio realizado por Crauwels et al, RPV (25mg/24h) se puede coadministrar con anticonceptivos orales sin que se requiera ajustar la dosis, dado que no se produce una interacción clínicamente significativa entre ambos. En este estudio abierto se incluyeron 18 mujeres seronegativas, que recibieron 3 ciclos de tratamiento anovulatorio con una asociación de 1mg de noretindrona y 35μg de etinilestradiol c/24h durante 21 días del ciclo. Durante los primeros 15 días del último ciclo recibieron adicionalmente RPV. En presencia de RPV, la farmacocinética de noretindrona no se modificó y tampoco el AUC ni la Cmin de etinilestradiol. La Cmax de etinilestradiol fue un 17% mayor, aumento que no se considera clínicamente importante20. Tampoco se modificaron los valores plasmáticos de progesterona, hormona luteinizante ni hormona foliculoestimulante en presencia de RPV.
Inhibidores de la hidroximetilglutaril-CoA reductasa- -
Atorvastatina. Puede administrarse junto con RPV sin que se requiera ajuste de dosis, ya que el AUC24h de la actividad hidroximetilglutaril-CoA reductasa total (calculada como la suma de atorvastatina y sus 2 metabolitos, 2-OH- y 4-OH-) aumentó solo un 20% y atorvastatina no modificó significativamente la cinética de RPV. En un estudio abierto, aleatorizado y de diseño cruzado se incluyeron 16 voluntarios sanos que recibieron, en 2 sesiones separadas por un período de lavado mínimo de 14 días, atorvastatina 40mg/24h durante 4 días o RPV 150mg/24h 15 días asociando atorvastatina los últimos 4 días. En presencia de RPV no se modificaron ni la Cmin ni el AUC de atorvastatina y la Cmax aumentó un 35%. Las AUC de sus metabolitos activos 2-OH-atorvastatina y 4-OH-atorvastatina aumentaron un 39 y un 23%, respectivamente. La razón entre las AUC del metabolito 2-OH y atorvastatina aumentó un 23%. Las combinaciones fueron seguras y bien toleradas. Debe considerarse que la dosis estudiada de RPV en este estudio es superior a la dosis terapéutica aprobada, por lo que el impacto en los cambios farmacocinéticos será menor al reflejado en este estudio21.
Se ha realizado un estudio en voluntarios sanos de las modificaciones farmacocinéticas de la administración conjunta de RPV y digoxina. Se concluye que RPV, a las dosis habituales empleadas en terapéutica, no tiene un efecto inhibidor clínicamente importante sobre la glucoproteína-P (que sí se ha observado in vitro). Se trata de un estudio de fase I, abierto, aleatorizado y cruzado, en el que 22 voluntarios sanos recibieron una dosis única de 0,5mg de digoxina antes y después de 10 días de RPV 25mg/24h. RPV no modificó la farmacocinética de digoxina. Dado que digoxina es el principal sustrato de la glucoproteína-P, los autores concluyen que es poco probable que RPV presente interacciones importantes in vivo mediadas por este transportador22.
Como se ha mencionado, RPV in vitro puede inhibir la glucoproteína-P intestinal y afectar a los medicamentos que son transportados por esta glucoproteína-P en el intestino, como dabigatrán. Este hecho puede desencadenar una elevación de las concentraciones plasmáticas de dichos medicamentos4.
No se recomienda administrar dexametasonajunto con RPV, aunque sí es posible su uso como tratamiento en dosis única, al igual que está contraindicado el uso simultáneo de la Hierba de San Juan4.
En pacientes que deseen abandonar el hábito tabáquico es posible el uso conjunto de RPV con vareniclina, pues no se esperan interacciones de importancia clínica4.
En el caso del tratamiento de la disfunción eréctil con sildenafilo,si un paciente recibe RPV se puede administrar de forma conjunta. En un estudio abierto, aleatorizado y de diseño cruzado en voluntarios sanos (n=16), no se observó interacción farmacocinética significativa entre RPV (75mg c/24h durante 12 días) y sildenafilo (dosis única de 50mg). No se modificaron el AUC ni la Cmax de RPV, sildenafilo o su metabolito activo N-desmetilsildenafilo, ni tampoco se modificó la razón N-desmetilsildenafilo/sildenafilo, por lo que no se requiere ajuste de dosis23.
Por otra parte, RPV inhibe la secreción tubular renal activa de creatinina y, por el mismo mecanismo, la exposición a metformina puede aumentar. Por ello, los pacientes deben ser vigilados cuando se inicie o suspenda la administración concomitante de RPV y met-formina4.
Se dispone de información sobre el potencial de interacciones farmacodinámicas entre RPV y los medicamentos que prolongan el intervalo QTc. En un ensayo en voluntarios sanos se ha demostrado que las dosis supraterapéuticas de RPV (75mg 1 vez al día y 300mg 1 vez al día) prolongan el intervalo QTc. Sin embargo, con la dosis recomendada de 25mg 1 vez al día se evaluó el efecto en el intervalo QTc en un ensayo aleatorizado, cruzado, controlado con placebo y con tratamiento activo (moxifloxacino 400mg 1 vez al día) realizado en 60 adultos sanos, mediante 13 mediciones durante 24h en estado de equilibrio, y no se observaron alteraciones, por lo que la dosis recomendada de 25mg 1 vez al día no se asocia a un efecto clínicamente relevante en el QTc4,24.
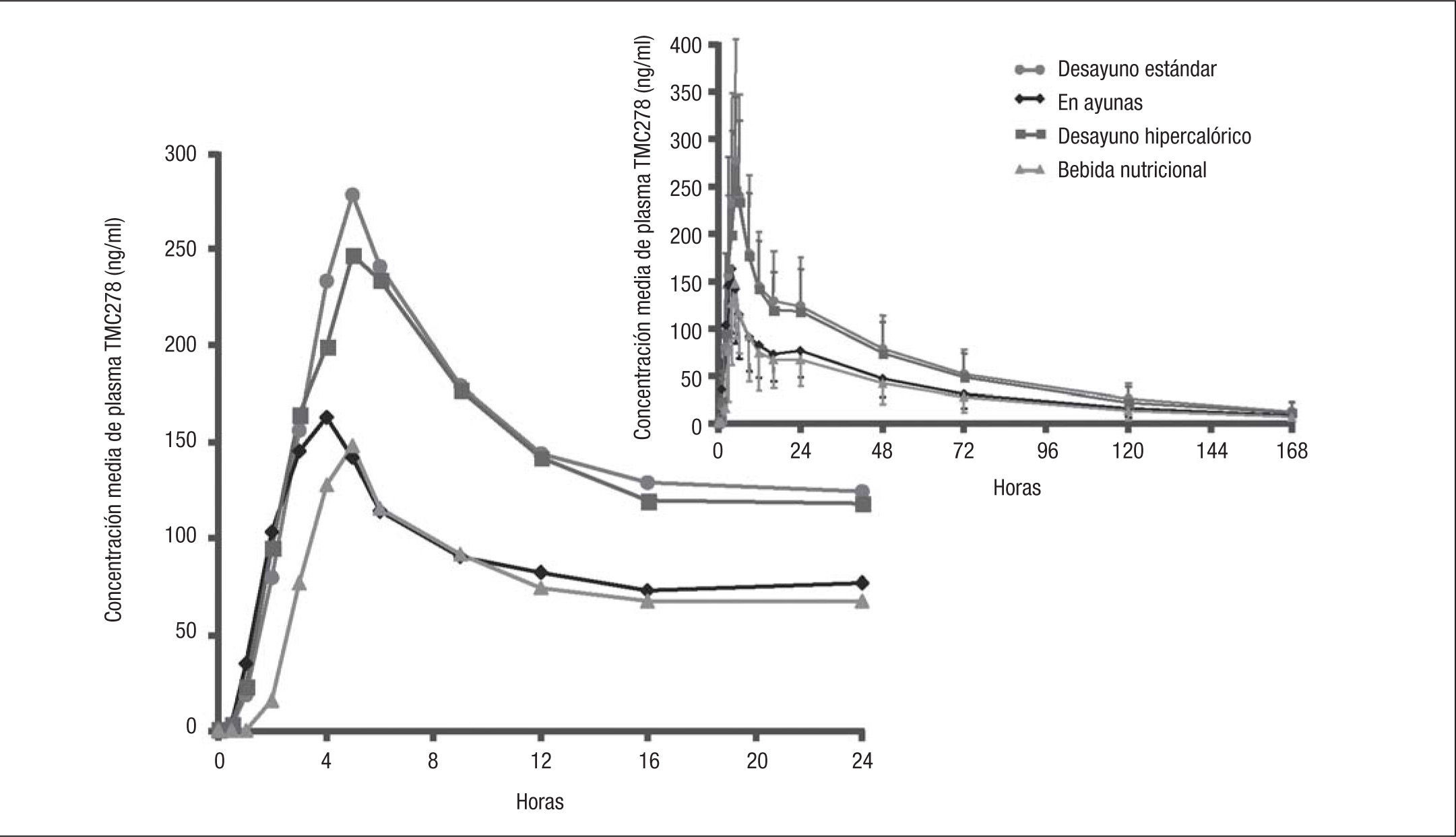
Interacciones con alimentosRPV se debe administrar conjuntamente con alimentos, puesto que es así como se obtiene mejor absorción y mejores valores plasmáticos. Crauwels et al25 realizaron un estudio con 20 voluntarios sanos, abierto, aleatorizado y de diseño cruzado con 4 ramas, para evaluar el efecto de distintos tipos de alimentos sobre la absorción de RPV (fig. 2). Los participantes recibieron una dosis única de 75mg justo después de un desayuno estándar (21g de grasa, 533kcal) (grupo control), después de un desayuno rico en grasas (56g de grasa, 928kcal), en ayunas y después de una bebida con alto contenido proteico (8g de grasa, 300kcal). En comparación con el grupo control, el AUC en ayunas fue un 43% menor, y tras una bebida con alto contenido proteico un 50% menor. El AUC después de un desayuno rico en grasas fue similar al obtenido tras un desayuno estándar. Ramanathan et al26 evaluaron en 23 voluntarios sanos el efecto de la comida sobre la absorción de RPV administrada como tableta única (RPV/FTC/TDF 25/200/245mg). Se administró en un diseño cruzado una dosis de la tableta única en ayunas o junto con una comida estándar (540kcal, 21g de grasa) o ligera (390kcal, 12g de grasa). En comparación con la administración en ayunas, el AUC de RPV aumentó un 9% con una comida ligera y un 16% con una comida estándar (fig. 2). Como puede observarse de los resultados de estos 2 estudios, el efecto de los alimentos es menor cuando RPV se administra asociada con TDF/FTC. El contenido calórico de los alimentos no supone una gran diferencia.
Efecto de distintos tipos de alimento en el perfil farmacocinético de rilpivirina25.
RPV es un fármaco potente de la familia de los ITINAN aprobado para pacientes naïve. En general es un fármaco seguro con respecto a las interacciones (tabla 1), si bien se debe desaconsejar su uso simultáneo con algunos IP y con otros ITINAN. La complejidad de las potenciales interacciones hace necesario consultar a expertos en el área y estar permanentemente al día. Actualmente se están realizando ensayos clínicos para evaluar las interacciones con otros fármacos, entre ellos simeprevir (TMC-435), fármaco en estudio para el tratamiento de la hepatitis C. Por tanto es recomendable evaluar las interacciones en un lugar de confianza debidamente actualizado. Las páginas web http://www.hiv-druginteractions.com (en inglés) y http://www.interaccioneshiv.com (en español) cumplen normalmente estos requisitos.
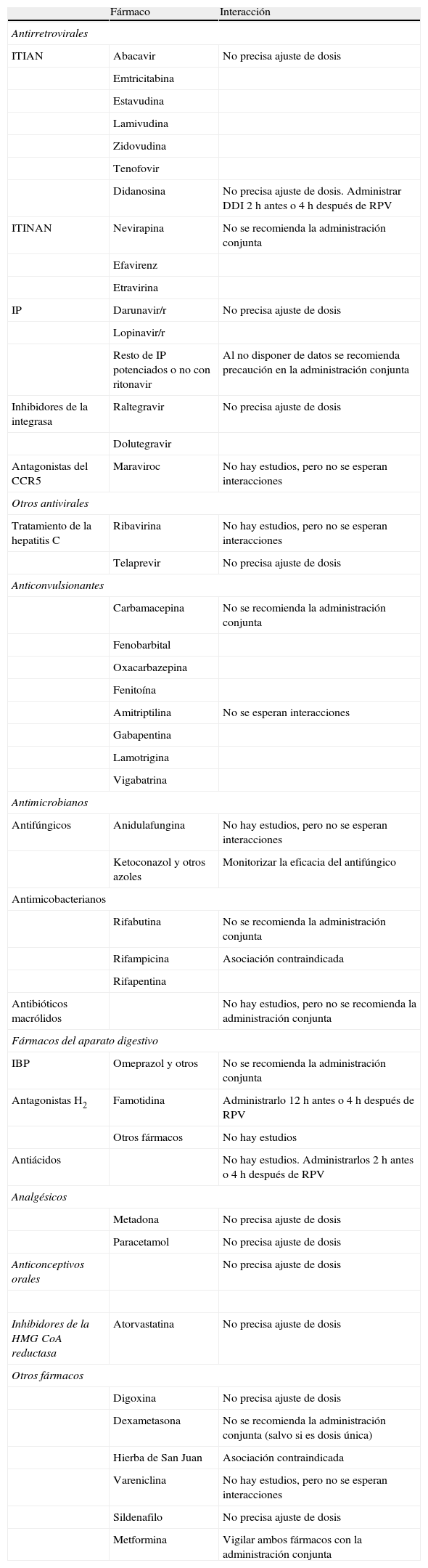
Resumen de las recomendaciones de uso combinado de rilpivirina (RPV) y otros fármacos.
| Fármaco | Interacción | |
| Antirretrovirales | ||
| ITIAN | Abacavir | No precisa ajuste de dosis |
| Emtricitabina | ||
| Estavudina | ||
| Lamivudina | ||
| Zidovudina | ||
| Tenofovir | ||
| Didanosina | No precisa ajuste de dosis. Administrar DDI 2h antes o 4h después de RPV | |
| ITINAN | Nevirapina | No se recomienda la administración conjunta |
| Efavirenz | ||
| Etravirina | ||
| IP | Darunavir/r | No precisa ajuste de dosis |
| Lopinavir/r | ||
| Resto de IP potenciados o no con ritonavir | Al no disponer de datos se recomienda precaución en la administración conjunta | |
| Inhibidores de la integrasa | Raltegravir | No precisa ajuste de dosis |
| Dolutegravir | ||
| Antagonistas del CCR5 | Maraviroc | No hay estudios, pero no se esperan interacciones |
| Otros antivirales | ||
| Tratamiento de la hepatitis C | Ribavirina | No hay estudios, pero no se esperan interacciones |
| Telaprevir | No precisa ajuste de dosis | |
| Anticonvulsionantes | ||
| Carbamacepina | No se recomienda la administración conjunta | |
| Fenobarbital | ||
| Oxacarbazepina | ||
| Fenitoína | ||
| Amitriptilina | No se esperan interacciones | |
| Gabapentina | ||
| Lamotrigina | ||
| Vigabatrina | ||
| Antimicrobianos | ||
| Antifúngicos | Anidulafungina | No hay estudios, pero no se esperan interacciones |
| Ketoconazol y otros azoles | Monitorizar la eficacia del antifúngico | |
| Antimicobacterianos | ||
| Rifabutina | No se recomienda la administración conjunta | |
| Rifampicina | Asociación contraindicada | |
| Rifapentina | ||
| Antibióticos macrólidos | No hay estudios, pero no se recomienda la administración conjunta | |
| Fármacos del aparato digestivo | ||
| IBP | Omeprazol y otros | No se recomienda la administración conjunta |
| Antagonistas H2 | Famotidina | Administrarlo 12h antes o 4h después de RPV |
| Otros fármacos | No hay estudios | |
| Antiácidos | No hay estudios. Administrarlos 2h antes o 4h después de RPV | |
| Analgésicos | ||
| Metadona | No precisa ajuste de dosis | |
| Paracetamol | No precisa ajuste de dosis | |
| Anticonceptivos orales | No precisa ajuste de dosis | |
| Inhibidores de la HMG CoA reductasa | Atorvastatina | No precisa ajuste de dosis |
| Otros fármacos | ||
| Digoxina | No precisa ajuste de dosis | |
| Dexametasona | No se recomienda la administración conjunta (salvo si es dosis única) | |
| Hierba de San Juan | Asociación contraindicada | |
| Vareniclina | No hay estudios, pero no se esperan interacciones | |
| Sildenafilo | No precisa ajuste de dosis | |
| Metformina | Vigilar ambos fármacos con la administración conjunta | |
HMG: hidroximetilglutaril; IBP: inhibidores de la bomba de protones; IP: inhibidores de la proteasa; ITIAN: inhibidores de la transcriptasa inversa análogos de nucleósidos; INNTI: inhibidores no nucleósidos de la transcriptasa inversa; r: ritonavir.
Los autores han efectuado labores de consultoría en los laboratorios Gilead, Abbott, Bristol-Myers Squibb, Boehringer Ingelheim, Janssen, Merck, Pfizer, ViiV Healthcare y han recibido compensación económica por charlas patrocinadas por estos laboratorios.