Introducción
Los antirretrovirales son fármacos con un gran número de interacciones, especialmente de tipo farmacocinético, que en numerosas ocasiones pueden tener importancia clínica. Estas interacciones pueden afectar tanto a los fármacos que se administran en combinación con los antirretrovirales como a ellos mismos. En este artículo se revisan las principales interacciones de antirretrovirales con fármacos de otras familias que pueden aumentar el riesgo de fracaso virológico del tratamiento antirretroviral, mientras que no se abordarán las interacciones que puedan presentar distintos antirretrovirales al combinarlos entre sí 1,2.
Los inhibidores de la proteasa (IP) y los no nucleósidos presentan mayor riesgo, por su metabolismo por las enzimas del citocromo P-450. El efavirenz (EFV) y la nevirapina (NVP) se metabolizan a través de las isoenzimas CYP3A4 y 2B6 de este citocromo 3,4. El amprenavir 5 (y su profármaco fosamprenavir 6), el atazanavir (ATV) 7, el indinavir (IDV) 8, el lopinavir (LPV) 9 y el saquinavir (SQV) 10,11 son sustratos de CYP3A4 y el ritonavir (RTV) 12 de CYP3A4 > CYP2D6. El nelfinavir 13 es sustrato de CYP3A4 > 2C19, 2D6 y posiblemente 2C9 y 2E1. Los fármacos que pueden actuar como inductores de estas isoenzimas podrían reducir las concentraciones de estos antirretrovirales. Los principales inductores son los antiepilépticos carbamacepina (CBZ), fenitoína y fenobarbital; los antituberculosos rifampicina y rifabutina; así como los propios antirretrovirales NVP y EFV. Algunos productos naturales, como la hierba de San Juan (Hypericum), han demostrado también un efecto inductor importante.
La enfuvirtida ha demostrado un bajo riesgo de interacciones metabólicas 14. De entre los análogos de los nucleósidos, tan sólo el abacavir 15 y la zidovudina (AZT) 16, que son metabolizados por glucuronidación, podrían ver reducidas sus concentraciones plasmáticas en presencia de inductores de ésta, como la rifampicina, el fenobarbital y la fenitoína. Las concentraciones de abacavir y AZT se reducen también en presencia del tipranavir (TPV). Las consecuencias clínicas no han sido establecidas, por lo que no se recomienda el uso de estos análogos en combinación con el TPV a menos que no haya otras alternativas disponibles 17.
Se ha demostrado que algunos antirretrovirales son también sustratos de transportadores celulares, como la glucoproteína P, y que las sustancias que pueden alterar el funcionamiento de estos transportadores podrían alterar la absorción y distribución por el organismo, como, por ejemplo, el acceso al sistema nervioso central, aunque sobre este tipo de interacción existe menos información 18.
Si bien la mayoría de interacciones afecta al metabolismo de los fármacos, también son importantes las que alteran su absorción, ya sea por la posible administración con o sin alimentos o por la administración junto con otros fármacos que puedan alterar el pH gastrointestinal. En general, cuando sea posible, es preferible administrar los fármacos antirretrovirales junto con alimentos para mejorar la tolerancia digestiva. Sin embargo, algunos requieren precauciones especiales. El IDV no potenciado con RTV debe administrarse una hora antes o 2 h después de las comidas, aunque puede tomarse con leche desnatada, zumos, café o té o comida ligera en grasas 8. El fosamprenavir en comprimidos puede tomarse con o sin alimentos, mientras que la solución oral debe tomarse en ayunas 6. El EFV suele administrarse por la noche para reducir sus efectos adversos neurológicos y en ayunas, ya que las comidas ricas en grasa aumentan un 50% su absorción y ello podría disminuir la tolerabilidad 3; sin embargo, algunos pacientes lo toleran bien junto con la cena y ello facilita la posología y puede mejorar la adherencia. Los análogos de los nucleósidos y el tenofovir pueden tomarse con o sin alimentos, a excepción de la didanosina 19. La didanosina en cápsulas de liberación entérica debe administrarse 2 h después de comer y no se debe ingerir ningún otro alimento hasta después de otras 1,5 h (los alimentos reducen un 20-25% sus concentraciones plasmáticas y un 23% las de su metabolito activo intracelular dideoxiadenosina trifosfato [ddA-TP]) 19. Sin embargo, los datos indican que habitualmente un elevado porcentaje de los pacientes toma las cápsulas entéricas junto con alimentos. Ello podría facilitar la adherencia y no parece tener una repercusión negativa en la eficacia del tratamiento antirretroviral 20.
Antiácidos, antihistamínicos H2 e inhibidores de la bomba de protones
Antiácidos
Existen algunas interacciones de interés con estos fármacos. Aunque no se han realizado estudios específicos con todos los IP, en general, éstos se absorben mejor en medio ácido y, por precaución, se recomienda que si deben administrarse antiácidos, los IP se administren como mínimo una hora antes o 2 h después de los antiácidos. Por ejemplo, en voluntarios sanos, la administración de una dosis única de antiácido (Malos®) redujo un 25-29% el área bajo la curva (ABC), Cmax y C12h de una dosis única de tipranavir/ritonavir (TPV/rtv) 21. La administración de una dosis única de Maalox® simultáneamente con 1.400 mg de fosamprenavir redujo el ABC y la Cmax del IP un 18 y un 35%, respectivamente, con un ligero incremento de la Cmin (14%). No cabe esperar que estos cambios tengan consecuencias clínicas, por lo que pueden administrarse de forma simultánea 22. La administración de antiácidos no parece modificar los parámetros farmacocinéticos de LPV/rtv y SQV/rtv 9,10.
Antihistamínicos H2 o inhibidores de la bomba de protones
Fosamprenavir puede administrarse conjuntamente con antihistamínicos e inhibidores de la bomba de protones (IBP). Su administración simultánea con 20 mg/24 h de esomeprazol 23 o con una separación de 12 h con 20 mg/24 h de omeprazol 24 no modificó significativamente los parámetros farmacocinéticos de FPV. Tampoco se ha observado interacción importante entre los IBP y otros IP como LPV/rtv, NFV, SQV o TMC 114 1. Con el TPV no hay estudios específicos, pero es probable que puedan afectar su absorción. Como precaución, se recomienda administrar el antirretroviral 1-2 h antes del gastroprotector 17.
Sin duda, el fármaco que puede verse más afectado por este tipo de interacción es el ATV. Su absorción se reduce de forma importante cuando el pH intragástrico aumenta por encima de 4 y justamente éste es el objetivo que se persigue con la administración de los IBP 4. El aumento de pH producido por los antihistamínicos H2 es menor y de menor duración. En voluntarios sanos, se ha observado que el pH vuelve a los valores basales unas 10 h después de la administración de 40 mg/12 h de famotidina (momento adecuado para la toma de ATV ± RTV), mientras que con 40 mg/24 h de omeprazol el pH se mantenía por encima de 4 durante la mayor parte del intervalo terapéutico 25.
En general, ATV o ATV potenciado con dosis bajas de ritonavir (ATV/rtv) pueden administrarse con antihistamínicos H2 (estudio realizado con famotidina) 26; sin embargo, se recomienda administrar el antirretroviral 2 h antes de la dosis de antihistamínico H2 o 10 h después de ésta (según la ficha técnica americana, ATV/rtv incluso podría administrarse conjuntamente con antihistmínicos H2 en pacientes sin tratamiento previo, debiendo mantenerse el intervalo en pacientes con mutaciones que confieren resistencia a IP) 7.
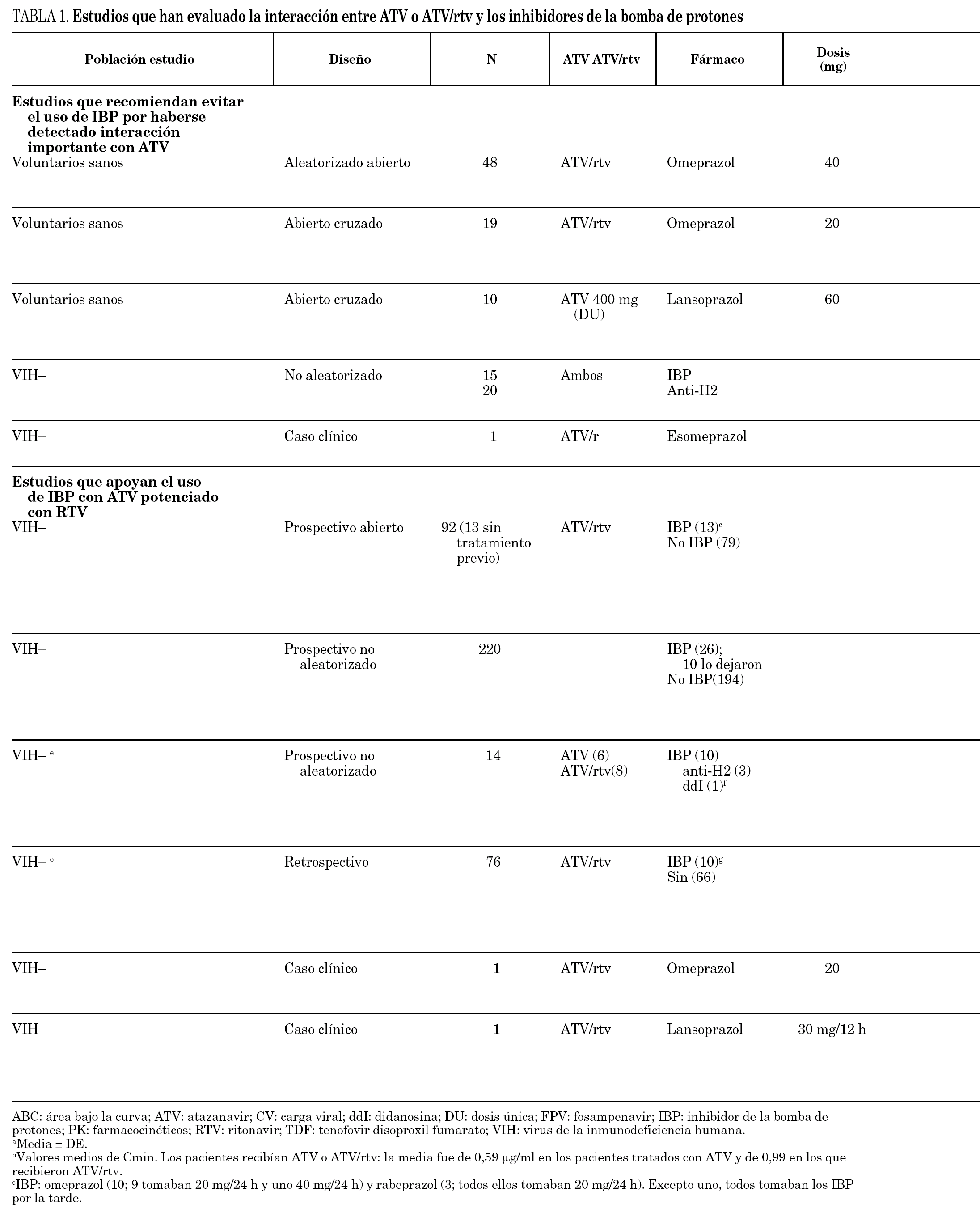
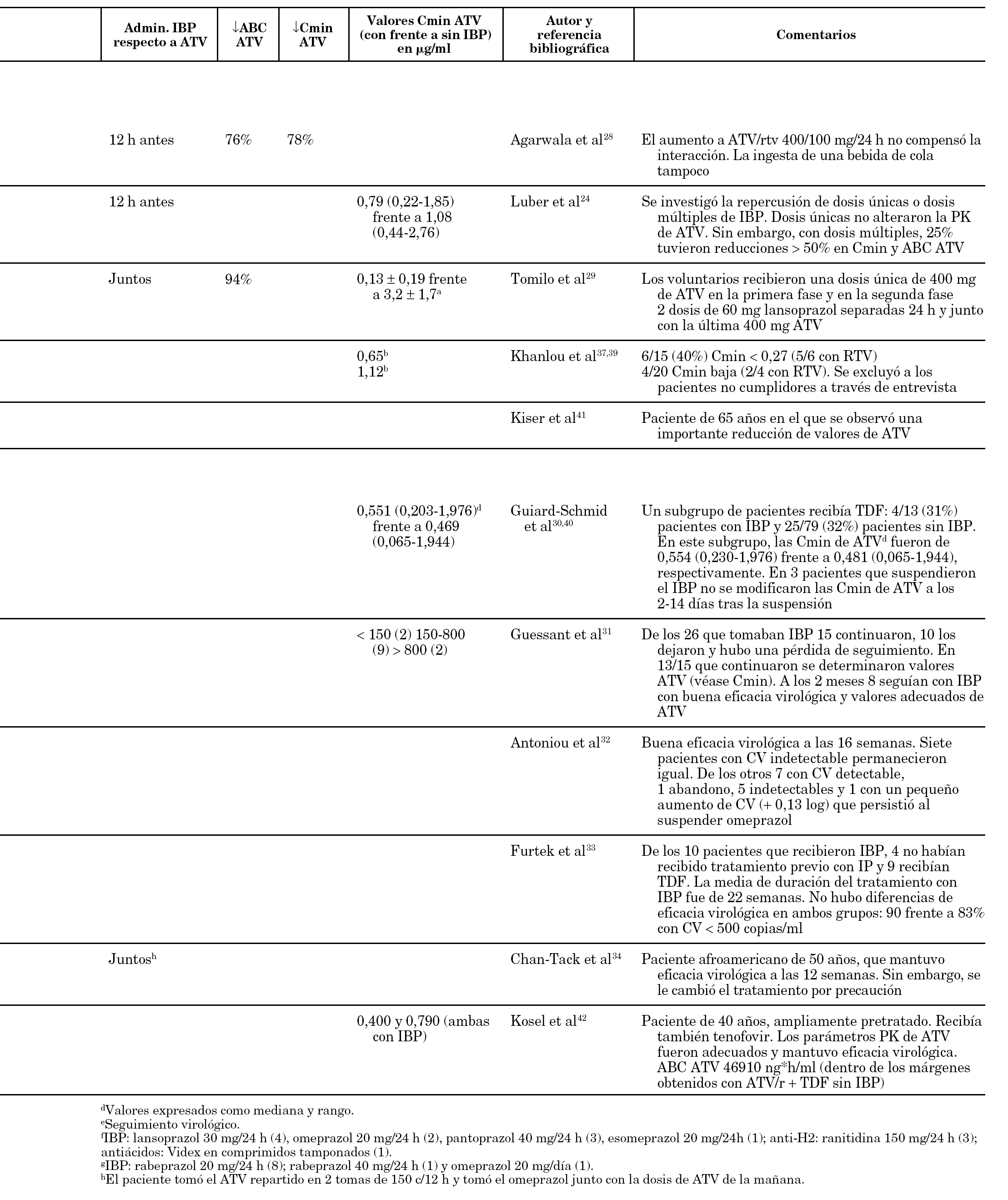
La posible administración del ATV con los IBP ha generado bastante controversia en los últimos meses y, por lo tanto, se comentará más detalladamente. Esta interacción puede tener consecuencias clínicas, ya que el uso de IBP en pacientes tratados con IP es frecuente. Entre el 20 y el 38% de los pacientes refiere haber utilizado IBP en algún momento durante el tratamiento con ATV 27. La solubilidad de ATV se reduce a medida que aumenta el pH. Estudios en voluntarios sanos han demostrado que la administración de omeprazol reduce de forma importante (> 75%) los valores plasmáticos de ATV, aun en presencia de RTV, por lo que no se recomienda esta combinación. El aumento de dosis de ATV/rtv a 400/100 mg/24 h no permite contrarrestar esta interacción ni tampoco la ingesta junto con una bebida de cola 28. Con lansoprazol, en voluntarios sanos se han observado reducciones todavía mayores (94%) con el empleo de ATV 400 mg/24 h no potenciado 29. En contraposición, han aparecido diversas publicaciones que indican ausencia de interacción en algunos pacientes 30-34. En la tabla 1 se revisan las principales publicaciones sobre este tema.
Se acepta un intervalo terapéutico para la Cmin de ATV entre 0,150 y 0,850 μg/ml 35 (los pacientes con mutaciones a IP podrían requerir unas Cmin entre 0,774 y 0,850 μg/ml 35-37). Dado que las concentraciones de ATV que se alcanzan con 400 mg/24 h no potenciado son muy justas 38, en ningún caso debería utilizarse en combinación con IBP. El estudio de Tomilo et al 29 pone de manifiesto este hecho, ya que 60 mg de lansoprazol redujeron un 94% el ABC de una dosis única de 400 mg de ATV.
No parece que dosis únicas de 20 mg de omeprazol separadas 12 h del antirretroviral puedan tener una repercusión negativa en los valores de ATV cuando se emplea potenciado con RTV, según observaron Luber et al 24 en voluntarios sanos. La polémica se centra en el posible uso de dosis múltiples de IBP en pacientes tratados con ATV/rtv (tabla 1). Mientras que Khanlou et al 37,39 no recomiendan esta asociación, otros autores 30,40-43, entre ellos Guiard-Schmid et al 30 defienden su posible uso en algunos pacientes (tabla 1).
Con 20 mg/24 h de omeprazol (en lugar de 40 mg) y ATV/rtv en dosis múltiples, ambos espaciados 12 h, Luber et al 24 observaron en voluntarios sanos una interacción menos importante. El ABC y la Cmin de ATV se redujeron un 27%; sin embargo, 4 de los 19 voluntarios (21%) presentaron reducciones de más del 50% en estos parámetros.
En conclusión, los estudios coinciden en el hecho de que hay una amplia variabilidad interindividual en los valores de ATV alcanzados. La alteración del pH producida por los IBP es más profunda y duradera que con los antihistamínicos H2 y su magnitud depende de la dosis de IBP administrada. Si bien en algunos pacientes no se produce la interacción, en otros sí y, a priori, no es posible predecir en cuáles, por lo que se recomienda evitar la asociación. Si ésta fuera imprescindible, se utilizará siempre ATV potenciado con RTV con un espaciamiento máximo del IBP (ATV/rtv 2 h antes de la dosis de IBP) y se deberían poder monitorizar las concentraciones plasmáticas de ATV para asegurar una Cmin adecuada.
A continuación, se revisan las interacciones con los principales grupos de inductores enzimáticos que podrían reducir las concentraciones de los antirretrovirales: antiepilépticos, antituberculosos y algunos productos naturales.
Antiepilépticos
En general, el riesgo de fracaso del tratamiento antirretroviral puede aumentar con algunos antiepilépticos, en especial carbamacepina y fenitoína, que son inductores enzimáticos potentes. A su vez, es posible que se modifiquen las concentraciones de los antiepilépticos (toxicidad o ineficacia), por lo que se recomienda monitorizar las concentraciones plasmáticas de ambos tipos de fármacos.
Se ha descrito un caso de fracaso virológico en un varón de 48 años tratado con AZT + lamivudina (3TC) + IDV (800 mg/8 h) con ARN-VIH plasmático indetectable que, tras iniciar tratamiento con CBZ a dosis bajas (200 mg/día) para una neuralgia postherpética, presentó una reducción en las concentraciones plasmáticas de IDV, elevación de la carga viral y aparición de resistencias a 3TC y probablemente a AZT 44.
Se han observado asimismo interacciones bidireccionales entre LPV/rtv y fenitoína 45,46 y entre EFV y CBZ 47 (CBZ 400 mg/24 h), con reducciones de aproximadamente el 30% tanto de los valores plasmáticos de antirretroviral como de antiepiléptico. Estas interacciones podrían llegar a ser clínicamente significativas.
Lim et al 45 realizaron un estudio farmacocinético en 24 voluntarios sanos para evaluar la interacción entre LPV/rtv y fenitoína. Los voluntarios recibieron durante 22 días 400/100 mg/12 h de LPV/rtv + 300 mg de fenitoína/24 h. Los valores de ABC y Cmin de LPV se redujeron un 33 y un 46%, los de RTV un 28 y un 47% y los de fenitoína un 31 y un 34%, respectivamente. Es probable que el mecanismo sea una inducción de las isoenzimas CYP2C9 y CYP2C19 por parte de LPV/rtv, con aumento del aclaramiento plasmático de fenitoína. A su vez, fenitoína induce el CYP3A4, por lo que aumenta el aclaramiento de LPV. En otro estudio se observó una elevada incidencia de toxicidad hepática 46. Se recomienda realizar el seguimiento de las concentraciones de fenitoína y, si es posible, también de LPV.
En voluntarios, Kaul et al 47 observaron una interacción significativa entre EFV y CBZ con reducción en el ABC, Cmax y Cmin de EFV del 36, 21 y 47%, respectivamente, en presencia de CBZ. Los valores de ABC, Cmax y Cmin de CBZ se redujeron un 27, 20 y 35%, respectivamente, en presencia de EFV. No se pueden establecer recomendaciones sobre el ajuste de dosis, ya que las dosis de CBZ evaluadas eran bajas (400 mg) y no hay datos con dosis mayores. Dado que es posible que esta interacción tenga consecuencias clínicas, los autores 47 recomiendan valorar otras alternativas terapéuticas. En cambio, Burman y Orr 48 describieron un caso de toxicidad por CBZ en un paciente tratado con CBZ en combinación con EFV y RTV. Existen otros casos descritos de toxicidad por CBZ en pacientes tratados con RTV 49,50.
Robertson et al 51 describieron en un paciente una potencial interacción entre EFV y fenitoína. Se observó una reducción de las concentraciones plasmáticas de EFV y un aumento de los valores de fenitoína. Según los autores, la reducción en las concentraciones de EFV se explicaría por el efecto inductor de fenitoína en el CYP 3A4 y 2B6, y el aumento en los valores de fenitoína se explicaría por el efecto inhibidor de EFV en CYP2C9 y CYP2C19 (causantes del metabolismo de fenitoína), efecto que se ha observado in vitro. Se recomienda monitorizar las concentraciones de fenitoína y, si es posible, también de los de EFV.
Normalmente se recomienda, si es posible, elegir antiepilépticos con menor riesgo de interacción, como el ácido valproico y la lamotrigina (porque se metabolizan por glucuronidación) o gabapentina y vigabatrina (que se eliminan principalmente por vía renal). Sin embargo, el estudio de Van der Lee et al 52 en voluntarios sanos demostró una interacción importante entre lamotrigina y LPV/rtv, con reducción de los valores plasmáticos de lamotrigina. Según la magnitud de esta interacción, se requería duplicar la dosis de lamotrigina.
Sheehan et al 53 describieron también un caso de potencial interacción entre ácido valproico y LPV/rtv, con reducción del 48% en las concentraciones de valproico (250 mg/8 h) al añadir LPV/rtv. Las concentraciones plasmáticas de LPV/rtv no se modificaron. Sin embargo, se trata de un solo caso y en un estudio previo realizado por DiCenzo et al 54 no se había observado interacción importante entre ambos fármacos. Este estudio tenía por objetivo evaluar el efecto de la administración de ácido valproico en los valores plasmáticos de EFV y LPV/rtv en pacientes con infección por el virus de la inmunodeficiencia humana (VIH). Se compararon las concentraciones de EFV (n = 11) y LPV/rtv (n = 8) antes y después de la administración de ácido valproico (250 mg/12 h durante 7 días). También se compararon las concentraciones de ácido valproico predosis y 8 h postdosis con las obtenidas en 11 pacientes que recibieron ácido valproico junto con ARV distintos a EFV o LPV/rtv (IDV, APV, NVP, NFV o sólo análogos). No se observaron cambios significativos en las concentraciones de ácido valproico ni en las de EFV.
Es probable que el mecanismo de las 2 interacciones anteriores sea una inducción de la glucuronidación de lamotrigina y, tal vez también de ácido valproico por parte de RTV, reduciendo las concentraciones plasmáticas de estos antiepilépticos, con el consiguiente riesgo de pérdida de efectividad. Por lo tanto, no se puede descartar que estas interacciones pudieran ser, hipotéticamente, extensibles a todos los esquemas de tratamiento antirretroviral que lleven RTV como potenciador, aunque no existen datos al respecto.
Antituberculosos
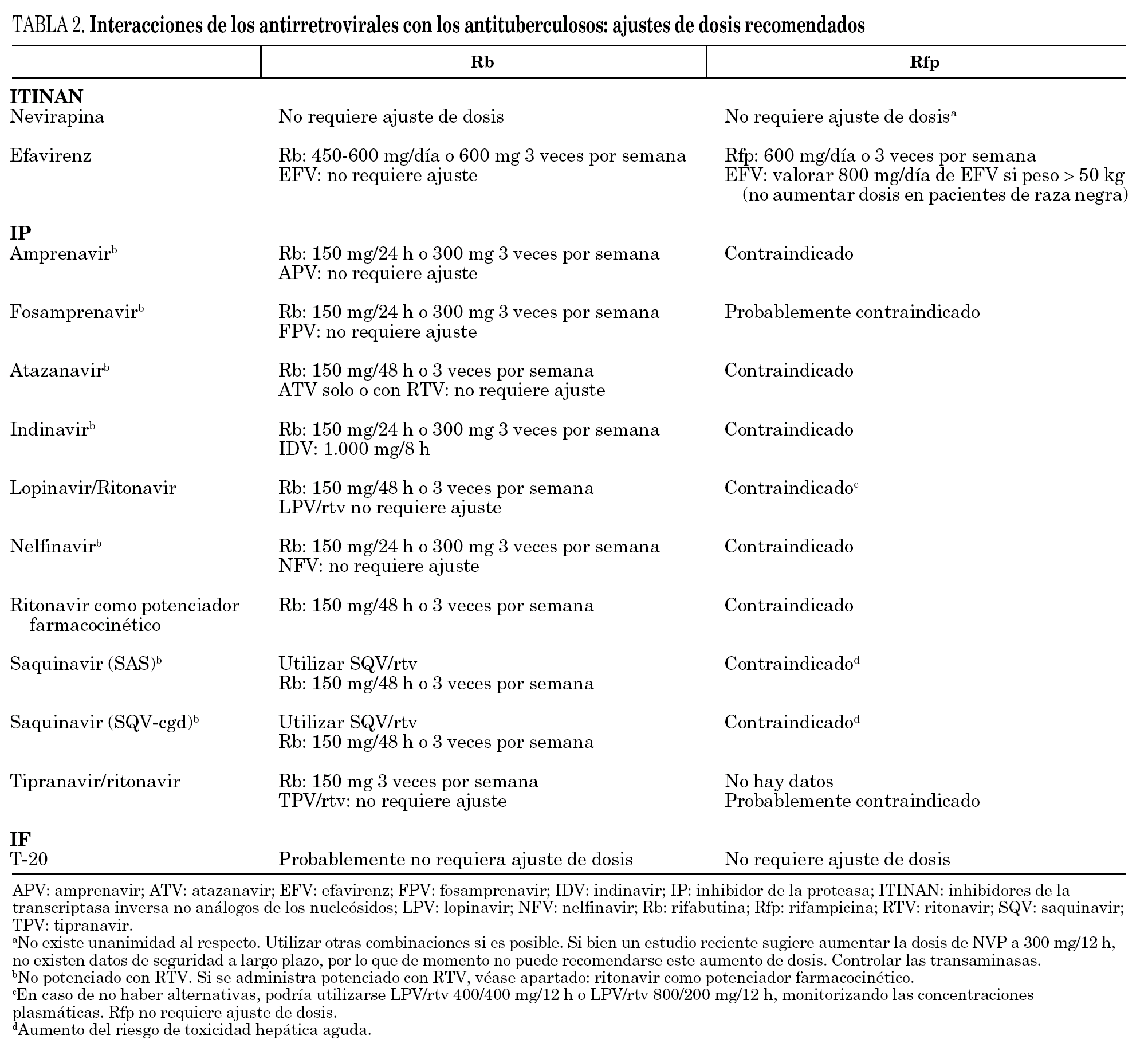
En la tabla 2 se indican los ajustes de dosis recomendados cuando se emplean rifampicina o rifabutina en combinación con IP o inhibidores de la transcriptasa inversa no análogos de los nucleósidos. A menudo se requieren ajustes de dosis, por lo que cuando se utilizan estas combinaciones es fundamental asegurar un buen cumplimiento del tratamiento. De no ser así, podría aparecer toxicidad por el antirretroviral o resistencias de Mycobacterium tuberculosis a rifamicinas. Es por ello que se prefiere administrar tratamiento directamente observado cuando sea posible.
La rifampicina es un inductor enzimático potente y se han observado reducciones importantes de alrededor del 80% en el ABC de la mayoría de los IP. En el caso de RTV, la reducción es menor, de alrededor del 35%, por lo que el RTV a dosis superiores a 400 mg/12 h podría asociarse con rifampicina; sin embargo, esta combinación, dada su mala tolerancia, se utiliza poco en la práctica clínica 1.
Por otro lado, una de las alternativas que se habían propuesto, la combinación de SQV/rtv 1.000/100 mg/12 h con rifampicina, ya no se recomienda en la actualidad por el riesgo de toxicidad hepática aguda observado en un ensayo clínico en voluntarios sanos 55. Al conocerse los resultados del estudio en voluntarios sanos 55, la Agencia Europea de Medicamentos y Productos Sanitarios recomendó a los profesionales sanitarios que evitaran esta combinación 56.
Aunque en algunos estudios en pacientes no se ha observado una incidencia de hepatotoxicidad tan elevada 57, Losso et al 58 observaron un caso de hepatotoxicidad grado 3 en un paciente coinfectado por el virus de la hepatitis C, de los 14 que fueron tratados con SQV/rtv 1.000/100 mg/12 h y rifampicina. Este paciente murió por progresión de la tuberculosis después de suspender el tratamiento antirretroviral por hepatotoxicidad. En otra serie se observó una elevada frecuencia de abandonos del tratamiento por efectos adversos (14/20 pacientes, en especial toxicidad hepática y gastrointestinal). Los pacientes recibían SQV/rtv 400/400 mg/12 h en combinación con rifampicina 59.
Otros estudios han evaluado el posible uso de IP en combinación con dosis mayores de RTV como potenciador, sin que haya suficientes datos para poder recomendar su uso.
Un estudio en voluntarios sanos 60 (n = 32), evaluó la combinación de LPV/rtv 800/200 mg /12 h (rama A) o LPV/rtv 400/400 mg /12 h (rama B) con rifampicina. Aunque desde un punto de vista farmacocinético los resultados son esperanzadores, la toxicidad fue importante, ya que tan sólo 20/32 individuos lograron terminar el estudio. Siete de ellos abandonaron por aumentos en las transaminasas tras el inicio de rifampicina + LPV/rtv. El número de abandonos por toxicidad fue superior en la rama LPV/rtv 400/400 mg/ 12 h. En cuanto al resto de efectos secundarios, la mayoría fueron leves (aunque frecuentes) y similares en ambas ramas. Con LPV/rtv 400/400 mg/12 h + rifampicina, el perfil farmacocinético de LPV fue comparable al obtenido con la dosis estándar de LPV/rtv en ausencia de rifampicina. En esta rama la variabilidad fue menor. Con LPV/rtv 800/200 mg/12 h se observó una amplia variabilidad, especialmente en la Cmin de LPV, de forma que la probabilidad de valores subterapéuticos de LPV fue mucho mayor. Si bien la posibilidad de utilizar LPV/rtv junto con rifampicina abre nuevas opciones en el tratamiento de la coinfección por el VIH y la tuberculosis, los autores recomiendan monitorizar las concentraciones plasmáticas de LPV, así como un control atento de las transaminasas 60.
Respecto a la combinación de rifampicina con NVP, existe cierta controversia. Se produce una interacción significativa con reducción de las concentraciones de NVP entre un 20 y un 58% 61. A pesar de ello, algunos autores aceptan la combinación de ambos fármacos sin que se requiera ajuste de dosis, debido a su amplio margen terapéutico. De hecho, a pesar de la reducción, los valores de Cmin de NVP son unas 40 veces superiores a la IC50 de la cepa salvaje del VIH 62. La eficacia clínica de dosis estándar de NVP administrada junto con rifampicina se evaluó en 36 pacientes, de los cuales 8 abandonaron el tratamiento por efectos adversos. Tras 9 meses, el 71% de los pacientes en tratamiento mantenía una carga viral inferior a 400 copias/ml, mientras que el porcentaje era sólo del 55% si el análisis se realizaba por intención de tratar 63. En cambio, otros autores han observado que, incluso en ausencia de rifampicina, un elevado porcentaje de pacientes tratados con NVP no alcanza los valores recomendados (estudio ANRS 088) 64. En otro estudio también se observaron valores plasmáticos bajos de NVP tanto en presencia como en ausencia de rifampicina 65. Un estudio reciente indica un posible aumento de dosis de NVP a 600 mg/24 h 66, aunque no hay datos de seguridad a largo plazo con este ajuste de dosis. Las guías del Department of Health and Human Services estadounidense 61 revisadas recientemente (mayo 2006) advierten sobre el potencial riesgo de hepatotoxicidad de ambos fármacos y sobre las posibles consecuencias virológicas. Por ello recomiendan evitar la asociación o utilizarla bajo un control cuidadoso.
Cuando el EFV se combina con rifampicina, los datos farmacocinéticos apoyan un aumento de dosis de EFV a 800 mg/24 h, en especial si el peso es > 50 kg 67,68. Los datos de eficacia y seguridad a las 56 semanas con este ajuste de dosis fueron buenos 69. Sin embargo, otros autores prefieren no modificar la dosis de EFV, basándose en su amplio margen terapéutico. Pedral-Samapio et al 70 demostraron la eficacia de EFV 600 mg/24 h en combinación con rifampicina en una serie de 49 pacientes sin experiencia previa al tratamiento antirretroviral, aunque en este estudio el peso inicial de los pacientes era bajo (entre 35 y 64 kg). En un estudio realizado en Tailandia por Manosuthi et al 71 se evaluó la interacción entre EFV y rifampicina en pacientes coinfectados por el VIH y tuberculosis. Se incluyó a 84 pacientes tratados con rifampicina durante por lo menos un mes, que fueron aleatorizados a recibir 3TC/estavudina (d4T) junto con EFV 600 o 800 mg/24 h. Las concentraciones plasmáticas de EFV a mitad del intervalo de dosis fueron, en mediana (rango), de 3,02 mg/l (0,07-12,21) en los pacientes tratados con 600 mg y de 3,39 mg/l (1,03-21,31) en los que recibieron 800 mg. Los valores de EFV fueron < 1 mg/l en el 7,9% de los pacientes que recibieron 600 mg de EFV y en ninguno de los que recibieron 800 mg (p = 0,274). Aproximadamente un 40 y 45% de los pacientes, respectivamente, presentaron unos valores de EFV > 4 mg/l 72. Los efectos adversos fueron similares en ambos grupos. Tuvieron que dejar el tratamiento 8 pacientes en el grupo tratado con 600 mg de EFV (19,1%) y 11 pacientes del grupo 800 mg EFV (26,1%). No se observaron diferencias significativas en cuanto a eficacia virológica o inmunológica del tratamiento antirretroviral en ambos grupos tras 48 semanas de seguimiento. El 91,2% (31 pacientes de los 34 tratados con 600 mg de EFV) y el 87,1% de los pacientes tratados con 800 mg de EFV (27/31) alcanzaron una carga viral indetectable. El número de CD4 determinado en las semanas 16, 24, 36 y 48 tampoco varió de forma significativa entre ambos grupos. Los autores concluyeron que en esos pacientes, cuyo peso era alrededor de 50 kg, era suficiente una dosis de 600 mg/24 h de EFV 71.
Si se desea aumentar la dosis de EFV, es necesario tener precaución en individuos de raza negra. Brennan-Benson et al 73 describen una serie de 8 pacientes VIH + con tuberculosis que presentaron toxicidad con la combinación de rifampicina y EFV a dosis altas (800 mg/24 h). Todos los pacientes pesaban más de 50 kg (el 75% pesaba más de 60 kg). El recuento basal de linfocitos CD4 era de 77 células/μl (25-668 células/μl). Siete pacientes presentaron efectos adversos en el sistema nervioso central (desde ansiedad hasta delirio) y uno desarrolló hepatitis inducida por EFV. Los 8 pacientes presentaban altas Cmin de EFV (media: 10.551 mg/dl, concentraciones muy superiores al rango terapéutico de 1.000-2.000 mg/dl) y eran de raza negra (a excepción del que desarrolló hepatitis). Tres de estos 8 pacientes dejaron el EFV y continuaron con otro régimen; 4 toleraron dosis de EFV más bajas (400-600 mg/24 h) y el último murió por complicaciones relacionadas con la tuberculosis. Los autores concluyen que no puede recomendarse el uso de EFV a altas dosis a todos los pacientes VIH + que toman rifampicina. Una variante del CYP2B6 más común en personas de raza negra puede estar relacionada con un aclaramiento plasmático menor de EFV. Esto podría explicar las altas concentraciones de EFV observadas en los 8 pacientes. El seguimiento de las concentraciones plasmáticas de antirretroviral podría ser eficaz para disminuir los efectos adversos graves.
A diferencia de rifampicina, rifabutina puede utilizarse en combinación con la mayoría de IP ajustando las dosis adecuadamente (tabla 2). Cuando se emplea rifabutina, se recomienda administrarla como mínimo 3 veces por semana. Esta recomendación afecta especialmente a los pacientes con un recuento de linfocitos CD4 < 100 células/μl. El estudio 23 del TBTC (TB Trials Consortium del Centers for Disease Control and Prevention) investigó el uso de rifabutina 2 veces por semana para el tratamiento de la tuberculosis en pacientes con infección por el VIH. Los pacientes con inmunodepresión avanzada (recuento de linfocitos CD4 < 100 células/μl) presentaron un riesgo elevado de aparición de resistencia a rifamicinas, por lo que en estos pacientes no se recomienda la administración de rifabutina 2 veces por semana 74.
Productos naturales
Es muy importante incluir los productos naturales en la anamnesis farmacológica, ya que a menudo se considera que son productos con poca actividad y no se tienen en cuenta, del mismo modo que los pacientes no indican a sus médicos que los toman porque no los consideran medicamentos. Las interacciones entre antirretrovirales y productos naturales adquirirán cada vez mayor protagonismo debido al amplio uso de estos productos en el colectivo de pacientes infectados por el VIH y en general en cualquier tipo de pacientes. Sin embargo, se conoce poco acerca de ellas. Dos de los productos con un mayor interés son la equinácea y la hierba de San Juan (Hypericum). La primera, por su amplio uso como inmunomodulador y la escasa información disponible sobre su posible repercusión en la infección por el VIH y el tratamiento antirretroviral, y el Hypericum, porque se ha descrito una interacción negativa clínicamente relevante con antirretrovirales y otros fármacos con elevado metabolismo hepático.
Equinácea
Se utiliza por su efecto inmunomodulador, para tratar infecciones del tracto respiratorio superior. En un metaanálisis realizado por la Biblioteca Cochrane se concluyó que, aunque algunas preparaciones de Echinacea pueden ser mejores que el placebo, no hay evidencia suficiente para recomendar su uso para el tratamiento o la prevención de los resfriados comunes 75.
Esta planta está contraindicada en pacientes con enfermedades graves, como enfermedades autoinmunes, enfermedades del colágeno, infección por el VIH, leucemia, esclerosis múltiple o tuberculosis. El motivo es que se desconoce su posible repercusión en la evolución de estas enfermedades; por ejemplo, en el caso del VIH, se desconoce si la activación de las células del sistema inmunológico podría aumentar la replicación viral 76,77.
Hypericum perforatum o hierba de San Juan
Su interacción con algunos antirretrovirales está bien documentada. Es ampliamente utilizada como antidepresivo, aunque el mecanismo de acción no ha sido claramente determinado. Algunos de sus componentes han demostrado in vitro inhibir la monoaminooxidasa de tipo B y, en menor medida, la de tipo A. También presenta efecto inhibidor de la recaptación de serotonina in vitro, pero a dosis mucho mayores que las terapéutica s77. Hypericum ha demostrado actividad in vitro frente a los retrovirus. Sin embargo, en 2 protocolos de fase I de la AIDS Clinical Trials Group que incluyeron a 30 pacientes con infección por el VIH, no se observó eficacia antirretroviral in vivo78.
La hierba de San Juan está contraindicada en pacientes que reciben tratamiento antirretroviral debido a su efecto inductor enzimático. De hecho, se han descrito interacciones con potencial importancia clínica entre Hypericum y múltiples fármacos con elevado metabolismo hepático como anticoagulantes orales, ciclosporina y anticonceptivos orales, por reducción de las concentraciones plasmáticas de estos fármacos 79. El probable mecanismo es una inducción enzimática por parte de Hypericum en las isoenzimas CYP3A4, CYP2C9 y CYP1A2 del citocromo P-450, así como en la glucoproteína P. El grado de interacción es impredecible debido a la falta de uniformidad en la composición del Hypericum, en cuanto a cantidad/calidad de sus componentes. Se ha observado un aumento del metabolismo de algunos antirretrovirales como IDV o NVP al administrarlos junto con la hierba de San Juan. En un estudio en 8 voluntarios sanos, Hypericum redujo un 57% el ABC de IDV y un 81% la Cmin 80. En un estudio retrospectivo, 20 pacientes que tomaban hierba de San Juan presentaron una reducción en el recuento de CD4, pero no se observó aumento de la carga viral 81. En 5 pacientes tratados con NVP, Hypericum aumentó un 35% el aclaramiento plasmático de este antirretroviral 82. Es probable que tenga el mismo efecto en otros IP. No se recomienda esta asociación porque podría contribuir al desarrollo de resistencia a IP y fallo terapéutico.
Ajo
El extracto de ajo es utilizado por su capacidad de reducir el colesterol. Se ha observado un empeoramiento de la tolerancia a RTV cuando se emplean conjuntamente. El extracto de ajo administrado durante 4 días no alteró significativamente el ABC de RTV (tan sólo la redujo ligeramente) 83. Sin embargo, suplementos de ajo administrados 2 veces al día durante un tiempo más prolongado (20 días) redujeron un 50% el ABC, la Cmin y la Cmax de SQV (1.200 mg/8 h, administrado junto con alimentos). Es más, tras 10 días de período de lavado, seguido de la nueva administración de SQV durante 3 días, tan sólo se alcanzó el 60-70% de los valores plasmáticos basales, lo que indica que el extracto de ajo tiene un efecto prolongado. Los pacientes que toman SQV no potenciado con RTV deben tener precaución al utilizar los suplementos de ajo. Sin embargo, esta situación es poco habitual en la actualidad 84.
Conclusión
En resumen, hay numerosas interacciones que pueden dar lugar a fracaso del tratamiento antirretroviral, si bien la mayoría pueden prevenirse conociéndolas y ajustando las dosis adecuadamente. La monitorización de las concentraciones plasmáticas puede ser útil en los casos en que se sospeche una interacción, dada la amplia variabilidad interindividual que a menudo presentan los antirretrovirales.
Correspondencia: Dra. M. Tuset Creus.
Servicio de Farmacia (Esc 8b sótano).
Hospital Clínic de Barcelona.
Villarroel, 170. 08036 Barcelona. España.
Correo electrónico: mtuset@clinic.ub.es