Introducción
Existe una gran variabilidad interindividual en la eficacia y la susceptibilidad a los efectos adversos de los fármacos. Esta variabilidad se debe a la influencia combinada de diferentes factores: ambientales, sexo del individuo, enfermedades asociadas, interacciones con otros fármacos y genéticos. La farmacogenética estudia las características genéticas del individuo y su influencia en la respuesta al tratamiento. Esto es importante en el tratamiento clínico de la infección por el virus de la inmunodeficiencia humana (VIH) debido a la necesidad de pautar un tratamiento crónico y a la elevada prevalencia de efectos adversos asociados. Variaciones genéticas en ciertas proteínas implicadas en el transporte o el metabolismo de los fármacos antirretrovirales pueden influir en su eficacia. Los factores genéticos también pueden influir en la aparición de efectos adversos asociados al tratamiento y en la respuesta virológica e inmunológica. En esta revisión, describimos los aspectos más relevantes de la farmacogenética del tratamiento antirretroviral.
Variaciones genéticas en proteínas transportadoras
Existen 2 grupos principales de proteínas transportadoras: las que exportan los fármacos desde el interior celular al medio extracelular y las que facilitan la entrada de los fármacos al interior celular. Dentro del primer grupo encontramos la glucoproteína P (Pg-p) que transporta múltiples sustratos entre los que se encuentran los inhibidores de la proteasa (IP). La Pg-p, que es el producto del gen ABCB1 (MDR1), es una de las más estudiadas en cuanto a la identificación de polimorfismos genéticos. Uno de los más relevantes es el 3435C > T en el exón 26. Este polimorfismo está asociado con una alteración de la expresión de la proteína y la estabilidad del ARN mensajero, aunque no provoca un cambio en el aminoácido correspondiente (isoleucina) 1,2. Numerosos estudios realizados para establecer la relación de este polimorfismo y otros, como el del exón 21 (2677G > T/A), con la farmacocinética de diferentes IP y del efavirenz han dado resultados controvertidos 3-11.
Otros transportadores, como los de la familia de las proteínas asociadas con la resistencia a diversos fármacos (MRP), podrían también influir en la disposición de los fármacos antirretrovirales, aunque no hay datos concluyentes. Las MRP1 y MRP2 transportan una gran cantidad de aniones orgánicos, incluidos los IP 12. Colombo et al 3 evaluaron la relación de diferentes polimorfismos en ABCC1 y ABCC2 (los genes que codifican para los transportadores MRP1 y MRP2, respectivamente) y los valores intracelulares de nelfinavir. Los autores concluyeron que no había ningún efecto de estos polimorfismos. Owen et al 13 demostraron un efecto del polimorfismo 260G > C en ABCC1 y los valores plasmáticos de nevirapina. Las proteínas transportadoras MRP4 y MRP5 participan en el transporte de adefovir, tenofovir y diferentes inhibidores de la transcriptasa inversa análogos de los nucleósidos (ITIAN), como azidotimidina, lamivudina, zalcitabina y estavudina 14-16. Numerosos polimorfismos han sido identificados en estos transportadores 17. Un estudio de Kiser et al apunta a una relación entre el polimorfismo 3463A > G en ABCC4 (gen que codifica para el transportador MRP4) y la farmacocinética de tenofovir. Los individuos heterocigotos o homocigotos para el alelo raro presentaban un aumento de la concentración plasmática e intracelular de tenofovir, así como una disminución de su aclaramiento renal 18. Estos resultados necesitan confirmación debido al reducido número de pacientes estudiados (n = 27).
Dentro del grupo de proteínas que facilitan la entrada de los fármacos al interior celular están los transportadores de aniones orgánicos y los de cationes orgánicos. Numerosos fármacos, entre los que se encuentran adefovir, tenofovir, y diferentes ITIAN e IP son sustratos de estos transportadores 19. Se han descrito polimorfismos genéticos que afectan a la actividad de ambos transportadores 20,21, aunque su influencia sobre la disposición de los fármacos antirretrovirales está todavía por determinar.
Variaciones genéticas en enzimas metabólicas
El metabolismo de los fármacos se divide en 2 fases: la fase I, que incluye reacciones de oxidación, reducción o hidrólisis; y la fase II, en la que tienen lugar reacciones de conjugación con compuestos endógenos para dotar al fármaco de mayor polaridad y facilitar su excreción del organismo. Uno de los grupos de enzimas más importantes de la fase I es el citocromo (CYP) P-450. Se trata de un grupo amplio y complejo de proteínas metabolizadoras que, en el ser humano, son codificadas por 57 genes divididos en 18 familias y varios seudogenes. Cinco isoenzimas del CYP (CYP3A4, CYP3A5, CYP2C19, CYP2D6 y CYP2B6) participan en el metabolismo de los fármacos antirretrovirales. Los polimorfismos genéticos en estas enzimas pueden resultar en un fenotipo metabolizador débil o por el contrario en un fenotipo metabolizador ultrarrápido debido a un fenómeno de duplicación genética. Numerosos polimorfismos se han identificado en las isoenzimas CYP, la mayoría de ellos son raros en la población general (frecuencia alélica < 1-2%) y algunos sólo se han descrito en grupos étnicos determinados 22.
El CYP3A4 y CYP3A5 son las isoenzimas más abundantes (constituyen el 25-40% del contenido hepático de P-450) y las que presentan el espectro más amplio, ya que metabolizan el 50% de los fármacos, incluidos la mayoría de los IP y los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINAN). Ambas enzimas son polimórficos, hay 20 alelos descritos para CYP3A4 y 11 para CYP3A5. El efecto de los polimorfismos -392A > G en la región 5' del gen CYP3A4 (CYP3A4*1B), el 6986A > G en el intrón 3 (CYP3A5*3) y el 14690G > A en el exón 7 (CYP3A5*6), han sido evaluados en la farmacocinética de efavirenz 4-6,10, nelfinavir 5,6,10 y saquinavir 23,24. Los resultados disponibles hasta el momento no demuestran ningún efecto significativo de estas variantes en la farmacocinética del efavirenz y el nelfinavir. Al contrario, 2 estudios independientes han demostrado una asociación del CYP3A5*3 con una disminución de la eliminación urinaria de saquinavir 23,24. Las diferencias en los valores de expresión de los CYP3A parecen más relevantes en el metabolismo de los fármacos que los polimorfismos genéticos 25. Un estudio reciente de Lamba et al 26 ha demostrado una relación entre el polimorfismo 2677G > T de MDR1 con los valores de expresión de CYP3A4 en hígado e intestino.
Para el CYP2C19 hay 21 alelos descritos. Un solo estudio describe una asociación entre el 681G > A (CYP2 C19*2) y valores plasmáticos de nelfinavir. Individuos heterocigotos u homocigotos para el alelo raro presentaban valores más altos de este IP en comparación con los individuos homocigotos para el alelo común. El mismo estudio también demostró una tendencia hacia una disminución de fallo virológico en individuos heterocigotos 5.
El CYP2D6 es el más polimórfico de todas las isoenzimas CYP con 59 alelos descritos. Un solo estudio ha analizado el efecto de 3 alelos no funcionales (CYP2D6*3, 2D6*4 y 2D6*6) en la farmacocinética de nelfinavir y efavirenz. Individuos homocigotos o heterocigotos para estos polimorfismos presentaban concentraciones plasmáticas más altas de ambos fármacos 10. Estos resultados deben interpretarse con cautela, ya que esta isoenzima no es la más importante para el metabolismo de estos fármacos.
CYP2B6 es una isoenzima que ha ganado importancia en los últimos años al demostrarse su participación en el metabolismo de importantes fármacos como el efavirenz. Ha demostrado ser polimórfico (28 alelos descritos) especialmente en población de raza negra 27. Diferentes estudios han demostrado una asociación significativa entre el 516G > T en el exón 4 (marcador del alelo CYP2B6*6) y valores plasmáticos elevados de ITINAN (efavirenz y nevirapina) 4,7,28,29. El 983T > C en el exón 7 (marcador del alelo CYP2B6*16 y *18) también se ha asociado con valores plasmáticos elevados de efavirenz 30. Las concentraciones de efavirenz extremadamente elevadas las encontramos en individuos con 2 copias de alelos no funcionales, generalmente una copia de CYP2B6*6 con otra copia de *6, *11 o *18, o nuevos alelos como *27 y *28 31.
Reguladores de las proteínas transportadoras y de las enzimas metabólicas
La gran variabilidad interindividual en la expresión y función de las proteínas transportadoras y las enzimas metabólicas no puede explicarse completamente por interacciones farmacológicas o polimorfismos genéticos. Todo esto indica que los reguladores de su trascripción contribuyen a estas diferencias. El receptor de pregnano X (PXR) y el receptor de androstano constitutivo (CAR) son miembros de la superfamilia de receptores nucleares que, cuando son activados por ligandos, regulan la trascripción de diferentes genes, entre ellos varias enzimas CYP y ABCB1 32-34. Los polimorfismos genéticos en PXR y CAR han sido descritos con una frecuencia alélica muy baja en la población general (≤ 3%), excepto el 79C > T (PXR*2), que es frecuente en población de raza negra (15-22%) 35-40. Su efecto en la disposición de los fármacos antirretrovirales está todavía por determinar.
Variaciones genéticas en la α1-glucoproteína ácida
La α1-glucoproteína ácida, también llamada orosomucoide, es una proteína de fase aguda que se une principalmente a los IP. Esta unión puede incidir en el efecto farmacológico ya que disminuye la fracción libre de fármaco. Existen 2 proteínas ORM1 y ORM2. La ORM1 es polimórfica, con 3 alelos ORM1*F1, ORM1*F2, ORM1*S descritos; ORM1*F1 y *S son bastante frecuentes mientras que *F2 es un alelo raro 41,42. Colombo et al 43 han evaluado la influencia de la concentración plasmática de estas proteínas y sus polimorfismos genéticos en la farmacocinética de indinavir, lopinavir y nelfinavir, y pudieron determinar que afectaban el aclaramiento aparente de indinavir y en menor medida el de lopinavir. El aclaramiento aparente de indinavir era significativamente más alto en individuos *F1*F1 que*F1*S y *S*S.
Susceptibilidad genética a los efectos adversos del tratamiento antirretroviral
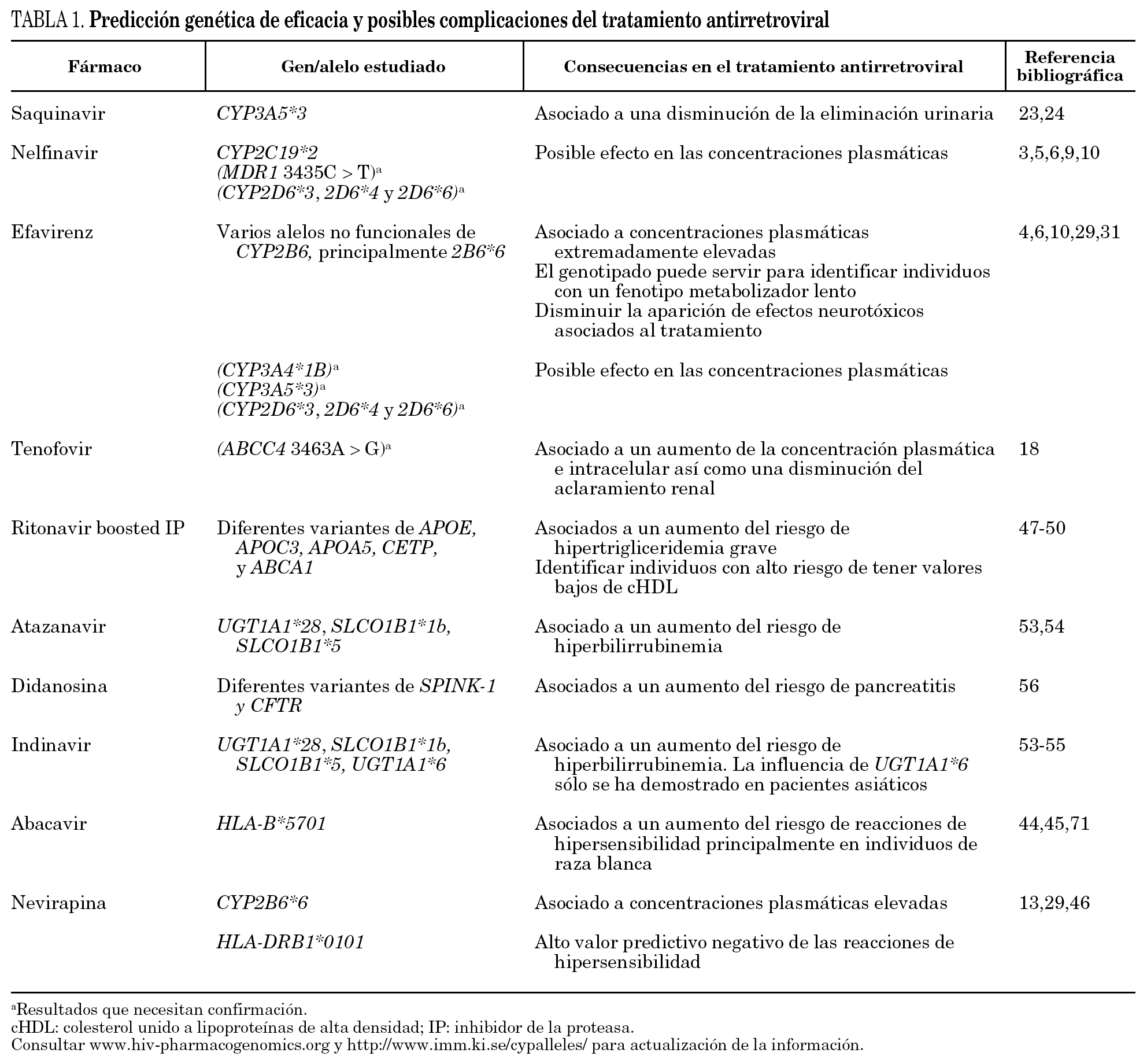
Las complicaciones del tratamiento antirretroviral en las que se ha encontrado predisposición genética incluyen reacciones de hipersensibilidad, dislipidemias, lipodistrofia, neurotoxicidad central, hiperbilirrubinemia y pancreatitis (tabla 1). Determinados alelos del complejo mayor de histocompatibilidad están asociados con un riesgo de hipersensibilidad al abacavir y nevirapina 44-46. Tres estudios han identificado varios polimorfismos genéticos en APOE y APOC3 como marcadores de riesgo para dislipidemias 47-49. Un estudio reciente de Arnedo et al 50 ha relacionado 5 genes (APOE/APOC3/APOA5/CETP/ABCA1) de un total de 12 estudiados con el riesgo de dislipidemia, y se demuestra que la predisposición genética a presentar este afecto adverso se debe al efecto combinado de varios genes. La lipodistrofia como efecto adverso se ha asociado a un polimorfismo en el promotor de TNF-α (-238G > A) 51,52. La aparición de neurotoxicidad se ha asociado principalmente al tratamiento con efavirenz, el alelo CYP2B6*6 ha demostrado ser un buen marcador tanto en la fase temprana del tratamiento 4 como en la crónica 29. La hiperbilirrubinemia es un efecto adverso asociado al tratamiento con atazanavir y en menor medida a indinavir. Un polimorfismo en el promotor del gen que codifica para UGT1A1 (alelo UGT1A1*28) causante del síndrome de Gilbert y 2 polimorfismos en SLCO1B1 (alelos SLCO1B1*1b y *5), gen que codifica para el transportador de bilirrubina OATP1B1, se han relacionado con la hiperbilirrubinemia asociada al tratamiento con atazanavir en individuos de raza blanca 53,54. Otro polimorfismo en UGT1A1 (alelo UGT1A1*6) se ha relacionado con la hiperbilirrubinemia asociada al tratamiento con indinavir en pacientes asiáticos 55. La aparición de pancreatitis se ha asociado principalmente al tratamiento con didanosina; un estudio ha demostrado la influencia de polimorfismos en CFTR y SPINK-1 (genes que codifican para la proteína reguladora de conducción transmembránica de la fibrosis quística y la proteína inhibidora de la tripsina secretora pancreática, respectivamente) y el riesgo de pancreatitis en pacientes infectados por el VIH 56.
Influencia de factores genéticos en la respuesta virológica e inmunológica
Aparte de afectar a los valores plasmáticos del fármaco, algunos polimorfismos pueden influir en la respuesta virológica e inmunológica al tratamiento antirretroviral. La presencia del polimorfismo CCR5Δ32, en el correceptor utilizado por el VIH para entrar en la célula, se ha asociado con una mejor respuesta virológica 57-60 e inmunológica 59,60 al tratamiento. Sin embargo, otros estudios no han encontrado ningún efecto 61-63. Diferencias en el diseño del estudio, el tamaño y la homogeneidad de la muestra y la eficacia del tratamiento dificultan la comparación de resultados entre estudios diferentes.
Tres estudios indican cierta repercusión del polimorfismo 3435C > T en el gen ABCB1 en la respuesta virológica tanto en pacientes sin tratamiento previo 64 como en los que han recibido tratamiento antirretroviral previo 5,6. En cuanto a su relación con la respuesta inmunológica son menos consistentes probablemente debido al mayor número de variables que intervienen en su control. Únicamente el estudio de Fellay et al 10 demuestra que individuos con el alelo 3435T presentan un aumento significativo de los linfocitos CD4 a los 6 meses de iniciar tratamiento. Otros estudios, en cambio, no demuestran ningún efecto de este polimorfismo, tanto en la respuesta virológica como en la inmunológica 8,9,65-67.
Conclusiones
El número de estudios farmacogenéticos está aumentado rápidamente 68 y se plantea la cuestión de si estamos preparados para aplicar los resultados a la práctica clínica. Actualmente, la mayoría de estudios se ha centrado en el efecto de polimorfismos en un solo gen. Sin embargo la respuesta farmacológica es más compleja con la participación de múltiples genes relacionados entre ellos y con factores no genéticos. El principal objetivo del proyecto HapMap fue crear una base de datos de las variaciones genéticas existentes en el genoma humano 69. Una vez que se conozca un número elevado de polimorfismos en múltiples genes y su frecuencia en diferentes grupos étnicos, podrán utilizarse para relacionar la "huella genética" de cada individuo con su perfil de respuesta al tratamiento más probable. Todavía queda trabajo por hacer, y la aplicación sistemática de los tests genéticos al tratamiento de la infección por el VIH en un futuro próximo parece poco probable. Sin embargo, tests farmacogenéticos concretos para situaciones clínicas determinadas son una realidad. En el año 2005 la Food and Drug Administration estadounidense aprobó la utilización de un test para detectar el alelo UGT1A1*28 en pacientes con cáncer de colon candidatos a recibir tratamiento con irinotecán 70. La aplicación de tests concretos en el tratamiento de la infección por el VIH puede también ser una realidad 71.
Fuentes consultadas
www.hiv-pharmacogenomics.org Página de acceso público donde se recoge información acerca de la farmacogenética del tratamiento antirretroviral.
http://www.imm.ki.se/cypalleles/ Página principal del comité de nomenclatura de los diferentes alelos existentes del citocromo P-450.
http://www.hapmap.org Página principal del International HapMap project.
Correspondencia: Dra. M. Rotger.
Institute of Microbiology.
Rue de Bugnon, 48. 1011 Lausanne. Switzerland.
Correo electrónico: margalida.rotger@hospvd.ch
Margalida Rotger tiene una beca del Fondo de Investigación Sanitaria (beca BF03/0005). Rubin Lubomirov tiene un contrato de formación en investigación para profesionales con formación sanitaria especializada cofinanciado por el Fondo de Investigación Sanitaria y el Hospital Universitario La Paz (CM04/00157).