Introducción
En la actualidad y desde la generalización del tratamiento antirretroviral (TAR) de gran actividad (TARGA) ha mejorado el control de los pacientes con infección por el virus de la inmunodeficiencia humana (VIH). Se ha observado un incremento progresivo tanto en el porcentaje de pacientes con carga viral indetectable como en la cifra de CD4, lo que ha permitido en muchos casos superar la barrera crítica de las 200 células/μl y con ello la situación de riesgo de aparición de infecciones oportunistas 1.
Pese al descenso de la morbimortalidad asociada directamente con el VIH 2,3, globalmente la principal causa de muerte en los pacientes infectados sigue siendo el sida, seguido de las hepatopatías (sobre todo las hepatititis virales), las cardiopatías y las neoplasias. Además, se ha observado que el riesgo de muerte, independientemente de la causa, se correlaciona de forma directa con el grado de depleción de los CD4, y es mayor en el grupo de pacientes con menos de 50 células/μl 4.
Por otro lado, la mortalidad sigue siendo mayor que en la población general, salvo en casos de buena respuesta al TARGA. Esto se ha puesto de manifiesto en un estudio recientemente realizado en Francia, en el que se compara la mortalidad observada en la población general, con la de una cohorte de pacientes que empezaron un TARGA con inhibidores de la proteasa (IP). La mayor mortalidad se daba en mujeres, pacientes adictos a drogas por vía parenteral (ADVP) y con infección por el virus de la hepatitis C (VHC) 5.
Pero el TARGA también plantea problemas tanto a corto como a largo plazo. La principal causa de suspensión de tratamiento al inicio de éste es la toxicidad, sobre todo gastrointestinal 6,7. Se ha observado una mayor incidencia de toxicidad (neuropatía, insuficiencia renal y lipoatrofia) en los pacientes con valores de CD4 inferiores a 200 células/μl 8.
En estos momentos disponemos de fármacos potentes y eficaces, cuya toxicidad conocemos bien tanto a corto como a largo plazo. Sabemos combinarlos de forma adecuada para conseguir la máxima potencia con los menores efectos secundarios, lo que ha motivado cambios en las recomendaciones para el tratamiento de inicio, y se han descartado los fármacos que antes se consideraban de elección. Todos estos hechos han determinado que el TAR se adapte cada vez más a las características del paciente para así conseguir el mayor éxito durante el mayor tiempo posible.
La comorbilidad es otro elemento fundamental 9,10 que va a influir en la elección del TARGA y en su eficacia, ya sea por las interacciones farmacológicas, la suma de toxicidades o la mayor probabilidad de aparición de efectos secundarios. Vamos a analizar distintas comorbilidades especialmente importantes por su frecuencia, sus implicaciones o su difícil tratamiento en nuestro medio sanitario.
Tuberculosis
Su prevalencia es elevada en el ámbito mundial y específicamente en nuestro entorno. La infección por el VIH incrementa de forma significativa el riesgo de desarrollarla 11.
El TAR ha reducido de forma importante la incidencia de infecciones oportunistas, hasta el punto de que son raras en el caso de que la cifra de CD4 sea elevada. Pese a todo, la incidencia de tuberculosis (TBC) sigue siendo alta en los pacientes con VIH, sobre todo si su cifra de CD4 es inferior a 100 células/μl y se asocian otros factores de riesgo, como el consumo de drogas, la marginación social o la institucionalización 12.
En los pacientes con TARGA se ha observado una disminución de la incidencia de TBC, sobre todo durante el primer año, permaneciendo alrededor de un 1% a partir del tercero. Todo ello coincide con una buena respuesta al TARGA, que es menor en los pacientes con TBC 13.
El objetivo del tratamiento es controlar la enfermedad lo antes posible y reducir el número de bacilos rápidamente, para así prevenir la aparición de resistencias y eliminar los bacilos persistentes para evitar las recidivas. Su eficacia es la misma que en la población general, por lo que se siguen las mismas recomendaciones aunque con algunos matices 14.
La pauta de tratamiento para los no coinfectados consiste en 6 meses de rifampicina a dosis de 10 mg/kg/día, e isoniacida a dosis de 5 mg/kg/día, a los que se añade durante los 2 primeros meses pirazinamida a dosis de 20-25 mg/kg/día. El número de fármacos iniciales depende de las tasas basales de resistencia primaria a isoniacida: si fuera superior al 4% se debería añadir etambutol a dosis de 15-25 mg/kg/día (o estreptomicina a dosis de 15 mg/kg/día) a la pauta triple hasta disponer de los resultados de sensibilidad. En nuestro entorno todavía mantenemos tasas primarias de resistencia inferiores al 5%, pero no es así en los inmigrantes de África, Asia, América Latina o Europa del Este, en cuyo caso deberíamos tratar con 4 fármacos 14.
En los pacientes infectados por el VIH la situación cambia. No hay análisis clínicos comparativos para valorar la duración óptima del tratamiento, aunque hay estudios en los que se pone de manifiesto que la eficacia de las pautas largas y cortas es similar 15. En las guías de GeSIDA se recomienda administrarlo durante 9 meses o hasta por lo menos 6 meses tras la negativización de los cultivos, sobre todo si la cifra de CD4 es inferior a 200 células/μl 14.
En cuanto a los fármacos a elegir, el problema está en las interacciones farmacológicas entre la rifampicina y los IP y los análogos no nucleósidos de la transcriptasa reversa (ANNTR), y en la potencial toxicidad hepática tanto de los antituberculosos como de los fármacos antirretrovirales. Las rifamicinas son potentes inductores del sistema hepático del citocromo P-450, sobre todo de su isoforma CYP3A4. La rifamicina de elección es la rifampicina, y su alternativa es la rifabutina en los pacientes con TARGA y potenciales interacciones (tabla 1). Así, el tratamiento de elección siempre que sea posible es la administración de rifampicina con un TARGA que contenga efavirenz 14,16.
Momento de inicio de TARGA y de tuberculostáticos
Depende de las características y la situación inmunológica del paciente. Se deben valorar las consecuencias en cuanto a la posibilidad de progresión de la infección por el VIH si se retrasa el TARGA, la potencial toxicidad y los efectos adversos de los distintos fármacos, e incluso la posibilidad y las consecuencias de aparición de un síndrome de reconstitución inmunológica. Por todo esto, se deben valorar el riesgo y el beneficio y tomar la decisión más adecuada 14-17.
El síndrome de reconstitución inmunológica en este caso consiste en un empeoramiento clínico y/o radiológico de la TBC; su aparición obliga a descartar una progresión de la enfermedad por tratarse de un germen resistente o por un mal cumplimiento del tratamiento antituberculoso. Su tratamiento es sintomático, e incluye ocasionalmente corticoides. Habitualmente no requiere la suspensión del TARGA ni del tratamiento antituberculoso.
Si la cifra de CD4 es superior a 350 células/μl y el paciente no toma TARGA, se puede iniciar el tratamiento antituberculoso vigilando la cifra de CD4 y la toxicidad.
Si la cifra de CD4 se encuentra entre 200 y 350 células/μl, la decisión debe individualizarse. Se han observado incrementos importantes de CD4 simplemente controlando la TBC, por lo que una opción es retrasar el inicio de TARGA hasta el final del tratamiento antituberculoso, y controlar los CD4.
Si los valores de CD4 son inferiores a 200 células/μl se debe empezar el TARGA lo antes posible. Se deberá optar por iniciar el tratamiento tanto más tempranamente cuanto menor sea la cifra de CD4. Si es superior a 100 células/μl se pueden esperar 4-8 semanas e iniciarlo una vez haya finalizado la fase de inducción y confirmado que se tolera bien el tratamiento antituberculoso. Si es inferior a 100 células/ml se debería iniciar durante el período de inducción, tras comprobar la tolerancia inicial del tratamiento antituberculoso.
En un estudio se ha puesto de manifiesto que en los pacientes con enfermedad avanzada con TBC no se han observado ventajas con el retraso del inicio del TARGA tras la finalización del TAR 17.
El TARGA más adecuado va a depender de la situación del paciente.
Si hablamos de un paciente sin tratamiento previo, el de elección es la asociación de 2 análogos nucleósidos de la transcriptasa reversa (ANTR) y efavirenz. La alternativa sería la administración de trizivir, pero como pauta inicial es inferior en eficacia y aumenta el riesgo de acumular resistencias. En el paciente con tratamiento estable y carga viral indetectable, puede valorarse como pauta de simplificación, ya que habitualmente mantiene su eficacia. Otras combinaciones a explorar serían la asociación de trizivir y tenofovir, o la asociación de 3 ANTR con T20 (tabla 1).
Si el paciente está tomando un TARGA estable y eficaz que contiene efavirenz o trizivir, se debe mantener el tratamiento, pautar rifampicina y ajustar la dosis de efavirenz en caso necesario.
Otra situación distinta es la del paciente estable pero que toma un tratamiento incompatible con rifampicina. En este caso se puede intentar cambiar el TARGA para poder administrar rifampicina, o mantener el TARGA y administrar rifabutina. Si el paciente está en tratamiento y ha presentado múltiples fracasos terapéuticos, se debe tratar la situación de forma individualizada. En este caso se recomienda administrar 4 fármacos como tratamiento de inducción.
Una última situación sería la del paciente bien controlado que inició tratamiento con cifras de CD4 superiores a 350 células/μl y se encuentra asintomático. En este caso, a las opciones previas se podría añadir la de interrumpir el tratamiento durante la administración de antituberculosos.
Una alternativa que hay que considerar en los pacientes en que se sospecha mala adherencia es la administración del tratamiento antituberculoso directamente observado (DOT).
Coinfección por el virus de la hepatitis B y/o C
Se trata de una de las causas más frecuentes de morbimortalidad en los pacientes con infección por el VIH no relacionadas directamente con ésta. Esto se ha puesto de manifiesto en datos recientemente comunicados en el estudio D:A:D 18. Aparece el sida como la principal causa de muerte (31%), seguida de la hepatopatía (15%), la enfermedad cardiovascular (9%) y las neoplasias no relacionadas con el sida (9%). Los factores identificados como predictores de muerte por hepatopatía son la edad, la ADVP, la cifra de CD4, el presentar en la serología el antígeno de superficie del virus de la hepatitis B (VHB) positivo y, sobre todo, los anticuerpos frente al VHC positivo.
El papel del TARGA con respecto a la supervivencia en estos pacientes es contradictorio. En algunos estudios se ha demostrado eficaz en cuanto al pronóstico de los pacientes coinfectados. En algunas cohortes se ha observado una mayor supervivencia en los pacientes con TARGA, y el hecho de no estar tomando TARGA es un factor predictor de muerte 19. Pero en otras cohortes, como EuroSIDA, los datos son totalmente distintos y se observa un descenso global de la mortalidad por enfermedad hepática, un descenso que desaparece una vez se ajusta el análisis por los años de exposición al TARGA 20. Para explicar estos datos los autores aducen el papel de la hepatotoxicidad del TARGA, y la progresión de la hepatopatía por el VHB y/o VHC con los años.
Los pacientes coinfectados presentan unas características especiales que van a influir tanto en la elección como en el éxito del TAR. Por un lado la mayoría de los fármacos se metabolizan en el ámbito hepático, y la progresión de la hepatopatía puede influir en su eficacia y en la aparición de toxicidad; por otro lado, hay interacciones medicamentosas relevantes y efecto aditivo de ciertas toxicidades entre el interferón y la ribavirina, utilizados actualmente como tratamiento frente a la hepatitis C, con los antirretrovirales. Por último, el momento de inicio del TARGA y su composición se pueden ver modificados por la coinfección por el VHB y/o el VHC.
Tratamiento antirretroviral y toxicidad hepática
Aunque la mayoría de los antirretrovirales se metaboliza en el hígado, las vías enzimáticas que utilizan son muy variadas, y no todas ellas están afectadas en la misma medida en situaciones de enfermedad hepática terminal.
El principal problema para conocer la incidencia real de hepatoxicidad por fármacos antirretrovirales radica fundamentalmente en la definición de hepatotoxicidad 21 utilizada en los distintos estudios y en la ausencia de un patrón de referencia claro, por lo que normalmente nos basamos en los valores de transaminasas y en estudios transversales de biopsias hepáticas. En primer lugar, para decir que un fármaco es la causa de toxicidad es fundamental establecer una relación temporal y descartar otras potenciales causas de ésta. Pero los pacientes están en tratamiento con distintos fármacos y además no se tiene en cuenta en múltiples ocasiones el consumo de drogas y/o alcohol o la coinfección por el VHC y/o el VHB. Además, en los ensayos clínicos se considera hepatotoxicidad grave únicamente a la elevación de las cifras de transaminasas por encima de 5 veces las cifras normales, sin tener en cuenta los fallos hepáticos o la colestasis, o el hecho de que es más fácil que los pacientes con cifras basales de transaminasas altas presenten mayores elevaciones 22-29. En este caso se puede considerar como significativa la elevación de la alanino aminotransferasa (ALT) y alaninoaspartato transferasa (AST) > 3,5 veces el valor basal.
En general se observa una mayor elevación de cifras de transaminasas en los pacientes coinfectados (10% frente a un 5% de hepatotoxicidad como elevación de transaminasas grado 3-4) 22-29. Se han publicado distintos estudios en los que se ha intentado conocer cuáles son los fármacos más hepatotóxicos. Se ha relacionado con una mayor hepatotoxicidad a los ANNTR, sobre todo la nevirapina 28-31, y al ritonavir a dosis completas, no a dosis bajas como potenciador. El fosamprenavir y el atazanavir 30 parecen ser poco hepatotóxicos; no sucede lo mismo con el tipranavir, sobre todo por su necesidad de ser potenciado con 200 mg de ritonavir cada 12 h.
Los factores de riesgo de aparición de hepatotoxicidad con el TAR son: coinfección con VHB y/o VHC, valores basales de ALT elevados, magnitud del incremento de CD4 con respecto a las cifras basales, consumo de alcohol, sexo femenino, y en cuanto a los fármacos, la administración de nevirapina sola o con otro IP, o la de ritonavir a dosis plenas 22-29,32.
Los mecanismos por los que el tratamiento antirretorival produce hepatotoxicidad son muy variados 33,34:
Toxicidad mitocondrial. Deriva de la inhibición de la polimerasa gamma que interviene en la síntesis de ácido desoxirribonucleico mitocondrial. Las alteraciones más graves se han relacionado con la toma de estavudina (d4T), didanosina (ddI) o zalcitabina. Los síntomas son muy variados y aparecen paulatinamente, excepto en casos aislados en que lo hacen de forma fulminante. En general se observan anorexia, vómitos, pérdida de peso y dolor abdominal. Los signos asociados son la presencia de hepatomegalia, colestasis y elevación de ALT, y signos extrahepáticos como elevaciones de los valores de amilasa, creatincinasa, lactato o acidosis metabólica en los casos más graves.
Hipersensibilidad. Se asocia fundamentalmente al abacavir. Aparece en individuos con HLA-B*5701. Puede aparecer hasta en un 5% de los pacientes tras el inicio del tratamiento, con una mediana de 9 días y un máximo de 6 semanas. Suele asociarse con fiebre, erupción cutánea y alteraciones digestivas. Cede con la suspensión del fármaco y si se reanuda provoca un shock anafiláctico.
Se relaciona además con la nevirapina. Sucede en las primeras 4-6 semanas de tratamiento, se suele acompañar de erupción cutánea, fiebre y eosinofilia y puede dar lugar a una insuficiencia hepática grave. Se ha observado un mayor riesgo de desarrollarla en mujeres con CD4 ≥ 250 células/μl y en varones con CD4 ≥400 células/μl 32. También produce una toxicidad tardía que consiste en elevaciones progresivas de las transaminasas por un mecanismo desconocido, sobre todo en pacientes coinfectados por el VHB y/o VHC.
Otros mecanismos de toxicidad son la elevación de transaminasas en el contexto de un episodio de reconstitución inmunológica, toxicidad directa farmacológica o reacciones idiosincrásicas.
Fibrosis hepática y tratamiento antirretroviral
La presencia y el valor de fibrosis hepática existente favorece la aparición de hepatotoxicidad relacionada con el TAR 35-38. Así, en un estudio publicado por Aranzabal et al 36 se pone de manifiesto que el 38% de los pacientes con fibrosis 3,4 presentaba hepatotoxicidad grave frente a un 15% con fibrosis 1,2. La hepatotoxicidad severa (> 5 veces las cifras normales) se asociaba a la presencia de fibrosis avanzada y toma de ANNTR, cifras de ALT basales elevadas si F1-F2. En pacientes con fibrosis no avanzada la incidencia era similar independientemente del TARGA administrado.
La fibrosis hepática sigue un curso acelerado en los pacientes coinfectados. Los factores que influyen en esta evolución más rápida no están claros. En general parece que la depleción de CD4 y la presencia de cargas virales elevadas del VIH favorecen su progresión rápida 35.
En cuanto al papel del TAR en la progresión de la hepatopatía crónica por el VHC, los datos de los distintos estudios son incompletos y contradictorios, probablemente por tratarse de estudios retrospectivos, con distintos análisis y sobre distintas poblaciones. Hay trabajos en los que no se observa relación alguna entre progresión y grado de fibrosis y exposición al TAR, mientras que en otros se observa una progresión a fibrosis más lenta en los pacientes que toman IP, o una correlación inversa entre el tiempo de exposición y la velocidad de desarrollo de la fibrosis. Recientemente se ha puesto también de manifiesto el potencial papel de los ANTR en la aparición de fibrosis 37,38.
Tratamiento antirretroviral en pacientes coinfectados
Los objetivos del tratamiento son los mismos que en pacientes no coinfectados 39-42. No hay ningún fármaco claramente contraindicado. Únicamente se ha propuesto si se debe empezar a tratar con cifras de CD4 > 350 células/μl dado el papel de la situación inmunológica en la progresión de la fibrosis, la posibilidad de aparición de síndrome de reconstitución inmunológica y la mayor dificultad de recuperación de la cifra de CD4. En cuanto a con qué tratar, parece que sería más indicado utilizar un régimen basado en IP, sobre todo en pacientes con fibrosis avanzada.
Los efectos secundarios y las interacciones entre los fármacos antirretrovirales y el tratamiento para el VHC complican también la situación. La elección del momento de inicio de ambos tratamientos va a depender del paciente y de su situación clínica con respecto a ambas enfermedades. En el último consenso europeo se recomienda que si el paciente presenta cifras de CD4 ligeramente por encima de las que indican el inicio del TAR, debe considerarse iniciar primero el TAR para evitar la depleción de CD4 inducida por el interferón y así no colocar al paciente en situación de riesgo 43,44.
En general se contraindica la administración de ddI por la posible aparición de pancreatitis y toxicidad mitocondrial con riesgo vital, de d4T porque se potencia la pérdida de peso y la aparición de lipoatrofia; la zidovudina se debe utilizar con precaución por el riesgo de anemia y neutropenia; no se debe empezar simultáneamente el tratamiento con abacavir ya que la reacción de hipersensibilidad puede confundirse con el cuadro seudogripal producido por el interferón.
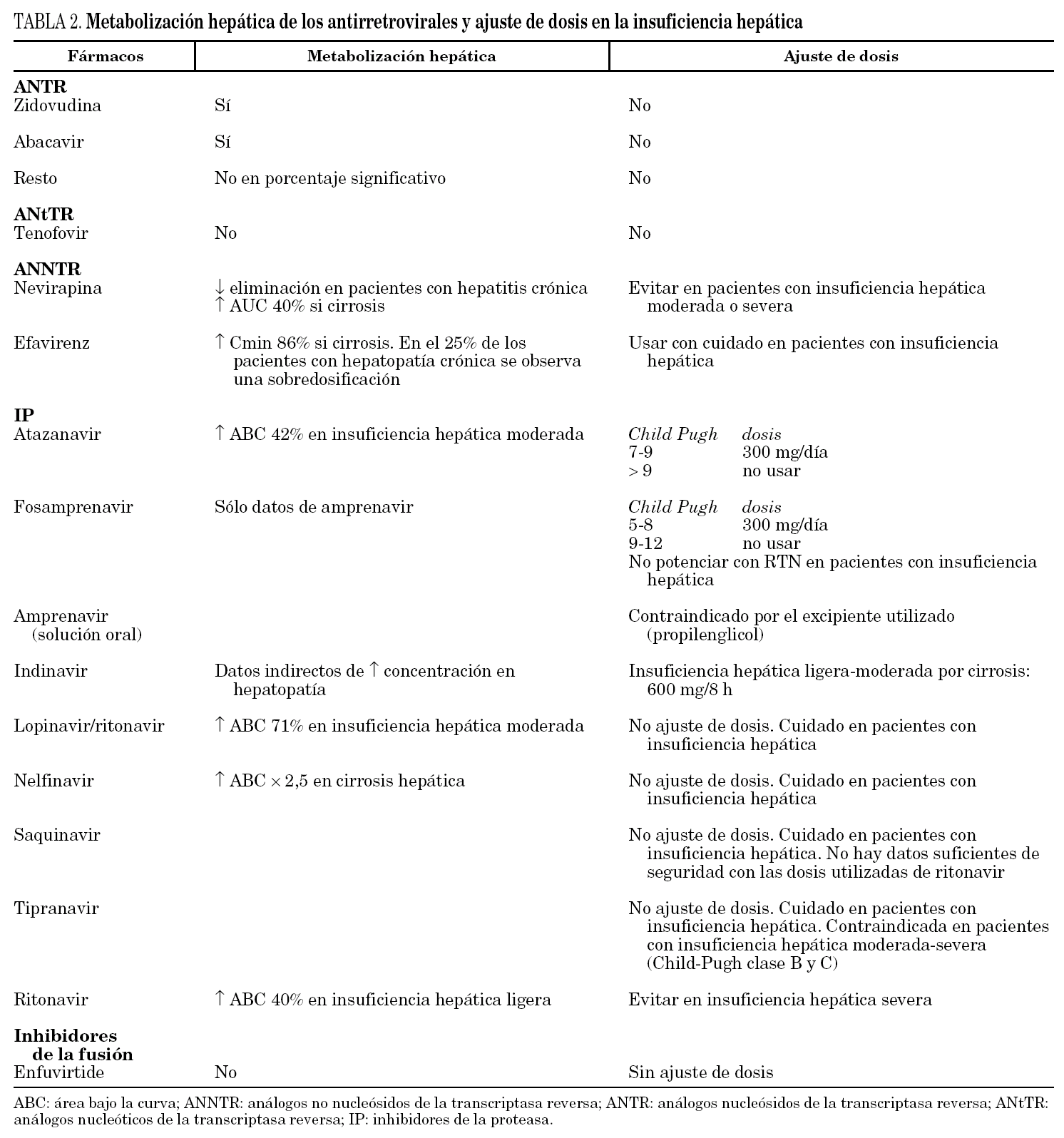
Por último señalar que ya en las últimas guías de TAR 10 se incluye la necesidad de ajustar la dosis de los distintos fármacos antirretrovirales en caso de insuficiencia hepática (tabla 2) y que ya se dispone de una experiencia importante en el campo del trasplante hepático, con resultados similares a los de población no coinfectada 45. Los criterios de trasplante aparecen en la tabla 3.
Alteraciones metabólicas y morfológicas
La importancia de la lipodistrofia radica sobre todo en los problemas a largo plazo que produce: estigmatización, cuadros depresivos, suspensión de tratamiento, retraso en el inicio o incluso rechazo de éste por este motivo; de ahí la importancia de conocer mejor su etiopatogenia, el papel de los fármacos y buscar las mejores combinaciones para retrasar su aparición o evitarla si es posible, todo ello sin comprometer el control virológico e inmunológico de la infección 46.
Las alteraciones metabólicas dan lugar a una situación de riesgo cardiovascular elevado y a un incremento del número de episodios cardiovasculares y cerebrovasculares, que hay que prevenir.
Estos problemas, que aparecen desde el año 1997 en los países desarrollados, están empezando a aparecer en el Tercer Mundo, donde se dispone de fármacos limitados y que en múltiples ocasiones se administran en forma de combinaciones fijas 47.
En cuanto a las alteraciones metabólicas tras la introducción del TARGA, se observa un perfil lipídico claramente aterogénico (elevación de triglicéridos y colesterol total a expensas sobre todo del colesterol unido a lipoproteínas de baja densidad y descenso de colesterol unido a lipoproteínas de alta densidad); alteraciones del metabolismo hidrocarbonado, tanto diabetes mellitus como intolerancia hidrocarbonada, con una base común de resistencia a la insulina. Estas alteraciones tienden a concentrarse en los mismos pacientes, que suelen presentar además redistribución de grasa corporal, a la que en múltiples ocasiones preceden. Esta tendencia se observó ya en las primeras cohortes estudiadas, sobre todo en los pacientes que tomaban IP y que presentaban acumulación de grasa abdominal 46,48-56.
En general, la redistribución grasa puede consistir en una pérdida de grasa periférica (miembros superiores, inferiores, nalgas y/o de bola adiposa de Bichat); acumulación de grasa en una o varias localizaciones o una lipomatosis múltiple, y lo más habitual, una combinación de pérdida y acumulación de grasa. Su etiopatogenia es muy compleja, en ella intervienen todos los grupos farmacológicos, mediante procesos que se superponen en múltiples ocasiones.
Inicialmente se responsabilizó a los antirretrovirales y sobre todo a los IP de todas las alteraciones metabólicas, pero pronto se encontraron otras causas 50-53. Así, datos de la cohorte MACS 49 ponen de manifiesto que el perfil lipídico de los pacientes no sólo varía con el TAR, sino que se observan cambios cuando se analizan muestras antes y después de estar infectados. Además, no todos los fármacos tienen el mismo perfil metabólico. De entre los IP el más benigno es el atazanavir y el de peor perfil el ritonavir a dosis plenas 51. Los ANNTR presentan un mejor perfil metabólico, sobre todo la nevirapina, como queda demostrado en el estudio 2NN 53. Los ANTR también tienen un papel importante, como se ha puesto de manifiesto en el estudio 903 54 y en el 934 55, en los que se observa que los pacientes que toman análogos timidínicos, sobre todo la d4T, presentan un peor perfil lipídico que los que toman tenofovir. Estos fármacos también están directamente implicados en la pérdida periférica de grasa.
En cuanto a otros factores de riesgo cardiovascular (FRCV), se ha observado una prevalencia mayor de diabetes mellitus en todas las franjas etarias de pacientes con infección por el VIH en comparación con la población no infectada, así como un incremento tanto de la incidencia como de la prevalencia, sobre todo en los pacientes con TARGA 56.
La hipertensión arterial (HTA) es otro aspecto menos estudiado que está adquiriendo cada vez mayor importancia. Recientemente se ha publicado un trabajo realizado en pacientes sin tratamiento previo a los que se controla durante un año, en el que se observa una prevalencia elevada de HTA a las 48 semanas. En el análisis multivariable, los factores predictores de desarrollo de HTA sistólica son la edad, el perfil lipídico y el estado inmunológico. El trabajo concluye que es fundamental la determinación periódica de la presión arterial, para detectar elevaciones de ésta de forma temprana 57.
Entre los factores modificables, el tabaquismo, muy extendido entre los pacientes seropositivos, es un factor de primer orden en la evaluación del riesgo vascular.
Si queremos conocer la prevalencia de los distintos FRCV en los pacientes con VIH, destacan como ejemplo los datos de la cohorte D:A:D. El factor de riesgo más frecuente es el hábito tabáquico, seguido de la hipercolesterolemia y la hipertrigliceridemia 58, datos distintos de lo que se observa en la población general. Además, en el seguimiento de esta cohorte se ha observado un incremento en la incidencia de infartos agudos de miocardio (IAM) con el tiempo de exposición a antirretrovirales 59. En cambio, hay datos contradictorios procedentes de otras cohortes. Como ejemplo destaca la cohorte HOPS 60 en la que se ha observado un descenso de la incidencia de casos de IAM desde el año 2002 y se han identificado como factores de riesgo a los clásicos: edad > 40 años, diabetes mellitus, HTA y dislipidemia. La disparidad de resultados depende de las características de las cohortes estudiadas, de la eficacia de la intervención para la prevención primaria, y de la forma de analizar y recoger los datos, entre otros factores.
Así pues, en un paciente con infección por el VIH se debe realizar inicialmente una estimación del riesgo cardiovascular utilizando la ecuación de Framingham o el SCORE, y según los resultados obtenidos intervenir, ya sea recomendando únicamente medidas higiénico-dietéticas, pautando además fármacos hipolipidemiantes (estatinas y/o fibratos), o modificando el TAR en función de la alteración metabólica observada 61. Existen datos de la seguridad de esta estrategia, como los del estudio Recover o la extensión del estudio 903 62 en su fase abierta, los del estudio SWAN 63 de sustitución de un IP por atazanavir, o los de distintos estudios 64 en los que se pautan regímenes de tratamiento sin ANTR o se utiliza sólo un IP, sobre todo en casos de lipoatrofia.
En general, el tratamiento de las dislipidemias con fármacos hipolipidemiantes sigue las mismas pautas que en la población no infectada, aunque con limitaciones por las interacciones farmacológicas observadas con los antirretrovirales 61,65. Como algo llamativo destacan los resultados de un estudio recientemente publicado en el que se observa una mejoría no sólo del perfil lipídico, sino también de la lipoatrofia en pacientes a los que se administra pravastatina 66. Un campo a explorar es el potencial papel de la uridina como tratamiento de la lipoatrofia 67.
En general se puede concluir que tanto la lipodistrofia como las alteraciones metabólicas y el riesgo cardiovascular son un problema importante, y que es fundamental valorar correctamente a los pacientes, para definir la situación de riesgo cardiovascular en la que se encuentran y así elegir la mejor pauta de TARGA y las intervenciones farmacológicas más adecuadas para así prevenir la aparición de episodios cardiovasculares.
Insuficiencia renal
Con la generalización del TARGA se ha observado un descenso del número de casos de insuficiencia renal secundaria a infecciones y a su tratamiento.
La prevalencia de personas que viven con el VIH en situación de riesgo de desarrollar enfermedad renal terminal (ERT) es cada vez mayor. En estos momentos hay un número creciente de pacientes infectados con insuficiencia renal, en parte por la mejoría en la supervivencia de los pacientes con ERT, incluso en programa de diálisis, y sobre todo por el mejor conocimiento de los fármacos antirretrovirales y su utilización. La mortalidad ha descendido de un 50% en el primer año en la era pre-TARGA a un 30% en la era TARGA. Los factores que influyen en la mayor supervivencia son el incremento de la cifra de CD4 y de hemoglobina, el descenso de los valores de creatinina sérica y de proteinuria y el tratamiento con corticoides. En los pacientes en programa de diálisis se relaciona con el incremento de la cifra de CD4 y con el descenso de las cifras de presión arterial 68,69.
Recientemente se han publicado datos de la cohorte española de los 4.962 pacientes en diálisis durante el año 2004 70. La prevalencia de infección por el VIH era del 1,15% (intervalo de confianza del 95%, 0,85-1,45). En el 58% de los pacientes la vía de contagio había sido la ADVP. Las causas más frecuentes de ERT eran las glomerulonefritis (44%). El tiempo medio en diálisis era de 46 meses. Un 60% estaba coinfectado por el VHC. Un 86% estaba tomando TARGA, el 68% presentaba carga viral indetectable y la mediana de CD4 era de 333 células/μl. De los 40 pacientes que completaron un cuestionario clínico, 9 (22,5%) cumplían criterios de trasplante renal.
La primera enfermedad renal relacionada con el VIH fue la nefropatía-VIH (HIVAN), descrita a principios de los años ochenta del siglo pasado y la causa del 60-67% de los casos de insuficiencia renal según los distintos estudios. El restante 33-40% se debe a glomerulonefritis membranoproliferativa, glomerulonefritis, enfermedad de cambios mínimos, glomerulopatía membranosa, amiloidosis, glomerulonefritis por inmunocomplejos, crioglobulinemia o nefropatía IgA 68,71,72.
En los últimos años estamos 69,71,73-75 asistiendo a la emergencia de nuevas enfermedades renales relacionadas con un mejor control de la infección por el VIH y con la potencial nefrotoxicidad del TAR, sobre todo relacionada con tenofovir 73-75 e indinavir.
Se ha observado algún tipo de alteración renal en hasta un 30% de los pacientes. Por otra parte, las enfermedades renales relacionadas con el sida son una causa frecuente de ERT que requiere diálisis y la misma enfermedad renal puede favorecer la evolución a sida y aumentar la mortalidad 70.
Según el perfil temporal se clasifica en insuficiencia renal aguda y crónica (IRC) 69.
La insuficiencia renal aguda se define como un descenso brusco del filtrado glomerular que se produce durante días o semanas. Su etiología y evolución son similares a las de los pacientes no infectados. Se ha descrito hasta en un 20% de los pacientes con sida. Su pronóstico no depende de la situación virológica e inmunológica, sino de la resolución de su causa.
La IRC se define como un deterioro progresivo, prolongado (≥3 meses) e irreversible de la función renal. Su gravedad depende del grado de deterioro de la función renal, estimado en función del aclaramiento de creatinina (ecuación de Cockcroft-Gault) o de la tasa de filtrado glomerular (ecuación MDRD o de modificación de la dieta en la enfermedad renal).
La prevalencia de IRC varía según las series estudiadas y los criterios de diagnóstico. Disponemos de datos anteriores y posteriores a la introducción de TARGA en los que se observa proteinuria hasta en un tercio de los pacientes. En un estudio de autopsias de pacientes con infección por el VIH y muchos de ellos con sida, se describe que un 18% de los pacientes presenta proteinuria y un 43%, enfermedad renal 68,71.
Los factores de riesgo de presentar IRC en los pacientes con VIH descritos en distintos estudios son: cifras de CD4 bajas, cargas virales elevadas, coinfección por el VHC y raza negra 72.
El diagnóstico etiológico no es posible en ocasiones porque es el proceso final de distintas enfermedades. La realización de biopsia renal para el diagnóstico etiológico sigue siendo un tema importante de discusión.
La importancia actual del tema es tal que recientemente se han publicado las primeras guías de tratamiento de los pacientes con infección por el VIH e IRC, elaboradas por la HIV Medicine Association of the Infectious Diseases Society of America (IDSA) 71.
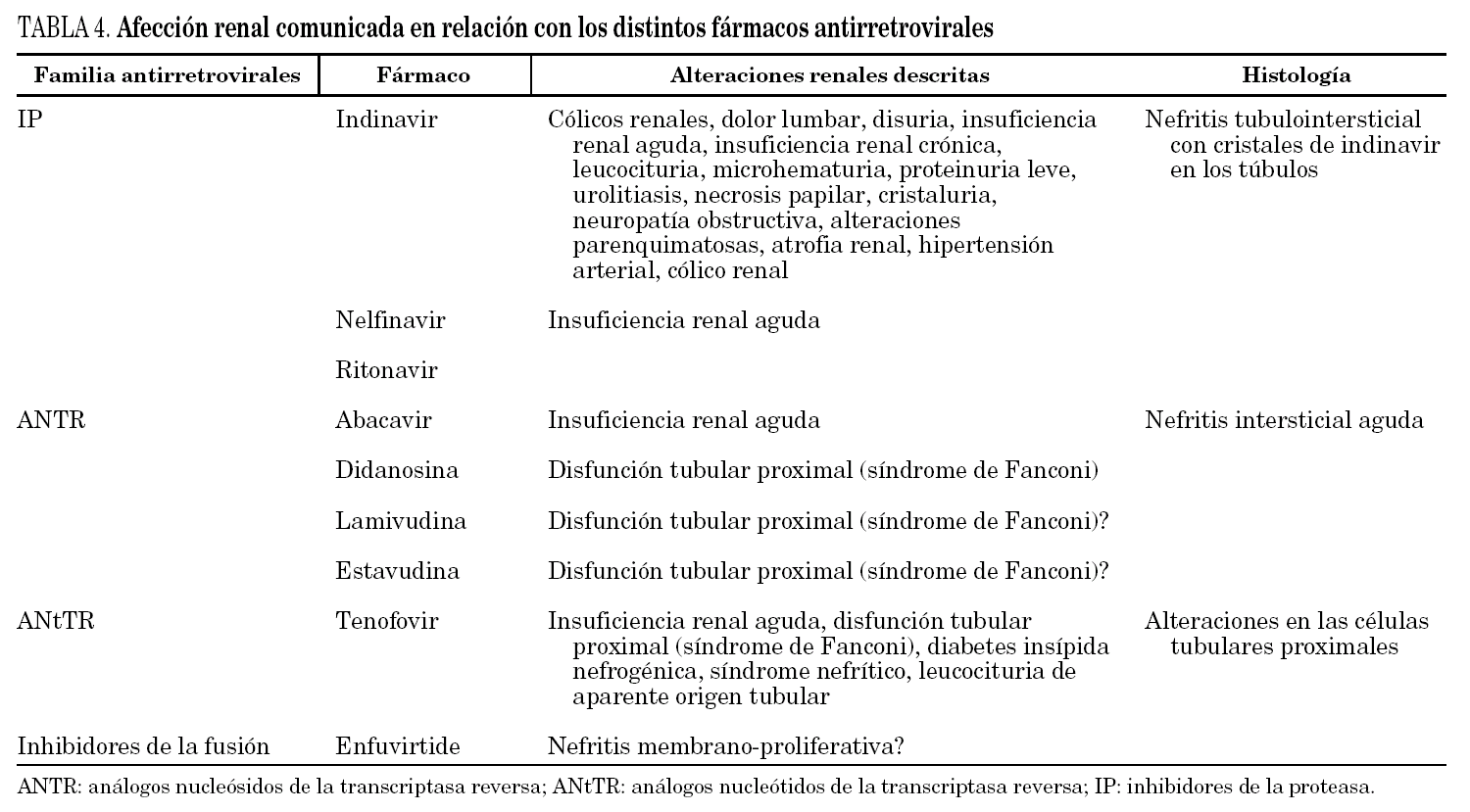
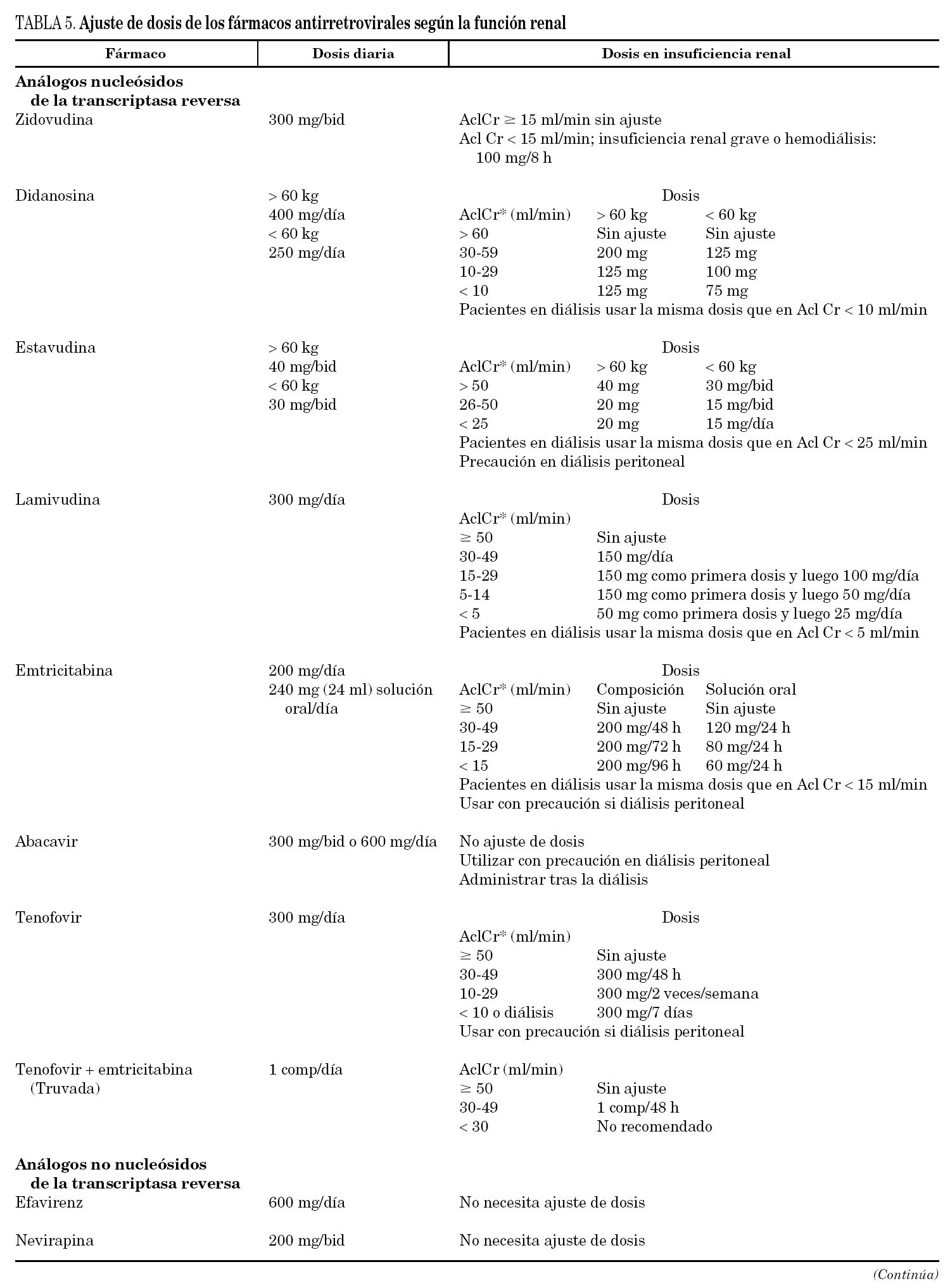
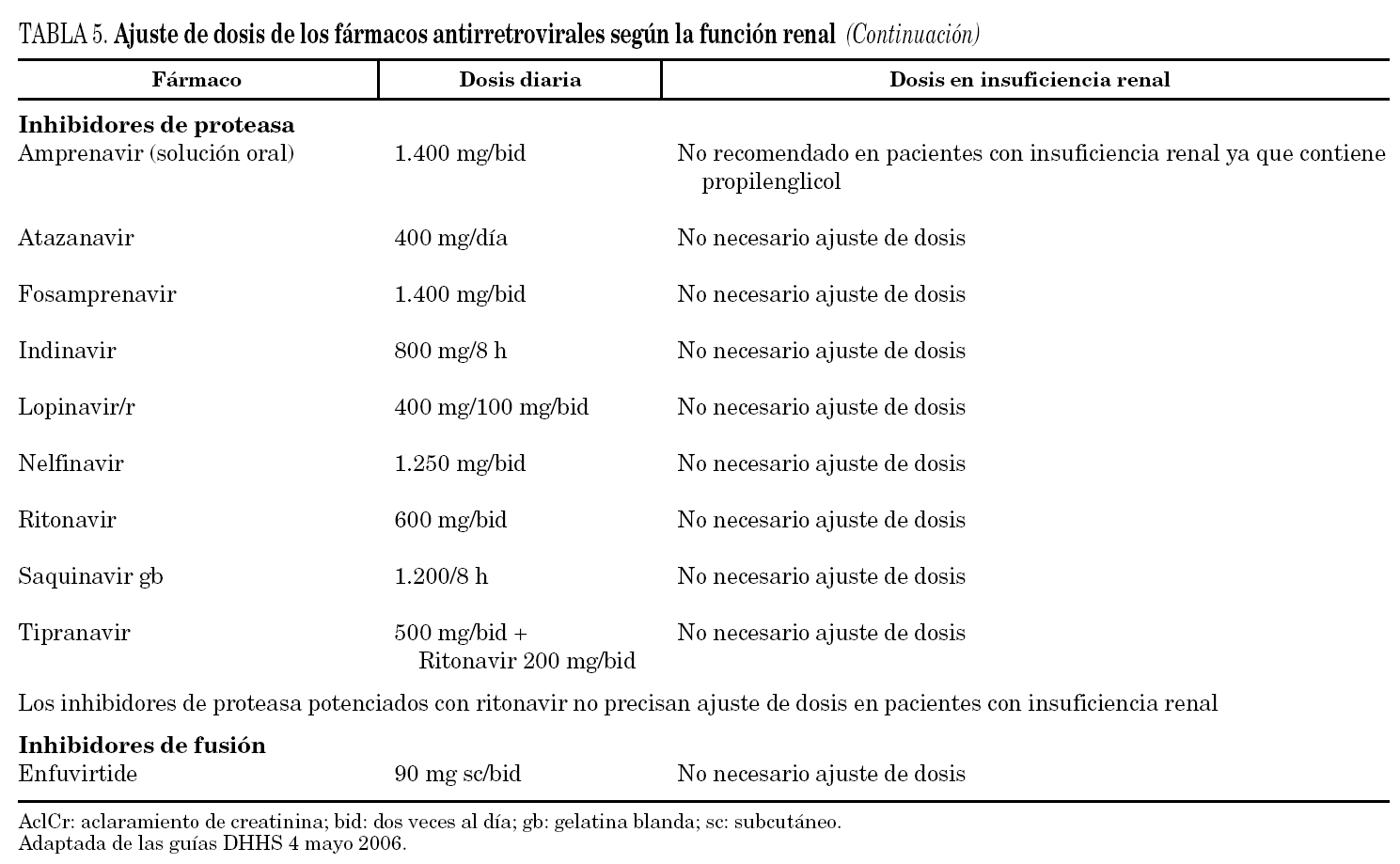
El TAR ha mejorado el pronóstico de la enfermedad renal y no renal relacionada con la infección por el VIH. La supervivencia de los pacientes ha mejorado, el TARGA se administra de por vida y los pacientes están más expuestos a desarrollar enfermedad renal, por lo que se hace necesario conocer mejor los fármacos antirretrovirales, tanto sus efectos adversos propiamente renales 69 (tabla 4) como los ajustes de dosis necesarios en caso de insuficiencia renal (tabla 5) y las interacciones con otros fármacos no antirretrovirales que también pueden ser nefrotóxicos o potenciar la nefrotoxicidad 10,71.
En la actualidad se dispone de datos más que suficientes para apoyar la realización de trasplantes renales en pacientes con enfermedad renal terminal. Ya hay datos de cohortes pequeñas de pacientes, en los que parece que la supervivencia y la eficacia del trasplante son similares a las observadas en pacientes no infectados por el VIH 45. Están en marcha distintos ensayos clínicos en los que se trata de conocer mejor la eficacia a largo plazo del trasplante y los problemas que aparecen.
Otros aspectos importantes
Con la introducción del TARGA y la mayor supervivencia de los pacientes se ha observado un incremento en la incidencia de las neoplasias definitorias de sida y no. Esta incidencia es claramente superior a la observada en población general 76,77.
Las neoplasias que se siguen observando con más frecuencia son los linfomas no hodgkinianos, los sarcomas de Kaposi y los de cérvix y canal anal, sobre todo en los pacientes muy inmunodeprimidos y expuestos a virus oncogénicos.
En este caso, un problema importante son las interacciones medicamentosas y otro, las toxicidades que producen la quimioterapia y el TARGA, que se pueden sumar, potenciar o solapar.
En general se recomienda mantener el TAR en los pacientes que se encontraban estables y con buen control inmunovirológico, excepto en el caso en que los citostáticos vayan a producir la misma toxicidad que los antirretrovirales pautados o aparezcan interacciones farmacológicas, vigilando estrechamente la aparición de efectos secundarios 9,10.
Si el paciente no tomaba tratamiento, elegir el TARGA más adecuado e iniciarlo después del primer ciclo.
Es básico tener siempre en cuenta la profilaxis para las infecciones oportunistas, dada la frecuente aparición de neutropenias y linfopenias y la inmunodepresión prolongada asociada al uso de nuevos esquemas de tratamiento, como algunos anticuerpos monoclonales.
Otro aspecto fundamental es la elevada prevalencia de alteraciones del sistema nervioso central observada en los pacientes con infección por el VIH. Aunque el TARGA ha disminuido de forma significativa la incidencia del complejo demencia-sida, también es la causa de efectos secundarios neurológicos y neuropsiquiátricos a veces difíciles de valorar, como sucede con el uso de efavirenz. A esto hay que añadir la elevada prevalencia tanto de consumo de drogas como de alteraciones psiquiátricas en la población infectada, que conlleva múltiples interacciones medicamentosas, problemas de adherencia y, en ocasiones, una nula conciencia de enfermedad 9,10,78,79. Todos estos aspectos hacen difícil el tratamiento de estos pacientes.
Por último, hay que recordar que la población infectada está cambiando. La vía de contagio más frecuente es la sexual y, sobre todo, la heterosexual, lo que determina que el número de mujeres infectadas vaya creciendo de forma progresiva. La mayoría de ensayos clínicos se realiza en varones. Las dosis de fármaco, la eficacia y la seguridad se han estudiado en varones y se han extrapolado a mujeres. La composición corporal y el metabolismo de las mujeres son distintos a los de los varones. En distintos trabajos se ha puesto de manifiesto que las mujeres desarrollan lipodistrofia y presentan más efectos adversos medicamentosos que los varones 80,81.
En los últimos años se han puesto en marcha distintas cohortes formadas por mujeres para caracterizar mejor la evolución y los problemas de la infección por el VIH y su tratamiento en mujeres.
También se está observando un mayor número de personas mayores 82, cuyo diagnóstico habitualmente es tardío, en fases avanzadas de la enfermedad, y la vía de contagio sexual. La mayoría son pacientes pluripatológicos y polimedicados de difícil tratamiento, sobre los que existen pocos datos, y que hay que estudiar mejor. Debemos mantenernos atentos a las formas de presentación en estos pacientes de enfermedades frecuentes asociadas con el envejecimiento en la población general, como la enfermedad degenerativa ósea o las alteraciones sensoriales, y a aspectos como la farmacocinética en esta población, que pueden suponer nuevos retos terapéuticos.
Conclusión
Como conclusión, podemos decir que cada vez se hace más difícil tratar a los pacientes con infección por el VIH. Disponemos de un gran número de fármacos para elegir, pero su combinación a veces es difícil por los problemas y enfermedades de base que presentan los pacientes. Por este motivo, hay que valorar al paciente de forma global para elegir el mejor tratamiento. La palabra clave es individualizar.
Correspondencia: Dra. M.J. Galindo Puerto.
Hospital Clínico Universitario.
Avda. Blasco Ibáñez, 17. 46010 Valencia. España.
Correo electrónico: med001021@saludalia.com