El sellado antibiótico de catéteres (SAC) se ha relacionado con una reducción de la necesidad de retirar el catéter en infecciones relacionadas con éstos. La estabilidad de las soluciones antimicrobianas utilizadas en el SAC no se ha estudiado suficientemente.
Se realizó una revisión sistemática de la literatura médica para identificar los artículos en inglés que incluían estudios de estabilidad de estas soluciones. Nueve estudios cumplieron los criterios de inclusión al aplicar técnicas específicas de determinación de sustancias sin alteración aparente del fármaco. Los modelos incluyeron principalmente Staphylococcus spp., Pseudomonas aeruginosa y Klebsiella pneumoniae. Se analizaron cefazolina, ceftazidima, ciprofloxacino, colistina, gentamicina, ticarcilina/ácido clavulánico y vancomicina solos o en combinación con otros antibióticos y en soluciones con o sin heparina. Todas las soluciones fueron estables, excepto ciprofloxacino a concentraciones de 10mg/ml.
Finalmente, pocos estudios aplican criterios estrictos para valorar la estabilidad de las soluciones utilizadas en el SAC. Por esto, parece aconsejable realizar estudios estrictos de estabilidad en futuras investigaciones de soluciones antimicrobianas para su empleo en el SAC.
Antibiotic-lock therapy (ALT) has been related to a reduction in the need for catheter withdrawal in patients with catheter-related infection. The stability of the antimicrobial solutions used in ALT has not been sufficiently investigated. A systematic literature review was performed to identify articles including studies on the stability of ALT solutions. Nine studies fulfilled the inclusion criteria requiring specific drug determination techniques, and no apparent drug alterations were observed. The main microorganisms studied were Staphylococcus spp., Pseudomonas aeruginosa, and Klebsiella pneumoniae. The antibiotics included cefazolin, ceftazidime, ciprofloxacin, colistin, gentamicin, ticarcillin/clavulanate, and vancomycin in solution, administered alone or in combinations, with or without heparin. All solutions were fairly stable except for ciprofloxacin at a concentration of 10mg/mL. Few studies applied strict criteria to assess the stability of antibiotic solutions used in ALT; hence, the currently available data are limited. Therefore, it seems advisable to include appropriate stability studies in further research on the use of ALT.
Los catéteres venosos centrales (CVC) son la principal fuente de bacteriemias nosocomiales1. Estas infecciones se relacionan con una elevada morbimortalidad en pacientes hospitalizados2. En 2004, el Centers for Diseases Control and Prevention estimó que 5,3 bacteriemias cada 1.000 catéteres por día en unidad de cuidados invasivos estaban relacionadas con la infección de CVC3. Los CVC se han relacionado con una mortalidad superior al 25% y un incremento de 6,5 días de estancia hospitalaria4. Se han propuesto varias alternativas para la prevención de las infecciones relacionadas con los catéteres. Una de esas técnicas, ahora en auge, es el sellado antibiótico de catéteres (SAC) que Messing et al5 describieron originariamente. La técnica consiste en dejar una elevada concentración de solución antimicrobiana en la luz del catéter. La solución debe permanecer allí un tiempo no suficientemente bien establecido (normalmente de 6 a 12h o durante más tiempo en caso de pacientes dializados). Durante este tiempo, el acceso intravascular no se debe utilizar; finalmente, la solución debe eliminarse. Se trata de una técnica preventiva de las infecciones relacionadas con catéter que evita la necesidad de su sustitución y a la que se le han atribuido otras ventajas teóricas6,7. En general, el SAC se ha relacionado con buenos resultados clínicos, aunque también se han observado algunos fracasos al aplicar esta técnica. Esos fallos pueden relacionarse con la estabilidad de las soluciones antimicrobianas utilizadas, la dificultad de algunos antibióticos para penetrar en las biocapas o la necesidad de alcanzar concentraciones suficientemente elevadas de antibiótico en la luz del catéter debido a la diferencia de la concentración mínima inhibitoria (CMI) y de la concentración mínima bactericida (CMB) entre células planctónicas y el biofilm, entre otras. La estabilidad de las soluciones antimicrobianas utilizadas es un factor que no se ha estudiado suficientemente en muchos de los trabajos, por lo que su influencia es actualmente desconocida. Se considera estable una solución ante la ausencia de precipitados, partículas, gas, cambios de color o cambios de viscosidad u otras alteraciones aparentes durante un período de tiempo, así como ante la ausencia de alteración en la estructura química original del fármaco, que mantiene en todo momento una concentración superior o igual al 90% del valor inicial8,9. El objetivo de este estudio es establecer criterios estrictos de estabilidad a fin de optimizar la técnica del SAC mediante una revisión de la literatura médica publicada hasta la fecha.
Material y métodoSe realizó una revisión sistemática en PUBMED, MEDLINE e IDIS-Iowa para identificar los trabajos en inglés que estudiaron la estabilidad de las soluciones utilizadas en el SAC. Las palabras clave utilizadas en la búsqueda fueron antibiotic-lock, bacteriemia, bloodstream infection, catheter associated infection, prevention y stability. Se analizaron las citas encontradas inicialmente para su posterior inclusión en esta revisión. La búsqueda abarcó el período de 1966 a 2008 y se realizó la última búsqueda el 5 de junio de 2008. Los estudios seleccionados fueron aquellos que evaluaron la estabilidad de las soluciones utilizadas en la prevención y en el tratamiento de la infección relacionada con los catéteres tanto in vivo como in vitro. Para su análisis, los estudios se clasificaron en soluciones de uno o de varios antibióticos y, a su vez, se subclasificaron en soluciones heparinizadas y en soluciones no heparinizadas.
Cuando los artículos publicaron resultados de estabilidad, se consideraron aceptables si describían la aplicación de técnicas específicas de determinación de sustancias, como la cromatografía líquida de alta resolución, o las técnicas de inmunoanálisis, como el radioinmunoanálisis, el inmunoanálisis de polarización por fluorescencia, el inmunoanálisis enzimático multiplicado o el ensayo inmunoabsorbente ligado a enzimas. Se exclureron todos los trabajos que no evaluaron directamente la estabilidad de las soluciones mediante técnicas específicas.
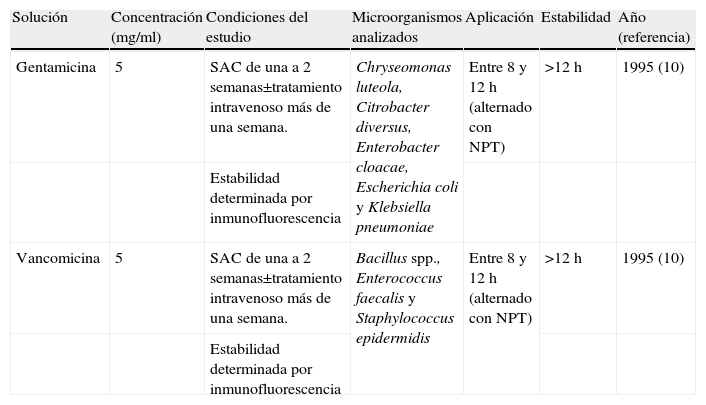
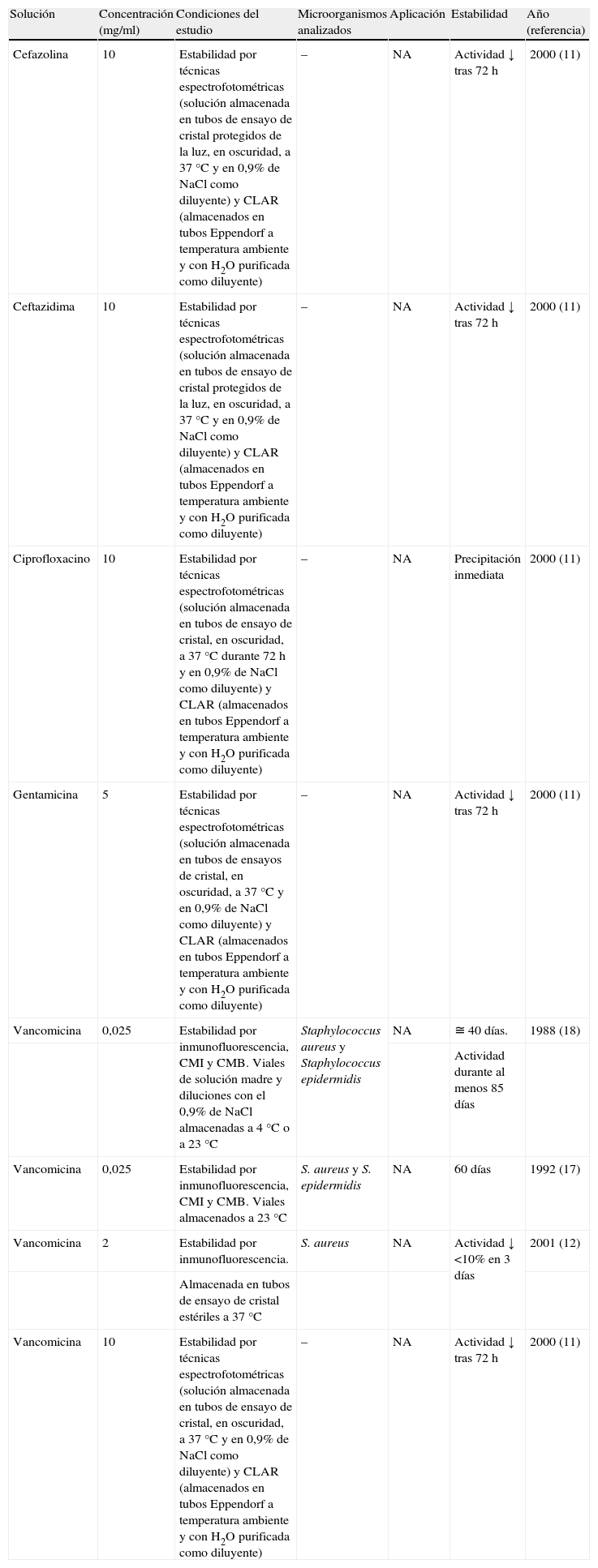
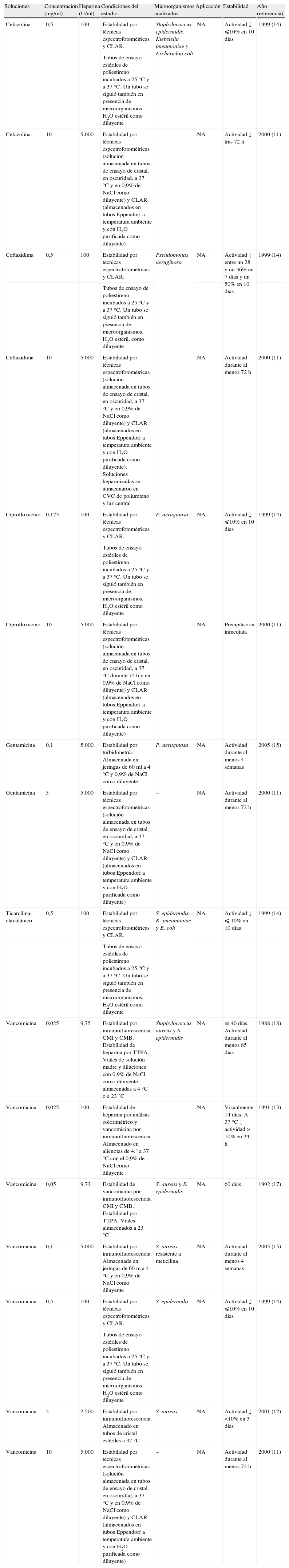
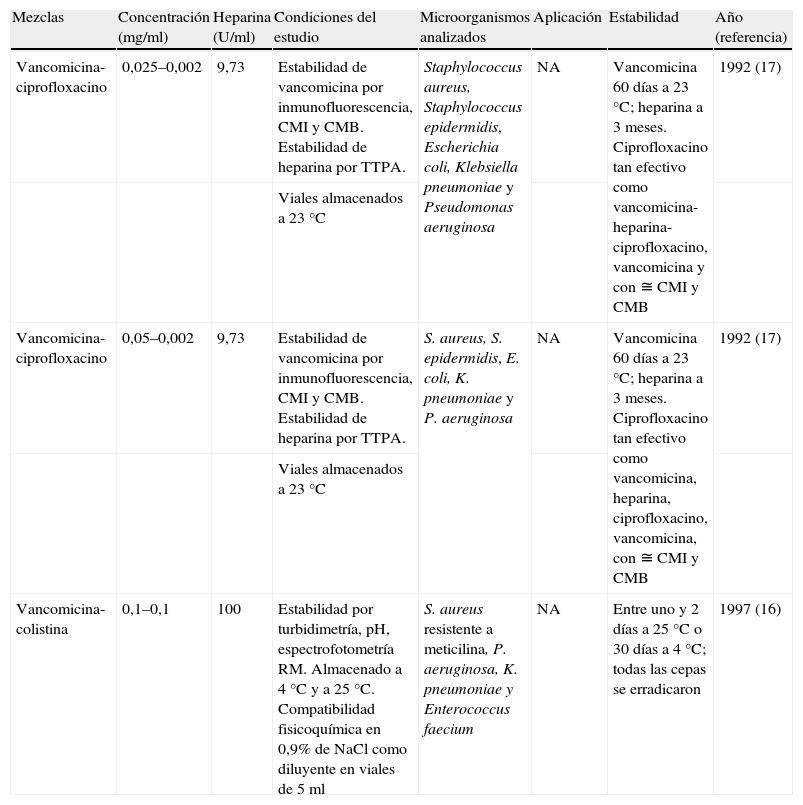
ResultadosInicialmente, se seleccionaron 78 artículos relacionados con el SAC, de los que finalmente se revisaron 9 artículos (11,5%) atendiendo a los criterios de selección. De los 69 artículos descartados, 55 no evaluaron directamente la estabilidad de las soluciones utilizadas en el SAC. Los 14 artículos restantes describían técnicas no consideradas aceptables para determinar de forma exacta la estabilidad, principalmente la mera observación visual de las soluciones utilizadas. De los 9 artículos analizados10–18, 710,12,14–18 evaluaron la efectividad en microorganismos grampositivos, 510,14–17 evaluaron la efectividad en microorganismos gramnegativos y sólo un estudio10 evaluó la efectividad en hongos. Los principales microorganismos estudiados fueron Staphylococcus spp. (7 de los 9 artículos revisados) seguidos por Pseudomonas aeruginosa (4 de los 9 artículos revisados) y Klebsiella pneumoniae (4 de los 9 artículos revisados). Sólo un artículo evaluó la estabilidad de las soluciones utilizadas en el SAC en condiciones clínicas (tabla 1)10. Este estudio se realizó en pacientes que recibieron nutrición parenteral total. Se usó vancomicina y gentamicina en el SAC de 7 a 14 días para el tratamiento de diferentes microorganismos grampositivos y gramnegativos. Las soluciones utilizadas en el SAC fueron estables al menos 12h, pero la estabilidad no se estudió durante más tiempo. Los 8 artículos restantes fueron estudios in vitro. Sus resultados se incluyen en la tabla 2 (soluciones no heparinizadas de un antibiótico), tabla 3 (soluciones heparinizadas de un antibiótico) y tabla 4 (soluciones heparinizadas de varios antibióticos). Las soluciones más estudiadas fueron aquellas que contenían vancomicina (5 trabajos) y ciprofloxacino (4 trabajos). La estabilidad de las soluciones en el SAC fue estudiada por técnicas específicas y no específicas12–14,17,18. En otros 4 estudios se utilizaron únicamente técnicas específicas10,11,15,16. La principal técnica no específica utilizada fue la CMI y la CMB para los diferentes microorganismos12,14,17,18. La técnica específica más utilizada fue el inmunoanálisis10–13,15–18.
Estudios clínicos de estabilidad de soluciones de un antibiótico utilizadas en el sellado antibiótico de catéteres
| Solución | Concentración (mg/ml) | Condiciones del estudio | Microorganismos analizados | Aplicación | Estabilidad | Año (referencia) |
| Gentamicina | 5 | SAC de una a 2 semanas±tratamiento intravenoso más de una semana. | Chryseomonas luteola, Citrobacter diversus, Enterobacter cloacae, Escherichia coli y Klebsiella pneumoniae | Entre 8 y 12h (alternado con NPT) | >12h | 1995 (10) |
| Estabilidad determinada por inmunofluorescencia | ||||||
| Vancomicina | 5 | SAC de una a 2 semanas±tratamiento intravenoso más de una semana. | Bacillus spp., Enterococcus faecalis y Staphylococcus epidermidis | Entre 8 y 12h (alternado con NPT) | >12h | 1995 (10) |
| Estabilidad determinada por inmunofluorescencia |
NPT: nutrición parenteral total; SAC: sellado antibiótico de catéteres.
Estudios in vitro de estabilidad de soluciones de un antibiótico utilizadas en el sellado antibiótico de catéteres
| Solución | Concentración (mg/ml) | Condiciones del estudio | Microorganismos analizados | Aplicación | Estabilidad | Año (referencia) |
| Cefazolina | 10 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayo de cristal protegidos de la luz, en oscuridad, a 37°C y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente) | – | NA | Actividad ↓ tras 72h | 2000 (11) |
| Ceftazidima | 10 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayo de cristal protegidos de la luz, en oscuridad, a 37°C y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente) | – | NA | Actividad ↓ tras 72h | 2000 (11) |
| Ciprofloxacino | 10 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayo de cristal, en oscuridad, a 37°C durante 72h y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente) | – | NA | Precipitación inmediata | 2000 (11) |
| Gentamicina | 5 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayos de cristal, en oscuridad, a 37°C y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente) | – | NA | Actividad ↓ tras 72h | 2000 (11) |
| Vancomicina | 0,025 | Estabilidad por inmunofluorescencia, CMI y CMB. Viales de solución madre y diluciones con el 0,9% de NaCl almacenadas a 4°C o a 23°C | Staphylococcus aureus y Staphylococcus epidermidis | NA | ≅ 40 días. | 1988 (18) |
| Actividad durante al menos 85 días | ||||||
| Vancomicina | 0,025 | Estabilidad por inmunofluorescencia, CMI y CMB. Viales almacenados a 23°C | S. aureus y S. epidermidis | NA | 60 días | 1992 (17) |
| Vancomicina | 2 | Estabilidad por inmunofluorescencia. | S. aureus | NA | Actividad ↓ <10% en 3 días | 2001 (12) |
| Almacenada en tubos de ensayo de cristal estériles a 37°C | ||||||
| Vancomicina | 10 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayo de cristal, en oscuridad, a 37°C y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente) | – | NA | Actividad ↓ tras 72h | 2000 (11) |
↓: disminuye; CLAR: cromatografía líquida de alta resolución; CMB: concentración mínima bactericida; CMI: concentración mínima inhibitoria; H2O: agua; NA: no aplicable por no usar un modelo real de infección de catéteres; NaCl: cloruro sódico.
Estudios in vitro de estabilidad de soluciones heparinizadas de un antibiótico utilizadas en el sellado antibiótico de catéteres
| Soluciones | Concentración (mg/ml) | Heparina (U/ml) | Condiciones del estudio | Microorganismos analizados | Aplicación | Estabilidad | Año (referencia) |
| Cefazolina | 0,5 | 100 | Estabilidad por técnicas espectrofotométricas y CLAR. | Staphylococcus epidermidis, Klebsiella pneumoniae y Escherichia coli | NA | Actividad ↓ ⩽10% en 10 días | 1999 (14) |
| Tubos de ensayo estériles de poliestireno incubados a 25°C y a 37°C. Un tubo se siguió también en presencia de microorganismos. H2O estéril como diluyente | |||||||
| Cefazolina | 10 | 5.000 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayo de cristal, en oscuridad, a 37°C y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente) | – | NA | Actividad ↓ tras 72h | 2000 (11) |
| Ceftazidima | 0,5 | 100 | Estabilidad por técnicas espectrofotométricas y CLAR. | Pseudomonas aeruginosa | NA | Actividad ↓ entre un 28 y un 36% en 7 días y un 50% en 10 días | 1999 (14) |
| Tubos de ensayo de poliestireno incubados a 25°C y a 37°C. Un tubo se siguió también en presencia de microorganismos. H2O estéril, como diluyente | |||||||
| Ceftazidima | 10 | 5.000 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayo de cristal, en oscuridad, a 37°C y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente). Soluciones heparinizadas se almacenaron en CVC de poliuretano y luz central | – | NA | Actividad durante al menos 72h | 2000 (11) |
| Ciprofloxacino | 0,125 | 100 | Estabilidad por técnicas espectrofotométricas y CLAR. | P. aeruginosa | NA | Actividad ↓ ⩽10% en 10 días | 1999 (14) |
| Tubos de ensayo estériles de poliestireno incubados a 25°C y a 37°C. Un tubo se siguió también en presencia de microorganismos. H2O estéril como diluyente | |||||||
| Ciprofloxacino | 10 | 5.000 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayo de cristal, en oscuridad, a 37°C durante 72h y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente) | – | NA | Precipitación inmediata | 2000 (11) |
| Gentamicina | 0,1 | 5.000 | Estabilidad por turbidimetría. Almacenada en jeringas de 60ml a 4°C y 0,9% de NaCl como diluyente | P. aeruginosa | NA | Actividad durante al menos 4 semanas | 2005 (15) |
| Gentamicina | 5 | 5.000 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayo de cristal, en oscuridad, a 37°C y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente) | – | NA | Actividad durante al menos 72h | 2000 (11) |
| Ticarcilina-clavulánico | 0,5 | 100 | Estabilidad por técnicas espectrofotométricas y CLAR. | S. epidermidis, K. pneumoniae y E. coli | NA | Actividad ↓ ⩽ 10% en 10 días | 1999 (14) |
| Tubos de ensayo estériles de poliestireno incubados a 25°C y a 37°C. Un tubo se siguió también en presencia de microorganismos. H2O estéril como diluyente | |||||||
| Vancomicina | 0,025 | 9,75 | Estabilidad por inmunofluorescencia, CMI y CMB. Estabilidad de heparina por TTPA. Viales de solución madre y diluciones con 0,9% de NaCl como diluyente, almacenadas a 4°C o a 23°C | Staphylococcus aureus y S. epidermidis | NA | ≅ 40 días. Actividad durante al menos 85 días | 1988 (18) |
| Vancomicina | 0,025 | 100 | Estabilidad de heparina por análisis colorimétrico y vancomicina por inmunofluorescencia. Almacenado en alicuotas de 4.° a 37°C con el 0,9% de NaCl como diluyente | – | NA | Visualmente 14 días. A 37°C ↓ actividad > 10% en 24h | 1991 (13) |
| Vancomicina | 0,05 | 9,73 | Estabilidad de vancomicina por inmunofluorescencia, CMI y CMB. Estabilidad por TTPA. Viales almacenados a 23°C | S. aureus y S. epidermidis | NA | 60 días | 1992 (17) |
| Vancomicina | 0,1 | 5.000 | Estabilidad por inmunofluorescencia. Almacenada en jeringas de 60m a 4°C y en 0,9% de NaCl como diluyente | S. aureus resistente a meticilina | NA | Actividad durante al menos 4 semanas | 2005 (15) |
| Vancomicina | 0,5 | 100 | Estabilidad por técnicas espectrofotométricas y CLAR. | S. epidermidis | NA | Actividad ↓ ⩽10% en 10 días | 1999 (14) |
| Tubos de ensayo estériles de poliestireno incubados a 25°C y a 37°C. Un tubo se siguió también en presencia de microorganismos. H2O estéril como diluyente | |||||||
| Vancomicina | 2 | 2.500 | Estabilidad por inmunofluorescencia. Almacenado en tubos de cristal estériles a 37°C | S. aureus | NA | Actividad ↓ <10% en 3 días | 2001 (12) |
| Vancomicina | 10 | 5.000 | Estabilidad por técnicas espectrofotométricas (solución almacenada en tubos de ensayo de cristal, en oscuridad, a 37°C y en 0,9% de NaCl como diluyente) y CLAR (almacenados en tubos Eppendorf a temperatura ambiente y con H2O purificada como diluyente) | – | NA | Actividad durante al menos 72h | 2000 (11) |
↓: disminuye; CLAR: cromatografía líquida de alta resolución; CMB: concentración mínima bactericida; CMI: concentración mínima inhibitoria; CVC: catéter venoso central; H2O: agua; NA: no aplicable por no usar un modelo real de infección de catéteres; NaCl: cloruro sódico; TTPA: tiempo de tromboplastina parcial activada.
Estudios in vitro de estabilidad de soluciones heparinizadas de varios antibióticos utilizadas en el sellado antibiótico de catéteres
| Mezclas | Concentración (mg/ml) | Heparina (U/ml) | Condiciones del estudio | Microorganismos analizados | Aplicación | Estabilidad | Año (referencia) |
| Vancomicina-ciprofloxacino | 0,025–0,002 | 9,73 | Estabilidad de vancomicina por inmunofluorescencia, CMI y CMB. Estabilidad de heparina por TTPA. | Staphylococcus aureus, Staphylococcus epidermidis, Escherichia coli, Klebsiella pneumoniae y Pseudomonas aeruginosa | NA | Vancomicina 60 días a 23°C; heparina a 3 meses. Ciprofloxacino tan efectivo como vancomicina-heparina-ciprofloxacino, vancomicina y con ≅ CMI y CMB | 1992 (17) |
| Viales almacenados a 23°C | |||||||
| Vancomicina-ciprofloxacino | 0,05–0,002 | 9,73 | Estabilidad de vancomicina por inmunofluorescencia, CMI y CMB. Estabilidad de heparina por TTPA. | S. aureus, S. epidermidis, E. coli, K. pneumoniae y P. aeruginosa | NA | Vancomicina 60 días a 23°C; heparina a 3 meses. Ciprofloxacino tan efectivo como vancomicina, heparina, ciprofloxacino, vancomicina, con ≅ CMI y CMB | 1992 (17) |
| Viales almacenados a 23°C | |||||||
| Vancomicina-colistina | 0,1–0,1 | 100 | Estabilidad por turbidimetría, pH, espectrofotometría RM. Almacenado a 4°C y a 25°C. Compatibilidad fisicoquímica en 0,9% de NaCl como diluyente en viales de 5 ml | S. aureus resistente a meticilina, P. aeruginosa, K. pneumoniae y Enterococcus faecium | NA | Entre uno y 2 días a 25°C o 30 días a 4°C; todas las cepas se erradicaron | 1997 (16) |
CMB: concentración mínima bactericida; CMI: concentración mínima inhibitoria; NA: no aplicable por no usar un modelo real de infección de catéteres; NaCl: cloruro sódico; RM: resonancia magnética; TTPA: tiempo de tromboplastina parcial activada.
Las mejores alternativas para el SAC frente a microorganismos grampositivos, incluido Staphylococcus aureus resistente a meticilina, fueron vancomicina sola (2–10mg/ml) o vancomicina (0,5–10mg/ml) mezclada con heparina (100–5.000U/ml). La mejor alternativa para el tratamiento de microorganismos gramnegativos fue gentamicina sola (5mg/ml) o gentamicina mezclada con heparina (5.000U/ml). En el caso concreto de P. aeruginosa, en situaciones de elevadas tasas de resistencia, la mejor alternativa fue ceftazidima sola (10mg/ml) o ceftazidima mezclada con heparina (5.000U/ml). El ciprofloxacino puede ser otra alternativa aconsejable a bajas concentraciones (0,125–1mg/ml) en soluciones heparinizadas (heparina 100–2.500U/ml, respectivamente). En caso de infecciones fúngicas, la anfotericina B (2mg/ml) puede ser efectiva en la erradicación de infecciones por Candida spp. y alargar la vida del catéter10.
DiscusiónMuchos estudios han evaluado la efectividad de las soluciones utilizadas en el SAC, pero sólo un 10% ha evaluado la estabilidad de estas soluciones. Sin embargo, varios de estos estudios no establecieron bien el criterio de estabilidad, no usaron las técnicas analíticas más apropiadas, presentaron errores de validez analítica o evaluaron un número insuficiente de muestras para determinar la estabilidad de estas soluciones8. Frecuentemente, los estudios analizaron diferentes soluciones antimicrobianas a diferentes concentraciones, con diferentes técnicas analíticas y para el tratamiento de diferentes microorganismos9,19. Por tanto, los estudios resultaron difíciles de comparar y las conclusiones resultaron difíciles de establecer. No hay un criterio unánime referente a la estabilidad de las soluciones utilizadas en el SAC. La estabilidad es normalmente definida8 como el mantenimiento de concentraciones del fármaco mayor o igual que el 90%. Otros autores consideran estable una solución cuando no hay presencia visual de precipitados20. Trisell et al utilizaron una definición más estricta8,9 y ésta fue la definición aplicada en esta revisión. La ausencia de cambios visuales no excluye el deterioro químico de la solución y de igual manera la estabilidad química no excluye la formación de partículas de tamaño considerable8. Por eso, la combinación de estos 2 métodos (técnicas específicas de determinación de sustancias y observación de cambios físicoquímicos) es el camino óptimo para establecer la estabilidad de las soluciones.
La vancomicina sola o la vancomicina mezclada con heparina en las concentraciones indicadas anteriormente se han mostrado como la mejor alternativa para el SAC en el caso de microorganismos grampositivos. No obstante, se han publicado resultados contradictorios, especialmente para soluciones heparinizadas de antibióticos12,17,18,20–25. Mientras que en un estudio11 la vancomicina (10mg/ml) fue compatible con heparina (5.000U/ml), algunos datos procedentes de otras experiencias indican que concentraciones muy elevadas de heparina pueden aumentar el riesgo de precipitación de este glucopéptido26. A pesar de que el ciprofloxacino puede ser una buena alternativa para el SAC en el caso de P. aeruginosa, concentraciones de 10mg/ml de este antibiótico, solo o mezclado con heparina, presentan un alto riesgo de precipitación20. Se dispone de pocos estudios de eficacia y de estabilidad en el sellado antifúngico de catéteres, aunque la anfotericina B (2mg/ml) puede considerarse como una alternativa en la erradicación de infecciones por Candida spp10.
En la mayoría de los casos, las concentraciones óptimas para las soluciones antimicrobianas en el SAC no se han estudiado suficientemente. Generalmente, las concentraciones antimicrobianas fueron mucho más elevadas que la CMI de los microorganismos estudiados. Sin embargo, a pesar de que con la pérdida de actividad mayor o igual que el 10% aún se puede erradicar ciertos microorganismos, disminuciones mayores de las concentraciones antibióticas pueden afectar la efectividad de la técnica. Este punto puede ser crítico en segmentos distales del catéter, en los que la concentración de los antibióticos puede disminuir. Un estudio reciente, que investigó el gradiente de vancomicina en la luz de los catéteres, encontró que en los segmentos distales se evidenció un descenso significativo (>50%) en la concentración de vancomicina respecto a los segmentos proximales27. Por tanto, las soluciones utilizadas en el SAC no deberían permanecer en la luz del catéter durante más de 12 a 24h.
Desde el punto de vista de la seguridad, no se puede descartar como hipótesis la posible formación de microprecipitados no visibles dentro del catéter o de productos tóxicos no detectables que dependen de las mezclas de fármacos y de sus concentraciones. Por esto, parece aconsejable evitar que esas soluciones alcancen el torrente sanguíneo. La infusión de soluciones con partículas superiores a 0,22nm puede producir importantes efectos adversos, como una embolia microvascular pulmonar, con consecuencias mortales28–31. Además, algunos fármacos pueden producir sustancias tóxicas y productos altamente reactivos que podrían resultar nocivos32–34. Sin embargo, estos casos no se han reportado en las soluciones utilizadas en el SAC hasta la fecha.
En conclusión, los estudios de estabilidad de las soluciones utilizadas en el SAC no siguieron un concepto homogéneo y unívoco para definir la estabilidad de las soluciones. Pocos estudios aplicaron criterios estrictos para el seguimiento de la estabilidad de las soluciones utilizadas en esta técnica. Los datos disponibles se limitan a unos pocos antibióticos. En consecuencia, parece aconsejable realizar estudios más estrictos de estabilidad en futuras investigaciones de soluciones utilizables en el SAC y combinar técnicas específicas de determinación de sustancias con la observación de cambios fisicoquímicos de éstas.