La neumonía adquirida en la comunidad (NAC) es una enfermedad frecuente que puede ser abordada en hospitalización a domicilio (HAD). En el presente trabajo evaluamos el margen de mejora con el uso de antibióticos en la NAC en HAD.
MétodosSe reclutaron retrospectivamente todos los pacientes con NAC en dos hospitales españoles desde el 01 de enero de 2018 al 30 de octubre de 2019. Se registraron variables demográficas, clínicas y sobre calidad de prescripción antibiótica. Posteriormente se construyó una variable que recogía seis indicadores de calidad asistencial, categorizando y comparando a los pacientes en dos grupos: buena calidad asistencial (cuatro o más indicadores realizados) o mala calidad asistencial (tres o menos indicadores realizados).
ResultadosObtuvimos una muestra de 260 pacientes. La solicitud de pruebas diagnósticas y la adecuación a las guías de práctica clínica fue del 85,4 y 85,8%, respectivamente. Los porcentajes de realización de desescalada (53,7%) y terapia secuencial (57,7%) cuando estaban indicadas fueron bajos. La duración media del tratamiento fue de 7,3 días para el intravenoso y 9,5 días para el total. La calidad de prescripción fue buena en 134 (63,2%) pacientes, siendo más frecuente en aquellos que ingresaron directamente en HAD desde urgencias. También se asoció a menor reingreso a 30 días.
ConclusiónExiste un amplio margen de mejora en algunos aspectos con el uso de antimicrobianos en HAD, que podría motivar la implementación de programas de optimización del uso de antibióticos.
Community Acquired Pneumonia (CAP) is common disease that can be treated in Hospital At Home (HAH). In this paper we evaluate the room of improvement in the use of antibiotics in CAP in HH.
MethodsPatients with CAP were retrospectively recruited in two Spanish hospitals from 1/1/18 to 10/30/19. Demographic, clinical and quality of antibiotic prescription variables were recorded. Subsequently, we created a new variable that collected six quality of care indicator, categorizing and comparing patients into two groups: good quality of care (4 or more indicators performed) or poor quality of care (3 or less indicators performed).
ResultsWe recruited 260 patients. The request for diagnostic tests and the adequacy to Clinical Practice Guidelines were 85.4% and 85.8% respectively. Percentages of de-escalation (53.7%) and sequential therapy (57.7%) when indicated were low. The average length of treatment was 7.3 days for intravenous and 9.5 days for total. Quality of prescription was good in 134 (63.2%) patients, being more frequent in those who were admitted directly to HAD from the emergency room. It was also associated with less readmission at 30 days.
ConclusionThere is a wide room for improvement in some fields of antimicrobials use in HAH that could stimulate the implementation of Antimicrobial Stewardship Programs.
La neumonía adquirida en la comunidad (NAC) tiene en España una elevada carga asistencial, con una tasa de incidencia y de hospitalización de 4,63 y 1,64 casos por cada 1.000 personas/año, respectivamente1,2. La hospitalización a domicilio (HAD) se ha establecido como una opción útil y segura para tratar a estos pacientes, teniendo en cuenta que el manejo antibiótico no debería ser diferente al de la NAC con hospitalización convencional3.
En el manejo de la NAC en HAD, el uso racional de los antibióticos tiene la misma vigencia que en la hospitalización convencional. Varios indicadores se asocian a una mejora en el tratamiento de la NAC, como la adecuación del tratamiento a las guías de práctica clínica (GPC)4, la realización de desescalada (reducción del espectro e impacto ecológico del antimicrobiano cuando está indicado)5, la terapia secuencial (paso a vía oral tras el tratamiento intravenoso)6 y la duración adecuada del tratamiento (entre cinco y siete días, en casos no complicados)7,8.
Dada la escasa bibliografía al respecto, en el presente trabajo evaluamos la calidad de la prescripción de antimicrobianos en pacientes con NAC en HAD en dos hospitales españoles, el Hospital Reina Sofía de Tudela (HRS) y el Hospital Royo Villanova de Zaragoza (HRV), pretendiendo determinar el margen de mejora existente.
MétodosSe recogieron retrospectivamente todos los casos de NAC en régimen de HAD en mayores de 18 años comprendidos entre el 01 de enero de 2018 al 30 de octubre de 2019. Se consideró NAC atendiendo a dos supuestos: si su médico hacía hecho tal diagnóstico y lo reflejaba en la historia clínica o si había síntomas típicos y condensación radiológica. Se incluyó la broncoaspiración y la neumonía en paciente institucionalizado. Se excluyó la neumonía nosocomial y la infección respiratoria sin condensación.
Se registraron variables demográficas (edad, comorbilidades o índice de Charlson), clínicas (contexto epidemiológico o gravedad) y de resultados. Se determinó la calidad de prescripción antibiótica durante la hospitalización, tanto en planta como en domicilio con cinco variables. La primera fue la solicitud de pruebas microbiológicas. La segunda, la adecuación de la elección del antibiótico a las GPC (locales en el caso de que existieran o generales en el que no). La tercera, la indicación y realización de desescalada (para lo que se tuvieron en cuenta los resultados microbiológicos, la evolución clínica del paciente y la probabilidad de bacterias resistentes, entendiendo esta como probable presencia de S. aureus resistente a meticilina (SARM) si había habido aislamiento previo o de P. aeruginosa si había habido aislamiento previo o cumplía dos de los siguientes criterios: EPOC severo con FEV1 < 30%, presencia de bronquiectasias generalizadas, hospitalización reciente, administración reciente de antibiótico (tres meses) o más de cuatro tandas de antibiótico en el último año y toma de corticoide oral, más de 10 mg de prednisolona o similares en las últimas dos semanas. La cuarta fue la indicación y realización de terapia secuencial (para lo que se atendió a si el paciente toleraba vía oral y había alcanzado la estabilidad clínica, entendiendo esta como la fecha en la que se cumplía que en las 24 h previas el paciente había presentado temperatura menor de 38°C, presión arterial sistólica mayor de 90 mmHg, frecuencia cardíaca menor de 100 pulsaciones por minuto, frecuencia respiratoria menor de 24 respiraciones por minuto y saturación arterial de oxígeno superior a 90% con, como máximo, oxígeno endonasal). La quinta fue la duración del tratamiento. Por último, se construyó una variable dicotómica para evaluar la calidad de prescripción. Para ello, se otorgó un punto a cada uno de los siguientes indicadores: solicitud de alguna prueba microbiológica, adecuación en la elección del fármaco a las GPC, desescalada realizada o no indicada, terapia secuencial realizada o no indicada, duración del tratamiento intravenoso menor de cinco días y duración del tratamiento total menor de siete días. Posteriormente se compararon los pacientes en los que se realizó una buena calidad de prescripción antibiótica (de cuatro a seis indicadores realizados), respecto de los que no (tres o menos indicadores realizados). Para dicho análisis se excluyeron aquellos casos en los que se ingresó al paciente directamente en el domicilio, sin ser admitido en urgencias, los casos en que se produjo fallecimiento durante el ingreso y los que presentaron motivos para prolongar el tratamiento (complicaciones como empiema, absceso o sobreinfección bacteriana e infección por P. aeruginosa y SARM), intentando con ello seleccionar a los pacientes con NAC no complicada. Por último, en cuanto a las variables de resultados, se registró la estancia y la tasa de exitus y de reingresos, tanto durante la hospitalización como a los 30 días del alta. Para ello se revisó que los pacientes hubieran tenido alguna consulta médica o prueba complementaria ambulatoria que confirmara que seguían vivos en algún momento desde el alta. Los datos, así como la interpretación de la adecuación de los indicadores, se recogieron por un equipo de médicos, revisando historias clínicas.
Para el descriptivo, se usaron porcentajes, medias y cuartiles. Para el contraste de hipótesis, se empleó el test de χ2, la corrección de Fisher y la razón de probabilidades (OR) para variables cualitativas y la U de Mann-Whitney para las cuantitativas (las variables no siguieron una distribución normal). Se consideró una p < 0,05 como estadísticamente significativa. Se empleó el programa SPSS® v. 15. Se obtuvo autorización del Comité Ético de Investigación Clínica de Navarra.
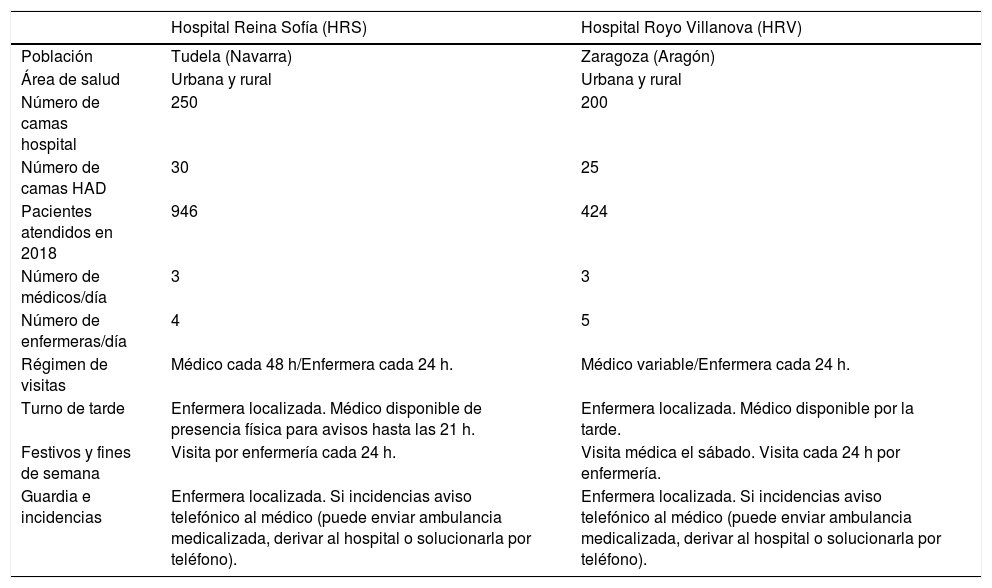
ResultadosCaracterísticas de los hospitales y descriptivo generalEl trabajo se llevó a cabo en el HRS y el HRV. Las características de dichos hospitales, así como de los respectivos servicios de HAD, vienen definidas en la tabla 1. Se reclutaron 260 pacientes cuyas variables principales se detallan en la tabla 2.
Características de los dos hospitales del estudio
| Hospital Reina Sofía (HRS) | Hospital Royo Villanova (HRV) | |
|---|---|---|
| Población | Tudela (Navarra) | Zaragoza (Aragón) |
| Área de salud | Urbana y rural | Urbana y rural |
| Número de camas hospital | 250 | 200 |
| Número de camas HAD | 30 | 25 |
| Pacientes atendidos en 2018 | 946 | 424 |
| Número de médicos/día | 3 | 3 |
| Número de enfermeras/día | 4 | 5 |
| Régimen de visitas | Médico cada 48 h/Enfermera cada 24 h. | Médico variable/Enfermera cada 24 h. |
| Turno de tarde | Enfermera localizada. Médico disponible de presencia física para avisos hasta las 21 h. | Enfermera localizada. Médico disponible por la tarde. |
| Festivos y fines de semana | Visita por enfermería cada 24 h. | Visita médica el sábado. Visita cada 24 h por enfermería. |
| Guardia e incidencias | Enfermera localizada. Si incidencias aviso telefónico al médico (puede enviar ambulancia medicalizada, derivar al hospital o solucionarla por teléfono). | Enfermera localizada. Si incidencias aviso telefónico al médico (puede enviar ambulancia medicalizada, derivar al hospital o solucionarla por teléfono). |
HAD: hospitalización a domicilio.
Características demográficas, clínicas y de resultados de la muestra
| n = 260 | Resultado |
|---|---|
| Hospital Reina Sofía; n (%) | 179 (68,8) |
| Hospital Royo Villanova; n (%) | 81 (31,2) |
| Tipo de ingreso | |
| Asistencia inicial en el domicilio; n (%) | 7 (2,7) |
| De urgencias a HAD; n (%) | 60 (23,1) |
| De la planta a HAD; n (%) | 193 (74,2) |
| Sexo, varón; n (%) | 138 (53,1) |
| Edad; media (p25/mediana/p75) | 77,3 (70/82/89) |
| Índice de Charlson; media (p25/mediana/p75) | 5,4 (4/6/8) |
| Insuficiencia cardíaca; n (%) | 84 (32,3) |
| Demencia; n (%) | 84 (32,3) |
| EPOC; n (%) | 62 (23,8) |
| Proveniente de residencia; n (%) | 77 (29,6) |
| Sospecha de aspiración; n (%) | 53 (20,4) |
| Alergias que condicionan el tratamiento antibiótico; n (%) | 33 (12,7) |
| Antibioterapia previa por el proceso que motivó el ingreso; n (%) | 97 (37,7) |
| Sospecha de P. aeruginosa; n (%) | 52 (20) |
| Sospecha de SARM; n (%) | 16 (6,2) |
| Solicitud de pruebas microbiológicas | |
| Hemocultivos; n (%) | 106 (40,8) |
| Esputo; n (%) | 93 (35,8) |
| Antígenos en orina; n (%) | 190 (73,1) |
| Serología; n (%) | 7 (2,7) |
| Líquido pleural; n (%) | 5 (1,9) |
| PCR gripe y VRS | 53 (27,7) |
| Diagnóstico microbiológico; n (%) | 72 (27,7) |
| Por antígenos en orina; n (%) | 39 (54,2) |
| Por hemocultivos; n (%) | 2 (2,8) |
| Por esputo; n (%) | 26 (36,1) |
| Por PCR gripe y VRS | 12 (16,7) |
| Etiología S. pneumoniae; n (%) | 41 (56,9) |
| Complicaciones; n (%) | 27 (10,4) |
| Empiema; n (%) | 4 (1,5) |
| Absceso; n (%) | 2 (0,8) |
| Sobreinfección; n (%) | 23 (8,8) |
| Estancia en el hospital; media (p25/mediana/p75) | 2,5 (1/2/3) |
| Estancia en HAD; media (p25/mediana/p75) | 8,2 (6/7/9) |
| Estancia total; media (p25/mediana/p75) | 10,6 (7/9/13) |
| Retorno al hospital desde HAD; n (%) | 19 (7,3) |
| Exitus durante el ingreso; n (%) | 21 (8,1) |
| Exitus a los 30 días del alta; n (%) | 12 (5) |
| Reingreso a los 30 días del alta; n (%) | 28 (11,9) |
HAD: hospitalización a domicilio; p25: mediana; p75: cuartiles y mediana; EPOC: enfermedad pulmonar obstructiva crónica; SARM, Staphylococcus aureus resistente a meticilina; PCR: reacción en cadena de la polimerasa; VRS, virus respiratorio sincitial.
Se solicitó alguna prueba microbiológica en 222 (85,4%) pacientes, realizándose diagnóstico microbiológico en 72 (32,4% respecto a los que se intentó) (tabla 2).
Adecuación a las GPCLa elección del antibiótico fue adecuada en 223 (85,8%) pacientes. La elección consistió en ceftriaxona en monoterapia en 91 (35%) casos, levofloxacino en monoterapia en 50 (19,2%) y ceftriaxona más azitromicina, claritromicina o levofloxacino en 57 (21,9%). Treinta y nueve (15%) iniciaron el tratamiento con carbapenems o piperacilina/tazobactam.
DesescaladaLa desescalada estuvo indicada en 41 (15,8%) pacientes, realizándose en 22 (53,7%). Se produjo aislamiento microbiológico en 25 (61%) de los pacientes con desescalada indicada. En 16 (72%) pacientes con desescalada indicada, esta se realizó en las primeras 24 horas desde el momento de la indicación.
Terapia secuencialLa realización de terapia secuencial fue potencialmente posible en 201 (77,3%) pacientes, realizándose en 116 (57,7%). Doscientos cuarenta y seis (94,6%) alcanzaron la estabilidad clínica y la tolerancia a vía oral en algún momento del ingreso. De estos pacientes, en 115 se realizó terapia secuencial. El tiempo hasta la realización fue de 3,9 días de media (p25, 2; mediana, 4; p75, 5).
Duración del tratamiento antibióticoExcluyendo 21 (9,1%) pacientes que murieron durante el ingreso y 26 (10%) que tuvieron complicaciones, P. aeruginosa o SARM, en 213 (81,9%) se analizó la duración de tratamiento antibiótico. La duración media del intravenoso fue de 7,3 días (p25, 5; mediana, 7; p75, 9), y la del total 9,5 días (p25, 7; mediana, 9; p75, 11). Las duraciones medias del tratamiento intravenoso y total en los pacientes excluidos por complicaciones, P. aeruginosa o SARM (26), fueron 10,8 y 15,3 días, respectivamente.
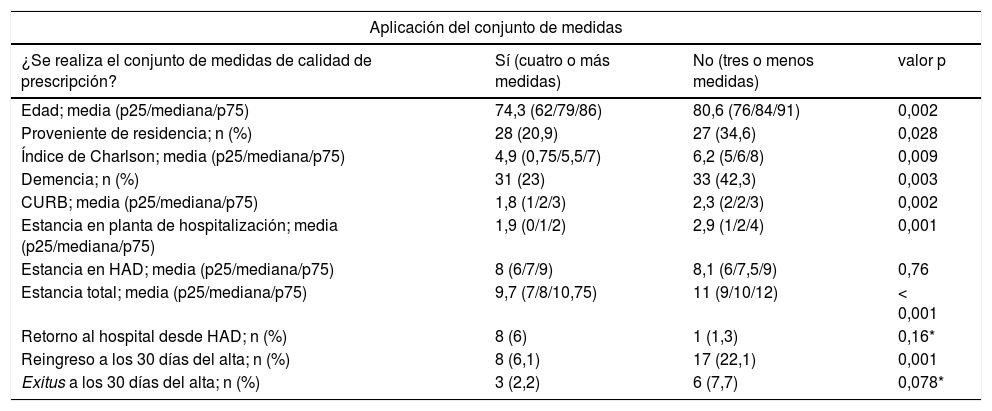
Comparativa en función de la calidad de prescripción antibióticaEn 212 (81,5%) pacientes se pudo aplicar el análisis de conjunto de indicadores de calidad de prescripción. En 134 (63,2%) se realizó una buena calidad de prescripción (cuatro o más indicadores de calidad), siendo estos más jóvenes y con menos comorbilidades, gravedad y estancia. Hubo diferencias entre hospitales. El HRV realizó una buena calidad de prescripción en el 82% de los pacientes frente al 55,6% del HRS (p < 0,001). La calidad de prescripción fue mejor en los pacientes trasladados desde urgencias a la HAD, que en los que pasaron algún día en planta; (75,9% de buena calidad frente a 59,5%, p = 0,031; OR 0,46 (IC 95% 0,23-0,94). También se asoció a no reingresar a los 30 días; OR 0,26 (IC 95% 0,11-0,59). No hubo diferencias significativas en el resto de las variables (tabla 3).
Ejemplo de interpretación de datos (31 pacientes [23%] de los que se realizó buena calidad de prescripción [cuatro o más medidas] tenían demencia, frente a 33 [42,3%] del grupo en los que no se realizó que tenían demencia; la demencia fue más frecuente en el grupo de no realización de buena calidad de prescripción con una p = 0,003)
| Aplicación del conjunto de medidas | |||
|---|---|---|---|
| ¿Se realiza el conjunto de medidas de calidad de prescripción? | Sí (cuatro o más medidas) | No (tres o menos medidas) | valor p |
| Edad; media (p25/mediana/p75) | 74,3 (62/79/86) | 80,6 (76/84/91) | 0,002 |
| Proveniente de residencia; n (%) | 28 (20,9) | 27 (34,6) | 0,028 |
| Índice de Charlson; media (p25/mediana/p75) | 4,9 (0,75/5,5/7) | 6,2 (5/6/8) | 0,009 |
| Demencia; n (%) | 31 (23) | 33 (42,3) | 0,003 |
| CURB; media (p25/mediana/p75) | 1,8 (1/2/3) | 2,3 (2/2/3) | 0,002 |
| Estancia en planta de hospitalización; media (p25/mediana/p75) | 1,9 (0/1/2) | 2,9 (1/2/4) | 0,001 |
| Estancia en HAD; media (p25/mediana/p75) | 8 (6/7/9) | 8,1 (6/7,5/9) | 0,76 |
| Estancia total; media (p25/mediana/p75) | 9,7 (7/8/10,75) | 11 (9/10/12) | < 0,001 |
| Retorno al hospital desde HAD; n (%) | 8 (6) | 1 (1,3) | 0,16* |
| Reingreso a los 30 días del alta; n (%) | 8 (6,1) | 17 (22,1) | 0,001 |
| Exitus a los 30 días del alta; n (%) | 3 (2,2) | 6 (7,7) | 0,078* |
Asterisco (*), aplicada corrección de Fisher.
HAD: hospitalización a domicilio; p25, p50, p75: cuartiles y mediana; CURB: escala pronóstica de neumonía (confusion, urea, respiratory rate, blood pressure).
Encontramos que existe un amplio margen de mejora en la calidad de prescripción antibiótica en nuestra muestra. Si bien se solicitan en gran medida pruebas microbiológicas y se adecúa la elección del tratamiento a las GPC7,9, observamos que casi la mitad de los pacientes podrían beneficiarse de desescalada y terapia secuencial (46,3 y 42,3%, respectivamente). También sería posible optimizar la duración del tratamiento (7,3 días de tratamiento intravenoso y 9,5 en total).
La desescalada se pudo realizar en pocos pacientes. Son varios los trabajos que han demostrado que la desescalada es segura en NAC, incluso con bacteriemia5,10,11. Más complejo resultaría realizarlo en pacientes sin aislamiento microbiológico (en nuestra muestra, 39%). Consideramos que en estos pacientes se eligió un antibiótico de mayor espectro del necesario y que en unos días, si la situación clínica lo permite, se podría haber reducido. Pese a ello, solo se tardó un día en realizar la desescalada cuando estaba indicada, lo que resulta positivo. Respecto a la terapia secuencial consideramos que quizá sea el principal punto a implementar debido a la sencillez de la misma y al margen de mejora. Hay suficiente evidencia en NAC en hospitalización convencional que refrenda que el paso a vía oral, al alcanzar estabilidad clínica, es seguro incluso en NAC grave, disminuyendo las complicaciones y la estancia6,12. En un estudio holandés en NAC en hospitalización convencional se detectaron tasas similares a las nuestras (estando indicada en el 46% de los pacientes, la terapia secuencial no se realizó en el 40% de ellos), identificando en los clínicos ideas equivocadas, consideraciones prácticas y factores de organización como barreras para la correcta puesta en práctica de dicha medida13. Además, en nuestra muestra se tardó 3,9 días de media en realizar la terapia secuencial, lo cual es demasiado. Por último, encontramos posible la mejora en la duración del tratamiento antibiótico en NAC no complicada. La duración óptima establecida en otros trabajos7,8 se daría en nuestra muestra en el percentil 25 (cinco días intravenoso, siete días en total), sin pasar por alto que uno de cada cuatro pacientes fue tratado con nueve o más días intravenoso y 11 o más días en total. La mejora de estas cifras reduciría estancia, complicaciones y consumo antibiótico.
Nuestro estudio tiene algunas limitaciones. En primer lugar, dado el carácter observacional, los investigadores que revisaron las historias clínicas pudieron pasar por alto elementos que el clínico tuviera en mente y que condicionaran un alejamiento de las indicaciones de las GPC. Existen asimismo una serie de sesgos de interpretación debido a que la mayoría de los trabajos sobre NAC se han realizado en hospitalización convencional, planteando la duda de si serían equiparables en HAD. En cuanto a la terapia secuencial es importante tener en cuenta que la elegibilidad para HAD pueda deberse al compromiso de la vía oral o a que el paciente precise tratamiento antimicrobiano domiciliario intravenoso (TADE), aunque creemos haber minimizado este sesgo con las variables de tolerancia a vía oral y estabilidad. También las dinámicas de trabajo de HAD podrían haber condicionado la pérdida de días y el retraso en la implementación de medidas, debido a que la visita médica se produce cada 48 h y a que determinadas inercias de tratamiento podrían mantenerse, aun cuando los datos clínicos y microbiológicos ofrecen nueva información. Estas suposiciones, por otro lado, dan mayor relevancia a este trabajo, pues aportamos luz en un campo donde hay poca bibliografía y creemos haber identificado algunos elementos prioritarios a la hora de implementar mejoras en la prescripción de antibioterapia en la HAD. Por último, interpretamos que las diferencias entre el grupo de buena calidad de prescripción (cuatro a seis indicadores) respecto al grupo de mala calidad de prescripción (tres o menos indicadores) podrían deberse a que en este último grupo había pacientes más ancianos y con más comorbilidades. Que se realice en ellos una peor prescripción podría relacionarse con que la fragilidad y las comorbilidades pudieran estar subestimando la mejora clínica en los aspectos infecciosos de la NAC, dilatando en el tiempo la implementación de dichos indicadores de calidad. Si bien consideramos que el menor riesgo de reingreso a 30 días en el grupo de buena calidad asistencial (OR 0,26) pudo deberse a las características basales de estos pacientes (más jóvenes y con menos comorbilidades), consideramos que las diferencias encontradas entre aquellos que ingresaron directamente en HAD desde urgencias respecto a los que ingresaron en HAD tras pasar uno o varios días en planta convencional (la calidad de prescripción fue mejor en el primer grupo con una OR 0,46), sí que pudieran verse relacionadas con las dinámicas asistenciales de la HAD, lo que señalaría otro lugar para la mejora. Es posible que el hecho de que un mismo médico pueda evaluar a un paciente desde el principio hasta el final (ingreso en HAD durante todo el curso de la enfermedad), se relacione con una mayor facilidad para aplicar los indicadores dependientes de la evolución del enfermo (desescalada, terapia secuencial y duración), que en los casos en los que han sido varios médicos o sistemas (planta convencional y HAD) los que han tratado a dichos pacientes. Este supuesto podría optimizarse mejorando la comunicación entre los médicos de planta y los de HAD o planificando los indicadores desde el día cero de la asistencia.
La optimización de la prescripción de antimicrobianos es un tema de creciente interés por sus implicaciones en la salud de los pacientes, la eficiencia de los sistemas sanitarios y la emergencia de resistencias bacterianas. Estas medidas deberían ser aplicadas en todos los aspectos de la medicina y la HAD sería uno, hasta la fecha, poco estudiado. Encontramos que existe un importante margen de mejora en la calidad de uso de antimicrobianos en la NAC en HAD, lo que sería traducible a otras enfermedades infecciosas. Consideramos que este sería un interesante campo para abordar por parte de los programas de optimización del uso de antimicrobianos (PROA)14.
FinanciaciónEl trabajo no recibió ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.