Desde el inicio de la era del tratamiento antirretroviral de gran actividad (TARGA), existe la evidencia de que el factor más importante que ha limitado la indudable eficacia del TARGA ha sido la toxicidad secundaria al tratamiento. Dicha toxicidad puede adoptar dos perfiles temporales: la toxicidad precoz, a corto plazo o tolerabilidad, y la toxicidad a largo plazo o toxicidad crónica. Ambos tipos de toxicidades son importantes no sólo por la carga adicional de comorbilidad que suponen, sino también por el hecho de que frecuentemente el paciente establece la relación entre la toma de medicamentos y la aparición de síntomas o signos de toxicidad. Este hecho puede suponer, en muchos casos, un menoscabo de la adherencia del paciente al TARGA y precipitar un fracaso virológico. En el caso de la toxicidad crónica, su aparición se verá favorecida por la exposición continuada a los fármacos de forma indefinida.
Las actuaciones a realizar frente a la aparición de toxicidad por antirretrovirales pueden resumirse en dos; por un lado, la retirada del fármaco implicado en la aparición de la toxicidad y su sustitución por un congénere que no la presente y, por otro, la implementación de intervenciones farmacológicas o no dirigidas a la corrección de los trastornos secundarios a dicha toxicidad. Debe tenerse en cuenta que si dicha intervención es farmacológica, los fármacos utilizados para dicho fin pueden interactuar con los antirretrovirales y, a resultas de ello, causar toxicidad adicional.
En los últimos años se han incorporado nuevos fármacos e incluso nuevas familias al arsenal antirretroviral, cuya toxicidad tanto a corto como a largo plazo es mucho menor que la de los antirretrovirales de primera generación. Es en desarrollo de nuevos fármacos con perfiles más benignos de toxicidad, así como en el conocimiento de los determinantes genéticos de la toxicidad farmacológica (toxicogenética), donde residen las mayores esperanzas para minimizar la toxicidad secundaria al TARGA. En este sentido la farmacogenética debe constituir una ayuda inestimable hacia el objetivo de personalizar el TARGA más eficaz y menos tóxico para cada uno de nuestros pacientes.
Highly active antiretroviral therapy (HAART)-associated toxicity has been the most important limiting factor of the doubtless efficacy of this treatment. HAART-associated toxicity can have two kinds of temporal profiles; early toxicity, also known as tolerability, and long-term or chronic toxicity. Both types of toxicity are of foremost importance, not only because they represent an added co-morbidity, but also because the patient often associates the starting of HAART with toxic effects. This fact has often been linked to a decrease in patient adherence to the treatment, which may eventually lead to virological failure. The appearance of long-term toxic effects is usually due to continuous, even indefinite, exposure to antiretroviral drugs.
When antiretroviral drug toxicity develops, the caregiver usually has two choices; to decrease and/or reverse such toxicity. On the one hand, withdrawal of the offending agent and its substitution for another agent with a different toxicity profile, and on the other, pharmacological or non-pharmacological interventions directed at correcting the toxicity-associated problems. However, it should be kept in mind that pharmacological interventions always have the possibility of giving rise to interactions with antiretroviral drugs, eventually leading to new toxic effects.
Fortunately, in the last few years, new drugs and drug families have been added to the antiretroviral armamentarium. Most of these drugs have more benign toxicity profiles than first-generation antiretroviral drugs. No doubt our best hope to decrease HAART-associated toxicity relies upon treatment with these new drugs, together with the knowledge of the genetic determinants of antiretroviral drug-associated toxicity (toxicogenetics). Hopefully, toxicogenetics will be of paramount importance in the future to design new antiretroviral regimes best fitted to a given patient, in order to personalize HAART with the objective of building up more effective and less toxic regimes.
La introducción del tratamiento antirretroviral de gran eficacia (TARGA) hace más de 14 años supuso un cambio radical en la historia natural de la infección por el virus de la inmunodeficiencia humana tipo 1 (VIH-1). No obstante, poco tiempo después de la introducción del TARGA, fue ya evidente que el factor limitante más importante de su indudable eficacia era la toxicidad inherente a los fármacos antirretrovirales1. Además, los efectos adversos y la toxicidad de dichos compuestos se hallan potenciados por la ineludible necesidad de administrarlos de forma indefinida, dada la imposibilidad de erradicar la infección por el VIH-1 con el TARGA, con lo que, en el caso de muchas toxicidades, los efectos nocivos de los fármacos antirretrovirales se acumulan en el tiempo.
La actitud ante la toxicidad inducida por fármacos de cualquier clase o familia puede resumirse en dos tipos de actuaciones que constituyen la base del manejo de la toxicidad farmacológica. Por un lado, la interrupción de la exposición del paciente a un determinado o determinados compuestos a los que se atribuyen el o los efectos adversos. Este tipo de actuación suele ser más necesaria cuando se trata de toxicidades que aparecen precozmente tras la exposición al fármaco y, especialmente, en el caso de reacciones adversas graves o que ponen en peligro la vida del paciente. Por otro lado, existen efectos adversos en que puede no ser preciso interrumpir la exposición al fármaco y que pueden corregirse de forma parcial o total mediante intervención farmacológica o de otras clases. Este tipo de toxicidad suele corresponderse con la toxicidad crónica o a largo plazo y no suele suponer una amenaza para la vida del paciente al menos de forma inmediata.
El perfil temporal de la toxicidad por fármacos permite, pues, clasificarla en dos tipos: toxicidad de aparición precoz, que también ha venido a denominarse tolerabilidad, y toxicidad crónica o a largo plazo. Los fármacos antirretrovirales presentan con diferentes frecuencias y gravedad ambos tipos de toxicidad y de este modo las consideraremos en esta revisión sobre su manejo y tratamiento.
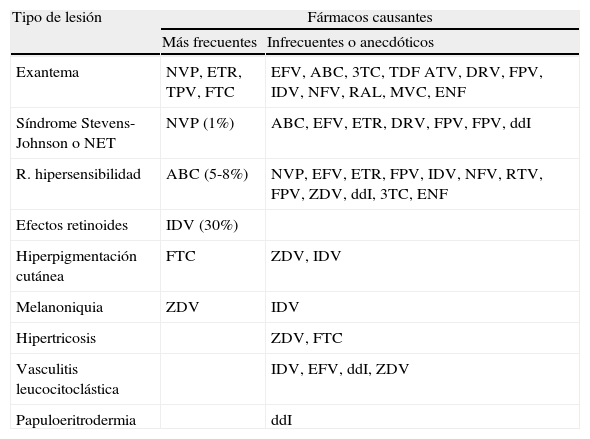
Toxicidad precoz por fármacos antirretroviralesAlteraciones cutáneasEn general, las reacciones cutáneas producidas por los antirretrovirales (ARV) son de aparición temprana, aunque algunas, como los efectos retinoides y las alteraciones pigmentarias, pueden presentarse más tardíamente. En cuanto a su espectro, abarcan desde formas absolutamente inocuas hasta otras muy graves que comprometen la vida del paciente.
Las erupciones exantemáticas morbiliformes y maculopapulosas son las reacciones cutáneas más comunes, que llegan a afectar al 8-12% de los pacientes que reciben TAR2. Aunque todos los ARV pueden ocasionarlas, los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN) y abacavir (ABC) son los que lo hacen con mayor frecuencia (tabla 1). Suelen aparecer en las primeras semanas de tratamiento y acompañarse de prurito. Se resuelven varios días después de la retirada del ARV responsable (formalmente indicada si el exantema es de grado 2b-4) y su tratamiento de elección lo constituyen los antihistamínicos, aunque cuando son intensas, se recomienda el uso de corticoides. La erupción debida a nevirapina (NVP), más frecuente en el sexo femenino, en mujeres con cifras de linfocitos CD4+ superiores a 250 células/μl y en varones con más de 400 células/μl, puede prevenirse subiendo progresivamente la dosis durante las primeras semanas de tratamiento3. Se ha descrito un 40-50% de reactividad cruzada entre la erupción cutánea de NVP y la de efavirenz (EFV), pero no entre las de ambos y la de etravirina (ETR). Por ello, si el exantema es intenso o grave, no es aconsejable la introducción de EFV tras una erupción de NVP o viceversa.
Efectos adversos cutáneo-mucosos y ungueales asociados con los antirretrovirales
| Tipo de lesión | Fármacos causantes | |
| Más frecuentes | Infrecuentes o anecdóticos | |
| Exantema | NVP, ETR, TPV, FTC | EFV, ABC, 3TC, TDF ATV, DRV, FPV, IDV, NFV, RAL, MVC, ENF |
| Síndrome Stevens-Johnson o NET | NVP (1%) | ABC, EFV, ETR, DRV, FPV, FPV, ddI |
| R. hipersensibilidad | ABC (5-8%) | NVP, EFV, ETR, FPV, IDV, NFV, RTV, FPV, ZDV, ddI, 3TC, ENF |
| Efectos retinoides | IDV (30%) | |
| Hiperpigmentación cutánea | FTC | ZDV, IDV |
| Melanoniquia | ZDV | IDV |
| Hipertricosis | ZDV, FTC | |
| Vasculitis leucocitoclástica | IDV, EFV, ddI, ZDV | |
| Papuloeritrodermia | ddI | |
3TC: lamivudina; ABC: abacavir; ATV: atazanavir; ddI: didanosina; DRV: darunavir; EFV: efavirenz; ENF: enfuvirtide; ETR: etravirina; FPV: fosamprenavir; FTC: emtricitabina; IDV: indinavir; MVC; maraviroc; NFV: nelfinavir; NVP: nevirapina; RAL: raltegravir; TPV: tipranavir; ZDV: zidovudina.
El síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica rara vez son producidos por ARV; no obstante, NVP es el que con mayor frecuencia (0,5-1%) puede ocasionarlos (tabla 1)4. Es importante saber que ambas reacciones pueden iniciarse como una erupción morbiliforme que evoluciona a pápulas, ampollas confluentes y despegamiento epidérmico. En lo que respecta a su manejo terapéutico, es vital realizar una inmediata retirada del agente causal, que debe ir acompañada del mantenimiento del estado hidroelectrolítico y nutricional, así como de la prevención y tratamiento de infecciones bacterianas secundarias.
Los efectos retinoides (queilitis, xerosis, eccema esteatósico, alopecia, paroniquia, onicodistrofia, etc.), denominados así por remedar las lesiones cutáneas y ungueales inducidas por los retinoides orales, son mayoritariamente causados por indinavir (IDV) y remiten tras la retirada de este. La hiperpigmentación cutánea es una anomalía meramente estética que suele revertir lentamente cuando se retira el ARV responsable, por regla general emtricitabina (FTC) o zidovudina (ZDV). Este último inhibidor de la transcriptasa inversa análogo de nucleósidos (ITIAN) produce también una hiperpigmentación ungueal típica en forma de banda (melanoniquia longitudinal).
Reacciones de hipersensibilidadSe han descrito reacciones de hipersensibilidad (RHS) a múltiples ARV (tabla 1), pero es abacavir (ABC) el que más frecuentemente las produce (alrededor del 5%)5. La RHS por ABC aparece durante las primeras 6 semanas de tratamiento en el 90% de los casos (media, 11 días) y se caracteriza por la asociación de un exantema morbiliforme o maculopapular, generalmente leve o moderado, con fiebre, artromialgias, síntomas gastrointestinales, respiratorios y constitucionales, a los cuales pueden añadirse también hipotensión, alteraciones de múltiples órganos (linfadenopatías, mucositis, hepatitis, nefritis intersticial, neumonitis, miocarditis, etc.) y alteraciones hematológicas, entre las que destaca la eosinofilia5,6. No obstante, el exantema puede no aparecer hasta en una tercera parte de los casos5. Puesto que su diagnóstico es clínico, la mejor ayuda para realizarlo es mantener un alto índice de sospecha. El cuadro clínico se resuelve tras suspender la administración de ABC, pero si este se mantiene o se reintroduce, puede progresar rápidamente y conllevar un fracaso multiorgánico y la muerte5–7. Por ello, ante la sospecha de una RHS por ABC debe retirarse este fármaco de forma inmediata y definitiva. Se debe informar al paciente de que el reinicio del tratamiento con ABC podría causarle una rápida recurrencia de los síntomas, más grave que la presentación inicial, e incluso la muerte.
Se ha demostrado la existencia de una estrecha asociación entre la presencia del haplotipo HLA-B*5701 y el desarrollo de RHS a ABC. La ausencia de HLA-B*5701 tiene un valor predictivo negativo del 100% respecto a la aparición de aquella7, por lo que se recomienda su investigación en todo paciente infectado por el VIH-1 que vaya a comenzar tratamiento con ABC. Por la misma razón, el uso de este ITIAN está contraindicado en los portadores del alelo HLA-B*5701.
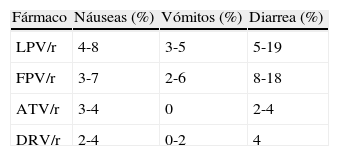
Trastornos gastrointestinalesNáuseas, vómitos y diarrea son los efectos adversos agudos más frecuentes y los que más a menudo motivan la sustitución de los ARV8, entre los que destacan los inhibidores de la proteasa (IP) como sus causantes. Los IP actuales, potenciados con pequeñas dosis de ritonavir (lopinavir [LPV/r], fosamprenavir [FPV/r], atazanavir [ATV/r] y darunavir [DRV/r]), producen menos trastornos gastrointestinales que los IP más antiguos (ritonavir [RTV] a dosis plenas, IDV y nelfinavir [NFV]), si bien su frecuencia varía sustancialmente de unos IP/r a otros, que es bastante mayor para LPV/r y FPV/r que para ATV/r y DRV/r (tabla 2). Saquinavir (SQV/r), otro de los IP más antiguos, tiene un perfil de toxicidad gastrointestinal intermedio. Los datos de tipranavir (TPV/r), un IP actualmente muy poco utilizado, son muy escasos, pero posiblemente sus efectos gastrointestinales sean parecidos a los de los IP/r peor tolerados.
Prevalencia de los efectos adversos gastrointestinales producidos por los inhibidores de la proteasa potenciados más utilizados en la actualidad
| Fármaco | Náuseas (%) | Vómitos (%) | Diarrea (%) |
| LPV/r | 4-8 | 3-5 | 5-19 |
| FPV/r | 3-7 | 2-6 | 8-18 |
| ATV/r | 3-4 | 0 | 2-4 |
| DRV/r | 2-4 | 0-2 | 4 |
ATV/r: atazanavir/ritonavir; DRV/r: darunavir/ritonavir; FPV/r: fosamprenavir/ritonavir; LPV/r: lopinavir/ritonavir.
Los ITIAN inducen relativamente pocos trastornos gastrointestinales, los cuales, no obstante, son más frecuentes con ZDV y ddI que con ABC y tenofovir (TDF)2. Los ITINN ocasionan aún menos efectos adversos de este tipo y los ARV de las nuevas familias, como los inhibidores de la integrasa, los antagonistas de CCR5 y los inhibidores de la fusión, tienen una excelente tolerabilidad gastrointestinal2. El tratamiento de estos trastornos incluye la sustitución del agente causal cuando son intensos o no desaparecen, además de antieméticos o antidiarreicos como loperamida. Asimismo, pueden servir de ayuda determinadas medidas dietéticas como, por ejemplo, aumentar la ingesta de alimentos ricos en fibras vegetales.
Efectos adversos neuropsiquiátricosNo constituyen una toxicidad común a diversos ARV ni a los de una misma clase, sino que se asocian característicamente con EFV, fármaco que los produce en la mitad o más de los pacientes a los que se les administra9. Su espectro clínico es muy amplio, pero los más comunes son: trastornos del sueño (sueños anormales o vívidos, insomnio, somnolencia), mareos, dificultad de concentración, confusión, cefalea, irritabilidad y nerviosismo9. Con menos frecuencia EFV se asocia a depresión y más rara vez aún a ideas suicidas y a reacciones paranoides o maníacas. Estos efectos adversos suelen desaparecer durante las primeras 24 semanas de tratamiento, la mayoría de las veces entre la segunda y la cuarta semana9, pero en un 10-15% de los pacientes persisten durante periodos prolongados, especialmente los trastornos del sueño y el nerviosismo10,11. En estos casos persistentes, constituyen un motivo frecuente de interrupción del tratamiento. Entre los factores favorecedores de la toxicidad neuropsiquiátrica de EFV, cabe destacar la presencia del polimorfismo CYP2B6 T/T en la posición G516T, que se asocia con concentraciones plasmáticas más elevadas de EFV12 y la existencia de enfermedades psiquiátricas previas. También ZDV puede ocasionar efectos adversos neuropsiquiátricos (sobre todo cefalea y confusión), pero en mucha menor cuantía que EFV, y aún más raramente lo hacen otros ARV.
Con el fin de prevenir los efectos adversos neuropsiquiátricos, especialmente los más intensos, se aconseja evitar la administración de EFV a pacientes con comorbilidades psiquiátricas (depresión, esquizofrenia, etc.). Se ha comunicado que la dosificación escalonada de EFV (200mg/día durante los días 1-6, 400mg/día durante los días 7-13 y 600mg/día a partir del día 14) reduce significativamente la frecuencia inicial de mareos, trastornos de la concentración y alucinaciones, sin menoscabar su eficacia virológica13. Asimismo, para minimizar estos efectos se aconseja tomar EFV por la noche, antes de acostarse. Y en cuanto a la farmacoterapia, los mareos pueden contrarrestarse con antihistamínicos del tipo meclizina o dimenhidrinato; para ayudar a conciliar el sueño puede utilizarse zolpidem, lorazepam o difenhidramina (un antihistamínico con efecto sedante); y para evitar la interrupción precoz del sueño: trazodona. Cuando los síntomas son intensos o persistentes conviene sustituir EFV por otro fármaco de la misma o distinta familia.
HepatotoxicidadLa toxicidad hepática por ARV constituye otro de los efectos adversos agudos más frecuentes del TAR (5-10%) y uno de los motivos más importantes para la suspensión de este14. Su espectro clínico es muy variado y abarca desde elevaciones de las enzimas hepáticas (EEH) asintomáticas y transitorias hasta, mucho más raramente, la hepatitis aguda fulminante. Asimismo, su patogenia puede estar mediada por mecanismos muy diversos: toxicidad directa, reacción inmunoalérgica, daño mitocondrial, reconstitución inmune, esteatohepatitis, etc.14. La coinfección por los virus de las hepatitis B (VHB) y C (VHC), el genotipo 3 de este último y una ingesta elevada de alcohol favorecen el desarrollo de toxicidad hepática por los ARV14.
Diversos ARV de las distintas familias se han asociado con hepatotoxicidad14. Entre los ITINN, NVP presenta un mayor riesgo de inducir reacciones inmunoalérgicas con afección hepática potencialmente grave en pacientes que previamente no han realizado TAR y tienen más de 250 células CD4/μl si son mujeres y más de 400 células CD4/μl en los varones. A más largo plazo, y probablemente por toxicidad directa, los ITINN pueden producir también EEH, en particular en los pacientes coinfectados con VHC o VHB15. Sin embargo, no suele ocurrir toxicidad hepática cruzada entre NVP y EFV15, y menos aún entre ellos y ETR. Los IP potenciados actuales son mucho menos hepatotóxicos que RTV a dosis plenas, IDV y NFV, cuyo uso en los países desarrollados puede considerarse como anecdótico. Entre los ITIAN, estavudina (d4T), ZDV y didanosina (ddI), que pueden inducir daño mitocondrial, y ABC, que puede ocasionar una RHS con afectación hepática, son potencialmente más hepatotóxicos que TDF, 3TC y FTC. Las nuevas familias de ARV (inhibidores de la integrasa, antagonistas de CCR5, etc.) tienen un perfil de seguridad hepática muy favorable14.
Se ha descrito una nueva forma de hepatotoxicidad, la hipertensión portal no-cirrótica, que se asocia con el uso prolongado de ddI y se produce a consecuencia de la obliteración de las venas portales terminales16,17.
El tratamiento de la hepatotoxicidad depende de su mecanismo patogénico, de su repercusión clínica y de la gravedad del daño hepático18. Existe una indicación neta de suspender inmediatamente el TAR causante de la hepatotoxicidad cuando: a) se trata de una hepatitis sintomática y especialmente si presenta ictericia franca; b) se sospecha que sea una manifestación de una RHS (aparición precoz, coexistencia con lesiones cutáneas y síntomas sistémicos, etc.); c) cursa con una descompensación de una hepatopatía crónica previa (encefalopatía, ascitis, ictericia, etc.); d) ocurre en el contexto de una acidosis láctica por ITIAN (véase a continuación), y e) se presenta con una EEH de grado 4 (10 o más veces los valores normales de laboratorio o más de 3-5 veces las cifras existentes antes de iniciar el tratamiento)14,18. Además, si se trata de una RHS con manifestaciones cutáneo-mucosas y sistémicas graves está indicada la administración de corticoides14, y si existe una acidosis láctica grave secundaria a toxicidad mitocondrial, es conveniente administrar riboflavina, L-carnitina, coenzima Q y vitamina C (véase más adelante). En todos los casos, una vez se haya resuelto el cuadro clínico, puede reintroducirse una nueva combinación de ARV, evitando los que sean sospechosos de haberlo ocasionado y los que tengan un peor perfil de hepatotoxicidad14,18.
Por último, en ausencia de los criterios de gravedad anteriormente mencionados, y una vez eliminados otros potenciales agentes hepatotóxicos, como alcohol y otros fármacos, puede continuarse el tratamiento bajo una estrecha monitorización de las enzimas hepáticas14,18.
HiperbilirrubinemiaDeterminados IP, como IDV y especialmente atazanavir (ATV), ocasionan hiperbilirrubinemia. Se debe al incremento de la bilirrubina indirecta resultante de la inhibición de la enzima uridina difosfato glucuroniltransferasa (UGT) por los mencionados IP, y no a daño hepático. La hiperbilirrubinemia por ATV se asocia con el haplotipo UGT1A1*28, variante genética causante del síndrome de Gilbert19. Con menor frecuencia (4-7%), los pacientes tratados con ATV desarrollan ictericia conjuntival y/o cutánea, que, aunque es una complicación puramente estética, puede ser interpretada como hepatotoxicidad y causar problemas psicológicos a los pacientes. El manejo de este efecto adverso consiste en la retirada del fármaco causante cuando sea necesario por motivos de intensidad o persistencia de la ictericia.
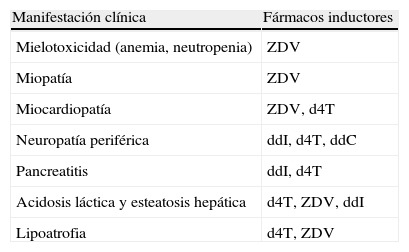
Toxicidad mitocondrialLos análogos de la timidina y didenucleósidos (d4T, ZDV, ddI y ddC) inhiben la enzima ADN-γ-polimerasa humana, que conlleva menor síntesis de ADN mitocondrial, disfunción oxidativa de la cadena respiratoria mitocondrial y menor producción de energía, a resultas de todo lo cual aumenta la producción de lactato y se dañan diversos órganos y sistemas. En la tabla 3 se muestran las distintas anomalías que tiene en común este mecanismo patogénico. Todas ellas son hoy en día mucho menos frecuentes como consecuencia del desuso total o parcial de los ITIAN anteriormente mencionados.
Efectos adversos de los antirretrovirales utilizados en la actualidad debidos a toxicidad mitocondrial
| Manifestación clínica | Fármacos inductores |
| Mielotoxicidad (anemia, neutropenia) | ZDV |
| Miopatía | ZDV |
| Miocardiopatía | ZDV, d4T |
| Neuropatía periférica | ddI, d4T, ddC |
| Pancreatitis | ddI, d4T |
| Acidosis láctica y esteatosis hepática | d4T, ZDV, ddI |
| Lipoatrofia | d4T, ZDV |
d4T: estavudina; ddC: zalcitabina; ddI: didanosina; ZDV: zidovudina.
El trastorno más grave de este grupo es la acidosis láctica (hiperlactatemia, acidosis metabólica tipo B y esteatosis hepática microvesicular), que tiene una mortalidad superior al 50%20. Antes de instaurarse la acidosis y los síntomas derivados de ella (hiperventilación, disnea, etc.) suele existir una hiperlactatemia sintomática caracterizada por concentraciones plasmáticas más bajas de lactato y un cuadro inespecífico de astenia, anorexia, náuseas y dolor abdominal, cuyo pronóstico es excelente. La determinación sistemática de lactato no es útil y sólo está indicada si existe un cuadro compatible. El diagnóstico implica un alto grado de sospecha y debe ser lo más precoz posible para evitar la acidosis láctica. El manejo clínico depende de la situación clínica del paciente, pero siempre empieza por la suspensión del ITIAN causante. Una vez normalizados los valores de lactato, debe reinstaurarse el TAR con un régimen libre de ITIAN, o con ITIAN que no suelen asociarse a toxicidad mitocondrial (ABC, 3TC, FTC, TDF), vigilando siempre la posible reaparición de manifestaciones clínicas o analíticas21. En los casos de acidosis láctica la administración de tiamina, riboflavina, L-carnitina, coenzima Q, vitaminas E y C, etc., se ha asociado a un mejor pronóstico, aunque no existen ensayos clínicos al respecto20,21.
La neuropatía periférica de los didenucleósidos es muy similar a la que produce la propia infección por el VIH (polineuropatía axonal de predominio sensitivo) y su incidencia está directamente relacionada con la dosis del fármaco22. A las dosis actualmente utilizadas su frecuencia es del 10% para d4T y del 1-7% para ddI. El tratamiento se basa en la retirada del ITIAN causante (la mejoría suele ocurrir 3-6 semanas después, aunque no en todos los pacientes23) y el alivio del dolor. A este respecto se ha demostrado la eficacia de la lamotrigina a dosis de 200mg/12h24 y de la L-acetil-carnitina25. En los casos de dolor intenso y refractario, puede recurrirse a los derivados morfínicos en parches cutáneos de liberación retardada.
Toxicidad a largo plazo de los fármacos antirretroviralesComo previamente ya se ha comentado, una peculiaridad del TARGA es que precisa administrarse de forma indefinida, probablemente durante toda la vida del paciente, hecho que facilita que la toxicidad inherente a los componentes de un determinado régimen antirretroviral pueda acumularse a lo largo de la exposición del paciente a estos. Las toxicidades secundarias al TARGA que pueden adoptar un perfil temporal más prolongado suponen una carga de comorbilidad importante que puede precisar intervenciones farmacológicas que en ocasiones, a través de interacciones con los antirretrovirales, pueden causar toxicidad adicional. Muchas de las toxicidades a largo plazo del TARGA adoptan un perfil similar al de los procesos fisiológicos o comorbilidades relacionados con el envejecimiento y, en el momento actual, se considera que dicha toxicidad contribuye a la senescencia prematura que presentan los pacientes con infección por el VIH-1.
Anomalías metabólicas y RCVEste grupo de trastornos incluye dislipemia, resistencia a la insulina y diabetes mellitus, todos los cuales son más frecuentes con los IP de primera generación que con los IP potenciados actualmente utilizados y con los análogos de timidina que con los demás análogos de nucleósidos. Asimismo, todas estas anomalías son más comunes en los pacientes con redistribución de la grasa corporal.
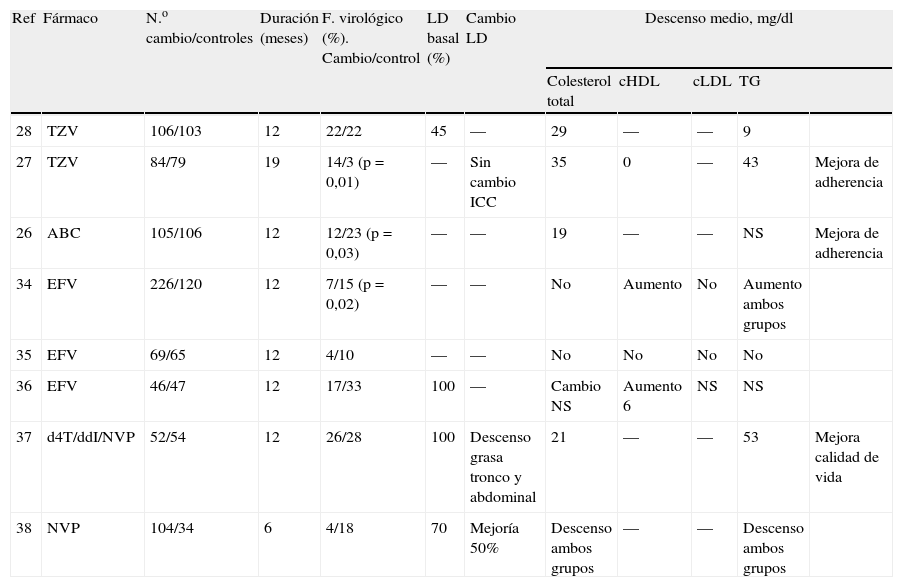
Básicamente existen dos tipos de estrategias para el manejo de la dislipemia asociada a la infección por el VIH-1 y al TARGA, que no son en absoluto excluyentes; a saber, sustitución de los fármacos implicados en la génesis de la dislipemia y/o tratamiento hipolipemiante. La sustitución del IP por abacavir (ABC) se ha asociado, en estudios aleatorizados, a una disminución significativa de colesterol total (diferencia media de 24mg/dl)26–28 y también con descensos de triglicéridos10,11 (tablas 4 y 526–28,34–38,30,39,40). Cuando se ha medido el colesterol HDL, o bien no se han hallado diferencias significativas27 o se ha objetivado un descenso tras 6 meses29. Existe coincidencia prácticamente total en los estudios de sustitución del IP por nevirapina (NVP), en la mejoría de los valores de triglicéridos tras el cambio, mientras que los datos sobre colesterol son contradictorios, aunque cuando se ha medido el colesterol HDL, se observan incrementos significativos (tablas 4 y 526–28,34–38,30,39,40)29–31. En los estudios de sustitución del IP por efavirenz (EFV) (tablas 4 y 526–28,34–38,30,39,40), tras una mediana de seguimiento de 12 meses, se ha documentado únicamente un incremento del colesterol HDL con respecto al basal32. El colesterol total, el colesterol LDL y los triglicéridos no varían significativamente tras la sustitución del IP por EFV. Existe un único estudio que ha comparado la estrategia de switching de un IP a un ITINN y el tratamiento clásico de las dislipemias con bezafibrato o pravastatina, demostrando la superioridad de la estrategia de intervención farmacológica con hipolipemiantes frente a la estrategia de switching33.
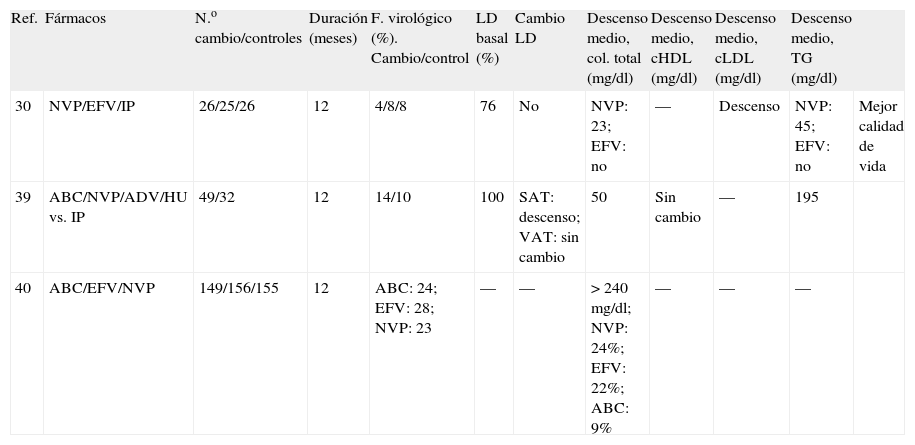
Estudios aleatorizados de sustitución de inhibidores de proteasa por abacavir, efavirenz o nevirapina
| Ref | Fármaco | N.o cambio/controles | Duración (meses) | F. virológico (%). Cambio/control | LD basal (%) | Cambio LD | Descenso medio, mg/dl | ||||
| Colesterol total | cHDL | cLDL | TG | ||||||||
| 28 | TZV | 106/103 | 12 | 22/22 | 45 | — | 29 | — | — | 9 | |
| 27 | TZV | 84/79 | 19 | 14/3 (p=0,01) | — | Sin cambio ICC | 35 | 0 | — | 43 | Mejora de adherencia |
| 26 | ABC | 105/106 | 12 | 12/23 (p=0,03) | — | — | 19 | — | — | NS | Mejora de adherencia |
| 34 | EFV | 226/120 | 12 | 7/15 (p=0,02) | — | — | No | Aumento | No | Aumento ambos grupos | |
| 35 | EFV | 69/65 | 12 | 4/10 | — | — | No | No | No | No | |
| 36 | EFV | 46/47 | 12 | 17/33 | 100 | — | Cambio NS | Aumento 6 | NS | NS | |
| 37 | d4T/ddI/NVP | 52/54 | 12 | 26/28 | 100 | Descenso grasa tronco y abdominal | 21 | — | — | 53 | Mejora calidad de vida |
| 38 | NVP | 104/34 | 6 | 4/18 | 70 | Mejoría 50% | Descenso ambos grupos | — | — | Descenso ambos grupos | |
ABC: abacavir; cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; ddI: didanosina; d4T: estavudina; EFV: efavirenz; LD: lipodistrofia; NVP: nevirapina; TG: triglicéridos; TZV: trizivir.
Estudios aleatorizados de sustitución de inhibidores de proteasa por más de un fármaco
| Ref. | Fármacos | N.o cambio/controles | Duración (meses) | F. virológico (%). Cambio/control | LD basal (%) | Cambio LD | Descenso medio, col. total (mg/dl) | Descenso medio, cHDL (mg/dl) | Descenso medio, cLDL (mg/dl) | Descenso medio, TG (mg/dl) | |
| 30 | NVP/EFV/IP | 26/25/26 | 12 | 4/8/8 | 76 | No | NVP: 23; EFV: no | — | Descenso | NVP: 45; EFV: no | Mejor calidad de vida |
| 39 | ABC/NVP/ADV/HU vs. IP | 49/32 | 12 | 14/10 | 100 | SAT: descenso; VAT: sin cambio | 50 | Sin cambio | — | 195 | |
| 40 | ABC/EFV/NVP | 149/156/155 | 12 | ABC: 24; EFV: 28; NVP: 23 | — | — | > 240 mg/dl; NVP: 24%; EFV: 22%; ABC: 9% | — | — | — |
ABC: abacavir; cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; col: colesterol; EFV: efavirenz; HU: hidroxiurea; IP: inhibidor de proteasa; NVP: nevirapina; TG: triglicéridos.
La implicación de los ITIAN, especialmente de los análogos de timidina, en la patogénesis de la dislipemia asociada a los regímenes TARGA, ha hecho que la estrategia de switching se aplicara también a los componentes ITIAN del TARGA41,42. El fármaco implicado más frecuentemente ha sido estavudina (d4T), y en diversos estudios, se ha demostrado que la sustitución de d4T por tenofovir o por ABC se acompaña de una rápida y significativa mejoría de las cifras de triglicéridos y de colesterol41–43.
La sustitución del IP por NVP o EFV se ha asociado a mejoría de la resistencia a la insulina tras 12 meses (tablas 4 y 5)36,44. En el subestudio metabólico del NEFA29, se observó un descenso de las concentraciones de insulina en las tres ramas de tratamiento. Otro estudio efectuado en nuestro país no mostró mejoría de la resistencia a la insulina después de un año del cambio del IP por EFV32.
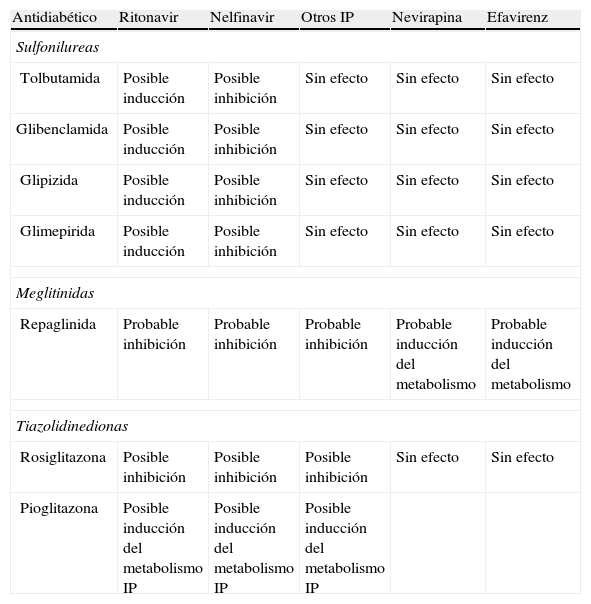
El manejo terapéutico de las dislipemias asociadas a la infección por el VIH-1 y al TARGA se halla estratificado en varios escalones terapéuticos, siendo las medias de inicio comunes a las de los sujetos sin infección por el VIH-1, e incluyen medidas dietéticas y ejercicio físico, conjuntamente con las modificaciones de los regímenes de TARGA previamente comentadas. Sin embargo, en la mayoría de los casos serán precisas medidas terapéuticas adicionales en forma de intervención con fármacos hipolipemiantes. Las posibles interacciones de los ITIAN con los fármacos utilizados en el tratamiento de las complicaciones metabólicas son muy improbables (tabla 6). Los efectos de los antirretrovirales en el metabolismo de los agentes hipolipemiantes se halla esquematizado en la tabla 645. No existen evidencias disponibles, hasta el momento actual, sobre las interacciones entre agentes antidiabéticos y antirretrovirales incluyendo los inhibidores de la integrasa y los antagonistas CCR5. La mayoría de las sulfonilureas de primera y segunda generación son metabolizadas a través del CYP2C9, el cual es inducido por algunos IP (ritonavir y nelfinavir), con lo que existe base teórica para ajustes de dosis en caso de uso simultáneo de ambos fármacos45. Las posibles interacciones entre biguanidas, tiazolidinedionas y TARGA se describen en el siguiente apartado.
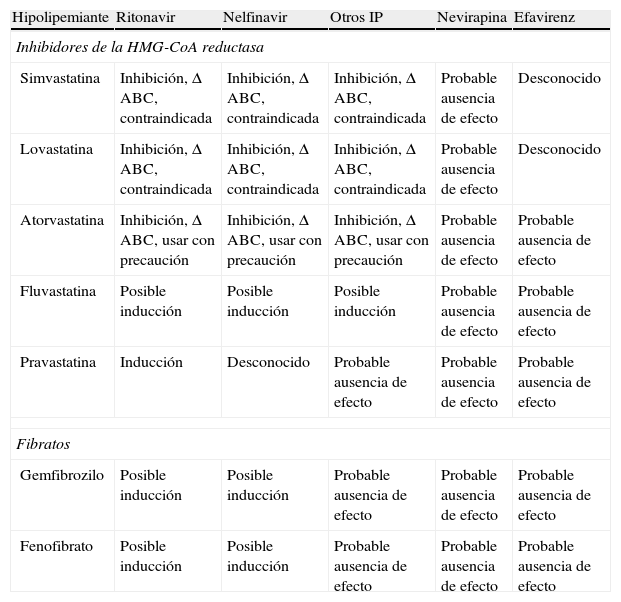
Efectos descritos y potenciales de los antirretrovirales en el metabolismo de los agentes hipolipemiantes
| Hipolipemiante | Ritonavir | Nelfinavir | Otros IP | Nevirapina | Efavirenz |
| Inhibidores de la HMG-CoA reductasa | |||||
| Simvastatina | Inhibición, Δ ABC, contraindicada | Inhibición, Δ ABC, contraindicada | Inhibición, Δ ABC, contraindicada | Probable ausencia de efecto | Desconocido |
| Lovastatina | Inhibición, Δ ABC, contraindicada | Inhibición, Δ ABC, contraindicada | Inhibición, Δ ABC, contraindicada | Probable ausencia de efecto | Desconocido |
| Atorvastatina | Inhibición, Δ ABC, usar con precaución | Inhibición, Δ ABC, usar con precaución | Inhibición, Δ ABC, usar con precaución | Probable ausencia de efecto | Probable ausencia de efecto |
| Fluvastatina | Posible inducción | Posible inducción | Posible inducción | Probable ausencia de efecto | Probable ausencia de efecto |
| Pravastatina | Inducción | Desconocido | Probable ausencia de efecto | Probable ausencia de efecto | Probable ausencia de efecto |
| Fibratos | |||||
| Gemfibrozilo | Posible inducción | Posible inducción | Probable ausencia de efecto | Probable ausencia de efecto | Probable ausencia de efecto |
| Fenofibrato | Posible inducción | Posible inducción | Probable ausencia de efecto | Probable ausencia de efecto | Probable ausencia de efecto |
ABC: área bajo la curva; IP: inhibidor de proteasa; Δ: incremento.
Al igual que en la población general, los factores de riesgo tradicionales son los que determinan principalmente el riesgo de desarrollar enfermedad cardiovascular en los pacientes infectados por el VIH-1. En estos, no obstante, la infección por el VIH-1 no controlada y ciertos regímenes de TARGA incrementan también dicho riesgo, aunque es muy probable que la contribución de estos últimos sea menor que la de los otros factores anteriormente mencionados. El efecto en el riesgo cardiovascular de los IP como familia está mediado, al menos en parte, por la dislipemia asociada con el uso de estos fármacos. Un análisis de la cohorte D:A:D ha revelado que determinados IP (IDV, LPV/r) están relacionados con un mayor riesgo de infarto de miocardio, que no puede justificarse exclusivamente por dicha anomalía metabólica46. Este mismo estudio ha mostrado también que el uso reciente (últimos 6 meses) de ABC o ddI se asocia con un mayor riesgo de infarto agudo de miocardio, especialmente en los pacientes que tienen un riesgo cardiovascular más elevado46. No obstante, la relación entre ABC e infarto de miocardio es un motivo de controversia, pues aunque ha sido constatada también en el estudio SMART y en sendos estudios de casos y controles47, otros estudios de cohortes y numerosos ensayos clínicos señalan que dicha relación es inexistente ni se ha demostrado un mecanismo biológico plausible para esta48. Todos estos estudios tienen numerosos sesgos que no es posible controlar de forma adecuada y que ponen en duda la contribución causal de los mencionados ITIAN en el desarrollo de la enfermedad cardiovascular.
El manejo del riesgo cardiovascular en pacientes con infección por el VIH-1 es similar al de la población general y deben incluir: modificación de los hábitos higiénico-dietéticos con control del peso del sujeto, abstinencia de tabaco (dado que es mayor contribuidor neto al riesgo cardiovascular), control adecuado de la dislipemia según las directrices establecidas por el NCEP, de la homeostasis de la glucosa, de la presión arterial y otros factores de riesgo (hipertrigliceridemia, hiperuricemia, etc.)49. En el caso de los pacientes con infección por el VIH-1, la propia infección sin tratamiento se considera un factor de riesgo cardiovascular con una importancia similar a la de la diabetes mellitus, por lo que muchas guías de TAR consideran que debe ofrecerse tratamiento para la infección por el VIH-1 si el paciente tiene un elevado RCV (> 20% a los 10 años) aunque no cumpla los criterios especificados de cifras de linfocitos CD450.
Anomalías de la distribución de la grasa corporalEl síndrome de lipodistrofia se caracteriza por la presencia, combinada o no, de pérdida de grasa periférica (lipoatrofia) y de acúmulo de grasa perivisceral y/o en abdomen, mamas (mujeres) y cuello (lipoacumulación)51. Como en las alteraciones metabólicas, las dos estrategias utilizadas son el cambio de fármacos implicados (los ITIAN timidínicos en este caso) y/o la intervención farmacológica, mientras que constituye una peculiaridad de dichos síndromes la cirugía plástica o reparadora mediante relleno facial para corrección de la lipoatrofia y la liposucción para la eliminación de lipoacúmulos52. No obstante, la evaluación de los cambios en la distribución de la grasa corporal en pacientes sometidos a regímenes TARGA resulta en extremo difícil por la falta de una definición del síndrome, por la escasa uniformidad de los estudios y por la falta de medidas objetivas en la mayoría de los estudios.
Ni la metformina ni rosiglitazona han demostrado efecto beneficioso alguno en la lipoatrofia en ensayos clínicos aleatorizados52. Existe un único ensayo clínico aleatorizado con pioglitazona que ha demostrado que su uso se asocia con incremento de la grasa periférica53. Las posibles interacciones de estos fármacos con los antirretrovirales se exponen en la tabla 7. La uridina, que parecía un agente potencialmente útil, no ha podido demostrar, en un ensayo clínico aleatorizado, beneficio alguno en cuanto a reversión de la lipoatrofia54. En resumen, no existe ninguna intervención farmacológica satisfactoria y la única que proporciona una satisfacción estética inmediata es la cirugía reparadora. Por lo tanto, la mejor opción consiste en evitar la aparición de lipoatrofia, cuya incidencia ha disminuido de forma notable con la práctica eliminación del uso de análogos de la timidina en el TAR.
Efectos potenciales de los antirretrovirales en el metabolismo de los antidiabéticos
| Antidiabético | Ritonavir | Nelfinavir | Otros IP | Nevirapina | Efavirenz |
| Sulfonilureas | |||||
| Tolbutamida | Posible inducción | Posible inhibición | Sin efecto | Sin efecto | Sin efecto |
| Glibenclamida | Posible inducción | Posible inhibición | Sin efecto | Sin efecto | Sin efecto |
| Glipizida | Posible inducción | Posible inhibición | Sin efecto | Sin efecto | Sin efecto |
| Glimepirida | Posible inducción | Posible inhibición | Sin efecto | Sin efecto | Sin efecto |
| Meglitinidas | |||||
| Repaglinida | Probable inhibición | Probable inhibición | Probable inhibición | Probable inducción del metabolismo | Probable inducción del metabolismo |
| Tiazolidinedionas | |||||
| Rosiglitazona | Posible inhibición | Posible inhibición | Posible inhibición | Sin efecto | Sin efecto |
| Pioglitazona | Posible inducción del metabolismo IP | Posible inducción del metabolismo IP | Posible inducción del metabolismo IP | ||
IP: inhibidor de proteasa.
TDF puede inducir toxicidad renal en una pequeña proporción de pacientes. Su incidencia en estudios de cohorte55 es mayor que la observada en ensayos clínicos, en los que solamente se ha encontrado una reducción discreta (aproximadamente del 10%) y no progresiva del filtrado glomerular55. Esta complicación consiste en una disfunción tubular y se manifiesta como un síndrome de Fanconi acompañado de una disminución del filtrado glomerular55. Es más frecuente cuando coincide con otros factores de riesgo (insuficiencia renal previa o concomitante, diabetes, hipertensión arterial, fármacos nefrotóxicos, edad avanzada, bajo peso corporal y cifras bajas de CD4)55. La nefrotoxicidad por TDF suele revertir al retirar el fármaco, aunque dicha reversión puede no ser completa y precisar un largo intervalo de tiempo56. IDV y, con mucha menor frecuencia, ATV producen nefrolitiasis por depósito tubular de cristales. No existen intervenciones para corregir la toxicidad renal por FAR más allá de la retirada del fármaco ofensor y su sustitución por otro agente sin capacidad nefrotóxica, el control de los factores que afectan a la función renal (HTA, homeostasis de la glucosa, otros fármacos y especialmente AINE, etc.), mantener un estado adecuado de hidratación y, en casos graves, medidas de sustitución de la función renal. Como en todas las toxicidades, la evaluación de la función renal antes del inicio del TAR resulta mandatoria para evitar toxicidades futuras55.
Osteopenia/osteoporosisDiversos grupos de investigadores han documentado la asociación entre osteopenia y osteoporosis e infección por el VIH-1, fenómeno que puede incrementarse en el futuro conforme aumente la edad de los pacientes infectados y su exposición acumulada a antirretrovirales y al propio VIH-157. El fármaco antirretroviral más frecuentemente implicado es TDF, tanto en ensayos clínicos como estudios observacionales58. Por lo tanto, el manejo de esta complicación incluye, en un primer escalón, la retirada de TDF y su sustitución por otro fármaco y, en un segundo paso, el tratamiento con fármacos específicos. Los fármacos más frecuentemente utilizados para el tratamiento de la osteopenia y osteporosis son los bisfosfonatos. Ambos tienen una baja biodisponibilidad y son excretados sin cambio por vía renal, por lo que las interacciones con los antirretrovirales son poco probables45. Otras modalidades de tratamiento de la osteopenia/osteoporosis, incluyendo la vitamina D, la calcitonina, los suplementos de estrógenos y los moduladores selectivos de los receptores de estrógenos, es también muy poco probable que presenten interacciones adversas con los antirretrovirales actuales, aunque no existen estudios disponibles sobre la posibilidad de dichas interacciones45.
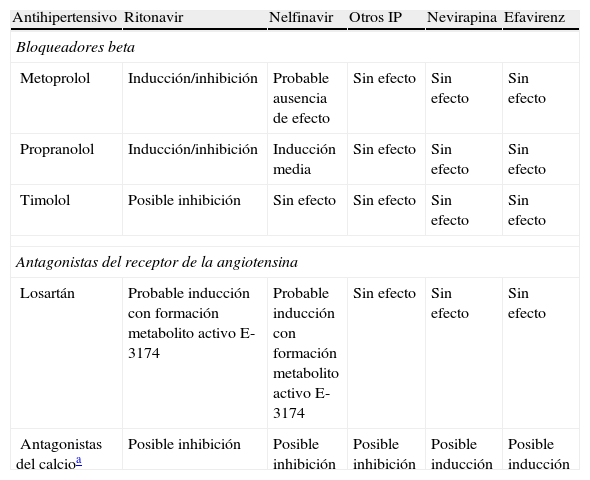
Otros efectos adversosLa hipertensión arterial constituye uno de los elementos integrantes del denominado síndrome metabólico, cuya incidencia en la población con infección por el VIH-1 con TARGA es significativamente superior a la de la población general59. Por lo tanto, el envejecimiento de la población infectada y una mayor incidencia de síndrome metabólico hacen prever la necesidad de tratamiento adicional para dicho síndrome en un futuro inmediato y, en consecuencia, la posibilidad de nuevas interacciones farmacológicas. Los antihipertensivos de eliminación renal, que inluyen los diuréticos, metildopa, clonidina y los inhibidores de la enzima de conversión de la angiotensina (IECA) probablemente no presentan interacciones significativas con los IP e ITINAN45. Por otro lado, muchos antihipertensivos se eliminan fundamentalmente por conjugación y, dado que RTV y NFV son inductores de las UDP-glucuroniltransferasas microsomales, existe potencialidad para interacción, dependiendo de qué enzimas de conjugación se utilicen en la eliminación de los antihipertensivos. Los tres grupos farmacológicos con mayor interés son aquellos en que las isoformas del citocromo P450 intervienen en su metabolismo y son los bloqueadores beta, los antagonistas del receptor de la angiotensina II y los antagonistas del calcio. Las principales interacciones potenciales de estas familias de fármacos se esquematizan en la tabla 8.
Efectos descritos y potenciales de los antirretrovirales en el metabolismo de los antihipertensivos
| Antihipertensivo | Ritonavir | Nelfinavir | Otros IP | Nevirapina | Efavirenz |
| Bloqueadores beta | |||||
| Metoprolol | Inducción/inhibición | Probable ausencia de efecto | Sin efecto | Sin efecto | Sin efecto |
| Propranolol | Inducción/inhibición | Inducción media | Sin efecto | Sin efecto | Sin efecto |
| Timolol | Posible inhibición | Sin efecto | Sin efecto | Sin efecto | Sin efecto |
| Antagonistas del receptor de la angiotensina | |||||
| Losartán | Probable inducción con formación metabolito activo E-3174 | Probable inducción con formación metabolito activo E-3174 | Sin efecto | Sin efecto | Sin efecto |
| Antagonistas del calcioa | Posible inhibición | Posible inhibición | Posible inhibición | Posible inducción | Posible inducción |
IP: inhibidor de proteasa.
Aunque la hiperuricemia no es un criterio definitorio de síndrome metabólico, frecuentemente se asocia a dicha constelación de síntomas. El tratamiento de elección en la mayor parte de los casos de hiperuricemia es el alopurinol. La administración de alopurinol es segura en el contexto de la mayoría de los regímenes TARGA, pero si estos integran didanosina, puede establecerse una interacción potencialmente peligrosa, incrementando de forma consecuente el riesgo del paciente de padecer toxicidad secundaria a didanosina, especialmente en forma de pancreatitis y neuropatía periférica60.
La disfunción sexual es un problema relativamente frecuente tanto en los varones como en las mujeres con infección por el VIH-1. Con respecto a los componentes de los regímenes TARGA con mayor responsabilidad en la aparición de disfunción sexual, esta clásicamente se ha asociado al tratamiento con inhibidores de proteasa, sobre todo IDV, y con EFV61. Adicionalmente, los hipolipemiantes también se han implicado como causa de disfunción sexual62. Desde hace unos años, se dispone de tratamiento efectivo de la disfunción eréctil, representado por sildenafilo, tadalafilo y vardenafilo. Dichos fármacos se metabolizan a través del CYP450 3A4 y, en consecuencia, su inhibición por el uso concomitante de IP puede causar un incremento de sus concentraciones plasmáticas, lo cual puede exacerbar los efectos adversos de sildenafilo en forma de cefalea, flushing, hipotensión y priapismo63. Por extrapolación, dichos datos se han extendido al resto de los IP y de fármacos utilizados en el tratamiento de la disfunción eréctil y, en la actualidad, en caso de coadministración de ambas clases de fármacos, se recomienda reducir la dosis inicial y, en todo caso, establecer una dosis máxima diaria64.
Determinantes genéticos de la toxicidad por antirretrovirales: papel de la toxicogenéticaLa aplicación de la farmacogénetica y su capacidad para determinar la eficacia y/o la toxicidad de un determinado fármaco han adquirido en tiempos recientes un notable protagonismo. La traslación más efectiva de la toxicogenética a la práctica clínica ha sido la implementación del cribado del HLA-B*5701 para evitar la reacción de hipersensibilidad a ABC7. No obstante, de forma menos exitosa, desde el punto de vista de su aplicación práctica, se han descrito múltiples polimorfismos de genes que codifican receptores, enzimas u otros elementos implicados en el metabolismo de los antirretrovirales, cuya actividad puede afectar a la concentración efectiva de un determinado fármaco y condicionar tanto su eficacia (por disminución de concentraciones) como su toxicidad (por aumento). Con respecto a esta última se han descrito polimorfismos en el gen que codifica CYP2B6 y que influye en las concentraciones plasmáticas de EFV y NVP, en el gen de UGT1A1 en la hiperbilirrubinemia asociada a IDV y ATV, en el del TNFα, polimerasa mitocondrial, interleucina-1β, y metaloproteasa 1 para la aparición de redistribución de la grasa corporal asociada a la infección por el VIH-1 y al TARGA65. Estos avances permiten suponer que el conocimiento presente y el por venir en este campo deberían idealmente permitir conocer, con antelación a la instauración del TAR, qué toxicidad es esperable en un sujeto determinado y con ello evitar el uso de fármacos antirretrovirales susceptibles de causar efectos adversos. Ello sin duda contribuirá a la mejor aceptación del TAR por parte del paciente y maximizará su adherencia, lo cual ha de redundar en un incremento de la tolerancia y eficacia.
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formación.