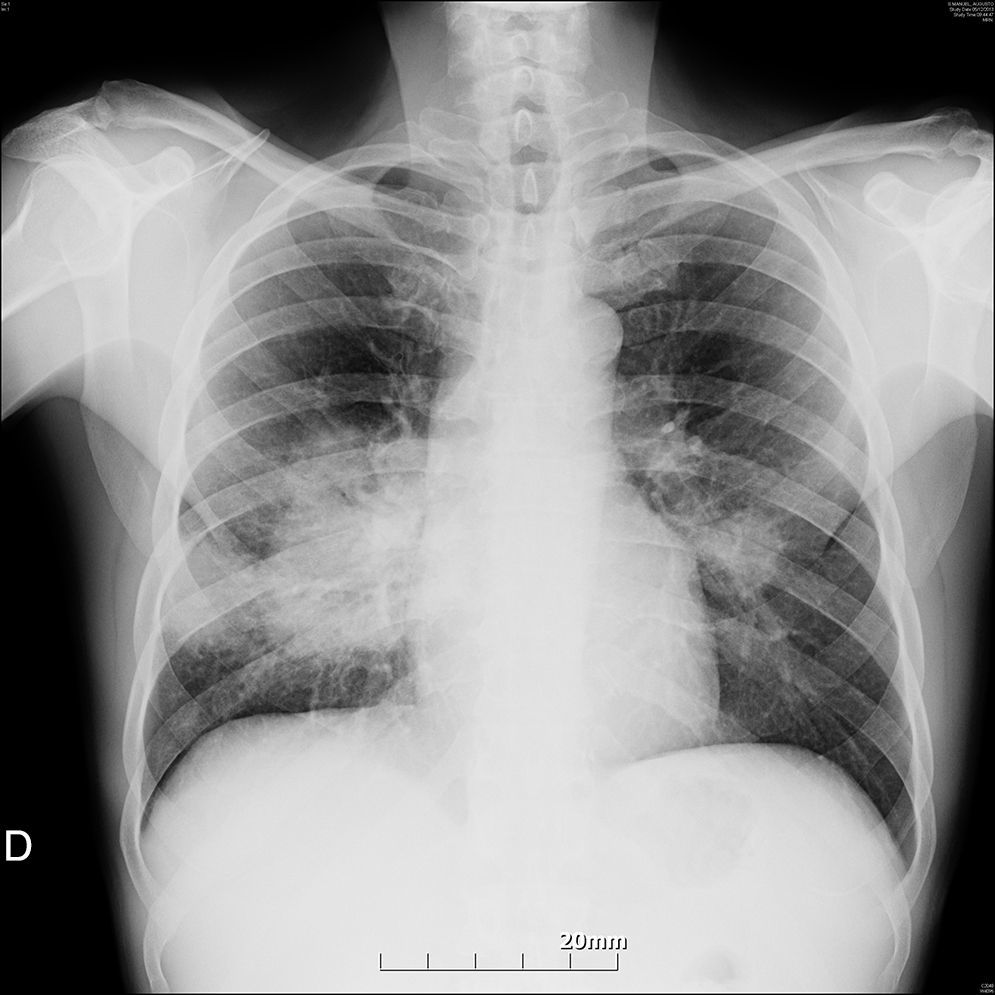
Varón homosexual de 48 años fumador de 80paquetes/año, originario de Portugal pero residente en España desde hace 22años, sin referir viajes a zonas tropicales. En junio de 2013 acude a Urgencias por malestar general, astenia y pérdida de peso. Tras realizarle una analítica en la que presentaba pancitopenia (1.710leucocitos/μl con fórmula normal, 11,9g/dl de hemoglobina y 83.000 plaquetas/μl) se le recomendó ingreso hospitalario, que rechazó. Vuelve a consultar en noviembre 2013 por fiebre de hasta 39°C, cefalea nocturna, disnea y pérdida de 20kg de peso en los últimos 5meses. A la exploración, el paciente se encuentra con regular estado general, deshidratado, desnutrido, taquipneico y con una saturación de oxígeno basal del 80%. El resto de la exploración física es anodina. El hemograma y la bioquímica elemental son normales. La radiografía y posterior TC de tórax muestran un infiltrado intersticial confluente bilateral. En la ecografía abdominal destacaba la presencia de hepatomegalia. Se solicita ELISA urgente para VIH, que resulta positivo. Ante los hallazgos clínicos y radiológicos se establece el diagnóstico empírico de neumonía por Pneumocystis jiroveci e ingresa en nuestro centro. Durante su ingreso, se confirma la infección por VIH con cifras CD4 absolutos de 48células/μl y carga viral (CV) de 69.000copias/ml. Se trató con cotrimoxazol a dosis plenas (160/800mg/6h) durante 21días y pauta estándar de prednisona. Inició emtricitabina +tenofovir +darunavir +ritonavir, con buena tolerancia. Al alta se encontraba asintomático, con mejoría radiológica clara (menor densidad del infiltrado) y saturación basal de O2>95% tras las marcha. Es citado al cabo de un mes para revisión, previa realización de control radiográfico.
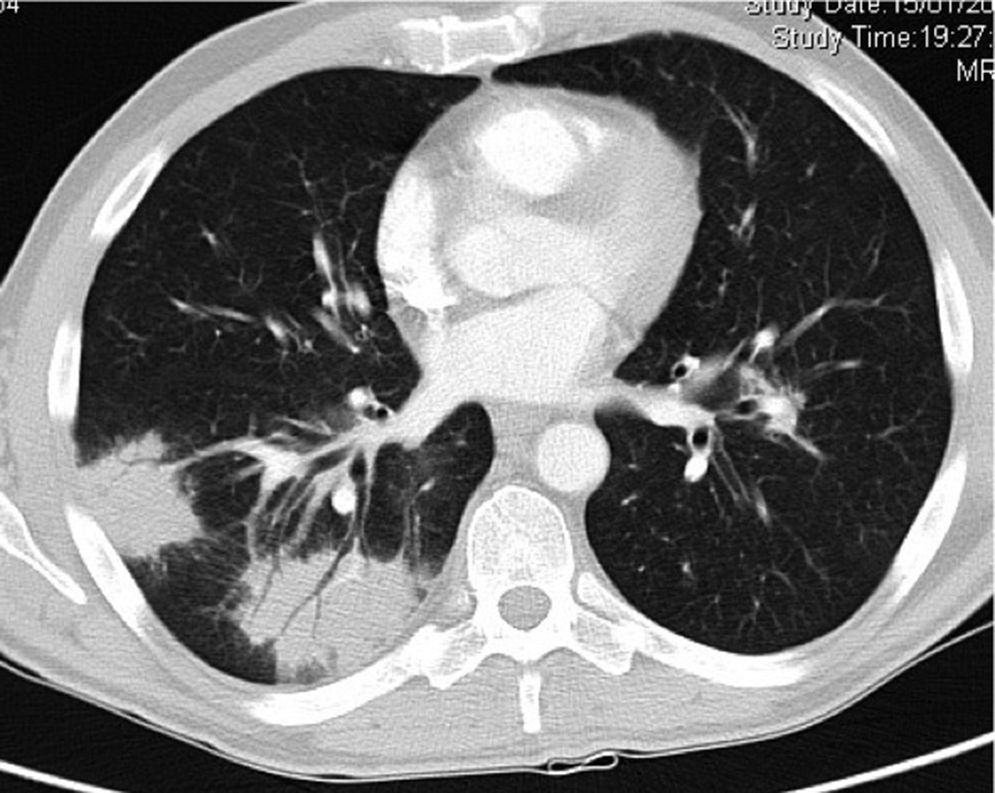
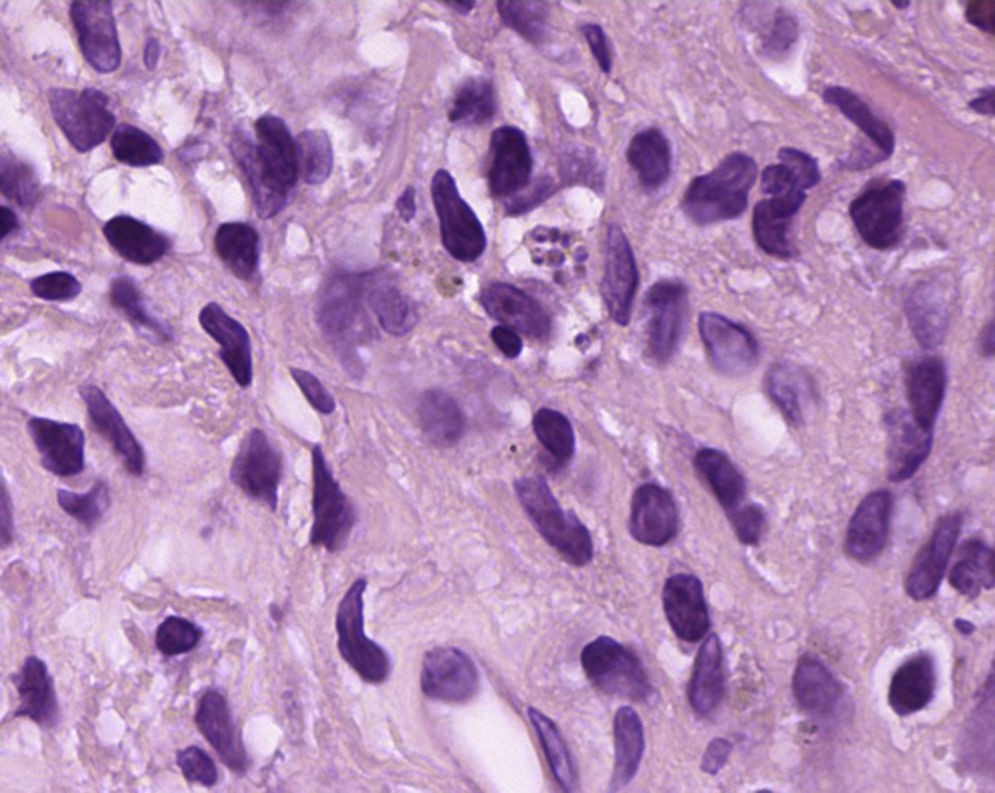
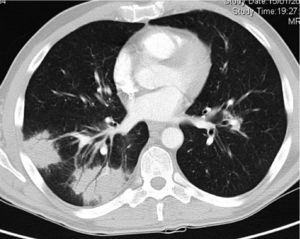
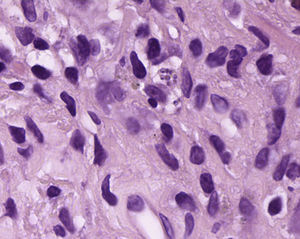
EvoluciónAcude a revisión completamente asintomático. En ese momento la CV es de 187 copias/ml y los CD4 de 312 células/μl, en el hemograma solo destaca Hb10,5g/dl, toleraba terapia antirretroviral (TAR), pero en la radiografía y la TC de tórax se observa una gran masa en lóbulo inferior derecho, y otra de menor tamaño en el lóbulo inferior izquierdo (figs. 1 y 2). No se realizó ecografía abdominal de revisión. Se solicita fibrobroncoscopia, que no muestra cambios macroscópicos; se realiza biopsia transbronquial en el lóbulo inferior derecho con presencia de hiperplasia de neumocitos y macrófagos intraalveolares. El Ziehl-Nielsen, la tinción de plata y la inmunohistoquímica para CMV, el cultivo del BAS y la PCR para M.tuberculosis son negativos. En el cultivo de la biopsia crecen Staphylococcus epidermidis y Streptococcus oralis, por lo que se trata durante una semana con amoxicilina-clavulánico 1g cada 12h sin mejoría radiológica. Se realiza biopsia transtorácica de la lesión, que pone de manifiesto la presencia de amastigotes de Leishmania (fig. 3), por lo que se instaura tratamiento con anfotericinaB liposomal intravenosa (i.v.) (3mg/kg/día durante 5días) y posteriormente 200mg i.v. a la semana durante 5semanas. No se realizó serología para Leishmania, dado que la presencia de kinetoplasto es característica y nos permite distinguirla de otros parásitos similares, fundamentalmente Histoplasma. Preguntado específicamente, el paciente negaba viajes a zonas endémicas de histoplasmosis. Actualmente se encuentra realizando profilaxis secundaria para leishmaniasis (3-5mg/kg/día de anfotericinaB liposomal cada 21días). Persiste completamente asintomático y con buena evolución radiológica, con 249 CD4/μl y CV indetectable.
ComentariosUn 15-25% de los pacientes VIH que inician TAR desarrollan un empeoramiento clínico paradójico pese a la buena respuesta viral e inmune, a lo cual denominamos síndrome de reconstitución inmune (SRI). Este porcentaje puede elevarse hasta el 45% en pacientes que inician TAR en el contexto de infecciones oportunistas1. Los microorganismos que se asocian con más frecuencia al SRI son las micobacterias, hongos (Cryptococcus neoformans, P.jiroveci y micosis regionales) y virus del grupo herpes. El SRI también se ha descrito como tumores (linfoma, cáncer de pulmón), fenómenos autoinmunes lupus-like o la enfermedad de Graves.
La leishmaniasis es una enfermedad causada por un protozoo y transmitida por la mosca del género Phlebotomus. Su presentación clínica es variada, desde úlceras cutáneas a afectación multiorgánica. Aunque se ha descrito la leishmaniasis visceral como una forma de SRI, es excepcional su presentación como masa pulmonar2,3. La presentación clínica más frecuente a nivel pulmonar fue en forma de neumonitis intersticial, seguido de derrame pleural; en el único caso descrito como nódulo pulmonar solitario2 no se consiguió confirmación histopatológica del parásito en tejido pulmonar, asumiendo el diagnóstico tras encontrarlo en tejido ganglionar y biopsia de médula ósea junto a la buena evolución tras tratamiento con antimoniales. Por tanto, nuestro caso sería el primero comunicado donde se identifica la presencia de Leishmania in situ en su presentación clínica como nódulo pulmonar.
En pacientes muy inmunodeprimidos es más frecuente su presentación de forma asintomática. En pacientes VIH existe una peor respuesta al tratamiento, necesitando una mayor dosis total de anfotericina; no obstante, el TAR junto a la profilaxis secundaria reducen el riesgo de recaída (recordemos que el protozoo no se erradica del organismo pese a la curación clínica). Las actuales guías recomiendan el inicio de TAR en los primeros 14días tras el inicio del tratamiento de una infección oportunista4. Apoyan este diagnóstico la relación temporal entre el inicio del TAR y el hallazgo radiológico, el aumento de la cifra de linfocitos CD4 y el rápido descenso de la CV. Se puede contemplar la retirada de profilaxis secundaria cuando se cumplan 6meses sin recaída clínica, CD4>200/μl (preferible >350), CV indetectable y PCR sangre/antigenuria negativa para Leishmania.
Llama la atención la ausencia completa de síntomas y la escasa afectación del hemograma en nuestro paciente (es habitual que la leishmaniasis visceral se acompañe de fiebre y afectación del estado general, como se describe en los casos arriba mencionados, así como de pancitopenia). El SRI constituye uno de los diagnósticos diferenciales obligados no solo ante el empeoramiento clínico de un paciente con infección VIH severamente inmunodeprimido que inicia TAR, sino también ante los hallazgos radiológicos de novo que se aprecien en este contexto.
FinanciaciónNo hay fuente de financiación.
Conflicto de interesesLos autores declaran que no hay conflicto de intereses.