*Al final del manuscrito se ofrece la relación de los participantes de GEIH/GEMARA/REIPI.
Introducción
Staphylococcus aureus resistente a meticilina (SARM) es uno de los principales patógenos nosocomiales por su frecuencia y trascendencia clínica. Los problemas relacionados con el tratamiento antimicrobiano de las infecciones por SARM, al existir menor número de alternativas terapéuticas, son bien conocidos. Así mismo, se admite que las infecciones causadas por SARM se asocian con mayor mortalidad, coste y duración de la estancia que las causadas por S. aureus sensible a meticilina (SASM) 1,2. Desde el punto de vista epidemiológico, SARM presenta una afamada capacidad para causar brotes epidémicos en el ámbito hospitalario. Por todo ello, la prevención de estas infecciones debe ser una prioridad entre los objetivos de control de infecciones en los hospitales.
La frecuencia de infecciones nosocomiales causadas por SARM respecto del total de S. aureus ha seguido aumentando en España 3,4, así como en la mayoría de países europeos 5 y EE.UU. 6. Para dar respuesta a este problema se han elaborado distintas guías con recomendaciones para la vigilancia y el control de SARM 7-11. Diversos estudios han mostrado buenos resultados con la implantación de medidas de control 9,11. Sin embargo, la complejidad de las medidas y la falta de éxito en muchos casos ha llevado a algunos autores a cuestionar la utilidad de algunas medidas habitualmente recomendadas 12,13. Esta controversia ha tenido como consecuencia una importante confusión sobre las medidas que llevar a cabo y la importancia de su cumplimiento en no pocos profesionales dedicados al control, diagnóstico y tratamiento de estas infecciones.
Los objetivos de este estudio son conocer con detalle las medidas de vigilancia y control de infecciones por SARM que se llevan a cabo en distintos hospitales españoles, su grado de implantación y la variabilidad existente entre los distintos centros.
Material y métodos
A través de los miembros de los Grupos de Estudio de Infección Hospitalaria (GEIH) y de Mecanismos de Acción y Resistencia a los Antimicrobianos (GEMARA) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y de la Red Española de Investigación en Patología Infecciosa (REIPI), se invitó a los hospitales a los que pertenecen a participar en un cuestionario que forma parte del proyecto SARM 2003 GEIH/GEMARA/REIPI. El proyecto, en el que participan 71 hospitales, tiene como objetivos la investigación sobre aspectos epidemiológicos, microbiológicos, clínicos y terapéuticos de las infecciones por SARM en hospitales españoles; no pretende disponer de una muestra representativa de los hospitales españoles, sino de reunir un amplio número de centros interesados en el problema. Se requirió la formación en cada centro de un equipo investigador integrado por un infectólogo o clínico con dedicación a las enfermedades infecciosas, un microbiólogo, un preventivista o epidemiólogo y personal de enfermería encargado del control de infecciones, salvo en aquellos centros donde no se contara con alguna de estas figuras.
Se diseñó un cuestionario basado en las medidas de control recomendadas en las distintas guías publicadas hasta ese momento 8-10, adaptando, modificando y ampliando las realizadas en estudios previos de otros países 14-19. El cuestionario se ensayó inicialmente en cuatro centros. Los aspectos abordados en el cuestionario se referían a características del centro, métodos microbiológicos, datos de incidencia de SARM en el año 2002 y aspectos generales y específicos de las medidas de control de SARM. Así mismo, se pidió a los participantes que definieran la situación de SARM en su centro en el año 2002 como una de las siguientes: a) endémica o brotes epidémicos frecuentes; b) brotes epidémicos poco frecuentes o esporádicos, o c) casos aislados o esporádicos. De manera intencionada, se evitó ofrecer una definición de estas situaciones. Los datos de incidencias se calcularon a partir de numeradores y denominadores facilitados por los centros participantes referidos al año 2002 (numeradores: casos nuevos de colonización/infección por S. aureus; denominadores: ingresos, estancias y total de pacientes con infección/colonización por S. aureus; se excluyeron los pacientes colonizados por S. aureus sensible o resistente detectados exclusivamente mediante muestras de vigilancia epidemiológica). Se establecieron los siguientes puntos de corte de incidencia para considerar una elevada transmisión en función del tamaño de los hospitales 8: < 200 camas, 0,13 casos/100 ingresos; 200-499 camas, 0,25; ≥ 500 camas, 0,5.
El cuestionario fue remitido por correo electrónico y contestado entre junio y noviembre del año 2003 por los miembros del equipo investigador de cada centro. Durante ese tiempo se contactó en dos ocasiones por correo electrónico con los centros participantes para intentar completar los cuestionarios con respuestas no contestadas.
Las variables continuas entre grupos se compararon mediante la prueba de la t de Student o U de Mann-Whitney, y los porcentajes mediante la prueba de chi cuadrado (χ 2). La relación entre variables continuas se evaluó mediante regresión lineal.
Resultados
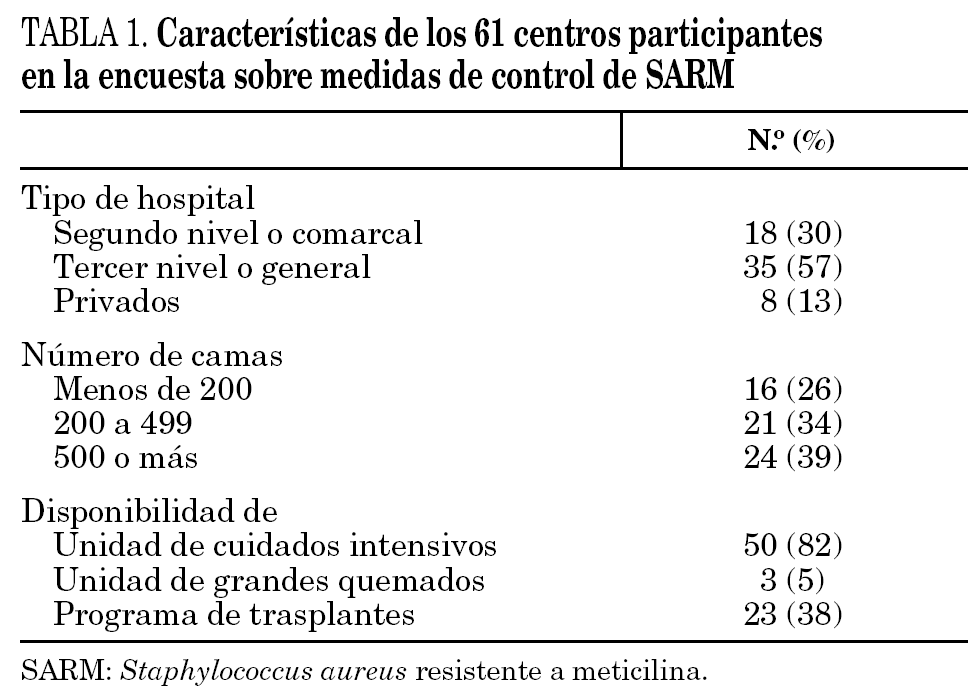
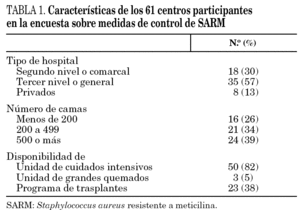
Contestaron la encuesta 61 de los 71 hospitales participantes en el proyecto (86%), distribuidos en 11 comunidades autónomas de la siguiente forma: 16 en Cataluña, 8 en la Comunidad Valenciana, 7 en Galicia, 6 en la Comunidad de Madrid, 5 en Asturias, Canarias y País Vasco, 4 en Andalucía, 3 en Castilla-La Mancha, y 1 en Baleares y Comunidad de Murcia. Los hospitales participantes atienden a una población superior a los 16 millones de habitantes, pero los porcentajes de población atendida no son homogéneos entre las distintas comunidades autónomas. Las características generales de los centros participantes se resumen en la tabla 1. El porcentaje medio de preguntas referidas a medidas de control respondidas por centro fue del 91%.
Métodos microbiológicos
En 43 hospitales (71%) se utiliza de forma cotidiana algún sistema automatizado para realizar el estudio de la sensibilidad de S. aureus; el método de disco-placa se utiliza en 25 (41%) (en algunos centros se utilizan ambos) y el e-test en tres (5%). En 17 centros (28%) se utiliza habitualmente algún método adicional fenotípico o genotípico para confirmar la resistencia a meticilina y en 27 (44%) se utilizan de manera ocasional.
Datos de incidencia y percepción de la situación epidemiológica
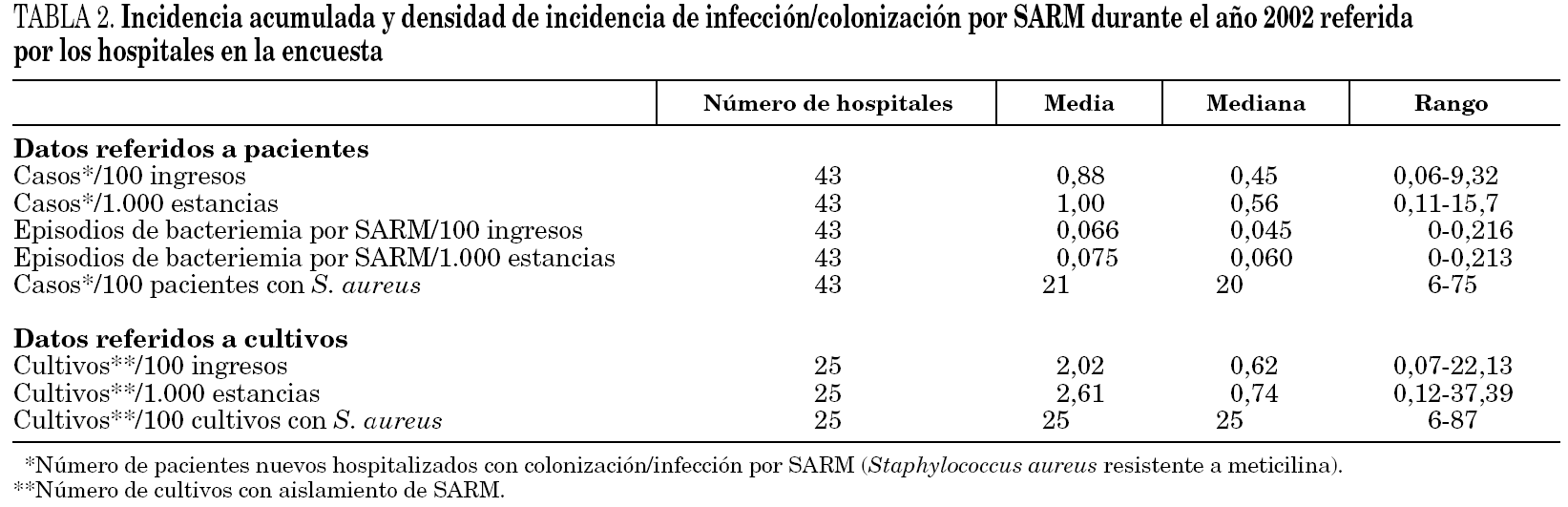
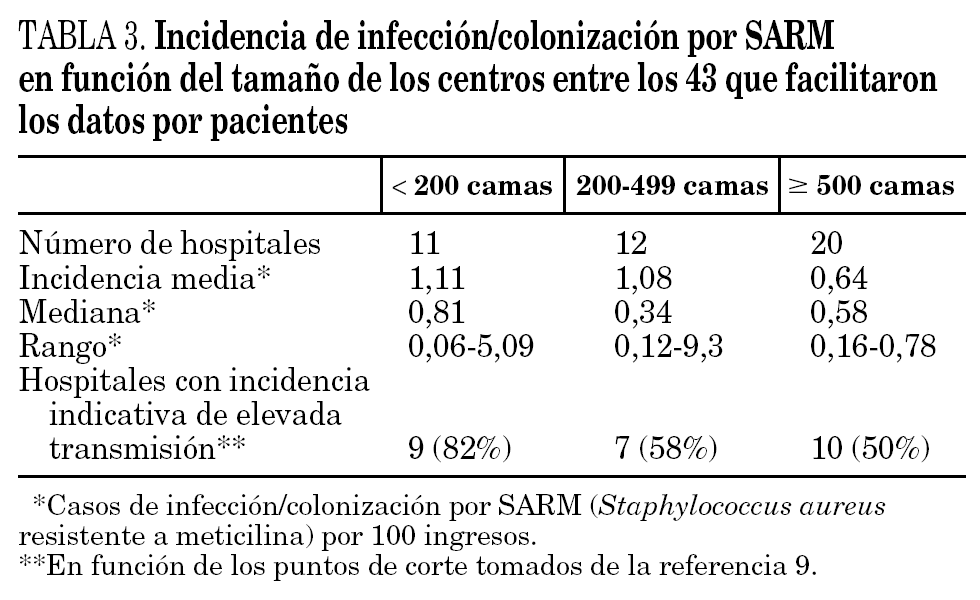
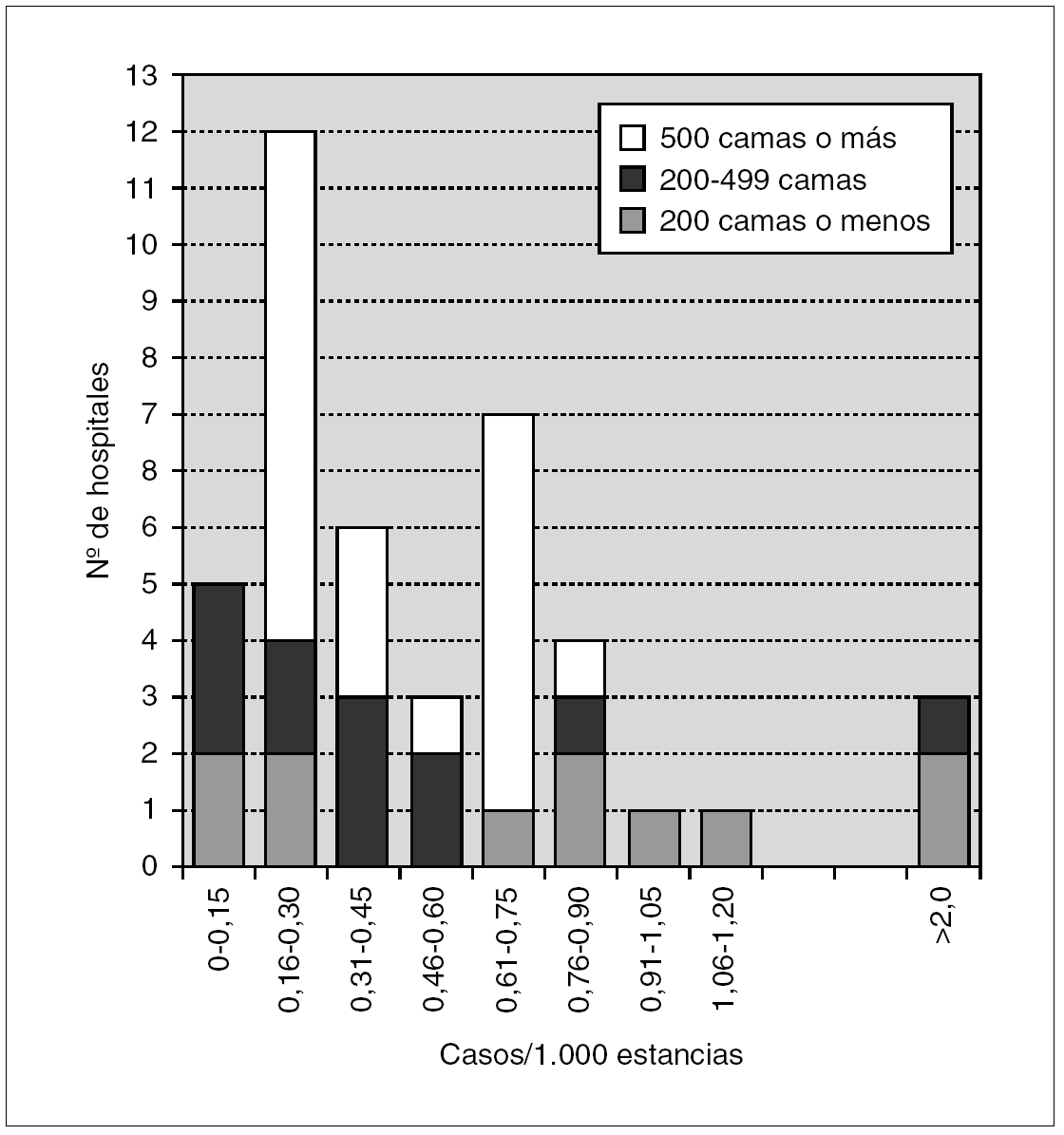
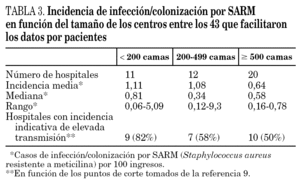
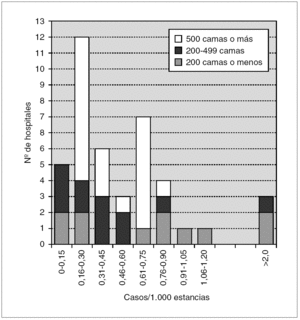
Los datos de incidencia de infecciones/colonizaciones por SARM fueron facilitados por 51 hospitales (84%): 43 (70% del total) pudieron ofrecer datos basados en número de pacientes nuevos colonizados o infectados por SARM, mientras que los ocho restantes (13%) sólo pudieron proporcionar datos basados en número de cultivos con aislamiento de SARM; 17 centros enviaron ambos tipos de datos. Los datos globales se muestran en la tabla 2 y por tamaño de hospitales en la tabla 3 y figura 1.
Figura 1. Histograma de incidencias de infección/colonización por SARM en los 43 hospitales.
Entre los 17 centros que ofrecieron ambos tipos de datos, los basados en cultivos sobreestimaron la incidencia respecto a los datos basados en pacientes en 0,16 casos/ 100 ingresos de media, y el porcentaje de S. aureus en el 5% (datos específicos no mostrados). Los análisis relacionados con la incidencia se realizaron sólo con los 43 centros que pudieron ofrecer datos basados en pacientes.
En función de los puntos de corte establecidos, 26 hospitales (60%) mostraron una elevada tasa de transmisión (tabla 3). Un total de 24 centros (39%) la definió como endémica o brotes epidémicos frecuentes, 19 (31%) como brotes epidémicos poco frecuentes o aislados y 18 (30%) como casos aislados o esporádicos. La incidencia de SARM (mediana, rango) durante ese año en estos 3 grupos de hospitales fue de 0,66 (0,22-2,91), 0,52 (0,11-1,91) y 0,33 (0,15-0,60) casos/100 ingresos, respectivamente. Las diferencias sólo fueron estadísticamente significativas entre los hospitales que catalogaron su situación de endémica y los que la catalogaron de casos esporádicos (p = 0,01). Un total de 12 hospitales (28%) que mostraban una elevada incidencia en función de los puntos corte establecidos describieron su situación como de brotes o casos aislados. La densidad de incidencia de bacteriemia por SARM mostró una relación directa con la de infección/colonización por SARM (r = 0,54; p = 0,01).
Medidas de control de SARM
Las medidas de control de SARM que se llevan a cabo en los hospitales participantes se resumen en la tabla 4.
Con respecto al personal de enfermería con dedicación específica a la vigilancia y control de las infecciones nosocomiales, 10 hospitales (16%) disponen de una o más enfermeras con dedicación exclusiva a estas tareas por cada 250 camas y cuatro (7%) de una o más por cada 200 camas. Dado que en algunos centros hay personal de enfermería con dedicación parcial a estas tareas, si sumamos los tiempos de dedicación puede considerarse que en 23 centros (38%) existe una dedicación de personal equivalente a una enfermera o más por cada 250 camas y en cinco (8%) hay una o más enfermeras por cada 200 camas.
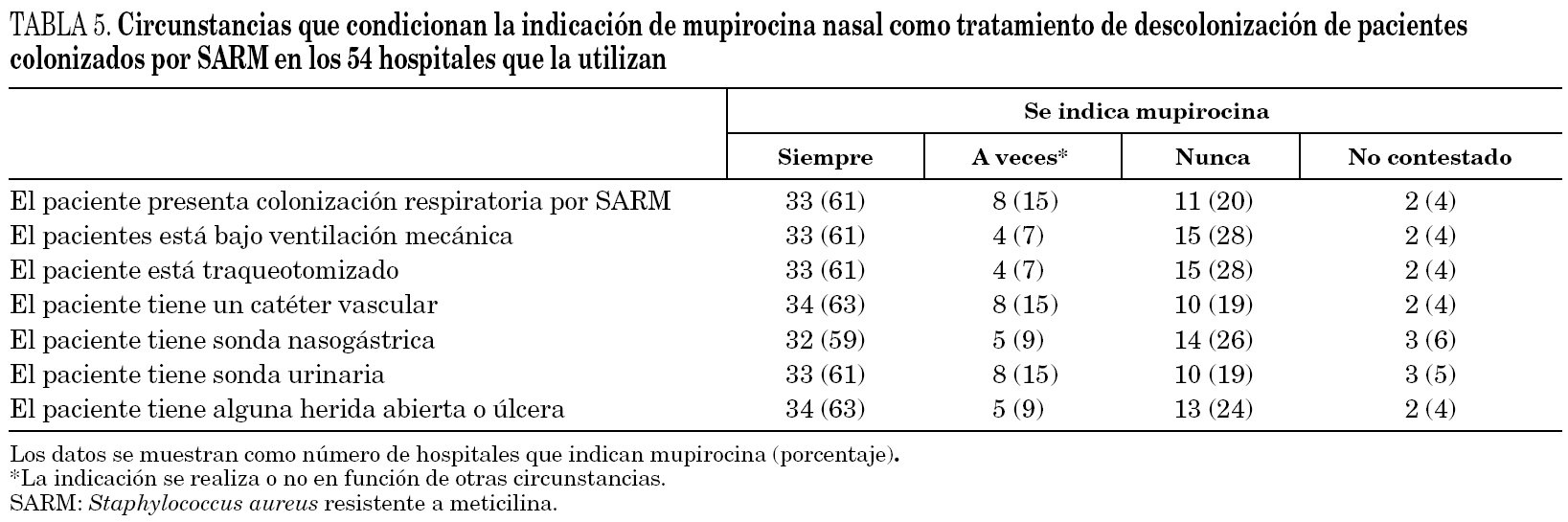
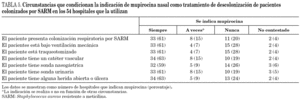
En cuanto a las muestras que se toman para la detección de pacientes colonizados por SARM (cribado de portadores) en los 57 hospitales donde esta medida se lleva a cabo, las muestras que con más frecuencia se toman de manera sistemática son el frotis nasal (97% de centros), el de úlceras o heridas (40%) y el cutáneo (23%). Las siguientes muestras se toman sólo en determinadas circunstancias: esputo o aspirado traqueal (51% de centros) y orina (39%). Finalmente, no se toman nunca frotis faríngeo y orina en el 25% de hospitales, esputo o aspirado traqueal en el 16% y frotis cutáneo en el 14%. Las circunstancias que condicionan la indicación de mupirocina en los centros que la utilizan para descolonización de pacientes se resumen en la tabla 5.
Los hospitales que pudieron ofrecer los datos de incidencia por pacientes tenían con más frecuencia un programa de control de SARM específico (91% frente a 59%; p = 0,008), realizaban cultivos de vigilancia a los reingresos (82% frente al 41%; p = 0,003) y habían realizado cultivos de vigilancia a todos los sanitarios en alguna unidad en el año previo (73% frente al 39%; p = 0,04). Para el resto de medidas, aunque los porcentajes de aplicación para la mayoría de ellas fueron más elevados entre los primeros, no se encontraron diferencias estadísticamente significativas (datos específicos no mostrados). No hemos podido realizar un análisis de la relación entre incidencia y utilización de medidas, dado que el 30% de centros no pudieron proporcionar datos de incidencia y que, precisamente, la utilización de medidas fue menos frecuente en esos centros. En cuanto a la frecuencia de utilización de medidas en función de la percepción de la situación de SARM, no se encontraron diferencias salvo en la realización de cribado de portadores, que fue menos frecuente en los centros que consideran su situación como casos o brotes aislados frente al resto (78% frente al 98%; p = 0,04).
Discusión
La detección, el control y el tratamiento de las infecciones causadas por los microorganismos multirresistentes suponen uno de los retos más complejos a que se enfrentan los sanitarios que trabajan en el campo de las infecciones nosocomiales. Aunque existen recomendaciones genéricas para el control de las resistencias en los hospitales 20,21 y es cierto que los factores de riesgo para los microorganismos multirresistentes son con frecuencia similares 22, las peculiaridades epidemiológicas de cada uno de ellos determina la necesidad de aplicar programas específicos. SARM es un buen ejemplo de esta necesidad.
Este microorganismo es posiblemente el de mayor relevancia epidemiológica y clínica entre todos los multirresistentes: su capacidad para producir brotes epidémicos extensos y continuados es bien conocida; es causa de morbilidad y mortalidad significativas; las alternativas terapéuticas para las infecciones moderadas o graves son escasas y menos satisfactorias que las existentes para S. aureus sensible a meticilina, y, en relación con lo anterior, se relaciona con mayor mortalidad, duración de la estancia y coste respecto a las infecciones causadas por S. aureus sensible 1,2. Por todo ello, parece claro que el control de las infecciones por SARM debe ser una de las prioridades entre las tareas de control de infecciones en los hospitales. Para ello, se han publicado guías con recomendaciones en distintos países 9-11.
Sin embargo, las infecciones causadas por SARM no han dejado de aumentar hasta llegar en la actualidad a situaciones verdaderamente alarmantes. En un estudio reciente realizado sobre S. aureus aislados de hemocultivos en Europa, el porcentaje de SARM fue superior al 40% en Italia, Grecia, Irlanda o Reino Unido 5. En EE.UU., SARM causa más del 40% de las infecciones nosocomiales por S. aureus, y en pacientes de UCI, la cifra está cerca del 50% 6. Esta situación contrasta con la de otros países como Dinamarca, Holanda o Suecia, cuya frecuencia es inferior al 1% 5; Holanda es bien conocida por seguir una estrategia muy agresiva de control de SARM (search and destroy)23. En España, los primeros brotes de gran magnitud se comenzaron a describir a finales de la década de 1980 24,25. En estudios de prevalencia realizados en una amplia muestra de hospitales (entre 74 y 113 centros), la frecuencia de resistencia a meticilina ha ido aumentando desde el 1,5% en 1986 hasta el 31% en 2002 4. En el estudio realizado por el European Antimicrobial Resistance Surveillance System (EARSS) sobre bacteriemias por S. aureus entre los años 2000 y 2002, el porcentaje de resistencia a meticilina en los aislamientos obtenidos de los 40 hospitales españoles participantes fue del 28% 3, con una mediana de porcentaje por centros del 18% (rango: 0-67%). La incidencia anual de bacteriemia nosocomial por SARM estuvo entre 0,033 y 0,041/100 ingresos 26. Los datos obtenidos en esta encuesta son prácticamente idénticos, confirmando la magnitud de la situación de SARM en España. Además, los datos de este estudio indican que el 59% de los centros presentan incidencias que indican elevadas tasas de transmisión 8, y que este porcentaje es superior en los hospitales pequeños. Estos resultados sugieren que esta realidad contrasta con la percepción que se tiene en muchos centros, en los cuales tiende a ser infravalorada. Un dato de interés es que el 30% de los centros no pudieron facilitar datos de la situación de SARM por pacientes; esto se asoció a menor frecuencia de implementación de otras medidas. Parece claro que el seguimiento individualizado de todos los pacientes con colonización o infección por SARM es necesario para el conocimiento preciso de la situación epidemiológica en cada centro.
El fracaso del control de las infecciones por SARM en muchos hospitales ha llevado a algunos autores a dudar de la eficacia de algunas de las medidas recomendadas en las guías 12,13. Esto, junto con la impresión de normalidad que producen los datos de la situación nacional e internacional, ha conducido a que muchos profesionales consideren poco menos que imposible el control de SARM y que cuestionen la necesidad de implementar unos programas de control complejos y costosos. Aquí podría radicar una de las explicaciones para la gran variabilidad en la aplicación de las medidas de control de SARM en los hospitales encuestados en nuestro estudio; otra posible causa podría estar en la dificultad de aplicar las recomendaciones. Estudios similares realizados en otros países con elevadas tasas de SARM como EE.UU. 14, Francia 16, Reino Unido 17, Irlanda 18 y Alemania 27 han mostrado también una gran variabilidad en la aplicación de medidas entre centros. Sin embargo, parece claro que el control efectivo de SARM sólo puede conseguirse mediante la aplicación de programas completos que incluyan la aplicación conjunta de todos los tipos de medidas necesarias 28-30.
Algunos datos de nuestro estudio merecen ser comentados brevemente. Con respecto a los aspectos más generales, el 18% de centros no dispone de un programa de control específico para SARM; el porcentaje de centros que realizan tareas de formación a sanitarios de manera regular y que proporcionan de forma habitual informes con la situación de SARM a las unidades es bajo (alrededor del 30%). El problema de la escasez de personal de enfermería dedicado al control de la infección nosocomial nos parece muy relevante; de hecho, en la encuesta realizada en Francia, los hospitales con mayor incidencia tenían un mayor número de camas por enfermera de control de infecciones 16. En prácticamente todos los centros se indica aislamiento de contacto para todos los pacientes; esta es una medida básica 31, pero su grado de cumplimiento también puede ser variable. Un dato relevante es que en un porcentaje significativo de centros no se coloca un cartel a la puerta de las habitaciones de aislamiento.
Sin embargo, las medidas de aislamiento de contacto son insuficientes si no se acompañan de la búsqueda activa de pacientes colonizados (cribado de portadores), ya que se ha estimado que los pacientes detectados a partir de muestras clínicas suponen aproximadamente un tercio de los pacientes reservorio de SARM, mientras que los pacientes colonizados detectables sólo mediante cribado suponen otro tercio, y los restantes son pacientes que reingresan 32. Por tanto, el cribado de portadores es otro pilar del control de SARM 11 y es recomendado en todas las guías 9-11. Su utilidad es aceptada para el control de brotes epidémicos, pero es más controvertida en situaciones de endemia 12. En estos casos, existen experiencias que han mostrado excelentes resultados mediante la realización del cribado a pacientes con alto riesgo de colonización por SARM (ingreso reciente, traslado de otro hospital, procedencia de centro sociosanitario, colonización previa) 28,33 o a todos los pacientes que ingresan en áreas de alto riesgo 34,35. En este sentido, en la mayoría de los centros encuestados se realiza alguna tarea de búsqueda activa de pacientes colonizados, pero al revisar cuáles son las circunstancias en las que se realiza esta actividad, encontramos bajos porcentajes de aplicación en la mayoría de las situaciones. Algo parecido puede decirse de la detección de sanitarios colonizados y su descolonización, otro de los pilares del control de SARM 9. En general, se recomienda en situaciones en las que se demuestra transmisión en una unidad o servicio a pesar de haber puesto en marcha el resto de medidas 8-11.
Una cuestión que nos parece preocupante es el elevado porcentaje de centros en los que se utiliza mupirocina como tratamiento de descolonización sin considerar circunstancias que se asocian habitualmente al fracaso de este tratamiento. El uso indiscriminado de mupirocina ha sido desaconsejado por asociarse con aparición de resistencia a este antimicrobiano.
Nuestro estudio debe interpretarse considerando sus limitaciones. Los hospitales encuestados, aunque atienden a una parte importante de la población española, no forman una muestra representativa de los hospitales del país ni de sus comunidades autónomas. Algunos aspectos que pueden ser relevantes en el control de SARM (como cuestiones relacionadas con la higiene de manos, política antibiótica, carga de trabajo de enfermería en las unidades de alto riesgo, etc.) no estaban entre los objetivos de la encuesta y no fueron incluidos en la misma. Finalmente, dado que algunos centros no pudieron ofrecer datos de incidencia, no hemos podido estudiar la relación entre las medidas utilizadas y la incidencia.
En conclusión, nuestro estudio muestra una considerable variabilidad tanto en la incidencia como en la aplicación de medidas de control de SARM. En nuestra opinión, sería necesario realizar una guía consensuada de recomendaciones para el control de SARM en España que tenga en cuenta la situación actual y las dificultades existentes para la implantación de las medidas en los hospitales.
Agradecimientos
El estudio ha sido financiado en parte por la Red Española de Investigación en Patología Infecciosa (Redes Temáticas de Investigación Cooperativa, C03/14. Red de Centros. Instituto de Salud Carlos III, Ministerio de Sanidad y Consumo). Agradecemos la colaboración anónima y desinteresada de numerosos profesionales de servicios y unidades de Medicina Preventiva, Microbiología, Enfermedades Infecciosas, Medicina Interna y Cuidados Críticos de los hospitales participantes.
Relación de los participantes en el proyecto SARM 2003 GEIH/GEMARA/REIPI
Fundación Hospital de Cieza: J Álvarez, M Alcalde, C Zamorano; Hospital de Mataró: G Sauca, L Force, E Martínez; Hospital de Jove: E Hidalgo, E Mata, JS Rubio; Hospital de Gran Canaria Doctor Negrín: A Bordes, MA Figuerola, B Lafarga; Hospital Nacional de Parapléjicos, Toledo: A Leturia; Hospital de Santa Marina, Bilbao: F Calvo, J Pérez, JL Sánchez; Hospital de S. Vicente, Alicante: J Blázquez, C Domínguez, C Mirete, M Gea, M Bermúdez; Hospital Universitario de La Princesa, Madrid: T Alarcón, C Cuevas, N Carrasco, J Jimeno; Hospital Santiago Apóstol, Vitoria: A Canut, A Labora, JL Novales, I Orio; Clínica Benidorm: J Serralta, D Arzua; Hospital Santa María Mai, Ourense: G Esteban, B Fernández, MD Díaz; Complejo Hospitalario La Mancha Centro, Alcázar de San Juan: R Carranza, D Tena, JR Barberá; Hospital Universitario Puerta de Hierro, Madrid: A Asensio, J Lobera, T Marco, A Ramos; Hospital de Cabueñes: ML García, MD Miguel; Hospital Universitario 12 de Octubre, Madrid: F Chaves, F Jaén, M Lizasoain, MI Sanz; Hospital General Universitario Gregorio Marañón: E Cercenado, B Padilla, F Grande; Complejo Hospitalario Arquitecto Marcide/Profesor Novoa Santos, Ferrol: MD Rodríguez, JF García, MV Lorenzo; Hospital Vega Baja, Orihuela: A Yagüe, A Cabrera, J Gregori, J Salinas; Hospital General Universitario de Elche: M Elía, JM Ramos, AM Haro; Hospital Esperit Sant, Santa Coloma de Gramenet: MT Bastida, R Porrón, F Nonell; Hospital Universitario Canarias: T Delgado, M de Frutos, I Montesinos; Mútua de Terrassa: M Xercavins, N Juan, M Riera, N Freixas; Hospital Virgen de la Salud, Toledo: MA Sepúlveda, C Gómez; Complejo Hospitalario de Pontevedra: P Álvarez, R Ojeu, F Vázquez, J Paz; Policlínica Gipuzkoa: JA Jiménez, E Laviñeta; Hospital Lluís Alcanyís, Xátiva: RM Ferreruela, A Viñuales, JM Tenias; Hospital de Jerez de la Frontera: A Zapata, JL de Francisco; Hospital Nuestra Señora de Candelaria: A Moreno, MC Durán, N Batista; Hospital Marina Baixa, Villajoyosa: C Martínez, MJ Gallego, C Amador; Hospital General de Lanzarote: FJ Noguera, D Panizo, E Melian; Hospital General Universitario de Asturias, Oviedo: A Fleites, A Moreno; Hospital Clínico Universitario de Santiago de Compostela: F Pardo, ML Pérez, E Carballo; Hospital Sant Joan de Déu, Martorell: MA Gasos, A Pérez, M Vidal; Hospital Universitario Virgen Macarena, Sevilla: J Rodríguez Baño, JR Hernández, L García, AB Millán; Hospital Santa Creu i Sant Pau, Barcelona: A Coloma, F Navarro, J Barrio, P Coll; Hospital Universitario Insular de Gran Canaria: M Bolaños, EE Álvarez, M Hernández, J Molina; Hospital Universitario de Getafe: P García, BR Blázquez, M Cal; Hospital Dr. Moliner, Serra: S Giner, P García, N Tolosa; Hospital Municipal de Badalona: A Calderón; Hospital Universitario Virgen de la Victoria, Málaga: C Arana; Hospital Nicolás Peña, Vigo: F Ulloa, E Pazos, M Maresclot; Hospital Virgen de Valme, Sevilla: JE Corzo, JL García; Hospital de Cruces, Baracaldo: JL Hernández, K Aguirrebengoa, JM Hernández; Hospital Dr. Josep Trueta, Girona: M Motjé, J de Batlle, D García, L Gavaldá; Hospital Xeral Cies, Vigo: M Álvarez, C Potel; Hospital de Sagunto: R Escoms, J Prat, C González, M Pinazo; Consorcio Hospitalario Parc Taulí, Sabadell: M Canals, D Mariscal, N García; Hospital Vall d'Hebron, Barcelona: A Andreu, M Campins, B Almirante, N Larrosa; Hospital Universitario Virgen del Rocío, Sevilla: JM Cisneros, AC Llanos; C.A. Son Dureta, Palma de Mallorca: JL Pérez, A Oliver, M Peñaranda, C Juan, E Ruiz; Hospital Ramón y Cajal, Madrid: V Pintado, R Cantón, J Oliva, L García, F Grill; Hospital del Oriente de Asturias, Arriendas: J Díaz, V Cárcaba; Hospital de Figueres: C García, J Cucurull; Centro Hospitalario Universitario Juan Canalejo, A Coruña: D Sousa, G Bou; Centro Sanitario Universitario de Bellvitge, Hospitalet de Llobregat: MA Domínguez, M Pujol, E Limón; Hospital General de Granollers: J Cuquet, C Martí, MD Navarro; Hospital de Galdakao: P Berdonces, J Mayo; Hospital de Barcelona SCIAS: M Sierra, M Vaque, M Calsina; Hospital Virgen de Altagracia, Manzanares: S Illescas, A López; Hospital Sant Jaume, Calella: A Hernández, ML Abellán, A García; Hospital Comarcal de la Selva, Blanes: A García, C Gallés; Hospital del Mar, Barcelona: M Salvadó; Hospital Germans Trias i Pujol, Badalona: L Matas, N Sopena, M Caraballo; Hospital Xeral Calde, Lugo: A Coira, J Varela; Hospital de la Ribera, Alzira: M Cuenca, A Guerrero; Hospital Clínico, Barcelona: JP Horcajada, F Marco, M Zaragoza, M Piazuelo, JA Martínez.
Correspondencia: Dr. J. Rodríguez-Baño.
Sección de Enfermedades Infecciosas. Hospital Universitario Virgen Macarena.
Avda. Dr. Fedriani, 4. 41071 Sevilla. España.
Correo electrónico: jrb@nacom.es
Manuscrito recibido el 22-3-2005; aceptado el 1-6-2005.