*Al final del manuscrito se ofrece la relación de miembros del Grupo de Estudio de la Infección de Prótesis.
Introducción
El objetivo de la implantación de una prótesis es la recuperación funcional y la desaparición del dolor 1. La infección de prótesis articular (IP) es una causa frecuente de fracaso, con una incidencia aproximada, en la actualidad, del 1% en las de cadera y del 2,5% en las de rodilla 2,3. Además la IP incrementa de forma importante los costes del procedimiento 4.
Han sido factores implicados en la presencia de IP: la edad avanzada, la coexistencia de diabetes mellitus, malignidad, artritis reumatoide, malnutrición, tratamiento esteroideo, la insuficiencia renal crónica, obesidad, infección urinaria, la drepanocitosis, la presencia de prótesis previa, de sepsis previa, el elevado riesgo quirúrgico definido por el índice NNIS (National Nosocomial Infection Surveillance derived risk index), las complicaciones relacionadas con la herida quirúrgica, así como la infección de la misma y la duración de la intervención 2,5,6.
La patogenia de la IP incluye fundamentalmente dos mecanismos: la introducción del agente causal localmente a partir de la infección de la herida quirúrgica o la contaminación en el acto quirúrgico: o bien la vía hematógena, a partir de una bacteriemia de cualquier origen 7,8. La etiología es variada, y los microorganismos aislados con más frecuencia son los cocos grampositivos 1,2,9.
Las manifestaciones clínicas son dolor, fiebre, tumefacción periarticular y signos de infección de herida quirúrgica o fístula de drenaje 10. El aislamiento del microorganismo causal, así como la implicación, en la etiología, de una determinada bacteria aislada pueden ser dificultosos, dependiendo de factores tales como la toma previa de antibióticos o el origen de la muestra a partir de la cual se ha aislado el microorganismo 11.
Por último hay que reseñar que no existe un único abordaje diagnóstico que permita diferenciar con alta sensibilidad y especificidad entre un aflojamiento aséptico o séptico de una prótesis, en el contexto de una articulación dolorosa 12,13.
El objetivo de este estudio es conocer la incidencia y las características clínicas y epidemiológicas de la IP de cadera y rodilla en pacientes intervenidos en cirugía programada en nuestros hospitales, cuatro de los cinco, comarcales. Así como identificar los factores que son predictivos de IP.
Métodos
Se incluyeron en el estudio 425 pacientes intervenidos de forma programada con motivo de la colocación de una prótesis de cadera o rodilla, desde enero hasta junio de 2001 en cinco hospitales de Cataluña.
Diseño del estudio
Estudio observacional, longitudinal y prospectivo.
Estudio del paciente y seguimiento
Se realizó una evaluación basal en la que se recogían los siguientes datos: edad, sexo, posibles factores predisponentes (artritis reumatoide, diabetes mellitus, utilización de corticoides durante un mínimo de una semana en el último año, neoplasias en los últimos cinco años), riesgo quirúrgico (medido según la escala ASA), tipo de prótesis (cadera o rodilla, total o parcial, cementada o no, injerto óseo), duración de la intervención, el antecedente de artroplastia previa sobre la misma articulación, profilaxis antibiótica previa (tipo, dosis y lugar). Se entendía como profilaxis en planta aquélla administrada el mismo día de la cirugía en la planta de hospitalización. Se aceptó como profilaxis en la inducción anestésica aquélla administrada en el antequirófano, o en el mismo quirófano, previa a cualquier incisión quirúrgica, además de los controles habituales por los servicios de traumatología de cada centro. A los 12 y 24 meses de la intervención, cada centro informaba sobre la presencia o no de infección en cada uno de los enfermos operados. En el caso de IP se recogía la información sobre todos los datos descritos en el apartado de definiciones.
Definiciones
Definición de infección de prótesis
Se diagnosticó IP, ante la constatación de clínica (dolor, fiebre, o signos sugestivos de infección de herida quirúrgica, o la presencia de fístula) 10, asociado a, como mínimo, uno de los siguientes parámetros.
Signos en la radiología simple, según informe del servicio de radiología del centro: radiolucencia mayor de 2 mm, o cambios de la posición de los componentes de la prótesis, fractura del cemento o reacción perióstica 14. Parámetros de laboratorio: VSG > 30 mm a la primera hora, o proteína C reactiva alterada atendiendo a la cifra de normalidad dada por el laboratorio de cada centro, o leucocitosis mayor de 12 * 10 9/l 1,8,15. Hemocultivos positivos en caso de haberse realizado 8. Positividad de la tinción de Gram o cultivo del líquido articular, de cultivos de biopsia de tejido periprotésico, o la presencia de más de 5 leucocitos por campo en la biopsia de tejido sinovial 11,16,17. La constatación de alteraciones compatibles en la artrografía, en la resonancia magnética, en la tomografía computarizada, o en las exploraciones gammagráficas; según informe médico del especialista que realiza la exploración complementaria 8.
Definición de infección protésica precoz
Aquella IP diagnosticada por el médico responsable del paciente, antes de transcurridos 3 meses a partir del acto quirúrgico 8,18.
Definición de infección protésica tardía
Aquella IP diagnosticada por el médico responsable del paciente, entre los 3 meses y el año a partir del acto quirúrgico 8,18.
Definición de curación o ausencia de infección
Siempre según criterio del médico responsable del paciente: la ausencia de clínica, exceptuando el parámetro dolor (que podría ser indicativo de aflojamiento aséptico de prótesis), además de la normalidad de los parámetros de laboratorio (VSG, proteína C reactiva, leucocitosis), en ausencia de otra causa/enfermedad que justifique su alteración.
Análisis estadístico
Para las variables cualitativas se determinaron la frecuencia absoluta y el porcentaje; para las cuantitativas media, mediana, desviación estándar y percentiles 25-75. Para el análisis comparativo la t de Student para las variables cuantitativas y chi cuadrado (x 2) (Fisher) para las cualitativas con un grado de significación de p < 0,05. Análisis multivariante: análisis de regresión logística (Forward stepwise LR) con un criterio de inclusión en el modelo PIN p < 0,05 y e exclusión POUT p > 0,10. Como medidas de frecuencia acumulada (IA) de IP definida como el número de casos nuevos en los 2 años de seguimiento/población libre de enfermedad al inicio del período, y la tasa de incidencia (TI) definida como el número de casos nuevos en el período de seguimiento/suma de los meses de riesgo de los sujetos expuestos en el período de seguimiento. Medidas de efecto, el riesgo relativo (RR), riesgo atribuible (RA) y la fracción etiológica de riesgo (FER).
Resultados
Entre el 8 de enero y el 8 de julio del año 2001 se intervinieron 425 pacientes en los 5 hospitales participantes en el estudio. Se completó el seguimiento de 24 meses en el 93%. Un total de 10 pacientes no acudieron a los controles programados, seis fallecieron por una causa distinta a la IP; y en 14 enfermos se diagnosticó una IP. La mediana de tiempo hasta el diagnóstico de una infección de prótesis fue de 60 días, aunque en el 71% se diagnosticó en los primeros 3 meses, de las cuales cuatro, durante el primer mes. La IA de IP fue del 3,29% en los 2 años del estudio. La TI a los 3 meses fue de 63, a los 6 meses de 52, a los 12 meses de 28, y a los 24 meses de 15 casos por 10.000 sujetos mes de exposición.
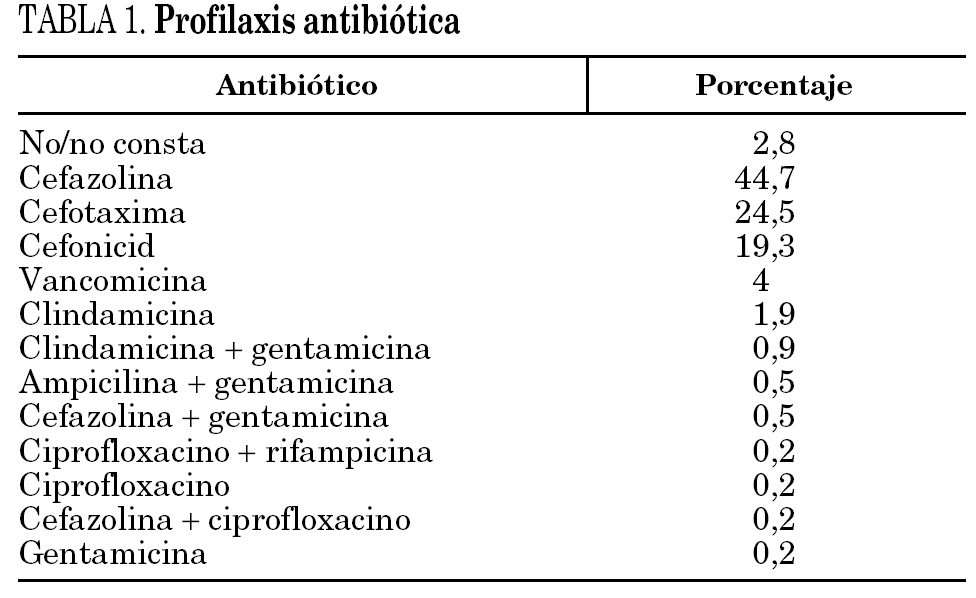
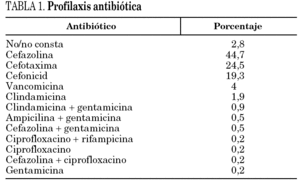
La edad media fue de 71 años (8,95), y el 63,1% fueron mujeres. Entre los factores predisponentes la diabetes mellitus era la patología más frecuente (15,5%). Se realizó profilaxis antibiótica en el 97% de los pacientes, con una duración media de 1,51 días. En la tabla 1 se muestran los antibióticos utilizados. El 75,6% de las profilaxis de inició en la inducción anestésica. En el 63,4% de los pacientes se evaluó el riesgo quirúrgico como ASA 2. En el 57,4% la prótesis fue de rodilla. En el 81,5% de las ocasiones la prótesis fue cementada, en el 7% se realizó un injerto óseo.
Las características clínicas, diagnósticas y de tratamiento de los pacientes con IP se describen en la tabla 2. Se documentó la infección microbiológica en todos los pacientes. La bacteria más frecuentemente aislada fue el Staphylococcus epidermidis. En 8 pacientes se realizó drenaje simple y administración de antibióticos para tratar la infección, en cinco, recambio protésico en dos tiempos y tratamiento antibiótico en el intervalo; en un caso se realizó tratamiento antibiótico y recambio posterior en un tiempo.
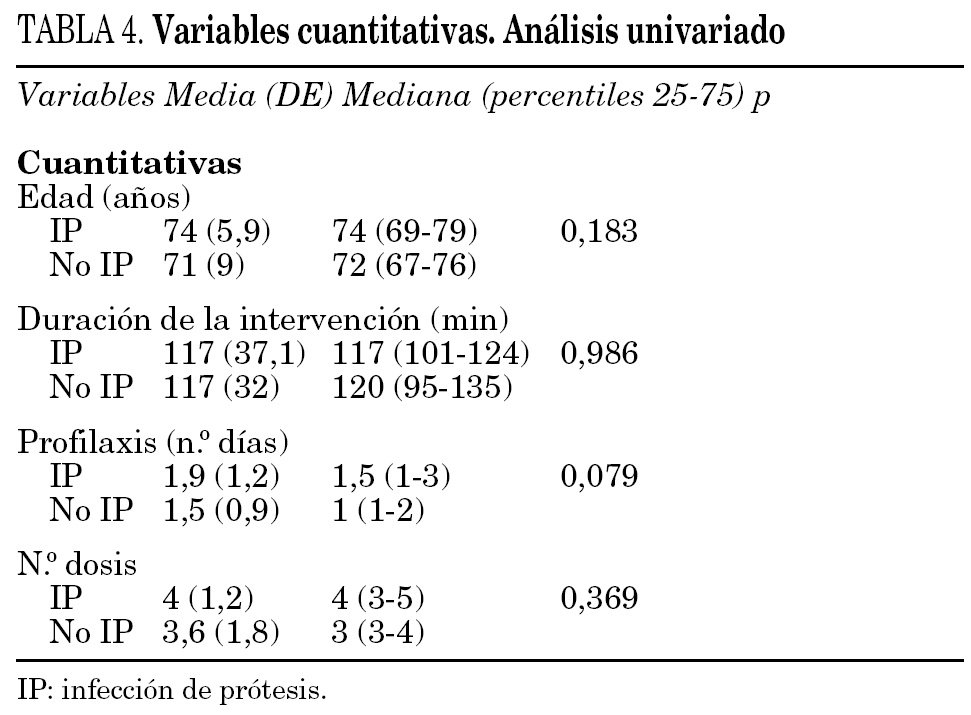
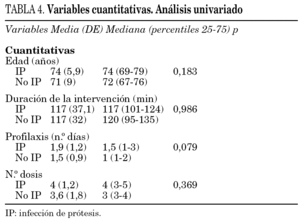
En el análisis univariado, tan sólo fueron significativas la diabetes mellitus (p = 0,034), y el número de días de profilaxis antibiótica en el límite de la significación (p = 0,079) (tablas 3 y 4). Se realizó una regresión logística incluyéndose la edad, sexo, tipo de prótesis, antecedentes de diabetes mellitus, ASA, lugar de la profilaxis, número de dosis y días de profilaxis. Sólo resultó significativa la diabetes mellitus OR 3,19, IC 95% 1,1-9,9. El RR para la diabetes fue de 3,02, el RA del 5,1% y la FER del 67%.
Discusión
La incidencia de una infección protésica disminuye a medida que transcurre el tiempo desde su implantación. En un estudio reciente sobre 63 episodios de IP de cadera el 29% fueron infecciones antes de los 3 meses de la implantación, el 41% entre los 3 meses y los 2 años y el 30% se presentaron después de los 2 años 19; a diferencia de nuestro estudio, en que el 71% se diagnóstico en los primeros 3 meses. La incidencia acumulada del 3,29% a los 2 años, objetivada en nuestro estudio, es un dato susceptible de mejora 3,20, ya que asume que las IP objetivadas durante este período han sido adquiridas durante el acto quirúrgico 8,20.
El tiempo de diagnóstico de la infección fue largo, con una mediana de 60 días, lo que podría parecer, en algunas ocasiones, excesivo asumiendo que de las 14 infecciones, nueve presentaron signos de infección de la herida quirúrgica, y en cinco se objetivó la existencia de una fístula/drenaje. Llama la atención que la presencia de dolor, relacionado con la infección, sólo se observó en 3 pacientes, a pesar de que es un síntoma casi constante en la mayoría de las series 1,8,15.
La precocidad en el diagnóstico y tratamiento de la infección es determinante a la hora de conseguir curar la infección sin tener que retirar el material protésico 21. Transcurridas unas semanas, la existencia de una biopelícula de exopolisacáridos o slime facilita una mayor resistencia de los microorganismos causales de la acción de los antimicrobianos 22. Este hecho ha llevado a algunos autores a hablar de diagnóstico precoz de IP, cuando éste se realiza en las primeras 2-4 semanas después del acto quirúrgico 23. En los casos de diagnóstico tardío se aconseja tratamiento antibiótico y el recambio protésico en uno o dos tiempos 8,9,20,21. Para algunos autores, los datos existentes en la actualidad aconsejan utilizar el tratamiento antibiótico y recambio en un tiempo, sólo en aquellos casos en que no hubiera compromiso de partes blandas, y en que se hubiera identificado un agente causal susceptible de ser tratado con antibióticos por vía oral con una buena biodisponibilidad y eficacia probada frente a bacterias que se adhieren al material protésico o al cemento, capaces de producir slime, como las quinolonas o la rifampicina 8,24.
En la mayoría de las ocasiones, los factores de riesgo implicados en las IP provienen de series de pacientes y no de estudios epidemiológicos formalmente diseñados. Una excepción es el estudio de Berbari et al 2 quienes publicaron en 1998 un estudio retrospectivo de casos y controles realizado sobre una población de 26.505 pacientes, a los que se les había colocado una prótesis de cadera o rodilla, con el objetivo de identificar los factores de riesgo relacionados con el desarrollo de IP. En el mismo, se constataron 462 IP, y se identificaron cuatro variables independientes, que demostraron significación en el análisis multivariado: a) el desarrollo de infección en el lecho quirúrgico sin afectar al material protésico; b) el diagnóstico de enfermedad tumoral maligna, exceptuando cánceres cutáneos diferentes del melanoma o neoplasias que afecten a la articulación que intervenir, en los 5 años previos al acto quirúrgico; c) un índice de riesgo quirúrgico elevado de acuerdo con la escala NNIS y utilizado por la Sociedad Americana de Anestesistas, y d) la intervención sobre una articulación con antecedente de artroplastia previa. Otros factores como la artritis reumatoide, el tratamiento con corticoides y la diabetes mellitus mostraron sólo significación en el análisis univariado.
En nuestros pacientes la diabetes mellitus ha sido el único factor de riesgo que ha demostrado relación estadísticamente significativa con la IP, tanto en el análisis univariado como en el multivariado. Una IP es 3,18 veces más frecuente en los individuos diabéticos que en los no diabéticos.
Otras series de pacientes han apoyado también la posibilidad de un mayor riesgo de IP en pacientes diabéticos 25,26, aunque no todos los autores han constatado este hecho 27.
El agente causal aislado con más frecuencia en nuestra serie es el Staphylococcus epidermidis, coincidiendo con los resultados de algunos estudios 1,9, mientras que en otros el Staphylococcus aureus es el germen predominante 2,21. El aislamiento de un germen exclusivamente de la herida superficial, hecho que ocurrió en tres de nuestros pacientes, puede hacer dudar sobre la causalidad del mismo en la IP 2. En los 3 pacientes en que se dio esta circunstancia la respuesta al tratamiento fue correcta adecuando el mismo a los antibiogramas obtenidos.
Es de destacar el escaso número de técnicas de imagen realizadas para confirmar el diagnóstico de IP. En nuestros pacientes el diagnóstico se basó en el aislamiento del germen causal, la clínica y la alteración de parámetros analíticos como la VSG y la proteína C reactiva. De los 14 casos, en ocho, la radiología pedida con la sospecha de IP fue informada como normal, algo que ya se ha constatado con anterioridad en otros estudios 28.
En el 88,5% de los casos se han utilizado betalactámicos para la profilaxis antibiótica, en el 24,5% cefotaxima, dato que sorprende, ya que no ha demostrado superioridad respecto a las cefalosporinas de primera o segunda generación, que son las más utilizadas 29. En el 4% se ha utilizado vancomicina y en el resto de los casos se constata una importante variabilidad en los antibióticos utilizados. El riesgo de infección aparece con la incisión cutánea y es máximo al final de la intervención 29, por lo que es importante administrar el antibiótico previamente a la cirugía, y de forma repetida durante la misma si fuera necesario, con el objetivo de mantener concentraciones adecuadas en los tejidos durante todo el acto quirúrgico. En las artoplastias de rodilla, en las que se realizan procedimientos isquémicos, parece importante la administración de fármacos con semividas prolongadas, previamente a la inducción de la isquemia. En nuestra serie, en el 2% de los pacientes se realizó la profilaxis de forma inadecuada, después de la cirugía, y en el 3% no se administró o no se recogió la información correctamente. El tiempo en que se debe mantener la profilaxis antibiótica no está establecido 29, aunque se sabe que una semana no es más eficaz que un día 30. Probablemente la elaboración de protocolos y/o guías de práctica clínica contribuiría a mejoras, también, en el aspecto de la profilaxis.
Finalmente, cabe reseñar que este trabajo presenta limitaciones, como son el tamaño de la muestra y el bajo número de IP, que limitan la evaluación de los factores de riesgo para IP. Del mismo modo la duración del seguimiento, 2 años, que limita la evaluación de los tratamientos utilizados para los casos de IP, imposibilita el estudio de las infecciones tardías.
Relación de miembros del Grupo de Estudio de la Infección de Prótesis
Vicky Ariza, Encarna Martínez Pérez, Ll. Moner i Coromina, Josefina Obradors Soriano, Miguel Pumareta, Irene Vidal y J.M. Baucells.
Correspondencia: Dr. J. García-Pont.
Torres i Pujal, 36. 08022 Barcelona. España.
Correo electrónico: 19688jgp@comb.es
Manuscrito recibido el 28-2-2005; aceptado el 9-6-2005.