Introducción
El trasplante alogénico de células progenitoras hematopoyéticas (TACPH) es, a fecha de hoy, la mejor alternativa terapéutica para numerosas enfermedades hematológicas, oncológicas, inmunológicas y metabólicas 1. En la última década, con el uso de nuevas medidas de soporte, se ha observado una disminución de la morbilidad y mortalidad de estos pacientes. Las complicaciones más frecuentes del TACPH son: la toxicidad de la quimioterapia y/o radioterapia que se utilizan como régimen de acondicionamiento, la enfermedad del injerto contra el huésped (EICH) y las infecciones 2. La etiología de estas últimas varía de acuerdo al tiempo transcurrido desde el inicio del trasplante 3. En el período de neutropenia predominan las infecciones bacterianas y micóticas, mientras que las infecciones virales se presentan con mayor frecuencia entre los 30 y 100 días posteriores al trasplante, relacionadas con una deficiencia grave de la inmunidad celular 4.
La enfermedad causada por el citomegalovirus (CMV) es una de las complicaciones infecciosas más frecuentes, y la neumonía por CMV es una de las presentaciones asociada a una mayor mortalidad 5. El reconocimiento de los factores de riesgo asociados a la enfermedad por CMV, el desarrollo de técnicas diagnósticas adecuadas y el uso de fármacos antivirales eficaces han permitido proponer diferentes estrategias preventivas de la enfermedad por CMV 6. Entre ellas se encuentra la profilaxis con antivirales, en todos los pacientes o en aquellos casos con factores de riesgo asociados a la enfermedad por CMV y el tratamiento preventivo de la infección en quienes se detecta el virus en la sangre o en el lavado broncoalveolar (LBA) 7-9.
Los objetivos de este trabajo eran:
1. Evaluar la frecuencia de la infección y/o enfermedad por CMV en pacientes pediátricos que recibieron un TACPH agrupados de acuerdo con la presencia de factores de riesgo asociados a estas complicaciones.
2. Determinar en el grupo de pacientes con serología positiva para CMV si la realización del cultivo rápido de CMV en el LBA en los pacientes con antígeno pp65 (antigenemia) negativo en sangre aumenta la frecuencia del diagnóstico temprano de la infección por este virus respecto a la detección aislada de la antigenemia.
Métodos
Desde el 1 de enero de 1997 al 1 de febrero de 2002, se realizó un estudio prospectivo de los pacientes que recibieron un TACPH en la Unidad de TACPH del Hospital de Pediatría Profesor Dr. Juan P. Garrahan. Se excluyeron los pacientes con inmunodeficiencia combinada grave, que recibieron trasplantes con donantes familiares no idénticos con depleción de linfocitos T, y los pacientes que fallecieron en el período de neutropenia antes de lograr la reconstitución hematológica. Durante los 12 meses posteriores al trasplante se evaluaron la frecuencia de la EICH aguda, la frecuencia y etiología de los episodios de neumopatía y la mortalidad relacionada con el trasplante.
Todos los pacientes fueron internados en habitaciones con filtros HEPA y recibieron profilaxis con ciprofloxacino (10 mg/kg/día) y fluconazol (6-8 mg/kg/día) durante el período de neutropenia. Los pacientes con serología positiva para herpes simple recibieron aciclovir (750 mg/m 2/día) hasta el día 45 postrasplante.
Como profilaxis para Pneumocystis jiroveci se utilizó trimetoprima-sulfametoxazol (5 mg/kg tres veces por semana) o pentamidina inhalatoria (150-300 mg cada 28 días) hasta los 180 días postrasplante.
Todos los pacientes recibieron gammaglobulina no específica intravenosa en dosis de 500 mg/kg cada 2 semanas; la dosis fue semanal para los pacientes con EICH aguda o infección por CMV. El soporte transfusional se efectuó con hemoderivados filtrados e irradiados sin control de serología para CMV. Los regímenes de condicionamiento y de profilaxis de la EICH aguda variaron según la patología por la que se indicó el trasplante.
Antes del trasplante se efectuó la serología para CMV a donantes y receptores. En el período postrasplante, al alcanzar una cifra de neutrófilos de 0,5 x 10 9/ml se realizaron los siguientes estudios:
1. Detección de la antigenemia sobre leucocitos polimorfonucleares con técnica de inmunofluorescencia indirecta. Se observaron 400.000 leucocitos de cada paciente, en dos improntas de 200.000 cada una, obtenidas por citocentrifugación. La fijación se realizó con una solución de formalina/sacarosa y la permeabilización con Igepal CA 630® (SIGMA, Alemania). Se utilizó un anticuerpo monoclonal contra pp65 C10/C11 (IQ Products, Holanda). Las dos improntas se observaron con microscopia de fluorescencia y el resultado se expresó como positivo (indicando el número de leucocitos con núcleos teñidos con fluorescencia que resultaran como promedio de ambas) o negativo si no existieran leucocitos con activación nuclear. Se consideró diagnóstico de infección un resultado de 1/200.000.
2. Cultivo rápido de CMV en el LBA. Este procedimiento se realizó en el quirófano de endoscopia respiratoria bajo anestesia general utilizando un fibroscopio Pentax n.º 10 o 15 de acuerdo con el calibre de la vía aérea. Se instilaron alícuotas de 1-1,5 ml/kg de solución salina. El material obtenido se estudió mediante técnica de cultivo rápido, con 45 min de centrifugación previa a la incubación en una estufa de 37 °C con atmósfera de 5% de CO2 en tubos de base plana con un cubreobjetos que contenían una línea controlada de fibroblastos de prepucio humano. Los cultivos se revelaron con anticuerpo inmediato temprano a las 24 y 48 h de incubación. Los resultados se expresaron como positivo (observación de células con núcleo fluorescente) o negativo.
Antes del trasplante los pacientes fueron agrupados según el riesgo de presentar la enfermedad por CMV:
1. Grupo 1 (riesgo bajo): se incluyeron los casos en que los que los donantes y receptores tenían serologías negativas para CMV.
2. Grupo 2 (riesgo intermedio): se incluyeron los casos en que los receptores y/o los donantes tenían serologías positivas para CMV.
3. Grupo 3 (riesgo alto): se incluyeron aquellos pacientes que presentaron una EICH aguda resistente al tratamiento con corticoides, sin considerar la serología para CMV del receptor y/o donante.
Las medidas de prevención de la enfermedad por CMV según el grupo de riesgo fueron las siguientes:
1. Para el grupo 1 los pacientes fueron seguidos postrasplante con detección semanal de antigenemia hasta el día 100 postrasplante. En caso de tener una antigenemia positiva se administró ganciclovir 10 mg/kg/día durante 15 días y tras obtener una antigenemia negativa, se continuó con una dosis de 6 mg/kg/día 5 días por semana hasta el día 100 postrasplante.
2. Para el grupo 2 se realizaron controles similares a los del grupo anterior. En aquellos casos que presentaron una antigenemia negativa se realizó la búsqueda del CMV en el LBA entre los días 35 y 45 postrasplante. Los pacientes con antigenemia positiva o un cultivo rápido positivo en el LBA recibieron el mismo esquema de tratamiento preventivo que los pacientes del grupo 1.
3. Para el grupo 3 los pacientes recibieron profilaxis con ganciclovir 5 mg/kg/día desde el diagnóstico de EICH aguda refractaria a los corticoides hasta el control de la enfermedad y descenso de la inmunosupresión, manteniendo el control de antigenemia semanal. Durante el tratamiento con ganciclovir, los pacientes que presentaron hemogramas con un recuento de neutrófilos de menos de 1,0 x 10 9/l, recibieron factor estimulante de colonias granulocíticas, y el ganciclovir se mantuvo en caso de obtenerse una buena respuesta. El recuento de plaquetas inferior a 50 x 10 9/l se consideró una indicación para la suspensión del ganciclovir.
Resultados
Durante el período de estudio se realizaron de manera consecutiva 82 TACPH. Se excluyeron inicialmente 12 pacientes que recibieron un TACPH no histoidéntico con depleción de linfocitos T y 7 pacientes que fallecieron en el período de neutropenia. Otros 4 pacientes fueron excluidos más tarde por no haber cumplido el protocolo establecido (a 2 pacientes no se les efectuó el LBA por el riesgo anestésico, un paciente recibió foscarnet por presentar una neumopatía por CMV durante el período de neutropenia y una paciente con EICH aguda resistente al tratamiento con corticoides y pancitopenia moderada no recibió profilaxis).
Las características de los 59 pacientes evaluables se resumen en la tabla 1. Un total de 4 (7%) niños ingresaron en el grupo 1, 49 niños (83%) en el grupo 2, y 6 (10%) en el grupo 3.
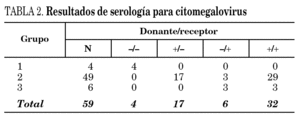
En la tabla 2 se muestran los resultados de las serologías de donantes y receptores en los pacientes de acuerdo con los diferentes grupos evaluados.
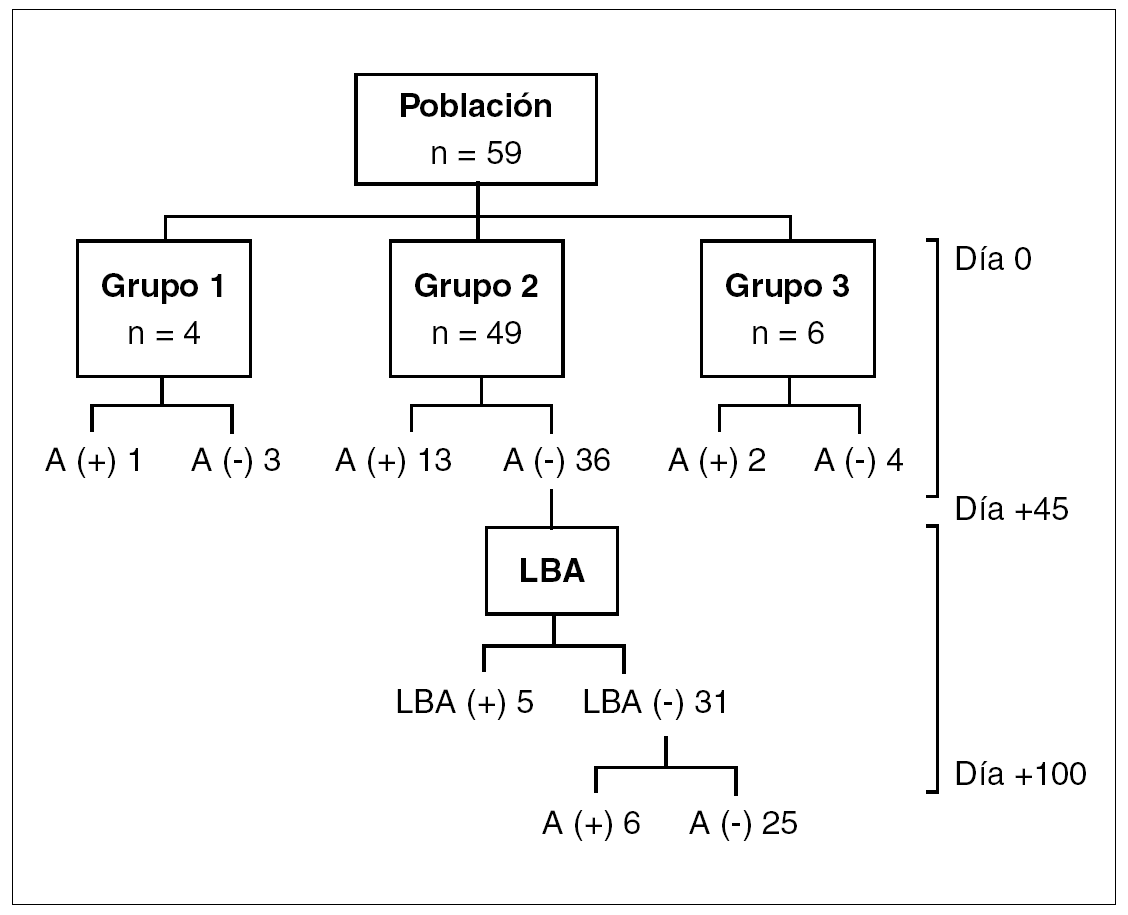
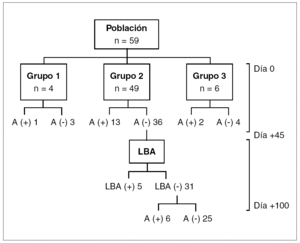
Los resultados de antigenemia y LBA en los distintos grupos se sintetizan en la figura 1. En el grupo 1, una niña con síndrome de Chédiak-Higashi presentó una antigenemia positiva.
Figura 1. Resultados de antigenemia y LBA en los diferentes grupos. LBA: lavado broncoalveolar.
En el grupo 2, 24 pacientes (49%) presentaron infección por CMV. El diagnóstico se estableció por la antigenemia en 19 pacientes (79%) y por cultivo del LBA en 5 pacientes (21%). Otros 6 pacientes con resultados negativos en la búsqueda de CMV en el LBA presentaron una antigenemia positiva pasados los 45 días postrasplante. No hubo complicaciones relacionadas con la realización de estos procedimientos. En el grupo 3, 2 pacientes (33%) tuvieron antigenemias positivas durante la profilaxis con ganciclovir, y 31 niños (53%) de este estudio recibieron ganciclovir: 25 pertenecían a los grupos 1 y 2 y los 6 restantes al grupo 3. En los pacientes de los grupos 1 y 2 el ganciclovir fue bien tolerado, y sólo de manera ocasional se requirió factor estimulante de colonias granulocíticas. Un total de 2 pacientes del grupo 3 debieron suspender el ganciclovir por toxicidad hematológica o por aparición de antigenemias positivas durante su administración. En ambos casos, con el uso de foscarnet, se obtuvieron resultados negativos en los controles posteriores.
De esta serie, 10 pacientes (17%) tuvieron diagnóstico de neumonía tras el trasplante (mediana y rango de 97 y 33 a 360 días postrasplante, respectivamente). Otros 3 pacientes, pertenecientes al grupo 2, no fueron estudiados mediante LBA porque se encontraban en mal estado general. Dos de estos pacientes, que tenían antigenemias negativas, recibieron ganciclovir y antibióticos de amplio espectro, y uno de ellos falleció a pesar del tratamiento utilizado. La tercera paciente fue una niña a quien se había administrado ganciclovir desde el día 14 hasta el día 100 postrasplante por tener antigenemias positivas persistentes. El día 120 postrasplante, esta paciente falleció a pesar del uso de foscarnet y gammaglobulina intravenosa. En la autopsia se informó de un daño alveolar difuso, sin evidencias compatibles con la presencia de CMV en los órganos estudiados.
A los 7 pacientes restantes con neumonía se les efectuó un LBA. Los resultados de estos estudios fueron los siguientes: P. jiroveci, 2 pacientes; Mycoplasma pneumoniae, un paciente; Influenza, un paciente; Candida albicans, un paciente y resultados negativos, 2 pacientes. De estas neumonías, cuatro se presentaron en niños del grupo 2 y las tres restantes en pacientes del grupo 3.
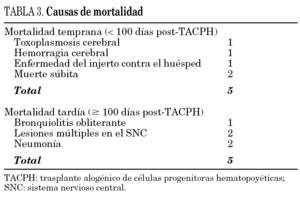
La mortalidad relacionada con el trasplante fue del 16%, la mortalidad temprana (< 100 días), del 8% y la mortalidad tardía del 8%. Ningún paciente del grupo 1 falleció, mientras que la mortalidad del grupo 2 fue del 12% y la del grupo 3 del 67%. En la tabla 3 se enumeran las causas de muerte relacionada con el trasplante.
Un total de 4 pacientes fallecieron tras los 100 días postrasplante por presentar una recaída leucémica.
Discusión
La neumonía por CMV fue reconocida desde la década de 1970 como una causa frecuente de mortalidad en los receptores de TACPH 5. La serología positiva para CMV del receptor y/o del donante, previo al trasplante, es considerada el factor de riesgo más importante asociado a esta enfermedad. Otros factores de riesgo descritos son la presencia de la EICH y edad mayor de 20 años 10. En los receptores seronegativos de injertos seronegativos, las transfusiones sanguíneas de donantes seropositivos son una fuente de infección por CMV. El reconocimiento de esta situación, llevó a considerar al soporte transfusional con donantes seronegativos como la primera medida efectiva para la prevención de la enfermedad por CMV, en este grupo de pacientes 11. Esta recomendación resulta de difícil implementación dada la baja frecuencia de donantes seronegativos. El desarrollo ulterior de filtros para leucorreducción de los componentes sanguíneos es una alternativa que, según algunas publicaciones, sería equivalente a las transfusiones sanguíneas con serología negativa con respecto al riesgo de transmisión del CMV 12.
En nuestra serie, un fallo en la respuesta inmunológica y una infección en el período de ventana serían explicaciones del hallazgo de la antigenemia positiva en una niña con síndrome de Chédiak-Higashi incluida en el grupo 1. Dada la relativa ineficacia del tratamiento de la enfermedad por CMV, se planteó el tratamiento preventivo como una alternativa para considerar en aquellos pacientes con serologías positivas 13. El reconocimiento de que la neumonía por CMV tiene un período de máxima incidencia alrededor de los 50-70 días postrasplante, facilitó la implementación de esta estrategia.
El uso del ganciclovir, desde la recuperación de la neutropenia hasta los 100 días postrasplante, es una de las estrategias utilizadas para la prevención de la enfermedad por CMV 7. Con ella no se ha observado una disminución de la mortalidad, mientras que se describió un aumento de la frecuencia de infecciones bacterianas y micóticas en los pacientes que recibieron ganciclovir. El incremento de estas complicaciones infecciosas asociado, en parte a la neutropenia que ocasiona el ganciclovir en alrededor del 30% de los pacientes, ha limitado el uso profiláctico de este fármaco a pacientes con elevado riesgo de presentar la enfermedad por CMV 6,15.
En los pacientes del grupo 3 de nuestra serie, que recibieron una profilaxis similar a la descrita previamente, se observó una frecuencia de infección por CMV del 33%. Estos niños no presentaron enfermedad por CMV. Sin embargo, se observó alta mortalidad asociada a complicaciones relacionadas a la EICH aguda grave, similar a la observada en otros estudios 16.
El tratamiento preventivo de la infección asintomática por CMV en su etapa es otra alternativa de prevención de la enfermedad por CMV. Los trabajos iniciales, basados en la búsqueda del CMV en cultivo de sangre o del LBA mostraron que la detección de la infección por estas pruebas y el uso de ganciclovir tras el hallazgo de resultados positivos, se asociaban a una disminución de la frecuencia de la enfermedad por CMV y de la mortalidad subsiguiente 8,9.
El desarrollo de la antigenemia permitió contar con una técnica más sensible y rápida para detección de CMV en sangre que el cultivo rápido. Los estudios comparativos entre antigenemia y cultivo rápido del LBA han demostrado que la primera, realizada en forma seriada, es más sensible para la detección del virus. Sin embargo, esos mismos estudios describieron que pacientes con antigenemia negativa podían presentar un cultivo rápido positivo en el LBA. Ibrahim et al 18, en un estudio de pacientes adultos a los que se les realizó, en todos los casos, el LBA además del control de antigenemia seriada, hallaron que la realización del LBA aumentó la frecuencia de diagnósticos de infección en el 13%, mientras que la frecuencia de la enfermedad por CMV fue del 3% 19. En nuestra serie, observamos que el control de antigenemias semanales permitió detectar la infección por CMV en 13 pacientes (26%) del grupo 2 antes del día +45. La realización del LBA en los pacientes restantes de este grupo aumentó la frecuencia de la detección del virus de CMV en el 10% en el grupo y en el 9% en el total de la serie.
La enfermedad tardía por CMV, como la que presentó uno de nuestros pacientes del grupo 2, ha surgido como un nuevo problema en aquellos pacientes tratados de forma preventiva con ganciclovir 20.
En nuestro estudio excluimos a los pacientes con inmunodeficiencia combinada grave que recibieron trasplantes no histoidénticos, en los que es imposible realizar estudios serológicos y cuya reconstitución inmunológica es más lenta. En la serie pediátrica que hemos estudiado las frecuencias de infección y neumonía por CMV fueron del 45% y 1,5%, respectivamente. Con esta estrategia de diagnóstico temprano y el uso de profilaxis en los pacientes de riesgo alto y de tratamiento preventivo en los restantes, se logró una prevención de la neumonía por CMV en la etapa temprana del trasplante, restringiendo el uso de ganciclovir al 53% de los pacientes de este estudio.
Correspondencia: Dr. C. Figueroa.
Servicio de Hematología y Oncología.
Pichincha 1850. Ciudad de Buenos Aires. Argentina.
Correo electrónico: cfigueroa@garrahan.gov.ar
Manuscrito recibido el 7-9-2004; aceptado el 15-6-2005.