Las infecciones fúngicas invasoras (IFI) son infecciones de difícil diagnóstico y causan una alta mortalidad a una amplia variedad de enfermos. Debido a las limitaciones del cultivo microbiológico, se han desarrollado otras técnicas diagnósticas, entre las que destacan la determinación sérica de galactomanano o beta-1,3-d-glucano, y los anticuerpos antimicelio y antimanano. La aplicación de la biología molecular y la espectrometría de masas (MALDI-TOF) son esperanzadoras para la optimización del diagnóstico y el manejo de pacientes con IFI. En lo relativo a los fármacos antifúngicos, el desarrollo de nuevos puntos de corte especie-específicos para clasificar a los aislados como sensibles o resistentes, y la necesidad de monitorización sérica de azoles, merecen especial atención.
Invasive fungal infections (IFIs) are difficult to diagnose and cause a high mortality to an expanding spectrum of patients. Culture of clinical samples has limitations for the diagnosis of IFI and alternative procedures have been developed. Among them, serum determination of galactomannan or beta-1,3-d-glucan, and antimicelium and antimannan antibodies are relevant. The use of molecular procedures and mass spectrometry (MALDI-TOF) are encouraging tools for the optimization of the diagnosis and management of patients with IFI. The proposal of species-specific breakpoint to classify the isolates as resistant or susceptible to antifungal agents and the necessity of monitor the azole serum levels deserve greater attention.
Las infecciones fúngicas invasoras (IFI) se han convertido en un problema para los hospitales por el aumento del espectro de enfermos susceptibles, el aumento en el número de pacientes en riesgo y su elevada mortalidad. El diagnóstico microbiológico de las IFI, fundamentalmente de las causadas por Candidaspp., se basa en el cultivo microbiológico. Para paliar las limitaciones del cultivo se han desarrollado técnicas alternativas como la detección de biomarcadores circulantes o ADN fúngico. Los 2 procedimientos estandarizados para determinar la sensibilidad a los antifúngicos de los aislados clínicos productores de IFI, desarrollados por el European Committee of Antimicrobial Susceptibility Testing (EUCAST) y el Clinical and Laboratory Standards Institute (CLSI) aportan puntos de corte para Candidaspp. Los niveles séricos de itraconazol, voriconazol y posaconazol son difícilmente predecibles. Los pacientes con niveles subterapéuticos tienen menor probabilidad de responder al tratamiento, mientras que aquellos con niveles elevados pueden desarrollar toxicidad atribuible al fármaco.
Consideraciones clínicasEl conocimiento de la epidemiología local de las especies causantes de candidemia es importante a la hora de instaurar tratamiento antifúngico empírico debido a las marcadas diferencias en la sensibilidad antifúngica entre especies. La distribución de especies difiere geográficamente; C.glabrata es especialmente prevalente en el norte de Europa y Norteamérica, mientras que C.parapsilosis es más frecuente en el sur de Europa y Latinoamérica. En los últimos años se ha constatado que los pacientes con enfermedades pulmonares crónicas como la enfermedad pulmonar obstructiva crónica o la enfermedad granulomatosa crónica, así como pacientes ingresados en unidades de cuidados intensivos, pueden desarrollar aspergilosis pulmonar invasora. Esto obliga al clínico a aumentar el nivel de sospecha en estos pacientes. Recientemente han aparecido cepas de Aspergillus fumigatus con resistencia a los azoles en países del norte de Europa. La hipotética diseminación aérea de estas cepas a otras áreas geográficas exige la monitorización de la sensibilidad a los azoles en A.fumigatus.
Recogida de la muestraLas muestras de sangre se deben tomar desde una vía periférica; el aislamiento de Candidaspp. exclusivamente en una muestra de sangre extraída por la luz del catéter no indica la presencia de candidemia. La sensibilidad diagnóstica de los hemocultivos es dependiente del volumen de sangre inoculada en la botella. En pacientes adultos se deben inocular no menos de 8-10ml de sangre por botella. En el caso de pacientes pediátricos, se deben inocular no menos de 1,5ml de sangre en botellas especiales. El galactomanano se puede detectar en suero o en muestras de lavado broncoalveolar (LBA). La detección en otras muestras no es recomendable. Cualquier muestra clínica es potencialmente adecuada para la detección de ADN fúngico. Es recomendable monitorizar los niveles séricos de itraconazol, voriconazol y posaconazol en todos los pacientes que reciban estos fármacos. El suero o el plasma son las muestras óptimas y se deben tomar 5-7días tras el inicio de la terapia antifúngica. Se debe tomar la muestra de suero justo antes de administrar la siguiente dosis del fármaco (valle).
Transporte, conservación y manejo de la muestra tras su recepción en el laboratorio de microbiologíaTodas las muestras se deben enviar al laboratorio con rapidez y previa manipulación aséptica de las mismas. Los hemocultivos se deben insertar en los sistemas de agitación automática a su llegada al laboratorio. Las muestras en las que se solicite cultivo microbiológico para el aislamiento de hongos oportunistas se deben refrigerar a 4°C hasta su procesamiento. Las muestras en las que se soliciten determinaciones moleculares se deben congelar a –20°C hasta su procesamiento. Las muestras clínicas de pacientes con sospecha de IFI se deben manejar con precaución en el laboratorio. El clínico debe informar de la sospecha de IFI causada por hongos regionales o endémicos, ya que esto obliga al cultivo de las muestras en medios incubados a diferentes temperaturas (dimorfismo térmico). Se debe indicar este hecho en las placas para proteger al máximo al personal del laboratorio.
Procesamiento de la muestraEl cultivo microbiológico de las muestras se realizará en medios habituales para la recuperación de hongos oportunistas (agar Sabouraud, CHROMagar Candida®). Las determinaciones basadas en PCR no están todavía recogidas como criterios diagnósticos de IFI, por lo que son siempre determinaciones adicionales al cultivo microbiológico. En caso de que la muestra sea escasa y se comprometa el resultado del cultivo, se debe dar preferencia al mismo. En el procesamiento de la muestra para las determinaciones de anticuerpos o antígenos fúngicos se recomienda seguir fielmente las instrucciones del fabricante. Las muestras para detección de ADN fúngico deben de ser centrifugadas (con la excepción del suero) y el precipitado se someterá a extracción de ADN y posterior purificación del mismo. Existen diversos sistemas comerciales para realizar este procedimiento. Para la monitorización de los niveles de azoles, se debe separar el suero o el plasma en una alícuota que se mantendrá refrigerada a 4°C hasta su posterior procesamiento. La caracterización de los aislados fúngicos se realizará sobre una cepa en cultivo puro que se procesará de acuerdo con los procedimientos correspondientes para los estudios moleculares o identificación por medio de espectrometría de masas.
Diagnóstico de las infecciones fúngicas invasoras basado en detección de biomarcadoresLa baja sensibilidad del cultivo micológico ha promovido el desarrollo de métodos alternativos basados en la detección de antígenos fúngicos (antígeno criptocócico, galactomanano de Aspergillus y manano de Candidaspp.), componentes estructurales (1,3-β-D-glucano), anticuerpos producidos por el propio paciente (anticuerpos antimanano y anticuerpos antimicelio) o detección de ADN del hongo en muestras clínicas1,2. La detección sérica de galactomanano (Platelia Aspergillus Ag®, Bio-Rad) es un criterio micológico en las definiciones de consenso de aspergilosis de la EORTC/MSG3. La determinación se hace generalmente en suero o plasma, y es recomendable hacerla 2 veces por semana para aumentar la especificidad. La detección de galactomanano en LBA de pacientes oncohematológicos, pacientes críticos y receptores de trasplante de órgano sólido también es útil para el diagnóstico de la aspergilosis invasora. La detección mediante ELISA de antígeno manano y de anticuerpos frente a este antígeno de Candidaspp. está disponible comercialmente (Platelia Candida Ag® y Platelia Candida Ab/Ac/Ak®; Bio-Rad). Se recomienda la realización conjunta de antígeno y anticuerpo en todo paciente con sospecha de candidiasis invasora y que presenta un elevado valor predictivo negativo (95%)4. Debido a la alta prevalencia de anticuerpos antimanano en la población sana o colonizada, se han investigado otros anticuerpos más específicos, como los anticuerpos antimicelio frente a antígenos del micelio de C.albicans, que presentan una sensibilidad del 84,4% y una especificidad del 94,7%5. El 1,3-β-D-glucano (Fungitell®; Associates of Cape Cod, Inc., EE.UU.) es un componente de la pared celular fúngica que se libera con el desarrollo de la infección; es un biomarcador panfúngico detectable en el suero de los pacientes con IFI, con la excepción de la mucormicosis y la criptococosis6–8. Es útil para el diagnóstico de aspergilosis invasora en pacientes oncohematológicos neutropénicos, con una sensibilidad del 64 al 88% y una especificidad cercana al 90%. También ha demostrado utilidad en el diagnóstico de otras IFI, como la candidiasis invasiva en pacientes críticos y en neumonías por Pneumocystis jirovecii. La detección de 1,3-β-D-glucano presenta resultados falsos positivos y negativos. El tratamiento empírico con antifúngicos no interfiere en su detección. Se recomienda realizarlo en sueros seriados (cada 3 o 4 días), en paralelo con otros biomarcadores, y se ha incluido como criterio micológico de enfermedad fúngica invasora probable en las definiciones de consenso de la EORTC/MSG.
Diagnóstico de las infecciones fúngicas invasoras basado en detección de ADN fúngicoLa justificación de la detección de ADN fúngico en una muestra clínica es similar a la de los biomarcadores discutidos en la sección anterior, con la ventaja de que los métodos moleculares ofrecen, además de un resultado positivo, la detección de la especie de hongo involucrada9. Las técnicas moleculares siguen siendo herramientas muy prometedoras, aunque desafortunadamente aún no han conseguido instaurarse en el laboratorio de microbiología por su elevado coste, la necesidad de personal cualificado y la falta de estandarización. El formato de PCR más extendido en el laboratorio es la PCR a tiempo real, que permite cuantificar el ADN presente en la muestra clínica, minimiza el riesgo de contaminaciones cruzadas y por tanto de falsos positivos, y permite el análisis una vez que se ha confirmado la amplificación del ADN (análisis de curvas de melting). En el diseño de las PCR se puede optar por una detección universal o panfúngica, o bien por la detección exclusiva de un género concreto o incluso de una única especie. Existen sistemas de PCR a tiempo real comercializados que permiten la detección de algunas especies de Candida y Aspergillus (Septifast Roche®), Aspergillusspp. o Pneumocystis jirovecii (MycAssay Aspergillus, MycAssay Pneumocystis, Myconostica Ltd.). La técnica PNA FISH (Peptide Nucleic Acid Fluorescent In Situ Hybridation; AdvanDx, Inc, Woburn, EE.UU.) permite la identificación precoz de las especies más relevantes de Candida visualizadas en tinciones de hemocultivos. Los PNA se forman a partir de una estructura artificial de poliamida resistente a la degradación por nucleasas y proteasas que forma complejos estables con ADN o ARN complementario. Los PNA se marcan con una molécula fluorescente que permiten la identificación en 2,5h.
Criterios para la interpretación de resultadosLos hemocultivos son válidos para el diagnóstico de candidemia, aunque presentan falsos negativos. La aspergilosis invasora o la mucormicosis casi nunca cursan con hemocultivos positivos. Sin embargo, las infecciones causadas por Fusariumspp. o Scedosporiumspp. pueden cursar con hemocultivos positivos. El cultivo de muestras respiratorias está recomendado para el diagnóstico de infecciones pulmonares causadas por hongos filamentosos, aunque este procedimiento tiene baja sensibilidad (50%) y especificidad para el diagnóstico de aspergilosis invasora. El aislamiento de Candidaspp. a partir de muestras respiratorias no indica la presencia de neumonía causada por este hongo. La detección de galactomanano sérico en pacientes oncohematológicos tiene alta especificidad (90%) y sensibilidad variable (30-100%). En combinación con la tomografía axial computarizada de alta resolución, la sensibilidad y la especificidad son ≥85 y ≥95%, respectivamente. Se considera positiva una determinación de galactomanano sérico ≥0,7ng/ml o 2 consecutivas de ≥0,5ng/ml. La detección de ≥1 ng/ml en el LBA podría considerarse diagnóstico, mostrando una sensibilidad y un valor predictivo positivo que llega al 90 y al 75%, respectivamente. Su utilidad en pacientes sin neutropenia es incierta por la menor angioinvasión observada (sensibilidad alrededor del 50%). Una de sus principales limitaciones es la presencia de falsos positivos, especialmente en niños. La interpretación de los resultados de la determinación de anticuerpos antimanano de Candida es la siguiente: resultado positivo (concentración superior a 10AU/ml), resultado intermedio (concentración entre 5 y 10AU/ml) y resultado negativo (concentración inferior a 5AU/ml). La presencia de anticuerpos antimanano de Candida es el resultado de una infección presente o pasada. Una variación importante en el título de anticuerpos antimanano de Candida puede constituir una evidencia de infección activa y debe confirmarse con los datos clínicos del paciente. Un resultado negativo no excluye el diagnóstico de candidiasis invasiva en pacientes inmunocomprometidos, por la menor capacidad para producir anticuerpos. La presencia de títulos de anticuerpos antimicelio ≥160 es compatible con una candidiasis invasora en un paciente inmunocompetente. Títulos inferiores pueden ser significativos en pacientes inmunocomprometidos. Una determinación de 1,3-β-D-glucano ≥80pg/ml se considera positiva. La detección de ADN fúngico no es un criterio de diagnóstico de IFI aceptado por la EORTC, por lo que la evaluación de los resultados se debe interpretar con precaución. Aunque la técnica PNA FISH no mejora la sensibilidad del hemocultivo para el diagnóstico de la candidemia, al menos anticipa su identificación, y su uso ha demostrado disminuir el uso de antifúngicos.
Aplicación de la biología molecular y la espectrometría de masas a la caracterización de aislados fúngicosLa identificación de aislados fúngicos por medio de biología molecular ha permitido descubrir especies fúngicas no diferenciables a partir de sus características morfológicas o bioquímicas. Lo que hasta ahora se han denominado especies son en realidad complejos de especies indistinguibles por los métodos de identificación convencional. La región ITS1-5,8S-ITS2 cumple estos requisitos y se considera el «código de barras» de los hongos, y es útil para la identificación precisa de levaduras. En el caso de Aspergillusspp., se debe amplificar y secuenciar el gen de la beta-tubulina10. En algunas ocasiones puede ser necesario llegar a realizar una caracterización molecular en cepas pertenecientes a la misma especie. Esto resulta esencial cuando se estudian brotes nosocomiales de IFI. La caracterización molecular permite evaluar la distancia genética existente entre cepas de la misma especie. Hay diferentes sistemas para realizar la caracterización molecular de los hongos. Los microsatélites están cobrando gran interés en los últimos años por su reproducibilidad, su capacidad discriminatoria y la posibilidad de exportar los resultados a otros laboratorios11. Por último, gracias a estas técnicas se ha podido avanzar considerablemente en el conocimiento de los mecanismos de resistencia a antifúngicos. La espectrometría de masas basada en la ionización y desorción suave mediante una matriz por láser y espectrometría con tiempo de vuelo (soft ionization Matrix-Assisted Laser Desorption Ionization Time-Of-Flight mass spectrometry, MALDI-TOF MS) se está aplicando a la micología12. Aunque hay comercializadas 3 plataformas, son 2 sistemas de MALDI-TOF MS comercializados los que más se han utilizado en la identificación fúngica: MALDI-Biotyper (Brüker-Daltonics) y VITEK MS AXIMA-SARAMIS (BioMerieux). El software de la plataforma utilizada se encarga de comparar los espectros obtenidos con su propia librería de espectros. El sistema MALDI-MS Biotyper presenta una escala de semejanza o puntuación del 0 al 3. El fabricante considera una identificación inaceptable por debajo de 1,7 de semejanza, aceptable a nivel de género de 1,7 a 2 y aceptable a nivel de especie por encima de 2. Las identificaciones obtenidas mediante espectrometría de masas tienen un grado de fiabilidad comparable a las técnicas de biología molecular, sin embargo conviene tomar precauciones cuando la identificación obtenida no es la esperada o se identifica una especie poco conocida, o cuando se va a identificar un hongo cuya identificación por MALDI-TOF MS ya se conoce como poco fiable porque está así recogido en la literatura o por la experiencia del propio laboratorio.
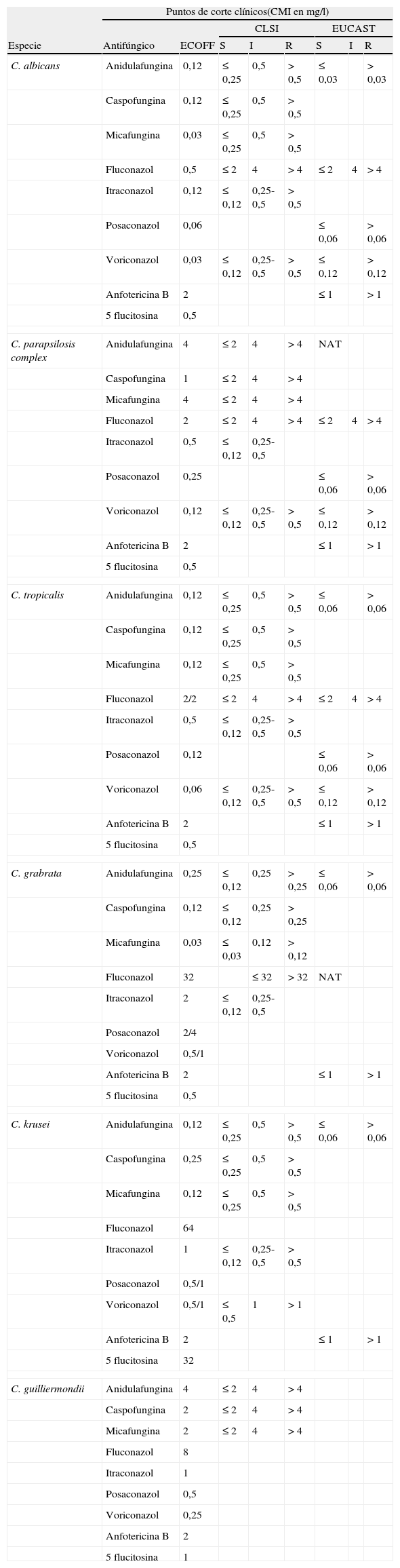
Estudios de sensibilidad in vitro a los antifúngicosEl principal fundamento de estas pruebas es detectar los aislados resistentes entre la población sensible o el desarrollo de resistencia durante el tratamiento. El CLSI y el EUCAST han desarrollado métodos reproducibles para determinar la sensibilidad a los antifúngicos de las levaduras, hongos filamentosos y dermatofitos13–16. El CLSI ha estandarizado 2 métodos para determinar la sensibilidad a los antifúngicos: el método de microdilución en caldo para levaduras (documento M27-A3)13 y para hongos filamentosos y dermatofitos (documento M38-A2)14, y el método de difusión en agar para levaduras (documentos M44-A2 y M44-S2)15 y hongos filamentosos no dermatofitos (documentos M51-A y M51-S1)16. El EUCAST también ha estandarizado un método de microdilución para levaduras (documento EDef 7.1)17 y para hongos filamentosos (documento E.DEF9.1)18. Los métodos del CLSI y del EUCAST son muy similares y comparables. Según el valor de la CMI, las cepas de Candidaspp. se clasifican en sensibles, intermedias, sensibles dependiendo de la dosis administrada, y resistentes (tabla 1). Para la anfotericina B y el posaconazol todavía no se han establecido puntos de corte clínicos. En la práctica clínica, y basándose en datos epidemiológicos, se consideran sensibles los aislados para los que la CMI es ≤1mg/l; para el posaconazol el punto de corte epidemiológico es especie-específico (tabla 1). Por el momento no se han establecido puntos de corte clínico para los hongos filamentosos: solamente se han establecido puntos de corte epidemiológicos. Debe tenerse en cuenta que en la evolución de las micosis invasoras influyen muchos factores inherentes al propio enfermo, como son el estado inmunológico, la enfermedad de base, el antifúngico y la dosis del mismo administrada, el tiempo que se ha tardado en instaurar el tratamiento, etc. Por tanto, el fracaso terapéutico no siempre es imputable al antifúngico. En general, los aislados de C.albicans y C.parapsilosis son sensibles a los azoles. Entre los aislados de C.tropicalis y C.glabrata es frecuente la resistencia al fluconazol y/o al itraconazol, mientras que C.krusei es intrínsecamente resistente al fluconazol. Las candinas son poco activas sobre C.parapsilosis y C.guilliermondii y no tienen actividad sobre C.neoformans. Hasta la fecha no se ha observado resistencia cruzada entre azoles y candinas, ni entre anfotericinaB y candinas. En los hongos filamentosos se han descrito aislados de A.fumigatus resistentes al itraconazol, al voriconazol, al posaconazol y/o a la anfotericinaB. Los aislados de A.terreus, Fusarium solani y Scedosporium prolificans son intrínsecamente resistentes a la anfotericinaB. Además, Fusariumspp. y los mucorales son intrínsecamente resistentes a las candinas. El posaconazol y la anfotericinaB son los únicos antifúngicos que tienen actividad sobre los mucorales.
Puntos de corte especie-específicos propuestos al CLSI para cada especie y por el EUCAST
| Puntos de corte clínicos(CMI en mg/l) | ||||||||
| CLSI | EUCAST | |||||||
| Especie | Antifúngico | ECOFF | S | I | R | S | I | R |
| C. albicans | Anidulafungina | 0,12 | ≤0,25 | 0,5 | >0,5 | ≤0,03 | >0,03 | |
| Caspofungina | 0,12 | ≤0,25 | 0,5 | >0,5 | ||||
| Micafungina | 0,03 | ≤0,25 | 0,5 | >0,5 | ||||
| Fluconazol | 0,5 | ≤2 | 4 | >4 | ≤2 | 4 | >4 | |
| Itraconazol | 0,12 | ≤0,12 | 0,25-0,5 | >0,5 | ||||
| Posaconazol | 0,06 | ≤0,06 | >0,06 | |||||
| Voriconazol | 0,03 | ≤0,12 | 0,25-0,5 | >0,5 | ≤0,12 | >0,12 | ||
| Anfotericina B | 2 | ≤1 | >1 | |||||
| 5 flucitosina | 0,5 | |||||||
| C. parapsilosis complex | Anidulafungina | 4 | ≤2 | 4 | >4 | NAT | ||
| Caspofungina | 1 | ≤2 | 4 | >4 | ||||
| Micafungina | 4 | ≤2 | 4 | >4 | ||||
| Fluconazol | 2 | ≤2 | 4 | >4 | ≤2 | 4 | >4 | |
| Itraconazol | 0,5 | ≤0,12 | 0,25-0,5 | |||||
| Posaconazol | 0,25 | ≤0,06 | >0,06 | |||||
| Voriconazol | 0,12 | ≤0,12 | 0,25-0,5 | >0,5 | ≤0,12 | >0,12 | ||
| Anfotericina B | 2 | ≤1 | >1 | |||||
| 5 flucitosina | 0,5 | |||||||
| C. tropicalis | Anidulafungina | 0,12 | ≤0,25 | 0,5 | >0,5 | ≤0,06 | >0,06 | |
| Caspofungina | 0,12 | ≤0,25 | 0,5 | >0,5 | ||||
| Micafungina | 0,12 | ≤0,25 | 0,5 | >0,5 | ||||
| Fluconazol | 2/2 | ≤2 | 4 | >4 | ≤2 | 4 | >4 | |
| Itraconazol | 0,5 | ≤0,12 | 0,25-0,5 | >0,5 | ||||
| Posaconazol | 0,12 | ≤0,06 | >0,06 | |||||
| Voriconazol | 0,06 | ≤0,12 | 0,25-0,5 | >0,5 | ≤0,12 | >0,12 | ||
| Anfotericina B | 2 | ≤1 | >1 | |||||
| 5 flucitosina | 0,5 | |||||||
| C. grabrata | Anidulafungina | 0,25 | ≤0,12 | 0,25 | >0,25 | ≤0,06 | >0,06 | |
| Caspofungina | 0,12 | ≤0,12 | 0,25 | >0,25 | ||||
| Micafungina | 0,03 | ≤0,03 | 0,12 | >0,12 | ||||
| Fluconazol | 32 | ≤32 | >32 | NAT | ||||
| Itraconazol | 2 | ≤0,12 | 0,25-0,5 | |||||
| Posaconazol | 2/4 | |||||||
| Voriconazol | 0,5/1 | |||||||
| Anfotericina B | 2 | ≤1 | >1 | |||||
| 5 flucitosina | 0,5 | |||||||
| C. krusei | Anidulafungina | 0,12 | ≤0,25 | 0,5 | >0,5 | ≤0,06 | >0,06 | |
| Caspofungina | 0,25 | ≤0,25 | 0,5 | >0,5 | ||||
| Micafungina | 0,12 | ≤0,25 | 0,5 | >0,5 | ||||
| Fluconazol | 64 | |||||||
| Itraconazol | 1 | ≤0,12 | 0,25-0,5 | >0,5 | ||||
| Posaconazol | 0,5/1 | |||||||
| Voriconazol | 0,5/1 | ≤0,5 | 1 | >1 | ||||
| Anfotericina B | 2 | ≤1 | >1 | |||||
| 5 flucitosina | 32 | |||||||
| C. guilliermondii | Anidulafungina | 4 | ≤2 | 4 | >4 | |||
| Caspofungina | 2 | ≤2 | 4 | >4 | ||||
| Micafungina | 2 | ≤2 | 4 | >4 | ||||
| Fluconazol | 8 | |||||||
| Itraconazol | 1 | |||||||
| Posaconazol | 0,5 | |||||||
| Voriconazol | 0,25 | |||||||
| Anfotericina B | 2 | |||||||
| 5 flucitosina | 1 | |||||||
NAT: no adecuado para tratamiento.
ECOFF (epidemiological cutoff value): concentración más elevada que separa la población salvaje (sin ningún mecanismo de resistencia) de los aislados con algún mecanismo de resistencia, no pertenecientes a la población salvaje. Se calcula para cada antifúngico y especie a partir de la CMI modal, distribución de las CMI, teniendo en cuenta la variabilidad inherente a la técnica, y debe incluir al menos el 95% de la población.
De: www.eucast.org (Versión: V4,1, Datos válidos desde 5/3/2012).
El objetivo de la monitorización sérica de azoles es aumentar las posibilidades de éxito terapéutico y minimizar la aparición de efectos adversos atribuibles al fármaco. De todos los procedimientos para realizar la monitorización sérica, la cromatografía líquida de alta presión es el deseable. Esta técnica presenta buena sensibilidad y además es reproducible.
El fluconazol presenta un perfil farmacocinético favorable y sus niveles séricos son predecibles. Esto significa que conociendo la dosis administrada se puede conocer el área bajo la curva del fármaco. El itraconazol se puede administrar por vía oral o intravenosa, pero su administración oral presenta problemas de absorción; además, este azol tiene una farmacocinética no lineal y numerosas interacciones medicamentosas a nivel hepático. Los niveles séricos de itraconazol en valle mayores de 6mg/l aumentan las probabilidades de éxito terapéutico; no existe una clara correlación entre niveles elevados y aparición de efectos adversos. El voriconazol se puede administrar por vía oral o intravenosa, y presenta una farmacocinética no lineal, lo que se traduce en cambios desproporcionados en la exposición al fármaco tras alteraciones en la dosificación. Además, el voriconazol se metaboliza principalmente por el citocromo CYP2C19, que presenta un considerable polimorfismo (metabolizadores lentos y rápidos). Niveles séricos de voriconazol en valle menores de 1μg/ml conducen a una menor probabilidad de éxito terapéutico; niveles séricos superiores a 5μg/ml conducen a una mayor probabilidad de aparición de efectos tóxicos, fundamentalmente a nivel del sistema nervioso central y hepático. El posaconazol se puede administrar exclusivamente por vía oral; presenta una farmacocinética lineal con dosis entre 50-800mg; sin embargo, la absorción se satura con dosis superiores a 800mg diarios. La exposición sistémica al fármaco aumenta tras la administración en dosis divididas. El problema del posaconazol es su absorción intestinal. La recomendación de la monitorización de niveles séricos de posaconazol no es tan evidente como en el caso del itraconazol y del voriconazol. Aunque parece existir una relación entre los niveles séricos elevados y una mayor respuesta terapéutica, no está claro cuál es el nivel a partir del cual disminuye la probabilidad de éxito terapéutico. Niveles séricos de posaconazol en valle superiores a 1,25-1,5μg/ml conducen a una mayor probabilidad de éxito terapéutico; no se ha establecido una relación entre niveles séricos elevados y la aparición de efectos adversos.
FinanciaciónJesús Guinea disfruta de un contrato para investigadores del Sistema Nacional de Salud del programa Miguel Servet, financiado por el Fondo de Investigación Sanitaria (MS09/00055).
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.