Las infecciones constituyen una de las complicaciones más importantes que afectan decisivamente al éxito de los trasplantes. El laboratorio de microbiología clínica ocupa un papel central en el diagnóstico, tratamiento y prevención de las complicaciones infecciosas. Los centros con programa de trasplantes deben contar con el soporte de un laboratorio de microbiología bien capacitado tecnológicamente y con una amplia cartera de servicios que ponga énfasis en las pruebas de diagnóstico rápido. En esta revisión se resumen los fundamentos clínicos que orientan la labor del laboratorio, el papel que desempeña en la evaluación de donantes y receptores y las técnicas diagnósticas a aplicar para los patógenos más relevantes.
Infections are one of the main complications that decisively affect the final outcome of transplants. Clinical microbiology laboratory has a key role in diagnosis, treatment and prevention of these complications. Centres with transplant programs must be technically supported with a well developed laboratory with special emphasis in rapid diagnostic techniques. In this article, we review the clinical background for the laboratory, its role in the evaluation of both donors and recipients, and the diagnostic methods for the main pathogens infecting transplant patients.
En las últimas décadas se han producido grandes avances en lo que conocemos como medicina del trasplante. Aún así, las infecciones continúan siendo uno de los principales obstáculos, a pesar de los indudables progresos en el diagnóstico y tratamiento. El laboratorio de microbiología clínica desempeña un papel crucial, de forma que existe una relación muy estrecha entre el desarrollo y éxito de un programa de trasplantes y la capacitación del laboratorio que ofrece sus servicios. Su cartera debe cubrir todas las áreas y debe estar guiada por criterios eminentemente prácticos, en particular con una amplia oferta de técnicas rápidas. La existencia de un programa de trasplante condicionará la estrategia, organización interna y utilización de recursos dentro de los servicios de microbiología pero, a su vez, éstos se benefician enormemente del conocimiento generado alrededor del trasplante. En esta línea, la integración del microbiólogo en los equipos multidisciplinarios es muy recomendable, no sólo por los beneficios directos para el paciente, sino porque solo así será posible que su oferta diagnóstica se modifique y adapte a un escenario que es y será cambiante.
En este artículo se resume una actualización de la microbiología en el contexto del trasplante, revisando conceptos básicos, líneas estratégicas y técnicas recomendables. Remitimos al lector al procedimiento SEIMC correspondiente para una información más detallada1.
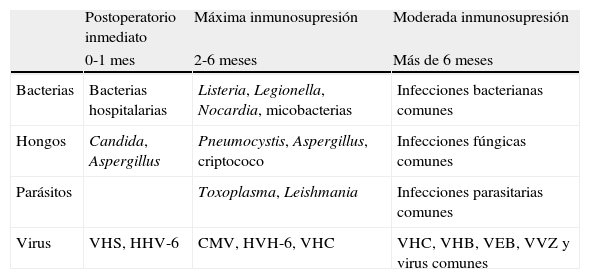
Cronología y factores de riesgo de la infección en el trasplantadoEn el receptor de un trasplante de órgano sólido (TOS) se combinan tres circunstancias que le hacen especialmente susceptible al desarrollo de complicaciones infecciosas: a) las acumuladas por la patología de base del receptor, b) las derivadas del procedimiento quirúrgico y requerimientos asistenciales, y c) las relacionadas con el tratamiento inmunosupresor. Puesto que cada paciente presenta características propias, el riesgo de infecciones deberá ser individualizado2. Aún así, desde un punto de vista práctico es posible encuadrar las distintas infecciones en tres períodos bastante definidos (tabla 1). En el primer mes o primeras semanas suelen predominar las infecciones bacterianas piógenas y por levaduras (infección de la herida quirúrgica, neumonía, bacteriemia, infección urinaria, etc.). Con alguna excepción, las infecciones víricas y por hongos filamentosos están ausentes. Por el contrario, éstas serán las predominantes entre el primer y tercer mes postrasplante, reflejo directo del tratamiento inmunosupresor. Las infecciones por citomegalovirus (CMV), virus de las hepatitis B (VHB) y C (VHC) y Aspergillus, entre otros, son un ejemplo típico de este período, mientras que las infecciones por Listeria o Nocardia son las expeciones bacterianas al predominio vírico. A partir del segundo semestre postrasplante, los pacientes con buena función del injerto y bajo nivel de inmunosupresión equiparan las infecciones a las del resto de la población, aunque otros pueden sufrir una infección crónica del injerto, por ejemplo la hepatitis crónica por el VHC en el trasplantado hepático, los cuadros linfoproliferativos asociados al virus Epstein-Barr (VEB) o el riesgo generalizado de infecciones en los pacientes que presentan rechazo crónico.
Cronología de las infecciones en el trasplantado de órgano sólido
| Postoperatorio inmediato | Máxima inmunosupresión | Moderada inmunosupresión | |
| 0-1 mes | 2-6 meses | Más de 6 meses | |
| Bacterias | Bacterias hospitalarias | Listeria, Legionella, Nocardia, micobacterias | Infecciones bacterianas comunes |
| Hongos | Candida, Aspergillus | Pneumocystis, Aspergillus, criptococo | Infecciones fúngicas comunes |
| Parásitos | Toxoplasma, Leishmania | Infecciones parasitarias comunes | |
| Virus | VHS, HHV-6 | CMV, HVH-6, VHC | VHC, VHB, VEB, VVZ y virus comunes |
CMV: citomegalovirus; HHV-6: herpesvirus humano 6; VEB: virus Epstein-Barr; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VHS: virus herpes simple; VVZ: virus varicela-zóster.
En el trasplante de precursores hematopoyéticos (TPH) los principales riesgos de infección en este tipo de pacientes se relacionan con alguno de los siguientes aspectos: reconstitución inmunohematopoyética, exposición a agentes infecciosos y formas de tratamiento (antineoplásico, inmunosupresor y antimicrobiano). En la tabla 2 se resumen los principales factores de riesgo. De ellos, el tipo de trasplante es uno de los más importantes, siendo mayor en el trasplante alogénico que en el autólogo. El trasplante de donante no emparentado tiene mayor riesgo que el familiar. La enfermedad del implante contra el huésped (EICH) aguda o crónica es también uno de los factores más relevantes, al igual que el régimen de acondicionamiento, entre otros. Los tiempos en que tienen lugar las infecciones en estos pacientes son consecuencia de los factores de riesgo anteriores3. Antes del prendimiento del injerto, la neutropenia y la rotura de las barreras mucosas (oral y gastrointestinal) y cutáneas (por el uso de catéteres) justifican la aparición de infecciones bacterianas gram-positivas, fúngicas (Candida y Aspergillus) y víricas (herpes simple). Tras el prendimiento (días 30 a 100), existe una profunda inmunodeficiencia humoral y celular agravada, en algunos pacientes, por la presencia de EICH aguda. En este período son frecuentes las infecciones por CMV, Pneumocystis jirovecii (P. jirovecii), y la mayoría de las infecciones oportunistas anteriormente mencionadas. En la fase tardía, el factor capital es la presencia de EICH crónica. Cuando esto ocurre, la lenta recuperación de la inmunidad humoral favorece las infecciones senopulmonares por agentes encapsulados (Streptococcus pneumoniae y Haemophilus influenzae), aunque también son frecuentes de este período las infecciones tardías por CMV, habitualmente asociadas a la profilaxis con ganciclovir en etapas tempranas.
Factores de riesgo de infección en trasplantados de precursores hematopoyéticos
| Trasplante alogénico frente a trasplante autólogo |
| Donante no emparentado frente a donante familiar |
| Infusión de dosis bajas de progenitores hematopoyéticosa |
| Depleción de células T |
| Presencia de EICH aguda o crónica |
| Receptor seropositivo para el CMV |
| Ambientes no protegidos y sistemas de aire sin filtrarb |
| Uso de corticoides para prevención o tratamiento del EICH |
| Administración de rituximab o alentuzumab |
| Uso de ganciclovir para la profilaxis o el tratamiento del CMV |
| Utilización de inmunoglobulinas |
| Administración de fluconazolc |
| Administración de productos de hemoterapia |
CMV: citomegalovirus; EICH: enfermedad del implante contra el huésped.
Muchas de las complicaciones infecciosas tienen un origen exógeno, incluyendo las producidas porpatógenos trasmitidos por el órgano trasplantado mientras que, en otras ocasiones, es el propio receptor quien los alberga de forma crónica o latente. En consecuencia, ciertas complicaciones pueden prevenirse o sus efectos negativos aminorarse mediante una correcta evaluación de donante y receptor. El laboratorio de microbiología desempeñará aquí un papel crucial.
Evaluación microbiológica del candidato a trasplanteLa selección y preparación del candidato a trasplante desde el punto de vista infeccioso es una actividad imprescindible en los programas de trasplante. Con la evaluación se persiguen los siguientes objetivos: a) el diagnóstico y tratamiento de las infecciones activas en el candidato, b) la toma de decisiones sobre su aceptación o exclusión, y c) la identificación de los factores de riesgo para el desarrollo de infecciones postrasplante con la consiguiente adopción de medidas de prevención.
Son muchas las posibles infecciones activas que puede sufrir el candidato a trasplante, por lo que es obligado orientar el diagnóstico microbiológico mediante la elaboración de una completa historia clínica, una exploración física cuidadosa y la consiguiente solicitud de las exploraciones pertinentes (tabla 3). Como principio general, el receptor debe estar libre de infección activa (bacteriana, fúngica, vírica o parasitaria) antes del inicio de la inmunosupresión, con especial cuidado en el área anatómica donde se va a realizar el trasplante. Algunas de estas infecciones, como la tuberculosis, algunas micosis y las producidas por microorganismos oportunistas, constituyen una contraindicación para el trasplante. Asimismo, la infección y colonización por bacterias multirresistentes causa graves complicaciones en algunas unidades de trasplante y es un fenómeno en aumento. La vigilancia de las tasas de prevalencia y el conocimiento de los perfiles antibióticos de estos microorganismos son clave para racionalizar las medidas preventivas y terapéuticas en el candidato.
Exploraciones complementarias a solicitar en la evaluación del candidato a un trasplante
| Prueba cutánea de la tuberculina (efecto booster y test de anergia) |
| Radiografía de tórax y de senos paranasales |
| Cultivos de sangre, orina, esputo, heces y de todos aquellos focos con sospecha de una infección activa y para descartar colonización, especialmente en el tracto respiratorio |
| Cultivos de vigilancia de bacterias multirresistentesa |
| Examen parasitológico de las heces o de otras muestras si se sospecha una infestación activa o si existen antecedentes clínico-epidemiológicos |
| Marcadores serológicos (y de otro tipo) de las infecciones latentes: VIH 1 y 2, hepatitis B, C y D, VHS 1 y 2, VVZ, CMV, VEB, T. gondii, T. pallidum |
| Obtención de suero y otras muestras para archivo y análisis futuro |
CMV: citomegalovirus; VEB: virus Epstein-Barr; VHS: virus del herpes simple; VIH: virus de la inmunodeficiencia humana; VVZ: virus varicela-zóster.
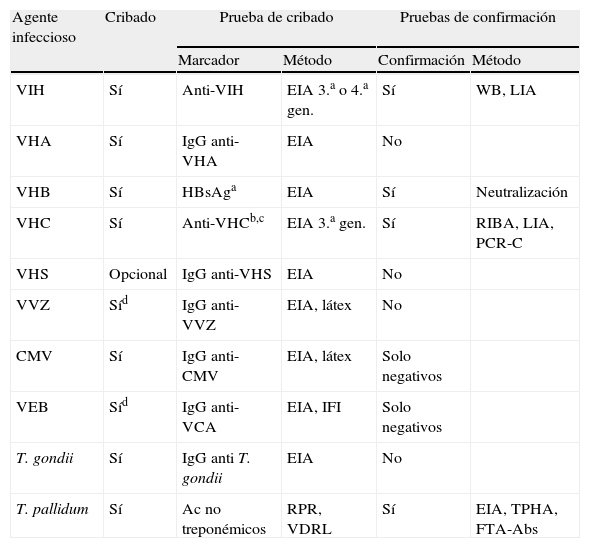
La realización de marcadores de infección crónica o latente es una actividad fundamental a realizar por el laboratorio por sus implicaciones preventivas, terapéuticas o pronósticas. Deberá basarse en la utilización de reactivos y métodos comerciales siempre homologados para uso diagnóstico. En general, los procedimientos y marcadores no difieren mucho de los que se aplican a otras situaciones clínicas, salvo la selección de los apropiados al fin que se busca. El laboratorio deberá incluir procedimientos de control interno y externo que aseguren la calidad de los resultados por él emitidos, especialmente en aquellos marcadores más críticos por las consecuencias negativas que pueda acarrear un resultado equivocado o, como en el caso de los hemodializados y el VHC, por la existencia de dificultades técnicas añadidas. En estos casos, se intensificarán los procedimientos de confirmación de resultados positivos. La detección fiable de valores negativos también puede ser muy importante ante la posibilidad de establecer medidas preventivas (vacunas, quimioprofilaxis, etc.) antes y después del trasplante (VHB), lo que puede obligar a exámenes repetidos a lo largo de todo el período. Las recomendaciones de cribado serológico se resumen en la tabla 4. A señalar, que la búsqueda se extiende más allá del cribado de los agentes víricos comunes (VHC, VHB, VIH-1), y que debe ampliarse a otras técnicas microbiológicas y microorganismos menos habituales, en función de las circunstancias clínicas y epidemiológicas. Ejemplos de esto serían el despistaje de infecciones activas parasitarias (paludismo, leishmaniasis, estrongiloidiasis, etc.). Además, el período previo al trasplante es el momento ideal para la inmunización frente a enfermedades infecciosas habituales prevenibles por vacunación, especialmente cuando no exista constancia de ello, por lo que deberán realizarse las determinaciones serológicas pertinentes (sarampión, rubéola, varicela, DTP, etc.) en función de la historia clínica del candidato.
Recomendaciones para el cribado serológico del candidato a trasplante
| Agente infeccioso | Cribado | Prueba de cribado | Pruebas de confirmación | ||
| Marcador | Método | Confirmación | Método | ||
| VIH | Sí | Anti-VIH | EIA 3.a o 4.a gen. | Sí | WB, LIA |
| VHA | Sí | IgG anti-VHA | EIA | No | |
| VHB | Sí | HBsAga | EIA | Sí | Neutralización |
| VHC | Sí | Anti-VHCb,c | EIA 3.a gen. | Sí | RIBA, LIA, PCR-C |
| VHS | Opcional | IgG anti-VHS | EIA | No | |
| VVZ | Síd | IgG anti-VVZ | EIA, látex | No | |
| CMV | Sí | IgG anti-CMV | EIA, látex | Solo negativos | |
| VEB | Síd | IgG anti-VCA | EIA, IFI | Solo negativos | |
| T. gondii | Sí | IgG anti T. gondii | EIA | No | |
| T. pallidum | Sí | Ac no treponémicos | RPR, VDRL | Sí | EIA, TPHA, FTA-Abs |
EIA: enzimoinmunoensayo; FTA-Abs: prueba fluorescente antitreponémica (absorbida); HBsAg: antígeno de superficie del VHB; IFI: inmunofluorescencia indirecta; LIA: line immunoblot assay; PCR-C: reacción en cadena de la polimerasa, cualitativa; RIBA: recombinant immnoblot assay; RPR: prueba rápida reagínica en plasma; TPHA: hemaglutinación de T. pallidum; VCA: antígeno de la cápsida viral del VEB; VDRL: prueba reagínica del Veneral Disease Research Laboratory; WB: western blot.
aMarcadores del sistema e o DNA vírico si es HBsAg(+); bConsiderar RNA VHC en hemodializados; cConsiderar PCR cuantitativa (carga vírica) y genotipado para el tratamiento; dEspecialmente en niños.
En nuestro país, la prevención de la tuberculosis en el trasplantado merece una consideración especial, no sólo por sus graves consecuencias sino por su relativa frecuencia. Al margen de la detección de la enfermedad activa que constituye una contraindicación para el trasplante, el laboratorio debe hacer un esfuerzo diagnóstico especial en el despistaje de la infección latente en el candidato, dadas las dificultades que pueden plantearse para hacerlo en el postrasplante (anergia). Se debe evaluar si existen antecedentes de tuberculosis clínica o radiológica y el tratamiento recibido y, en su ausencia, realizar una prueba de tuberculina junto a una prueba de reactividad cutánea para antígenos de recuerdo. En caso de ser positiva, tras descartar una enfermedad activa, se valorará la realización de quimioprofilaxis.
Evaluación microbiológica del donanteLa investigación microbiológica en el donante persigue: a) descartar la presencia de agentes infecciosos transmisibles que comprometan la viabilidad del injerto o la evolución normal del trasplantado; b) predecir las posibles complicaciones que puedan surgir en el receptor, c) seleccionar el candidato más idóneo para el éxito del trasplante, y d) incrementar la disponibilidad de órganos con las máximas garantías de seguridad, pero sin descartar órganos innecesariamente. En todas estas labores es crucial la colaboración del microbiólogo, más aún en un entorno como el actual, en el que el perfil del donante está cambiando hacia personas con mayor potencialidad de complicaciones infecciosas. La búsqueda debe ser exhaustiva, incluyendo bacterias multirresistentes, pero siempre guiada por las circunstancias clínicas y epidemiológicas, dada la posibilidad de tratamiento en el potencial donante o de realizar profilaxis en el receptor. Los métodos a emplear no difieren de otras situaciones clínicas, con la excepción de una mayor intensidad en su aplicación.
Tras el trasplante, las infecciones latentes o crónicas del injerto pueden reactivarse en el receptor. La evaluación de la infección crónica en el donante de órganos se basa fundamentalmente en la utilización de protocolos serológicos, pero éste es un aspecto en continua evolución debido a los cambios y avances en el conocimiento científico y tecnológico, a los que se deberá estar siempre atento4,5. Las pruebas de cribado serológico deberán ser realizadas en laboratorios con un adecuado control de calidad y experiencia contrastada. Deberan utilizarse reactivos homologados, y ser actualizados a medida que aparezcan sucesivas generaciones con mejores características técnicas, buscando la máxima sensibilidad y valor predictivo negativo, pero sin despreciar la buena especificidad. Es muy importante que el laboratorio tenga presente las diversas circunstancias que pueden producir resultados falsos negativos, como la hemodilución o la existencia de un período ventana en el donante, adoptando las medidas correctoras oportunas (elaboración de una buena historia clínico-epidemiológica, educación sanitaria, realización de marcadores especiales o repetición de pruebas cuando sea factible, etc.), todo ello tratando de evitar el descarte innecesario de órganos. Así, hay que ser muy cauto con la utilización de pruebas de biología molecular, pues aportan tanto ventajas como problemas en este campo6. Los falsos positivos también son posibles, especialmente en el donante cadáver, por la presencia de productos de degradación tisular que lleven a reactividades inespecíficas. Por último, los centros implicados en el cribado de órganos deberían mantener un archivo de sueros y una trazabilidad perfecta durante un período mínimo de 10 años.
La tabla 5 muestra los principales marcadores a realizar en el cribado. De ellos, algunos se realizarán antes de hacer efectiva la donación, como es el caso del VIH-1, VHB, VHC y Treponema pallidum (T. pallidum), mientras que otros pueden ser diferidos. Especial atención se pondrá en las características del donante y en su procedencia geográfica, lo que obligará a realizar técnicas de cribado adicionales, como los anticuerpos frente al virus Epstein-Barr (VEB) en los donantes infantiles, o la investigación de las tripanosomiasis o el paludimo, entre otros, a veces recurriendo a técnicas microbiológicas distintas de la serología.
Marcadores serológicos en el donante
| Agente infeccioso | Marcadores recomendados |
| Previamente a la donación | |
| VIH 1 y 2 | Anticuerpos totalesa |
| Antigeno p24 | |
| VHB | HBsAgb |
| Anticuerpos totales anti-HBc | |
| Anticuerpos totales y antígeno VHDc | |
| VHC | Anticuerpos totalesd |
| HTLV-I/II | Antigeno, anticuerpos IgGe |
| T. pallidum | Reaginas |
| Pruebas treponémicas si las reaginas son positivas | |
| Diferidos 24-48 h | |
| CMV | IgG o anticuerpos totales |
| VEB | Ig G anti-VCAf |
| T. gondii | IgG (IgM si la determinación de IgG es positiva) |
aVIH1+2, subtipo O, 3.a/4.a generación; bSensibilidad analítica: 0,2 ng/ml; cSi HBsAg (+); dEnzimoensayos de 3.a generación; eFactores de riesgo u obligatoriedad en país de destino; fTan sólo si el receptor es seronegativo (especial atención en el trasplante infantil).
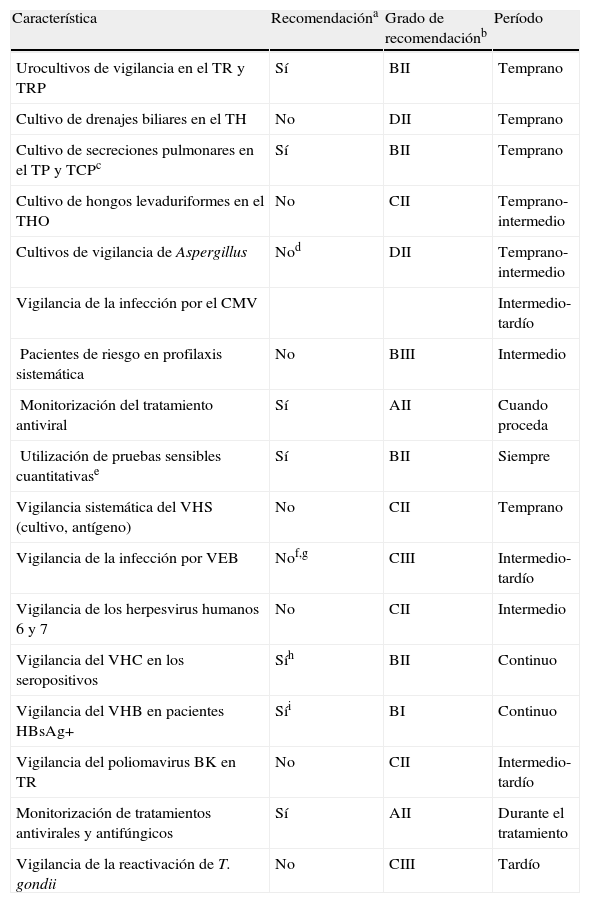
El número de los potenciales patógenos que pueden infectar al paciente trasplantado es amplísimo, lo que complica mucho la puesta en práctica de protocolos sistemáticos de monitorización. Por todo ello, en los últimos años se ha incidido más en la correcta evaluación de donante y receptor, simplificando en buena parte los protocolos, tratando de adaptarlos a las peculiaridades del paciente. Las tablas 6 y 7 resumen unos esquemas básicos de seguimiento propugnados por sociedades científicas y grupos de expertos7–9. Respecto a la metodología microbiológica concreta, las recomendaciones acerca de las muestras más apropiadas y las técnicas a emplear no difieren básicamente de las que puede aplicar el laboratorio para otras situaciones clínicas complejas, y remitimos al lector al procedimiento SEIMC del que este artículo es un resumen1. La cartera de servicios del laboratorio debe ser amplia y contará con técnicas sofisticadas, con especial énfasis en las pruebas rápidas, como las detecciones de antígeno o los métodos moleculares. La implantación de un sistema de calidad de certificación o acreditación es muy recomendable, incluso podría ser exigible para todos los hospitales con programa de trasplante.
Recomendaciones sobre la vigilancia microbiológica de los pacientes trasplantados de órgano sólido
| Característica | Recomendacióna | Grado de recomendaciónb | Período |
| Urocultivos de vigilancia en el TR y TRP | Sí | BII | Temprano |
| Cultivo de drenajes biliares en el TH | No | DII | Temprano |
| Cultivo de secreciones pulmonares en el TP y TCPc | Sí | BII | Temprano |
| Cultivo de hongos levaduriformes en el THO | No | CII | Temprano-intermedio |
| Cultivos de vigilancia de Aspergillus | Nod | DII | Temprano-intermedio |
| Vigilancia de la infección por el CMV | Intermedio-tardío | ||
| Pacientes de riesgo en profilaxis sistemática | No | BIII | Intermedio |
| Monitorización del tratamiento antiviral | Sí | AII | Cuando proceda |
| Utilización de pruebas sensibles cuantitativase | Sí | BII | Siempre |
| Vigilancia sistemática del VHS (cultivo, antígeno) | No | CII | Temprano |
| Vigilancia de la infección por VEB | Nof,g | CIII | Intermedio-tardío |
| Vigilancia de los herpesvirus humanos 6 y 7 | No | CII | Intermedio |
| Vigilancia del VHC en los seropositivos | Síh | BII | Continuo |
| Vigilancia del VHB en pacientes HBsAg+ | Síi | BI | Continuo |
| Vigilancia del poliomavirus BK en TR | No | CII | Intermedio-tardío |
| Monitorización de tratamientos antivirales y antifúngicos | Sí | AII | Durante el tratamiento |
| Vigilancia de la reactivación de T. gondii | No | CIII | Tardío |
Fuente: Tomada de Pérez JL et al7, con modificaciones.
CMV: citomegalovirus; TCP: trasplante de corazón-pulmón; TH: trasplante hepático; TP: trasplante pulmonar; TR: trasplante renal; TRP: trasplante renal y pancreático; VEB: virus Epstein Barr; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VHS: virus herpes simple.
aCuando no se indica una monitorización sistemática, las pruebas de laboratorio se realizarán solo si hay sospecha clínica; bGrado: A: fuerte evidencia de eficacia y beneficio clínico; B: moderada evidencia de eficacia; C: insuficiente evidencia de eficacia; D: moderada evidencia de la ineficacia; II: evidencia de más de un ensayo clínico bien diseñado y no aleatorizado; III: evidencia a partir de opiniones de expertos; cEn la primera semana postrasplante; dExcepto en los trasplantados de pulmón y pulmón-corazón; eAntigenemia o PCR en muestras de sangre o plasma; fExcepto en el paciente de alto riesgo D+/R- para el VEB; gCambios previsibles en el futuro con el desarrollo de técnicas moleculares; hRNA del VHC (cualitativo o prueba cuantitativa de alta sensibilidad analítica); iPerfil serológico: HBsAg, anti-HBs, HBeAg, anti-HBe, ADN del VHB.
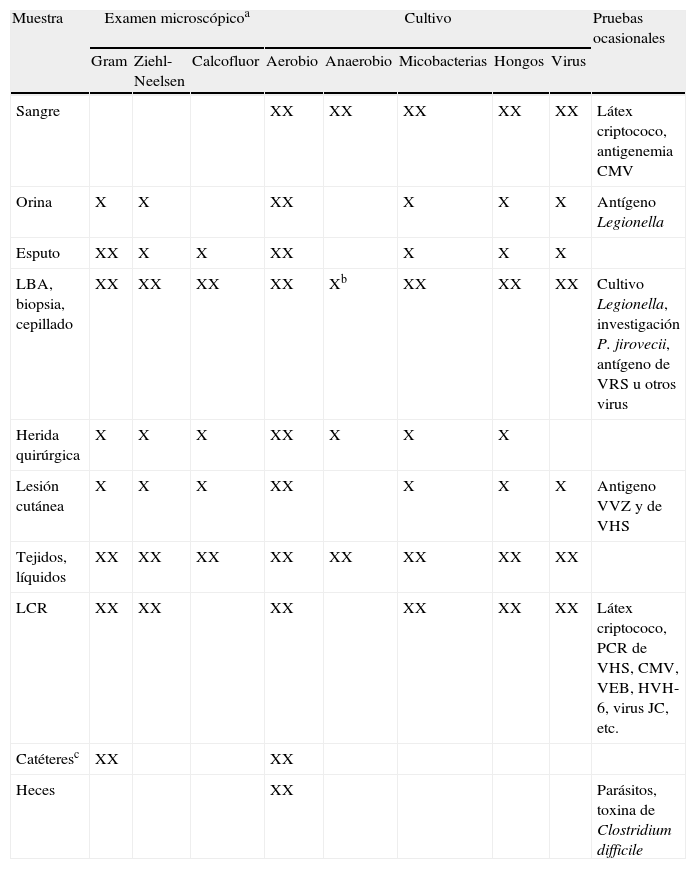
Evaluación microbiológica en el paciente trasplantado con sospecha de infección
| Muestra | Examen microscópicoa | Cultivo | Pruebas ocasionales | ||||||
| Gram | Ziehl-Neelsen | Calcofluor | Aerobio | Anaerobio | Micobacterias | Hongos | Virus | ||
| Sangre | XX | XX | XX | XX | XX | Látex criptococo, antigenemia CMV | |||
| Orina | X | X | XX | X | X | X | Antígeno Legionella | ||
| Esputo | XX | X | X | XX | X | X | X | ||
| LBA, biopsia, cepillado | XX | XX | XX | XX | Xb | XX | XX | XX | Cultivo Legionella, investigación P. jirovecii, antígeno de VRS u otros virus |
| Herida quirúrgica | X | X | X | XX | X | X | X | ||
| Lesión cutánea | X | X | X | XX | X | X | X | Antigeno VVZ y de VHS | |
| Tejidos, líquidos | XX | XX | XX | XX | XX | XX | XX | XX | |
| LCR | XX | XX | XX | XX | XX | XX | Látex criptococo, PCR de VHS, CMV, VEB, HVH-6, virus JC, etc. | ||
| Catéteresc | XX | XX | |||||||
| Heces | XX | Parásitos, toxina de Clostridium difficile | |||||||
Fuente: Modificada de LaRocco MT et al8.
CMV: citomegalovirus; HVH-6: herpesvirus humano 6; LBA: lavado broncoalveolar; LCR: líquido cefalorraquídeo; PCR-C: reacción en cadena de la polimerasa; VEB: virus Epstein-Barr; VHS: virus herpes simple; VRS: virus respiratorio sincitial; VVZ: virus varicela-zóster.
aLa marca XX indica que esta técnica suele realizarse de forma rutinaria; bSólo en muestras obtenidas con catéter telescopado; cCultivo semicuantitativo de la punta; Gram de la conexión y del punto de inserción del catéter.
El gran número de posibles microorganismos que pueden causar infecciones en el trasplantado es amplísimo, por lo que su abordaje diagnóstico está fuera de las posibilidades de este artículo. Remitimos de nuevo al lector al documento original, más detallado, centrándonos ahora en algunos microorganismos que, por su gravedad, frecuencia o impacto asistencial tienen, a nuestro juicio, una mayor relevancia. En los apartados anteriores se pueden encontrar también muchas de las claves para un enfoque racional del diagnóstico microbiológico.
Infecciones bacterianasLos pacientes transplantados reúnen todos los factores de riesgo para el desarrollo de las infecciones bacterianas hospitalarias. El primer mes postrasplante es el período de mayor incidencia de infecciones agudas por bacterias piógenas (tabla 1). En general, no se ha demostrado la utilidad de los cultivos de vigilancia sistemáticos, por lo que el diagnóstico se basará en el conocimiento de los factores de riesgo y en mantener una elevada sospecha clínica. Una excepción podrían ser las infecciones nosocomiales por microorganismos multirresistentes10, que requieren un abordaje integral y multidisciplinar y una metodología común a otros pacientes (tabla 8).
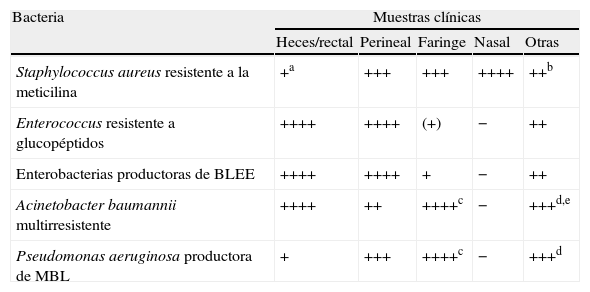
Vigilancia de la colonización por bacterias multirresistentes
| Bacteria | Muestras clínicas | ||||
| Heces/rectal | Perineal | Faringe | Nasal | Otras | |
| Staphylococcus aureus resistente a la meticilina | +a | +++ | +++ | ++++ | ++b |
| Enterococcus resistente a glucopéptidos | ++++ | ++++ | (+) | − | ++ |
| Enterobacterias productoras de BLEE | ++++ | ++++ | + | − | ++ |
| Acinetobacter baumannii multirresistente | ++++ | ++ | ++++c | − | +++d,e |
| Pseudomonas aeruginosa productora de MBL | + | +++ | ++++c | − | +++d |
BLEE: β-lactamasa de espectro extendido; MBL: metalo-β-lactamasa (resistencia a carbapenemas).
aNo parece de interés para su estudio sistemático, aunque algunos estudios sí recogen esta utilidad; bAspirado traqueal en pacientes con ventilación mecánica (++), úlceras crónicas (+++), orina en pacientes sondados (++); cMás habitual: esputo, exudado de traqueostomía, etc. en vez de muestras faríngeas; dEn especial muestras de exudado de herida (+++); eMuestra perineal (++++).
Dentro de las infecciones latentes, la tuberculosis tiene una particular importancia en nuestro país11. Se ha estimado una frecuencia de hasta el 3%, superior en el caso del trasplante pulmonar. Las complicaciones pueden ser graves, con mayor frecuencia de formas extrapulmonares y diseminadas. La tuberculosis plantea problemas desde el punto de vista del diagnóstico clínico y microbiológico, pero también de tratamiento, por las interacciones medicamentosas de los fármacos antituberculosos y las drogas inmunosupresoras. Por esas razones, la tuberculosis debe formar parte de la evaluación de los candidatos al trasplante, y es en este período donde deben hacerse los mayores esfuerzos diagnósticos y, si fuese necesario, de tratamiento de la infección latente. A pesar de ello, pueden presentarse casos en el período postrasplante y, por las dificultades diagnósticas mencionadas, el laboratorio debe dar un soporte tecnológico y de conocimiento de alto nivel, incluyendo pruebas rápidas y de sensibilidad. El mantenimiento de un alto índice de sospecha y la buena interconexión entre clínicos y microbiólogos son, una vez más, factores claves para diagnosticar con éxito esta grave complicación.
Infecciones fúngicasLa población trasplantada cumple todos los factores de riesgo de infección fúngica invasiva, siendo un factor clave para desarrollarla el grado y la duración de la neutropenia. Los avances en el diagnóstico, prevención y manejo de las micosis han tenido un impacto muy positivo, contrarrestado con el progresivo acceso al trasplante de pacientes con factores de riesgo aumentados. Como oportunistas típicos, son muchos los hongos que pueden afectar al trasplantado, entre ellos las candidiasis (con su cambio de espectro hacia especies con resistencia asociada), la criptococosis, la infección por P. jirovecii, las micosis endémicas asociadas a la globalización, o los hongos filamentosos poco habituales, pero de difícil tratamiento (zigomicetos, Scedosporium, Fusarium, etc.). El diagnóstico microbiológico de las micosis, tanto por la amplitud de posibles patógenos fúngicos como por la inespecificidad de las manifestaciones clínicas o su mal pronóstico, resulta muy complejo a la vez que crucial. Debe hacerse un esfuerzo adicional en desarrollar técnicas rápidas y fáciles de adaptar al trabajo diario del laboratorio, así como en el desarrollo e implantación de técnicas de sensibilidad a los antífúngicos. La integración del microbiólogo en los equipos multidisciplinares tiene un valor añadido a la hora de racionalizar el diagnóstico, seleccionando las muestras y técnicas apropiadas en función de la situación clínica del paciente. La SEIMC ha publicado normas y procedimientos específicos a los que remitimos al lector1,12.
De todas las micosis, la aspergilosis constituye el ejemplo más ilustrativo y la más frecuente en los trasplantados granulopénicos tras la candidiasis. La mayoría de infecciones están causadas por Aspergillus fumigatus. Le siguen en frecuencia A. flavus, A. terreus, A. niger y A. glaucus. La incidencia puede alcanzar el 8% en el TPH. Dentro del TOS, los trasplantados de pulmón son los que tienen mayor iresgo, siendo infrecuente en los renales. Es conocida la aparición de brotes nosocomiales de infección por Aspergillus asociados a las construcciones en el hospital o en zonas cercanas, lo que se controla mediante habitaciones especiales con filtros HEPA y flujo laminar. La manifestación clínica más frecuente en los pacientes trasplantados es la aspergilosis pulmonar invasiva.
El diagnóstico de la aspergilosis es difícil, ya que no existen signos clínicos característicos, las pruebas de imagen no son siempre concluyentes y los métodos de laboratorio tienen poca sensibilidad. Se basará en mantener una elevada sospecha clínica complementada con varias técnicas de laboratorio, desde las más simples, como la observación microscópica, a las más novedosas, como las pruebas moleculares. El examen microscópico es sencillo y rápido, pudiendo aportar un diagnóstico de probabilidad muy valioso en según qué circunstancias, pero su sensibilidad es insuficiente y no establece el diagnóstico definitivo. El cultivo también puede ayudarnos a consolidar una sospecha clínica. El valor predictivo positivo del cultivo en una muestra única es bajo, mejorando con la repetición del aislamiento de la misma especie de Aspergillus y la selección de muestras más representativas del proceso infeccioso (lavado broncoalveolar [LBA], biopsia, etc.).
La gravedad de la aspergilosis ha forzado la búsqueda de soluciones diagnósticas alternativas. La detección de antígeno galactomanano por enzimoinmunoensayo ha supuesto un gran avance en el diagnóstico y control del tratamiento, aunque no está exento de limitaciones. Su sensibilidad y especificidad son variables en los trasplantados, en función del tipo de muestra, frecuencia de muestreo y puntos de corte interpretativos. La mayor experiencia y utilidad se ha demostrado en los TPH granulopénicos, con valores predictivos positivo y negativo del 94,4 y del 98%, respectivamente, precediendo a la aparición de síntomas hasta en un 80% de los pacientes. El tratamiento efectivo se sigue de una disminución de los valores13. En relación con el punto de corte, actualmente la técnica puede interpretarse de forma dinámica (índices ≥ 0,5 ng/mL en muestras consecutivas), o estática (índice ≥ 0,7 ng/mL) en una muestra. Los resultados no han sido tan concluyentes en los TOS, incluso en los de mayor riesgo, como los pulmonares, si bien la técnica puede ser un complemento valioso, dadas las dificultades de diagnóstico a las que hemos aludido. La experiencia y valores de corte se refieren a muestra de suero. No están bien definidos con otras muestras, como el LBA, aunque hay estudios con buenos resultados14. Se conocen resultados falsos positivos asociados a diversos factores biológicos: colonización por Bifidobacterium, absorción de galactomanano alimentario en pacientes con EICH crónica, tratamiento con piperacilina-tazobactam o amoxicilina-clavulánico y reactividad cruzada con otros hongos como Penicillium, Alternaria o Paecilomyces. Se debe ser muy cuidadoso durante la realización de la técnica en el laboratorio ya que la contaminación ambiental por Aspergillus podría originar también resultados espurios.
En relación con las técnicas de PCR, la falta de estandarización del método y la variabilidad de los resultados en los distintos estudios publicados no aconseja su utilización como método diagnóstico habitual en los laboratorios clínicos y, por el momento, sigue estando reservada al ámbito de la investigación o a su utilización como método adicional.
Infecciones parasitariasTambién son numerosos los parásitos que pueden causar patología en los trasplantados. Algunos de ellos como Toxoplasma gondii (T. gondii), Leishmania o Cryptosporidium, son prevalentes en la población de nuestro país, por lo que deben ser considerados en todos los pacientes15. Otros son endémicos de otras áreas geográficas, pero el fenómeno de la globalización obliga a tenerlos muy presentes a la hora del diagnóstico. Es el caso de la malaria o la tripanosomiasis americana, pero también la infestación por nemátodos como Strongyloides stercoralis, en este caso compartiendo endemia con ciertas áreas de nuestro país. De nuevo, mucho del esfuerzo diagnóstico se debe hacer durante la evaluación de candidatos y donantes. Es el caso del diagnóstico de la toxoplasmosis, esencialmente serológico, que a su dificultad intrínseca añade la errática respuesta de anticuerpos una vez efectuado el trasplante. Más que la utilización de técnicas sofisticadas poco habituales en los laboratorios, una característica común de muchas de las parasitosis será la necesidad de realizar exámenes repetidos para lograr el diagnóstico. No se deben regatear esfuerzos, debido al impacto clínico que pueden tener algunas de ellas (leishmaniasis, estrongiloidiosis, etc.).
La enfermedad de Chagas (Trypanosoma cruzi) es un ejemplo paradigmático del panorama cambiante en la medicina del trasplante en nuestro país, debido a las especiales circunstancias sociológicas de la inmigración desde zonas endémicas. Las personas que proceden o han vivido en estas zonas pueden ser candidatos a un trasplante, con el riesgo añadido de una reactivación del parásito, pero tambien se han convertido en donantes potenciales, con la posibilidad de transmitir la infección a través de los órganos donados16. En ambas situaciones, las consecuencias clínicas son graves. Sin embargo, el diagnóstico de laboratorio es, en conjunto, insatisfactorio. En la evaluación pretrasplante se recomienda el estudio serológico, para lo que se dispone de reactivos comerciales, incluso para diagnóstico rápido, pero la recomendación actual es utilizar dos pruebas que utilicen antígenos diferentes, lo que obligará en muchos casos a disponer de un centro externo de apoyo. Los métodos de PCR pueden ser de ayuda, si bien la presencia del parásito en la sangre en la infección crónica es intermitente y de baja intensidad: son posibles los resultados falsos negativos. La estrategia diagnóstica no cambia tras el trasplante, con la consideración de que la prueba de PCR podría reflejar una infección latente sin reactivación y que la proporción de falsos negativos con las pruebas serológicas es mayor por el estado de inmunodepresión. Es obligado valorar rigurosamente los resultados de laboratorio junto con las circunstancias clínicas de cada paciente.
Infecciones víricasEn su conjunto, las infecciones víricas son las que más consecuencias tienen de cara al trasplante, tanto porque el candidato pueda albergarlas de forma latente como por la posibilidad de ser transmitidas por el órgano donado o por el propio procedimiento. Tras el trasplante, estos pacientes tienen un mayor riesgo de sufrir infecciones víricas debido a su estado de inmunodepresión. De nuevo, buena parte del esfuerzo diagnóstico de laboratorio deberá hacerse durante la evaluación de donante y receptor, ya que muchas de las infecciones víricas pueden prevenirse, o al menos aminorar sus efectos. Entre los diversos virus que pueden afectar al trasplantado citaremos los de las hepatitis A, B y C, los retrovirus, en especial el VIH-1, papilomavirus, poliomavirus JC y BK, así como también otros virus habituales en la población general, como los virus respiratorios comunes. No obstante, son los herpesvirus, y en concreto el CMV, los que tienen mayor incidencia en el trasplante17. En lo sucesivo, nos referiremos a este virus, remitiendo al documento SEIMC1 correspondiente para una información detallada de otros virus.
La mayor parte de la patología asociada a los herpesvirus deriva de la reactivación de una infección latente, pero cuando se produce una infección primaria, ésta se suele acompañar de un cuadro clínico más grave, que en ocasiones compromete seriamente la vida del paciente o la viabilidad del órgano trasplantado. La aportación del laboratorio de microbiología es crucial para el buen cuidado de estos pacientes (tabla 9), no sólo desde el punto de vista diagnóstico sino también para establecer el pronóstico y guiar el tratamiento antivírico18. El CMV es un virus muy ubicuo en la población general y la causa más importante de infección vírica en los trasplantados. En el TOS, las mayores complicaciones se producen en el receptor seronegativo que recibe un órgano de un donante seropositivo, mientras que en el TPH la seropositividad del receptor se considera un factor de riesgo. Una característica importante del CMV es que no todas las infecciones activas (replicación del virus en las células permisivas) se traducen en manifestaciones clínicas, esto es, en la llamada enfermedad por CMV. Este hecho condiciona también la selección e interpretación de las pruebas de laboratorio, ya que la enfermedad se produce cuando el equilibrio entre virus y hospedador se rompe en beneficio del primero, que se multiplica de forma descontrolada.
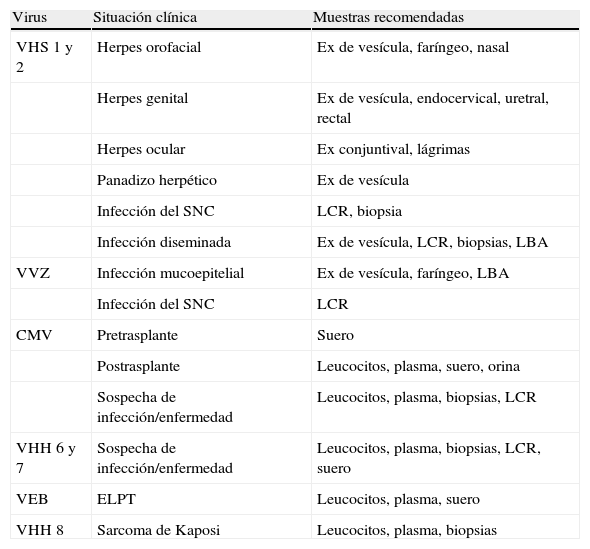
Muestras adecuadas para el diagnóstico de las infecciones por herpesvirus
| Virus | Situación clínica | Muestras recomendadas |
| VHS 1 y 2 | Herpes orofacial | Ex de vesícula, faríngeo, nasal |
| Herpes genital | Ex de vesícula, endocervical, uretral, rectal | |
| Herpes ocular | Ex conjuntival, lágrimas | |
| Panadizo herpético | Ex de vesícula | |
| Infección del SNC | LCR, biopsia | |
| Infección diseminada | Ex de vesícula, LCR, biopsias, LBA | |
| VVZ | Infección mucoepitelial | Ex de vesícula, faríngeo, LBA |
| Infección del SNC | LCR | |
| CMV | Pretrasplante | Suero |
| Postrasplante | Leucocitos, plasma, suero, orina | |
| Sospecha de infección/enfermedad | Leucocitos, plasma, biopsias, LCR | |
| VHH 6 y 7 | Sospecha de infección/enfermedad | Leucocitos, plasma, biopsias, LCR, suero |
| VEB | ELPT | Leucocitos, plasma, suero |
| VHH 8 | Sarcoma de Kaposi | Leucocitos, plasma, biopsias |
CMV: citomegalovirus; ELPT: enfermedad linfoproliferativa postrasplante; Ex: exudado; LBA: lavado broncoalveolar; LCR: líquido cefalorraquídeo; SNC: sistema nervioso central; VEB: virus de Epstein-Barr; VHH: herpesvirus humanos (6, 7 y 8); VHS: virus herpes simple; VVZ: virus varicela-zóster.
Cronológicamente, las infecciones son típicas del segundo o tercer mes postrasplante, pero se pueden presentar de forma más temprana y también más tardía, más allá del sexto mes, especialmente si se realiza profilaxis sistemática con valganciclovir, de larga duración. La forma de presentación clínica más habitual es el cuadro mononucleósico llamado síndrome viral: fiebre con leucopenia, trombocitopenia y alteración de pruebas hepáticas en presencia del virus en sangre. En los casos más graves, produce afectación orgánica, siendo la gastrointestinal la más frecuente. También puede observarse neumonitis, y más raramente, encefalitis y esofagitis. Los efectos indirectos causados por el CMV, debidos a su carácter inmunomodulador son actualmente motivo de interés y controversia. El impacto clinico del CMV y los avances técnicos recientes hacen que el diagnóstico de laboratorio tenga una importancia capital.
En el caso de las infecciones por CMV existen protocolos de seguimiento de la infección/enfermedad por CMV que los llevan a cabo muchos grupos de TOS y TPH de forma que monitorizan a los pacientes durante los primeros meses del trasplante. La tendencia actual es a simplificar en la medida de lo posible dichos protocolos y reservar las pautas más estrictas para las situaciones de mayor riesgo (TOS D+/R- sin profilaxis, trasplante de pulmón o intestino, etc.). El objetivo fundamental que deben perseguir las pruebas diagnósticas es diferenciar la enfermedad por CMV, la que cursa con sintomatología atribuible al virus, de la infección activa asintomática. Las pruebas cuantitativas en sangre son fundamentales, y se utilizan con tres propósitos: a) predecir la aparición de la enfermedad por CMV antes de que ésta se presente, b) diagnosticarla cuando aparecen síntomas compatibles, y c) comprobar la eficacia del tratamiento antiviral.
Las pruebas cuantitativas en sangre pueden realizarse mediante las técnicas de antigenemia pp65 y de carga viral (ADNemia o viremia). La primera detecta el antígeno pp65 de CMV que expresan los leucocitos de sangre periférica infectados por el virus mientras que la segunda cuantifica el genoma del virus. Ambas se correlacionan directamente con la presencia de síntomas, ambas son perfectamente utilizables para el seguimiento de los trasplantados, incluyendo las estrategias de tratamiento anticipado (preemptive therapy) y ambas tienen también ventajas e inconvenientes. Sin embargo, las mayores posibilidades de estandarización, especialmente ahora que comienza a introducirse un patrón internacional, así como la mayor estabilidad del material diana (ADN frente a la proteína pp65), hace que muchos laboratorios se decanten progresivamente hacia las pruebas moleculares cuantitativas.
La interpretación de los valores de carga vírica de CMV, se midan como se midan, continua siendo compleja. Ni siquiera las pruebas comerciales moleculares, con menor variabilidad técnica, permiten establecer valores de corte con validez universal, ya que otros factores relacionados con el paciente, como el tipo de trasplante o la pauta de inmunosupresión, así como la variabilidad interlaboratorio influyen decisivamente en la cuantificación. Los valores que se muestran en la literatura pueden tener valor aproximativo, pero siempre deberán ser precisados con la experiencia acumulada en cada laboratorio. Además, hay que señalar que la correlación es buena en presencia de síndrome viral, mientras que en la afección intestinal, la forma focal más frecuente de enfermedad por CMV, la antigenemia o la ADNmia pueden ser bajas o, incluso, negativas. Por eso, cuando exista sospecha de enfermedad focal por el CMV, se recomienda obtener una muestra representativa del órgano afectado para examen histológico. En este sentido, hay que señalar, que salvo para la encefalitis en muestra de LCR, las pruebas de amplificación por PCR no establecen el diagnóstico, dada su gran sensibilidad analítica que permite detectar genoma vírico en ausencia de efecto citopático marcado.
La determinación de la carga vírica del CMV también tiene interés para el control del tratamiento. Desde hace años se dispone de antivirales con actividad específica frente al CMV (ganciclovir y su prodroga valganciclovir, foscarnet, cidofovir) y su administración se sigue de la negativización de los valores de antigenemia o ADNmia. Cuando esto no ocurre, se plantea la sospecha de aparición de resistencia. En los trasplantados, este fenómeno es raro pero bien conocido, aunque el empleo de pautas de profilaxis de larga duración plantea interrogantes de cara al futuro. Si bien hasta el 85% de los fallos terapéuticos obedecen a factores distintos de la resistencia vírica (la llamada «resistencia clínica»), los expertos recomiendan disponer de pruebas de sensibilidad a los antivirales, preferiblemente en centros de referencia experimentados. Para llevarlas a cabo, se pueden aplicar métodos fenotípicos o genotípicos. Los primeros reflejan mejor lo que ocurre in vivo, pero resultan lentos y sólo aplicables en el contexto de técnica de investigación. Los métodos genotípicos ponen de manifiesto mutaciones puntuales en el gen UL97 del CMV que conducen a la resistencia al ganciclovir, las más frecuentes y de mayor relevancia clínica. También se produce resistencia por mutaciones en la polimerasa codificada en el gen UL54 y, en este caso, es posible la resistencia cruzada entre antivirales. Los métodos genotípicos se llevan a cabo hoy en día mediante amplificación directa y posterior secuenciación. La interpretación requiere experiencia para distinguir mutaciones con un efecto bien establecido sobre la resistencia de simples polimorfismos sin traducción biológica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido posible, en parte, gracias al soporte de la Red de Investigación en Patología Infecciosa (REIPI), Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación, España (RD 06/008).