Mujer de 46 años, consumidora de drogas por vía intravenosa hasta 4 años antes, que había sido diagnosticada de infección por el VIH en 1991, tuberculosis pulmonar en 1996 y varias neumonías bacterianas durante la última década, y cuya cifra nadir de linfocitos CD4+ fue 73 células/μl. Estaba coinfectada por los virus de las hepatitis B y C y tenía una cirrosis hepática en grado A de la clasificación de Child-Pugh. Nunca había realizado tratamiento antirretroviral (TAR), hasta que en junio de 2007 comenzó a tomar efavirenz (EFV) a dosis de 600mg/día y una combinación de tenofovir (TDF) y emtricitabina (FTC) a dosis fijas (300/200mg/día), por vía oral. Cuando 19 meses después la vimos en nuestro centro estaba asintomática y presentaba: carga viral (CV)<50 copias/ml de ARN-VIH, recuento de linfocitos CD4+: 177 células/μl, fosfatemia: 1,67mg/dl (N=2,7-4,5); proteinuria: 747mg/l (N=<300) y filtrado glomerular (FG) estimado por MDRD: 93ml/min/1,73 m2. En esta fecha se simplificó el régimen de TAR a un comprimido diario de una coformulación a dosis fijas de EFV, TDF y FTC (600/300/200mg). Tres meses después tenía dolores osteomusculares generalizados y muy intensos, que requerían la administración de analgésicos habituales junto a un parche transdérmico de fentanilo (75μg/hora de morfina) cada 72h, y presentaba una gran debilidad muscular e impotencia funcional que le impedía sentarse, levantarse o caminar sin ayuda y que le obligaba a permanecer encamada. La CV fue < 50 copias/ml y el recuento de linfocitos CD4: 128 células/μl. En la bioquímica plasmática destacaba: creatinina 0,74mg/dl (FG: 109 m,/min/1,73 m2); fosfato 1,46mg/d, (N=2,7-4,5); fosfatasa alcalina: 673 U/l (N=40-129) y urato 1,1mg/dl (N=3,4-7). El análisis de orina mostró: proteinuria: 1.862mg/l; cociente proteínas/creatinina: 982mg/g (N=< 200); glucosuria: 76mg/l; calciuria: 264mg/24h (N=0-260); fosfaturia: 1.332mg/24h (N=600-1.200); reabsorción de fosfato: 51,6% (N=75-90) y aminoaciduria generalizada con excreción muy aumentada de alanina, asparragina, fenilalanina, glicina, glutamina, histidina, hidroxiprolina, lisina, serina, tirosina, treonina y triptófano. Los parámetros hematológicos, la glucemia basal y los niveles plasmáticos de sodio, potasio, calcio, aspartato aminotransferasa, alanino aminotransferasa, lactatodeshidrogenasa, complemento y proteína C reactiva, así como el estudio del sedimento urinario, fueron normales. Un estudio del equilibrio ácido-base efectuado 10 días después de suspender la administración de TDF mostró: pH: 7,35; bicarbonato: 25,2 mmol/l; exceso de base: –1 mmol/l. La concentración plasmática de parathormona (PTH) fue 85 pg/ml (N=11-67). No se determinó la vitamina D.
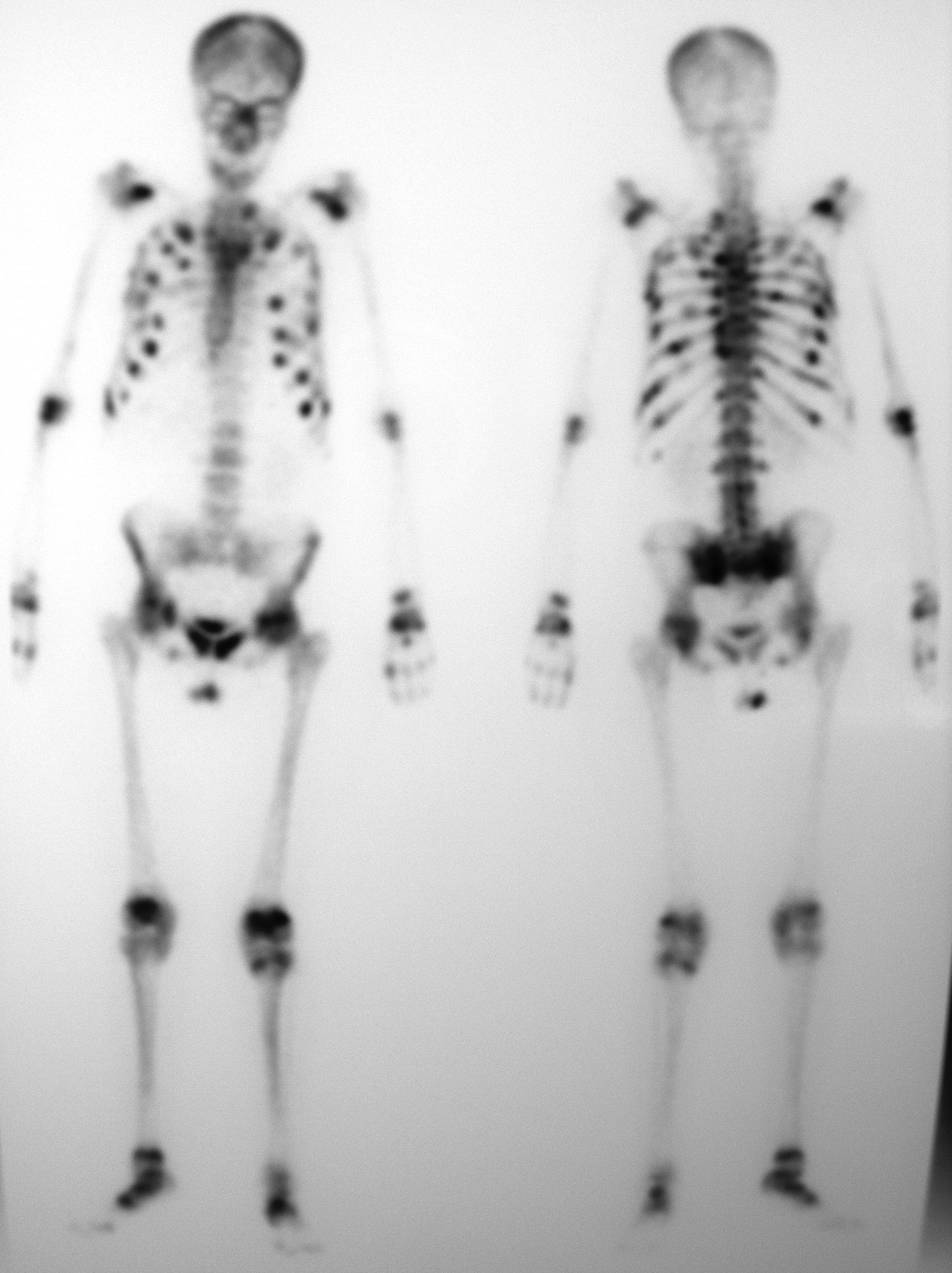
Ante este cuadro clínico, se suspendió la administración del TAR y se efectuó una gammagrafía ósea con 99mTC-HDP, en la que se observaron múltiples depósitos patológicos del trazador en la parrilla costal, articulaciones costo-vertebrales, hombros, codos, carpos, sacroilíacas, cadera, rodillas y tarsos, así como una escasa captación renal del mismo (fig. 1).
DiagnósticoSíndrome de Fanconi (SF) y osteomalacia hipofosfatémica (OH) secundarios a nefrotoxicidad por tenofovir.
EvoluciónSe reinició el TAR con un nuevo régimen de EFV (600mg/día) y una coformulación a dosis fijas de lamivudina y abacavir (300/600mg/día), por vía oral, y en una revisión efectuada 6 semanas después de haber suspendido la administración de TDF la paciente había experimentado una notable mejoría del dolor (no necesitaba parches de fentanilo) y de la impotencia funcional (podía deambular con una muleta) y ya no tenía proteinuria. Tres meses más tarde estaba totalmente asintomática, sin necesidad de tomar analgésicos, y se habían normalizado todos los parámetros bioquímicos en plasma y orina.
ComentariosLa presentación de la nefrotoxicidad por TDF como un SF es rara y más aún como una OH. En relación a este trastorno metabólico óseo, cuyo origen es una disfunción tubular proximal por acumulación intracelular de TDF, a consecuencia de la cual se produce una pérdida exagerada de fosfato, sólo se han publicado poco más de una docena de casos1–8 y su prevalencia en una gran cohorte de pacientes tratados con TDF fue del 0,50%7. La OH, cuya sintomatología aparece generalmente entre 8 y 30 meses después de iniciar la terapia con TDF1–8, debe sospecharse en todo paciente tratado con este análogo de adenosina que presente dolores osteomusculares, con o sin fracturas patológicas, debilidad muscular, niveles elevados de fosfatasa alcalina y un SF parcial o completo (glucosuria normoglucémica, aminoaciduria generalizada, hipercalciuria, hipouricemia, hipofosfatemia, hipocaliemia, acidosis metabólica, etc.). La gammagrafía ósea, que revela una hipercaptación de 99Tc en múltiples huesos y articulaciones, confirma el diagnóstico. La PTH suele estar elevada para compensar la pérdida de fosfato mediante una mayor reabsorción ósea3. En la mayoría de los casos publicados los regímenes de TAR incluían un inhibidor de la proteasa potenciado con ritonavir1–8 (lo que puede explicarse porque estos fármacos incrementan la concentración plasmática de TDF y favorecen su nefrotoxicidad9), mientras que en nuestro paciente el TDF se administraba junto con el EFV. El tratamiento de la OH consiste en suspender el TDF y administrar fosfato y analgésicos. Entre éstos, conviene evitar los antiinflamatorios no esteroideos, pues pueden potenciar el efecto tóxico de el TDF6,10. La evolución suele ser muy buena, con desaparición del cuadro clínico en un periodo de pocas semanas o meses1–8.