La infección por virus respiratorios adquirida en la comunidad es la causa más frecuente de infección febril en niños, y una causa importante a tener en cuenta en niños con cáncer. A pesar de ello, no existen apenas estudios bien diseñados y controlados en esta población, lo que dificulta conocer la importancia y comportamiento de estos virus en niños inmunocomprometidos así como su manejo. Las nuevas técnicas de diagnóstico en microbiología basadas en PCR abren múltiples oportunidades para realizar un diagnóstico precoz, evitando la diseminación del virus y permitiendo la aplicación de medidas terapéuticas correctas. Por todo ello, parece importante diseñar estudios prospectivos, comparativos para evaluar este tipo de infecciones en niños con cáncer. En esta revisión se recopilan los principales estudios publicados en la literatura, evaluando la epidemiología, diagnóstico y manejo de niños con cáncer e infección por virus respiratorios.
Community-adquired respiratory viral infection is the most common cause of febrile infection in children, and an important cause of infection to consider in children with cancer. Nevertheless, there are few well-designed, controlled studies in this population, which makes it difficult to understand the importance, behaviour and management of these viruses in immunocompromised children. New diagnostic techniques in PCR-based microbiology, could provide many opportunities for early diagnosis, preventing the spread of the virus and to implement the correct therapy. It is important to design appropriate prospective studies to assess these types of infections in children with cancer. In this review we analyse the main studies published in the literature, evaluating the epidemiology, diagnosis and management of children with cancer and respiratory viral infection.
El cáncer es la segunda causa de mortalidad en la población infantil, siendo la incidencia en España de 2 casos/1.000 nacidos vivos, lo que supone 800 nuevos casos al año. El pronóstico del cáncer infantil ha mejorado en las últimas décadas como consecuencia de la optimización de las estrategias terapéuticas, sin embargo, las infecciones continúan siendo una causa importante de morbimortalidad en esta población1,2. Aproximadamente un tercio de los niños con tumores sólidos o hematológicos y neutropenia asociada a quimioterapia presentan un episodio febril3, aumentando al 75-90% (según acondicionamiento) en los 30 días siguientes al trasplante de progenitores hematopoyéticos (TPH)1,2. En relación con las infecciones asociadas a fiebre y neutropenia, los avances en los últimos años se han centrado, sobre todo, en las infecciones bacterianas y fúngicas, con especial énfasis en la identificación de factores de riesgo en estos niños y protocolos de tratamiento empírico con antimicrobianos de amplio espectro4, existiendo menos avances en el conocimiento de la infección viral.
La infección por virus respiratorios adquirida en la comunidad es la causa más frecuente de infección febril en niños y una causa importante a tener en cuenta en niños con cáncer y sospecha de infección5. Además, la diseminación de estos virus se realiza por vía aérea y por contacto, lo que hace que la transmisión a niños con cáncer se produzca con mucha facilidad6,7. Resulta llamativo, sin embargo, los pocos estudios prospectivos, apropiadamente realizados, encontrados en la literatura que hayan analizado adecuadamente la infección viral respiratoria en niños con cáncer, lo que podría deberse a una infravaloración de su papel en estos pacientes, a una terapia viral poco efectiva hasta la fecha, y a las limitaciones diagnósticas para la detección de virus, situación que está cambiando en los últimos años. Así, recientemente estamos viendo un mayor reconocimiento de estas infecciones como causa de importante morbimortalidad y fracaso de injerto en pacientes inmunodeprimidos (ID)8–11.
Asimismo, se desconoce la importancia de las infecciones virales tras el uso de nuevas terapias, concretamente tratamientos biológicos en el cáncer, con aumento del riesgo de infección por la inmunosupresión asociada. Entre los más usados en pediatría, rituximab, que ha demostrado utilidad en linfomas B, produce hipogammaglobulinemia mantenida, siendo los estudios controvertidos respecto al aumento de infecciones oportunistas, y concretamente, no hay estudios que demuestren aumento de infección por virus respiratorios en niños12,13.
EpidemiologíaEstudios realizados en la década de los noventa del siglo xx describen algún tipo de infección viral respiratoria en un tercio de los episodios febriles que sufren los niños con cáncer, siendo el rinovirus, virus respiratorio sincitial (VRS), parainfluenza (VPI) y adenovirus, los más frecuentemente implicados14,15. Estos estudios utilizan como métodos diagnósticos el cultivo viral y la detección de antígenos virales. En un estudio epidemiológico retrospectivo español reciente en niños con cáncer, el VRS fue el virus respiratorio aislado con más frecuencia (42%), seguido de influenza (29%), adenovirus (17%) y VPI (12%)16. No obstante, este estudio tiene la limitación de presentar sólo 24 aislamientos en un periodo de 14 años, lo cual lo hace, probablemente, menos representativo. En este estudio, el número de niños con infección respiratoria de vías bajas (IRVB) fue de cuatro casos (21%), tres de ellos por VRS y uno por influenza. Dos niños fallecieron, ambos con infección por VRS.
Tras el desarrollo de nuevas técnicas diagnósticas se ha visto un aumento de resultados positivos para virus respiratorios y que otros virus podrían también tener un impacto importante en la población ID, como es el caso del rinovirus, cuyo papel anteriormente no se conocía bien. Así, un estudio prospectivo realizado en Finlandia en niños con leucemia hospitalizados por fiebre detectó una infección respiratoria viral en 61 de los 138 (44%) procesos febriles estudiados10. En este estudio se utilizaron como métodos diagnósticos el cultivo viral y la detección antigénica por medio de inmunofluorescencia (IF) para algunos virus, y métodos de reacción en cadena de la polimerasa (PCR) para otros. Las muestras analizadas se obtuvieron mediante exudado nasal10. Los virus más frecuentemente detectados fueron rinovirus (51% de aislamientos), VRS (25%), bocavirus humano (BVh), VPI e influenza (11% cada uno). Otros virus aislados con menos frecuencia fueron adenovirus (5%) y coronavirus (2%). No hubo ningún aislamiento de metapneumovirus (MTPh). La mayoría de los casos (78%) fueron adquiridos en la comunidad. Sólo hubo dos casos (3,9%) que progresaron a neumonía (VRS y rinovirus), con dos fallecimientos (ambos con rinovirus aislado: uno con una sepsis bacteriana y otro con aspergilosis invasiva). Christensen et al17 analizaron de forma prospectiva 250 episodios febriles en niños con leucemia, con un aislamiento protector estricto, detectando virus únicamente en un 6% de los casos (13% con infección dual viral-bacteriana) mediante técnicas de PCR en secreciones nasofaríngeas, siendo el rinovirus, nuevamente, el más frecuentemente aislado (todo el año), seguido del VRS (primavera-invierno). La mayoría de estas infecciones no progresaron a neumonía y la mortalidad fue baja (un caso de neumonía por VRS). La linfopenia fue un factor de riesgo de hospitalización.
Un estudio prospectivo reciente para investigar infección por virus respiratorios como posible agente causal en 90 episodios de neutropenia febril en niños, compara métodos diagnósticos convencionales detectando un agente infeccioso en el 29% de los episodios, aumentando los resultados positivos hasta un 60% de los casos con la utilización de PCR, quedando por aclarar el significado de estos hallazgos18.
Algo importante a tener en cuenta a la hora de evaluar este tipo de infecciones es que la mayoría de los estudios realizados se han basado en diagnósticos de pacientes hospitalizados, lo que podría infraestimar la frecuencia y sobreestimar la gravedad11. Estudios prospectivos recientes en adultos hablan de que cada paciente ID puede presentar dos infecciones virales respiratorias al año19, que podrían correlacionarse con la prevalencia de los virus circulantes en la comunidad20.
La infección por virus respiratorios en niños que han recibido un TPH, autólogo o alogénico, está igualmente poco estudiada, y se necesitan estudios prospectivos para conocer la epidemiología, relevancia y manejo de estos virus, así como para analizar la fiabilidad de las nuevas técnicas diagnósticas.
Estudios retrospectivos en niños trasplantados previos al uso de PCR describen una incidencia de infección por virus respiratorios del 11%, con una mortalidad alrededor del 10-14% (VPI, adenovirus, influenza y VRS son los virus más frecuentes)21,22. En los niños que recibieron un TPH alogénico el riesgo de infección viral fue 5 veces mayor. Este riesgo también se vio aumentado en el caso de enfermedad de injerto contra huésped (EICH) grado 3-4. La progresión a neumonía aumentó cuando la infección ocurrió en los 30 primeros días post-trasplante21–23.
Estudios prospectivos más recientes utilizando cultivo viral y PCR como métodos diagnósticos describen una frecuencia del 21% de infección por virus respiratorios en niños trasplantados, incluyendo virus como el MTPh y el rinovirus entre los agentes causales24,25. En estos estudios se demuestra que las técnicas de PCR detectan la infección de forma más precoz y en mayor porcentaje. Así, el VRS es el virus más frecuente implicado en infección respiratoria alta (IRVA) e IRVB en los 30 días siguientes al TPH, siendo otros virus respiratorios encontrados en este periodo influenza, VPI, adenovirus y rinovirus, este último con un papel controvertido en cuanto a causa de morbi-mortalidad o coinfección10. El MTPh se describe como agente causal más tardío. El coronavirus y el BVh se han descrito también en TPH en niños y adultos desde el uso de la PCR10,26.
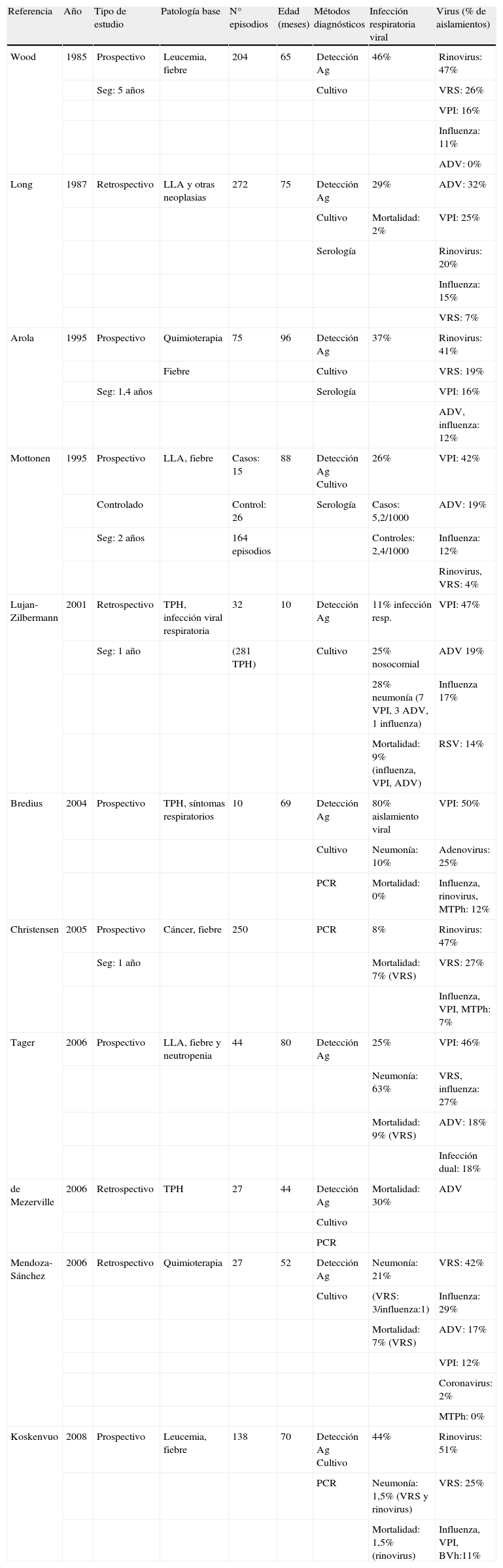
Por otro lado no hay que olvidar que, a pesar de presentar un aislamiento de virus respiratorios, estos niños pueden presentar una infección bacteriana grave. En la tabla 1 se resumen los estudios epidemiológicos más relevantes en niños con cáncer e infección viral respiratoria.
Estudios epidemiológicos de infecciones virales respiratorias en niños con cáncer
| Referencia | Año | Tipo de estudio | Patología base | N° episodios | Edad (meses) | Métodos diagnósticos | Infección respiratoria viral | Virus (% de aislamientos) |
| Wood | 1985 | Prospectivo | Leucemia, fiebre | 204 | 65 | Detección Ag | 46% | Rinovirus: 47% |
| Seg: 5 años | Cultivo | VRS: 26% | ||||||
| VPI: 16% | ||||||||
| Influenza: 11% | ||||||||
| ADV: 0% | ||||||||
| Long | 1987 | Retrospectivo | LLA y otras neoplasias | 272 | 75 | Detección Ag | 29% | ADV: 32% |
| Cultivo | Mortalidad: 2% | VPI: 25% | ||||||
| Serología | Rinovirus: 20% | |||||||
| Influenza: 15% | ||||||||
| VRS: 7% | ||||||||
| Arola | 1995 | Prospectivo | Quimioterapia | 75 | 96 | Detección Ag | 37% | Rinovirus: 41% |
| Fiebre | Cultivo | VRS: 19% | ||||||
| Seg: 1,4 años | Serología | VPI: 16% | ||||||
| ADV, influenza: 12% | ||||||||
| Mottonen | 1995 | Prospectivo | LLA, fiebre | Casos: 15 | 88 | Detección Ag Cultivo | 26% | VPI: 42% |
| Controlado | Control: 26 | Serología | Casos: 5,2/1000 | ADV: 19% | ||||
| Seg: 2 años | 164 episodios | Controles: 2,4/1000 | Influenza: 12% | |||||
| Rinovirus, VRS: 4% | ||||||||
| Lujan-Zilbermann | 2001 | Retrospectivo | TPH, infección viral respiratoria | 32 | 10 | Detección Ag | 11% infección resp. | VPI: 47% |
| Seg: 1 año | (281 TPH) | Cultivo | 25% nosocomial | ADV 19% | ||||
| 28% neumonía (7 VPI, 3 ADV, 1 influenza) | Influenza 17% | |||||||
| Mortalidad: 9% (influenza, VPI, ADV) | RSV: 14% | |||||||
| Bredius | 2004 | Prospectivo | TPH, síntomas respiratorios | 10 | 69 | Detección Ag | 80% aislamiento viral | VPI: 50% |
| Cultivo | Neumonía: 10% | Adenovirus: 25% | ||||||
| PCR | Mortalidad: 0% | Influenza, rinovirus, MTPh: 12% | ||||||
| Christensen | 2005 | Prospectivo | Cáncer, fiebre | 250 | PCR | 8% | Rinovirus: 47% | |
| Seg: 1 año | Mortalidad: 7% (VRS) | VRS: 27% | ||||||
| Influenza, VPI, MTPh: 7% | ||||||||
| Tager | 2006 | Prospectivo | LLA, fiebre y neutropenia | 44 | 80 | Detección Ag | 25% | VPI: 46% |
| Neumonía: 63% | VRS, influenza: 27% | |||||||
| Mortalidad: 9% (VRS) | ADV: 18% | |||||||
| Infección dual: 18% | ||||||||
| de Mezerville | 2006 | Retrospectivo | TPH | 27 | 44 | Detección Ag | Mortalidad: 30% | ADV |
| Cultivo | ||||||||
| PCR | ||||||||
| Mendoza-Sánchez | 2006 | Retrospectivo | Quimioterapia | 27 | 52 | Detección Ag | Neumonía: 21% | VRS: 42% |
| Cultivo | (VRS: 3/influenza:1) | Influenza: 29% | ||||||
| Mortalidad: 7% (VRS) | ADV: 17% | |||||||
| VPI: 12% | ||||||||
| Coronavirus: 2% | ||||||||
| MTPh: 0% | ||||||||
| Koskenvuo | 2008 | Prospectivo | Leucemia, fiebre | 138 | 70 | Detección Ag Cultivo | 44% | Rinovirus: 51% |
| PCR | Neumonía: 1,5% (VRS y rinovirus) | VRS: 25% | ||||||
| Mortalidad: 1,5% (rinovirus) | Influenza, VPI, BVh:11% |
ADV:adenovirus; Ag:antígeno; BVh:bocaviru humano; LLA:leucemia aguda linfoblástica; MTPh: metapneumovirus humano; PCR: reacción en cadena de la polimerasa; Seg:seguimiento; TPH:trasplante precursores hematopoyéticos; VRS: virus respiratorio sincitial; VPI: virus parainfluenza.
Conocer el periodo de incubación de las infecciones por virus respiratorios es esencial para la investigación, el control de la infección nosocomial y el uso de antivirales de forma precoz. Estos periodos no se conocen bien en la población pediátrica sana, existiendo aún menos datos en niños con cáncer27.
La eliminación viral tras una infección aguda por parte de pacientes ID parece ser más prolongada que en la población general, y puede ocurrir sin sintomatología asociada28. Esto es especialmente importante en niños ingresados por la posibilidad de diseminación y aparición de brotes en zonas hospitalarias con pacientes ID8,9, los cuales podrían presentar una frecuencia más elevada de adquisición nosocomial de estas infecciones (50-80% de pacientes expuestos), lo que puede prolongar la estancia hospitalaria29. No obstante, se ha visto en algunos estudios pediátricos que la infección nosocomial es menos frecuente que la adquirida en la comunidad10. Igualmente, esta eliminación prolongada podría ser un factor favorecedor de aparición de resistencias durante el tratamiento según algunos modelos animales experimentales30. A pesar de todo lo comentado, en el estudio de Koskenvuo et al ya no se detectó la eliminación de virus respiratorios en un 85,2% de niños con leucemia entre 1-11 días después del aislamiento inicial10. Con todo lo analizado, parece prudente que todo niño que ingrese con sospecha de infección viral respiratoria en una planta con pacientes ID, permanezca en una habitación individual con medidas de aislamiento adecuadas hasta que no se detecte eliminación viral, o, incluso, durante toda su hospitalización29.
Co-infección viralLa detección de más de un virus y su significado es otra pregunta que se plantea de forma más frecuente con las nuevas técnicas de PCR. Así, el estudio de Koskenvuo et al encuentra coinfección en un 19,7% de los aislamientos, especialmente de rinovirus-VRS, aunque no se especifica sobre el curso clínico o la mayor gravedad de estos niños10. El rinovirus es uno de los virus cuya frecuencia ha aumentado de forma significativa con las nuevas técnicas diagnósticas, detectándose en muchas ocasiones como co-infección con otros virus, no estando bien descrito en el TPH cuándo causa infección verdadera o eliminación asintomática25. El BVh es otro virus respiratorio en el que la tasa de co-infección supera el 50% en algunos estudios31,32, por lo que su detección en vía respiratoria debe interpretarse con precaución10, y plantea dudas sobre el significado patológico de este nuevo virus. Por otro lado, el MTPh parece predisponer a una enfermedad más grave cuando se detecta junto con VRS (situación muy frecuente), como se describe en un estudio prospectivo reciente realizado en niños inmunocompetentes33. El coronavirus produce neumonía con poca frecuencia y se ha visto co-infección con otros virus, por lo que, cuando se detecta conviene descartar otras infecciones asociadas34,35. Por último, adenovirus, con frecuencia puede co-existir con CMV, Aspergillus o bacterias, lo que empeora el pronóstico, sobre todo en TPH, donde podría producir retraso o fracaso en el prendimiento medular36.
Infección dual viral-bacterianaOtro punto de interés en el que el uso de la PCR podría ser de gran utilidad sería conocer la frecuencia de infección viral asociada a infección bacteriana en niños oncológicos, la cual parece oscilar entre 9-13% de los episodios de fiebre y neutropenia10,17,18,37. El interés de estas infecciones mixtas en niños se justifica por la posibilidad de que cursen con una clínica más grave, una respuesta más lenta al tratamiento antibiótico, y unos valores más elevados de la proteína C reactiva, lo que puede conllevar un manejo más agresivo, con más cambios y asociaciones de antibióticos, más días de hospitalización y retrasos de quimioterapía, sin un beneficio en la evolución clínica18.
En el futuro, cuando los estudios aclaren la causalidad del aislamiento viral y la clínica, el uso de métodos diagnósticos rápidos podría permitir una utilización más adecuada de antimicrobianos y un manejo individualizado en los niños ID.
Entre los factores de riesgo descritos para una evolución más grave destacan la linfopenia y la edad < 2 años38,39, mientras que la neutropenia no parece predecir la gravedad. Nichols et al, también objetivan que la presencia de linfopenia en adultos con TPH aumenta el riesgo de una infección grave por influenza28. Otros factores de riesgo para el desarrollo de infección respiratoria grave incluyen el periodo precoz post-TPH, especialmente si es alogénico, y la EICH11. Sung et al, en un estudio realizado en niños con leucemia mieloide aguda (LMA) en el que comparan prevalencia y características de infecciones bacterianas, fúngicas y virales en relación con diferente intensidad de la terapia, encuentran que durante la fase de inducción existe una mayor incidencia de infección en niños con una terapia intensiva comparado con un tratamiento estándar (14% vs 3,9%, p<0,001, para el caso de infecciones virales)40. Así, el Grupo COG (Children¿s Oncology Group) ha recomendado recientemente incluir la LMA como factor de riesgo de gravedad en infección por VRS41. Por último, este tipo de infecciones podrían asociarse con rechazo agudo o crónico en receptores de trasplante42, aunque no existe una evidencia de causalidad en todos los casos.
A continuación, se resumen algunas características epidemiológicas relevantes de los diferentes virus respiratorios en niños ID.
InfluenzaEl virus influenza produce una importante morbimortalidad, siendo más elevada en pacientes ID8,9. Se ha visto que los pacientes con TPH presentan un mayor riesgo de complicaciones8,9,28 y de desarrollo de neumonía8, con una media de infección de 29 días tras el trasplante25. Así, un estudio reciente en niños con cáncer previo al TPH e infección por influenza objetivó una IRVB en el 13% de los mismos, aunque no hubo mortalidad43. Respecto al riesgo de diseminación, depende de varios factores, que incluyen edad (mayor en niños), exposición (mayor en la comunidad que en hospital), niveles de inmunidad (infección previa, vacunación), grado de inmunodeficiencia y magnitud de la epidemia. La prevalencia estimada en receptores de trasplantes no parece ser diferente a la población general (2-29% vs 5-20%, respectivamente)8,9,44. Como con otros virus, se ha visto que el tiempo de eliminación puede ser prolongado en relación con el grado de inmunosupresión y el tratamiento. De esta manera, se ha visto que el tiempo de eliminación, más prolongado en pacientes ID, puede acortarse con el tratamiento antiviral. Así, en un estudio en adultos, el tiempo medio de eliminación fue de 6,7 días para TPH autólogo, 11,1 días para TPH alogénico, 9,7 días en caso de TPH tratado con inhibidores M2 y 7,5 días si el tratamiento se realizó con inhibidores de neuraminidasa (NA)28.
VRSEs un virus con una alta incidencia en infecciones respiratorias en niños, especialmente entre octubre y marzo, coincidiendo durante varios meses con el virus influenza45. En pacientes con cáncer se ha aislado durante todo el año25. En niños y adultos con TPH es la causa más frecuente de IRVA/B25, con frecuencia en los primeros 30 días pos-trasplante46. El VRS es una causa muy importante de morbimortalidad en pacientes ID8,9,47, sin embargo, en un estudio reciente en niños con cáncer donde aislaron 39 infecciones por VRS (23% nosocomial), ninguno de los pacientes falleció como consecuencia de esta infección, aunque un niño con LMA requirió ventilación mecánica48. En un 64% de los casos la quimioterapia tuvo que aplazarse, con las consecuencias negativas que esto conlleva. Además, el virus siguió aislándose hasta 43 días después en algunos niños. Dos niños fueron tratados con ribavirina oral y uno con una dosis IV de palivizumab, sin observarse cambios en el curso clínico de la infección. En otro estudio más reciente, realizan una revisión de la prevalencia y mortalidad relacionada con VRS en niños con LMA durante la fase de neutropenia, encontrando una prevalencia en época epidémica del 0-2,2% en la fase de inducción, y del 0,6-2,5% en la de consolidación41. La mortalidad atribuible al VRS la cifran en un 10%. En este estudio no describen el método diagnóstico utilizado, comentando los autores que la prevalencia podría ser mayor. El desarrollo de neumonía en un estudio retrospectivo de 58 niños con cáncer u otras inmunodeficiencias e infección por VRS fue de un 28%38, con una mortalidad relacionada con el VRS de un 31% y una mortalidad global de un 8,6% (todos con neumonía). Todas estas cifras podrían estar sobreestimadas por colonización por VRS, dado que la eliminación del VRS en paciente ID es más prolongada8,9. Por último, el diagnóstico de VRS antes del acondicionamiento suele retrasarlo, aunque no parece que exista un riesgo de progresión de la neoplasia20.
VPIExisten 4 cepas, siendo el VPI-3 el más frecuente en pacientes trasplantados35. El VPI produce varios tipos de infecciones respiratorias a lo largo de todo el año8,9, con una media de tiempo pos-trasplante de 2 meses47. La infección puede complicarse con pancitopenia, síndrome de Guillain-Barré, parotiditis o encefalomielitis, con una progresión a neumonía de un 44%25. La mortalidad aumenta en casos de neumonía, de co-patógenos asociados o de ventilación mecánica, siendo de alrededor del 35%25,47. Los pacientes ID pueden excretar durante mucho tiempo el virus, y se ha descrito infección nosocomial en unidades de trasplante y clínicas en niños y adultos47,49. También se han encontrado casos de pacientes trasplantados infectados por VPI sin clínica acompañante50, lo que hace difícil saber con exactitud su patogenicidad.
MTPhEl MTPh es un virus respiratorio cada vez más reconocido como patógeno en personas inmunocompetentes e ID. Su epidemiología y curso clínico son similares a los del VRS51–56, normalmente en niños más mayores (6-12 meses). Se detecta entre un 6-40% de niños con infección respiratoria. En un estudio se objetivó que hasta un 25% de las infecciones respiratorias en trasplante de pulmón en adultos y un 14% de niños sanos hospitalizados se produjeron por MTPh35. Williams et al detectaron MTPh en el 20% de 248 muestras de secreciones nasofaríngeas de niños sanos con neumonías filiadas como idiopáticas57. En el TPH la máxima incidencia ocurre entre los 40-144 días pos-trasplante. En un estudio retrospectivo y prospectivo en 1.899 pacientes con neoplasias hematológicas y tumores sólidos, el MTPh se detectó en 51 casos (2,7%), de los cuales 19 eran niños58, siendo la frecuencia de aislamiento mayor en niños que en adultos (4,5% vs 2,2%). La clínica fue de tos y fiebre en la mayoría de casos, 43% tenían neutropenia y 61% linfopenia, con alteraciones radiológicas en el 55% de los pacientes. En los casos de TPH la mayoría se infectaron pasados 12 meses del mismo. En este estudio no se objetivó mortalidad, aunque sí se ha visto en otros casos51,56.
RinovirusExisten más de 100 serotipos de este virus. Es la causa más importante de catarro común en niños y adultos, con una incidencia máxima entre el final de la primavera y el principio del otoño35. El rinovirus parece ser la causa más frecuente de infección respiratoria viral en ID, con una gravedad que va de IRVA a neumonía grave19,59,60, aunque puede existir una eliminación viral prolongada sin clínica ni progresión a IRVB59,60. Estudios prospectivos en niños con cáncer por medio de técnicas de PCR han objetivado una frecuencia alta de detección de este virus, aunque la morbimortalidad no parece muy elevada10,17, y podría ser menor que en adultos, aunque no está bien estudiado37. En el TPH no está bien descrito cuándo causa infección y cuándo se trata de co-infección o eliminación asintomática25.
AdenovirusEs el virus ADN respiratorio más importante, del que existen 51 tipos diferentes, recientemente clasificados en 6 especies (A-F)36. Asimismo, se ha descrito un nuevo serotipo (serotipo 14) con importante virulencia, implicado en infección grave de vía respiratoria inferior en niños y adultos sanos61. La infección por adenovirus suele ser autolimitada y afectar con más frecuencia al tracto respiratorio, gastrointestinal o conjuntiva, según el serotipo, y su incidencia no es estacional. La transmisión se produce por contacto o por inhalación, así como por exposición a tejidos infectados o sangre, con un periodo de incubación entre 2 días y 2 semanas35. La eliminación de la faringe de adultos inmunocompetentes con catarro común oscila entre 1-3 días, mientras que es de hasta 3-6 semanas de la faringe o heces de niños con infección respiratoria. La eliminación en pacientes ID parece ser más prolongada, habiéndose descrito infección nosocomial en unidades de trasplante62. Se cree que este virus puede permanecer de forma latente en el organismo, habiéndose detectado meses o años después de la infección aguda. En pacientes ID el adenovirus puede producir infección específica de un órgano o infección diseminada, y presentar alta mortalidad36. La incidencia en TPH varía entre el 3-47%63–66, siendo más elevada en TPH alogénico (8,5-30% vs 2-12%)63, en niños vs adultos (31-47% vs 13,6%)63,66,67, en pacientes que reciben muestras con depleción de células T (45 vs. 11%)39,68, y en pacientes con EICH65,69,70. Se ha visto en estudios retrospectivos que la mayor parte de las infecciones se producen en los primeros 100 días pos-trasplante (mediana 36-90 días), lo que indicaría reactivación frecuente36,64–66,68–71. En niños se ha visto una incidencia más tardía de neumonía que en adultos (mediana 7 meses)25. Un estudio en adultos demostró que sólo en el 10% de pacientes con neumonía existía colonización nasofaríngea previa, lo que indicaría que la mayor parte de las neumonías se producen a través de viremia65. El adenovirus puede detectarse en múltiples fluidos y secreciones, pero sólo en suero (PCR) predice la enfermedad diseminada72. Esta infección puede tener una alta mortalidad sin tratamiento (26%), pudiendo alcanzar un 50-80% en el caso de neumonía o infección diseminada36.
CoronavirusExisten 5 coronavirus humanos clínicamente significativos, uno de ellos responsable del síndrome de la infección respiratoria aguda grave (SARS)35,73. En general, producen IRVA34,35, aunque se han descrito casos en niños sanos con IRVB, especialmente lactantes34. En pacientes ID también se han descrito casos de IRVB, algunos, incluso letales35,74. Coronavirus 229E se ha detectado en adolescentes y adultos con TPH y clínica de fiebre, tos e infiltrados pulmonares, produciendo en algunos pacientes derrame pleural, neumotórax, e incluso fracaso multiorgánico75.
BVhEn el año 2005 Allender et al describen, mediante PCR, un nuevo parvovirus humano, previamente desconocido31,76. El nombre deriva de dos virus de este género descritos en animales, un virus bovino (bo) y un virus canino (ca). Los estudios publicados hasta el momento demuestran que el virus tiene una distribución mundial32,77. El BVh se ha detectado durante todo el año, sin embargo, parece más frecuente entre octubre y febrero32. El BVh inicialmente se detectó en el tracto respiratorio, preferentemente en niños pequeños, causando infección respiratoria alta y sibilancias, y con frecuencia neumonía, sobre todo en menores de 2 años32,77. Un estudio prospectivo español en niños inmunocompetentes concluye que produce bronquiolitis en niños mayores que el VRS, menos fiebre que adenovirus y más hipoxemia que rinovirus78. Su papel en pacientes ID se desconoce, aunque se ha descrito un caso de infección diseminada en un niño en las primeras semanas tras TPH26. Igualmente, se han descrito 3 niños con leucemia linfoblástica aguda en los que se detectó BVh en las secreciones respiratorias en diferentes episodios febriles. Uno de los niños presentó 5 episodios febriles consecutivos en los que se objetivo BVh, y sólo en una ocasión acompañado de otro virus respiratorio (rinovirus)79. Este virus, inicialmente encontrado en el tracto respiratorio, se ha objetivado también en heces y en suero26.
Manifestaciones clínicasLa presentación clínica de las distintas infecciones virales respiratorias puede ser diferente en pacientes ID respecto a personas sanas, no existiendo un cuadro clínico característico; es decir, producen sintomatología indistinguible entre ellos8,9,11. Así, por ejemplo, con frecuencia podrían no presentar fiebre. Igualmente, sobre la base de la revisión de la literatura, parece obvio que producen una mayor morbilidad en pacientes ID11. Estos virus pueden dar lugar a cuadros clínicos muy variados que incluyen laringitis, cuadros pseudogripales, infección respiratoria de vías altas, bronquitis y croup. Además, en estos pacientes, las infecciones respiratorias virales inducen un aumento del riesgo de desarrollo de neumonía, sobreinfección bacteriana, aspergilosis invasiva y muerte8,9,80.
DiagnósticoEl diagnóstico de las infecciones respiratorias virales se basa fundamentalmente en 4 pruebas: serología, cultivo viral, detección antigénica y técnicas moleculares o de PCR, habiendo sido hasta hace poco el cultivo el método de referencia. Dado el riesgo de diseminación y de desarrollo de complicaciones, pensamos que a todo niño oncológico con fiebre o síntomas respiratorios, especialmente si ingresa, se le debería realizar una detección viral en secreciones respiratorias. La serología no suele ser útil en este tipo de niños, dado que la respuesta serológica puede ser pobre, y suele ser necesaria una detección en fase convaleciente. En el caso del cultivo viral, para alcanzar un diagnóstico amplio conviene utilizar varias líneas celulares inoculadas ya que se aumenta la sensibilidad comparado con una sola línea celular81–83, variando la sensibilidad y el tiempo de positividad para cada virus82–84. Hay que tener en cuenta que existen virus como el coronavirus, el MTPh y el BVh que no crecen bien en cultivo, por lo que son importantes otras técnicas diagnósticas. Una variante del cultivo celular es el shell vial, donde la muestra se inocula sobre las líneas celulares, se centrifuga y pasadas 24-48 horas se tiñen con anticuerpos monoclonales. En general, la sensibilidad es mejor que las técnicas rápidas, aunque varía dependiendo del virus, siendo mayor para VRS y menor para adenovirus y VPI85. Detección antigénica. Lo más rápido y cómodo son las detecciones rápidas de antígeno por medio de inmunocromatografía, ELISA o IF, aunque su sensibilidad podría ser más baja en paciente trasplantados, especialmente de muestras nasales comparadas con muestras de lavado broncoalveolar (BAL)11. De hecho, algunos estudios en adultos86 y niños26 han objetivado una mayor sensibilidad en muestras obtenidas de secreciones de vías respiratorias bajas para el diagnóstico de estas infecciones, lo que podría ser especialmente importante cuando existe neumonía. A pesar de todo, es bien sabida la mayor rentabilidad de las muestras respiratorias de vías altas en niños, lo que, junto a la dificultad de obtención sistemática de muestras de vías respiratorias bajas, ha llevado a muchos investigadores a la utilización de muestras de vías respiratorias altas para el diagnóstico10,17,18. Existen varias mezclas de anticuerpos (Ac) para detectar varios virus a la vez, los cuales pueden usarse en shell vial, en cultivo o directamente en muestras de pacientes87. También existen Ac individuales para tinción específica de cada virus.
Técnicas molecularesA pesar de que estas pruebas tienen una buena rentabilidad, las técnicas de PCR parecen tener una sensibilidad superior en pacientes ID, especialmente en co-infecciones74, tanto en niños como en adultos, y tienen la ventaja de poder analizar un gran número de virus respiratorios con una sola muestra10,17,19,74,88–93. De esta manera, probablemente la incidencia de infección respiratoria en pacientes oncológicos haya sido infraestimada92: las técnicas de PCR parecen ser un 20-50% y un 46% más sensibles que el cultivo viral y la detección por IF, respectivamente11. En el estudio pediátrico de Koskenvuo et al, el diagnóstico por PCR fue superior a las otras técnicas diagnósticas, especialmente para el rinovirus10. Por otro lado, en los últimos años, gracias a estas técnicas de PCR, se han detectado nuevos virus que pasaban inadvertidos con otras técnicas, cuya significación clínica e implicaciones no se conoce bien. Es el caso del MTPh, coronavirus (incluidos SARS, NL63, HKU1, implicados en IRVB) y BVh, entre otros. Desde el desarrollo de estas técnicas de PCR, la diferenciación y el diagnóstico de la etiología en infecciones respiratorias en pacientes ID, muy difícil en la mayoría de las ocasiones10, puede verse facilitada. En este sentido, podría ser importante la medición de la carga viral por medio de PCR en secreciones respiratorias, aunque los estudios son hasta el momento escasos. En un trabajo reciente en 119 niños sanos hospitalizados por infección respiratoria aguda, se objetivó una correlación casi significativa entre la carga viral del BVh y la gravedad de la infección, mientras que esta correlación no se objetivó para el VRS ni rinovirus94. En otro estudio en adultos con cáncer la mediana de carga viral en secreciones respiratorias de VRS en muestras nasofaríngeas fue de 6,9 log copias/ml cuando el virus se detectaba en cultivo y de 7,3 log copias/ml cuando el VRS se detectaba por determinación antigénica. Así, una carga viral inferior a este umbral podría no ser detectada más que con técnicas moleculares92[93]. Gerna et al realizan mediciones de carga viral de rinovirus mediante PCR en niños inmunocompetentes e ID encontrando que, cuando la carga viral es ≥106 copias ARN/ml en muestras nasofaríngeas o de BAL, el rinovirus puede causar infección grave de vías respiratorias altas o bajas, mientras que si la carga viral es media o baja, lo que ocurre sobre todo en ID, puede representar sólo colonización viral95. Así, sería importante definir el umbral de carga viral que indique relación entre aislamiento y clínica, y nos permita determinar la fiabilidad de estas nuevas técnicas diagnósticas frente a las técnicas tradicionales.
Existen varias pruebas basadas en técnicas de PCR para la detección de virus respiratorios comercializados en la actualidad, incluso con excelente sensibilidad en pacientes ID88,89,96. Algunas de estas pruebas incluyen PCR multivirus, aunque hay pocos análisis comparativos entre ellas. Algunas de estas técnicas utilizan una PCR-ELISA, y han demostrado una mayor sensibilidad que las pruebas de IF y cultivo en todos los virus analizados97, manteniendo buena especificidad, incluso en niños85. En la actualidad, algunas de ellas incluyen también la detección de MTPh y de BVh.
Se han desarrollado nuevas técnicas basadas en PCR utilizando diferentes métodos para la detección y cuantificación del producto amplificado, que simplifican el procedimiento, y que también permiten un diagnóstico múltiple. Una de ellas es el panel respiratorio Multi-Code PLx (EraGen Biosciences Inc) que utiliza PCR asociado a métodos específicos de marcar el ADN para poder detectarlo, y técnicas de hibridación, y que puede detectar, al menos, 17 virus96. Luminex Inc (Austin, TX) ha creado la tecnología Luminex¿s xMAP®, basada en microesferas de colores para distinguir los diferentes productos obtenidos, capaces de detectar hasta 20 virus respiratorios a la vez. Recientemente la FDA americana ha aprobado el panel respiratorio viral xTAG® basado en esta técnica, que también está disponible en Europa. Aunque los datos sobre sensibilidad y especificidad son escasos todavía, podrían ser prometedores98. Otras compañías han desarrollado técnicas de PCR basadas en electroforesis fluorescente con un programa específico de lectura que también han demostrado una mayor sensibilidad que las técnicas tradicionales en muestras respiratorias de niños ingresados99. En el momento actual, todas estas técnicas están muy desarrolladas, muchas de ellas semiautomatizada, con una menor carga de trabajo de laboratorio frente a cultivos virales, mucho más laboriosos. Aunque su precio en la actualidad sea superior al de los cultivos celulares, es probable que su rentabilidad en ciertas circunstancias sea favorable por la posibilidad de evitar el consumo de otros recursos asociados, algo que habrá que seguir analizando. Otros métodos diagnósticos, como los microarrays, se están comparando con la determinación por PCR de infecciones respiratorias en niños, con buenos resultados preliminares100. Estas técnicas más novedosas permiten, además, realizar un subtipaje de los virus.
En conclusión, se están desarrollando nuevos métodos diagnósticos basados en tecnología molecular, capaces de detectar de forma rápida, sensible y específica un gran número de virus respiratorios con una sola muestra, algunos con buenos resultados en niños, y que podrían ser una herramienta muy útil en el futuro en el manejo de niños oncológicos con fiebre o clínica respiratoria. Es importante validar todas estas técnicas más novedosas con la clínica de los pacientes ya que, en ciertas ocasiones, podrían corresponderse con infecciones subclínicas, eliminaciones prolongadas o simplemente restos genéticos intracelulares sin trascendencia patogénica18.
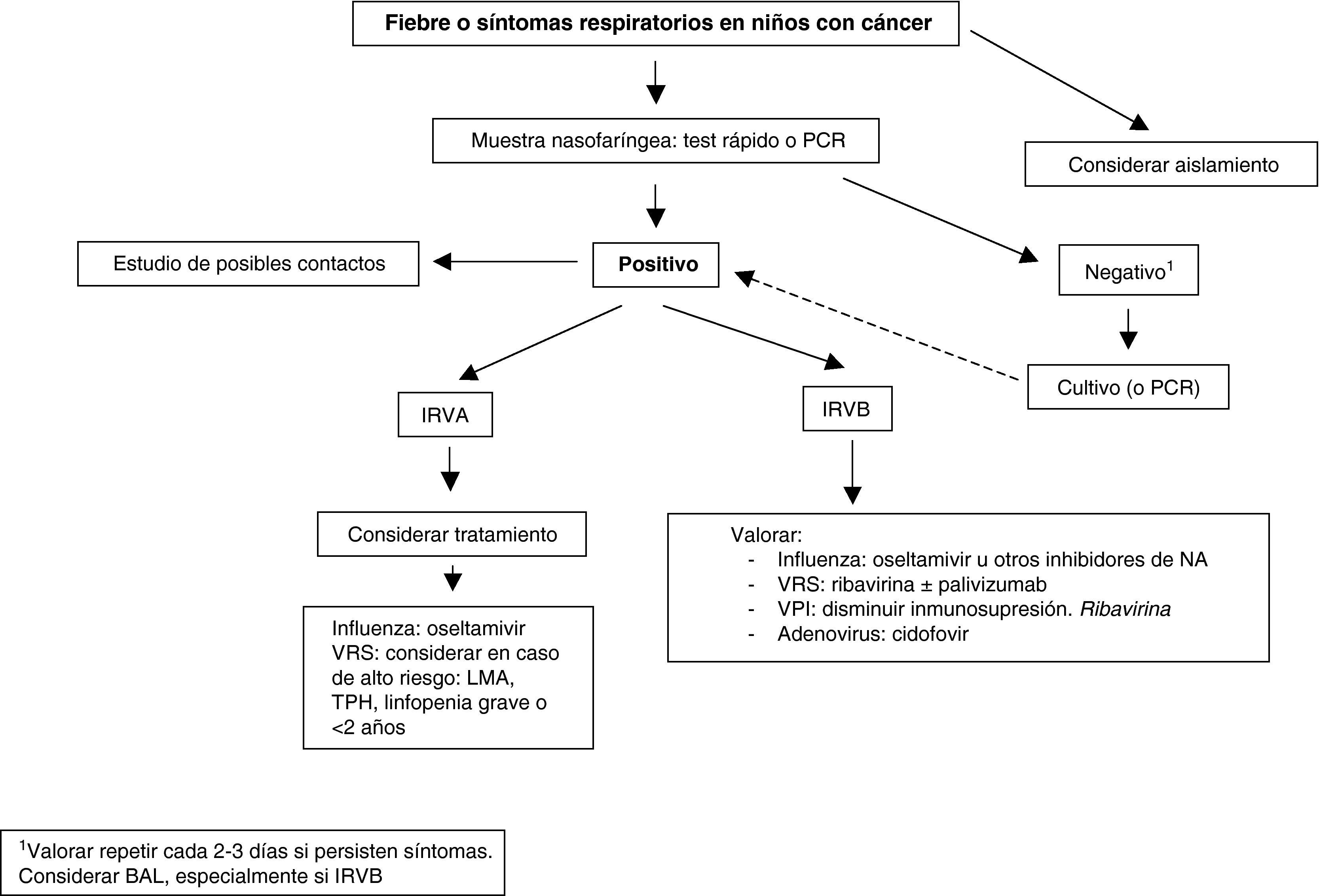
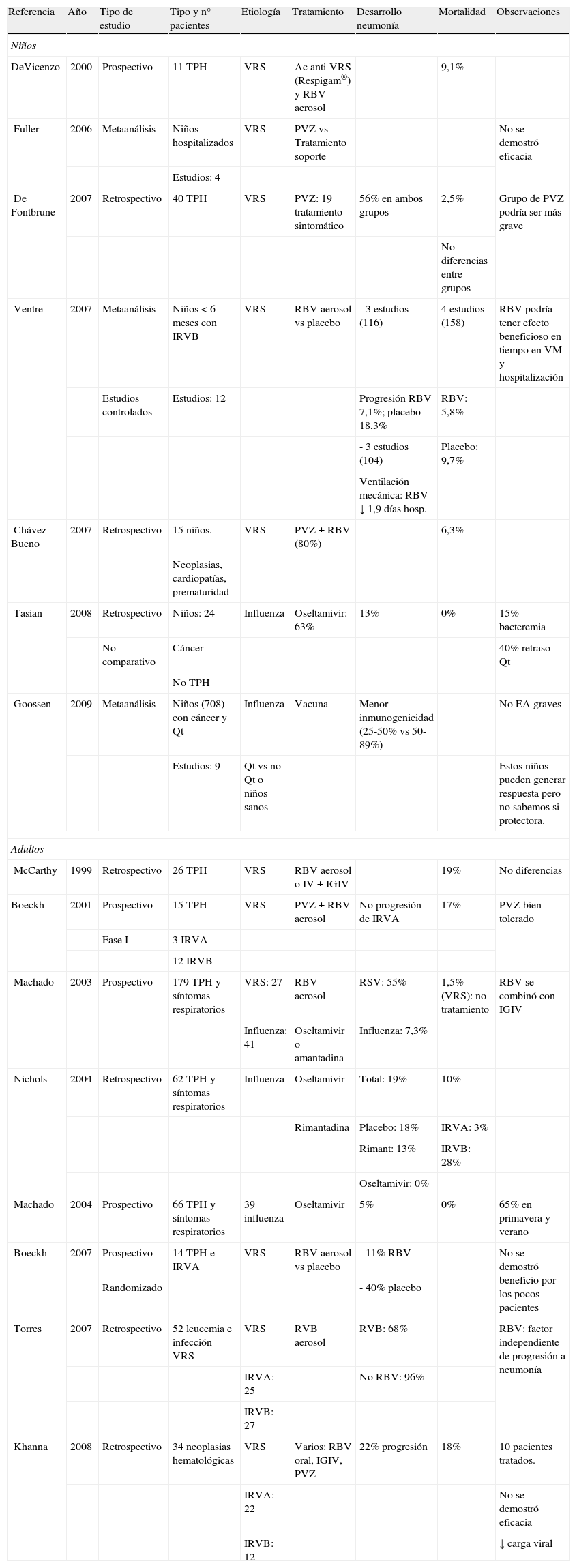
TratamientoLos datos sobre el tratamiento antiviral en niños ID con una infección viral respiratoria son escasos, y se comentan a continuación brevemente con cada virus específico. Siempre que sea posible se debe disminuir la inmunosupresión o retrasar el siguiente ciclo de quimioterapia o TPH. En la tabla 2 se exponen los estudios sobre tratamiento más representativos en niños y adultos. La figura 1 muestra un posible algoritmo de manejo de estos niños.
Estudios más representativos sobre tratamiento de infecciones virales respiratorias en pacientes con cáncer
| Referencia | Año | Tipo de estudio | Tipo y n° pacientes | Etiología | Tratamiento | Desarrollo neumonía | Mortalidad | Observaciones |
| Niños | ||||||||
| DeVicenzo | 2000 | Prospectivo | 11 TPH | VRS | Ac anti-VRS (Respigam®) y RBV aerosol | 9,1% | ||
| Fuller | 2006 | Metaanálisis | Niños hospitalizados | VRS | PVZ vs Tratamiento soporte | No se demostró eficacia | ||
| Estudios: 4 | ||||||||
| De Fontbrune | 2007 | Retrospectivo | 40 TPH | VRS | PVZ: 19 tratamiento sintomático | 56% en ambos grupos | 2,5% | Grupo de PVZ podría ser más grave |
| No diferencias entre grupos | ||||||||
| Ventre | 2007 | Metaanálisis | Niños < 6 meses con IRVB | VRS | RBV aerosol vs placebo | - 3 estudios (116) | 4 estudios (158) | RBV podría tener efecto beneficioso en tiempo en VM y hospitalización |
| Estudios controlados | Estudios: 12 | Progresión RBV 7,1%; placebo 18,3% | RBV: 5,8% | |||||
| - 3 estudios (104) | Placebo: 9,7% | |||||||
| Ventilación mecánica: RBV ↓ 1,9 días hosp. | ||||||||
| Chávez-Bueno | 2007 | Retrospectivo | 15 niños. | VRS | PVZ±RBV (80%) | 6,3% | ||
| Neoplasias, cardiopatías, prematuridad | ||||||||
| Tasian | 2008 | Retrospectivo | Niños: 24 | Influenza | Oseltamivir: 63% | 13% | 0% | 15% bacteremia |
| No comparativo | Cáncer | 40% retraso Qt | ||||||
| No TPH | ||||||||
| Goossen | 2009 | Metaanálisis | Niños (708) con cáncer y Qt | Influenza | Vacuna | Menor inmunogenicidad (25-50% vs 50-89%) | No EA graves | |
| Estudios: 9 | Qt vs no Qt o niños sanos | Estos niños pueden generar respuesta pero no sabemos si protectora. | ||||||
| Adultos | ||||||||
| McCarthy | 1999 | Retrospectivo | 26 TPH | VRS | RBV aerosol o IV±IGIV | 19% | No diferencias | |
| Boeckh | 2001 | Prospectivo | 15 TPH | VRS | PVZ±RBV aerosol | No progresión de IRVA | 17% | PVZ bien tolerado |
| Fase I | 3 IRVA | |||||||
| 12 IRVB | ||||||||
| Machado | 2003 | Prospectivo | 179 TPH y síntomas respiratorios | VRS: 27 | RBV aerosol | RSV: 55% | 1,5% (VRS): no tratamiento | RBV se combinó con IGIV |
| Influenza: 41 | Oseltamivir o amantadina | Influenza: 7,3% | ||||||
| Nichols | 2004 | Retrospectivo | 62 TPH y síntomas respiratorios | Influenza | Oseltamivir | Total: 19% | 10% | |
| Rimantadina | Placebo: 18% | IRVA: 3% | ||||||
| Rimant: 13% | IRVB: 28% | |||||||
| Oseltamivir: 0% | ||||||||
| Machado | 2004 | Prospectivo | 66 TPH y síntomas respiratorios | 39 influenza | Oseltamivir | 5% | 0% | 65% en primavera y verano |
| Boeckh | 2007 | Prospectivo | 14 TPH e IRVA | VRS | RBV aerosol vs placebo | - 11% RBV | No se demostró beneficio por los pocos pacientes | |
| Randomizado | - 40% placebo | |||||||
| Torres | 2007 | Retrospectivo | 52 leucemia e infección VRS | VRS | RVB aerosol | RVB: 68% | RBV: factor independiente de progresión a neumonía | |
| IRVA: 25 | No RBV: 96% | |||||||
| IRVB: 27 | ||||||||
| Khanna | 2008 | Retrospectivo | 34 neoplasias hematológicas | VRS | Varios: RBV oral, IGIV, PVZ | 22% progresión | 18% | 10 pacientes tratados. |
| IRVA: 22 | No se demostró eficacia | |||||||
| IRVB: 12 | ↓ carga viral | |||||||
EA: efectos adversos; IGIV: inmunoglobulina intravenosa; IRVA=infección respiratoria de vías altas; IRVB: infección respiratoria de vías bajas; PVZ: palivizumab; Qt: quimioterapia; RVB: ribavirina; TPH: trasplante de progenitores hematopoyéticos; VM: ventilación mecánica; VRS: virus respiratorio sincitial.
La escasa experiencia que se tiene con este virus se refiere a los virus estacionales que han estado circulando hasta ahora, careciendo de datos con el nuevo virus influenza A H1N1. La mortalidad en pacientes ID parece ser más elevada (17-43%)8,9,25, especialmente cuando cursa con neumonía28 y en co-infecciones bacterianas25,43, pero podría disminuir con el uso de antivirales8,9,11,25,28,101,102, aunque no se han llevado a cabo estudios controlados11,25. Así, el 18% de los pacientes no tratados desarrollaron neumonía, frente al 13% de los tratados con rimantadina y el 0% de los tratados con oseltamivir28. Además, se ha visto que unas dosis más elevadas de inhibidores de NA podrían aclarar el virus más rápidamente en pacientes ID11. Se especula que en este tipo de pacientes un tratamiento más prolongado, quizás hasta la eliminación del virus de las vías respiratorias, podría ser más beneficioso, como podría serlo iniciar el tratamiento más allá de las 48 horas dada la dinámica del virus en pacientes ID11.
El tratamiento con antivirales, tanto con inhibidores M2 (influenza A) como, especialmente, con inhibidores de NA, ha demostrado una disminución de los síntomas en niños sanos, así como del tiempo de su eliminación103,104, pero no hay estudios adecuados en niños con cáncer. El aumento de resistencias del virus de la gripe frente a todos los antivirales debido a un uso desmesurado podría ser un problema en el futuro. La aparición de resistencias se ha objetivado, incluso, intratratamiento105. Finalmente, tanto la vacuna anual con virus inactivados al sujeto (quizá con menor efectividad106), y, especialmente, a la familia y personal sanitario, como la quimioprofilaxis con antivirales en situaciones de alto riesgo, podrían disminuir la transmisión del virus influenza a estos niños11.
VRSNo existen estudios adecuadamente realizados para poder dar recomendaciones definitivas respecto al tratamiento de la infección por VRS. Una revisión del año 2006 concluyó que no existía evidencia de la eficacia del tratamiento con inmunoglobulina (IG) anti-VRS en niños hospitalizados con IRVB por VRS107. Por otro lado, aunque otra revisión del efecto del tratamiento con ribavirina en niños con IRVB por VRS tampoco alcanzó un poder suficiente para demostrar eficacia de forma global, cuando se analizaron estudios más seleccionados, se vio que el tratamiento con ribavirina podría reducir los días de ventilación mecánica y hospitalización, así como las sibilancias recurrentes secundarias a largo plazo108. Un estudio en niños sanos hospitalizados con bronquiolitis por VRS analizó la evolución clínica tras la administración de palivizumab IV vs placebo objetivando una disminución de los días de hospitalización y de necesidad de O2 en el grupo de palivizumab, aunque no alcanzó significación estadística en posible relación con el tamaño de la muestra109.
La mayoría de los estudios de tratamiento en pacientes con cáncer son retrospectivos y observacionales, con diferentes combinaciones de IGIV, palivizumab y ribavirina25. Khanna et al especulan sobre la posible eficacia clínica y virológica de ribavirina oral en adultos con neoplasias hematológicas comparándolo con controles históricos con ribavirina en aerosol92. En la revisión de la literatura que realizan encuentran que los pacientes tratados con ribavirina progresan de IRVA a IRVB un 32% frente al 68% de los casos no tratados, no pudiendo sacar ninguna conclusión respecto a la mortalidad92. Otro estudio en fase I objetiva un mortalidad baja (17%) de pacientes con TPH y neumonía por VRS que reciben Ac monoclonales contra VRS asociado a ribavirina en aerosol110. El único estudio randomizado para evaluar el tratamiento de ribavirina en aerosol en adultos con TPH e IRVA por VRS tuvo que detenerse debido a la lentitud de reclutamiento111. En este estudio se objetivó una disminución de la carga viral en secreciones respiratorias en pacientes tratados frente a un aumento en pacientes no tratados, sin diferencias clínicas.
Respecto al tratamiento en niños ID, la evidencia es también escasa. Un estudio retrospectivo en 26 pacientes con TPH (la mayoría < 16 años) objetivó una mortalidad del 19% asociada a infección por VRS, sin diferencias entre pacientes tratados con alguna combinación de ribavirina en aerosol/IV e IGIV. Un 15% de los pacientes presentó un fracaso de injerto en probable relación con esta infección112. Un estudio reciente, retrospectivo, realizado por Chávez-Bueno y colaboradores, analizó el uso de palivizumab en 31 niños con neoplasias, enfermedad cardíaca o prematuridad, encontrando una mortalidad global muy baja (6,4%). El 80%, además, recibieron ribavirina113. DeVicenzo et al unos años antes habían visto en un estudio prospectivo realizado en niños con TPH que recibieron Ac anti-VRS, asociado o no a ribavirina en aerosol, una mortalidad del 9%46. En cuanto al uso de ribavirina oral, un estudio reciente en 30 niños en tratamiento con quimioterapia±TPH autólogo o alogénico a los que se realizó vigilancia frente a VRS por medio de IF directa, detectó 6 casos positivos (todos con neumonía), de los cuales, 5 se trataron con ribavirina oral e IGIV con buena evolución. Los autores hacen hincapié en la baja mortalidad en estos niños cuyo tratamiento se inició de forma precoz114. Por último, otro estudio retrospectivo en niños con TPH e infección por VRS a los que se administró palivizumab IV, no objetivó beneficio en el desarrollo de neumonía ni en mortalidad115. Al igual que con otras infecciones respiratorias, la mortalidad en niños con infección VRS podría ser menor que en adultos, y el tratamiento precoz, antes del desarrollo de neumonía grave, asociarse con un mejor pronóstico11. La profilaxis con palivizumab utilizada por algunos centros en pacientes con TPH no cuenta con una evidencia definitiva sobre su eficacia11,25, aunque un estudio reciente sugiere que la profilaxis tras TPH en niños podría disminuir un 10% la mortalidad por este virus116. Existen nuevos tratamientos en diferentes fases de estudio, incluyendo el anticuerpo monoclonal motavizumab, que se ha comparado con palivizumab en niños, con buenos resultados preliminares117.
VPIExisten casos anecdóticos de tratamiento con ribavirina en pacientes ID (JSL, primer autor, tiene alguna experiencia con ribavirina IV en niños ID), aunque, en general, no parece que el tratamiento con este antiviral en aerosol, con o sin IGIV, tenga ningún impacto en la mortalidad de pacientes con TPH y neumonía por VPI25,47. Otros antivirales más específicos están en fase de investigación.
MTPhNo existe tratamiento, aunque ribavirina parece tener cierta actividad antiviral, y existe algún caso tratado con éxito combinando ribavirina e inmunoglobulinas118.
RinovirusPleconaril, antiviral con actividad frente a picornavirus, no está comercializado.
AdenovirusSe ha usado ribavirina IV de forma exitosa para el tratamiento de la infección diseminada por adenovirus en niños y adultos, sin embargo, hacen falta estudios con un mayor número de pacientes para poder sacar conclusiones25. Igualmente, se han descrito casos de pacientes con TPH con infección por adenovirus tratados con éxito con cidofovir, aunque hay que tener en cuenta su posible toxicidad renal y de médula ósea25,65,119. Un estudio pediátrico prospectivo en receptores de TPH demostró una baja mortalidad (19%) tras una vigilancia semanal prolongada de los pacientes y tratamiento precoz con ribavirina, o cidofovir como segunda línea39. En este estudio la mortalidad se relacionó directamente con linfopenia, y sólo 4 niños (19%) aclararon el virus sin recuperación de los linfocitos39. Otro estudio retrospectivo en niños con TPH e infección grave por adenovirus objetivó una curación clínica y virológica en un 80-90% cuando se administró cidofovir frente a un 50-62% en niños con tratamiento sintomático66. La mortalidad en el primer grupo fue de un 10% comparado con un 50% en el segundo grupo. Por último, un estudio en el que se administró tratamiento de anticipación con cidofovir a niños con TPH y alto riesgo de infección por adenovirus no objetivó ningún fallecimiento120.
CoronavirusNo existe tratamiento para esta infección, con la posible excepción de interferón. Así, en un estudio abierto en adultos, interferon-α asociado a corticoides mejoró la oxigenación y aceleró la resolución de infiltrados pulmonares comparado con pacientes tratados sólo con corticoides121. En la actualidad existen estudios con un inhibidor de proteasa35.
BVhNo existe información sobre posibles tratamientos para la infección por este virus.
Conclusiones- -
Las infecciones respiratorias virales parecen ser una causa frecuente de fiebre en niños con cáncer.
- -
La detección precoz con técnicas de alta sensibilidad como aquéllas basadas en PCR, permitirían un diagnóstico precoz de estas infecciones, evitando la diseminación del virus y la aplicación de las medidas terapéuticas adecuadas. Dado que las IRV parecen más frecuentes y graves en el periodo post-trasplante, parece importante la aplicación de medidas más estrictas de aislamiento durante este tiempo.
- -
A pesar de que existen estudios contradictorios, la morbimortalidad parece superior en estos pacientes, especialmente en caso de IRVB, y, quizás, el tratamiento precoz en ciertas infecciones respiratorias en estos niños, más frente al virus influenza, y quizá VRS y adenovirus, podría tener un efecto beneficioso en su evolución clínica.
- -
Es importante determinar en el futuro el papel de cada detección viral en procesos clínicos y patológicos, e identificar criterios que nos permitan saber el estado de infección aguda, crónica o portador. Igualmente, podría existir la posibilidad de un manejo sin antibióticos (menos agresivo) de niños con cáncer, gravemente ID, en los que se diagnostica una infección respiratoria, aunque en un porcentaje de niños no desdeñable se objetiva una infección dual.
- -
Se necesitan estudios prospectivos, controlados, y bien diseñados, para resolver todas estas incógnitas planteadas, como el espectro de las infecciones virales, factores de riesgo, pronóstico y posibles tratamientos.
Los autores declaran no tener ningún conflicto de intereses.