En los últimos años, se ha producido la aparición y dispersión de bacterias gramnegativas capaces de expresar enzimas, como las carbapenemasas, que confieren una elevada resistencia a los antibióticos betalactámicos, incluyendo los carbapenémicos. Este grupo de enzimas es una mezcla heterogénea de betalactamasas, que pueden pertenecer según la clasificación de Ambler, a la clase B o metalobetalactamasas (MLB) dependientes de Zn, y a las clases A y D o serincarbapenemasas. Las MBL más prevalentes en cepas clínicas son las pertenecientes a los tipos VIM e IMP. Posteriormente, se ha descrito un nuevo tipo, el denominado Nueva Delhi metalobetalactamasa (NDM-1) que inactiva, al igual que los anteriores, a todos los betalactámicos excepto aztreonam, aunque la mayor parte de las cepas que albergan el gen blaNDM-1 producen conjuntamente otras betalactamasas de espectro extendido que afectan a este último, convirtiendo a estos patógenos en absolutamente resistentes a todos los betalactámicos1.
La primera descripción de NDM-1 se hizo en 2009 a partir de 2 cepas de Klebsiella pneumoniae (K. pneumoniae) y Escherichia coli (E. coli) aisladas de un paciente sueco que requirió tratamiento en un hospital de Nueva Delhi (India)1 y a las que posteriormente se añadieron otras 22 cepas procedentes de Bombay (India)2, produciéndose la primera muerte achacable a la infección causada por un microorganismo productor de NDM-1 en 20103.
A lo largo de 2011 se multiplican las publicaciones con referencia a descripciones de enterobacterias, singularmente E. coli, portadoras de blaNDM-1, produciéndose una dispersión global extremadamente rápida de NDM-1.
Presentamos un nuevo caso de colonización por K. pneumoniae portadora de NDM-1 en nuestro país.
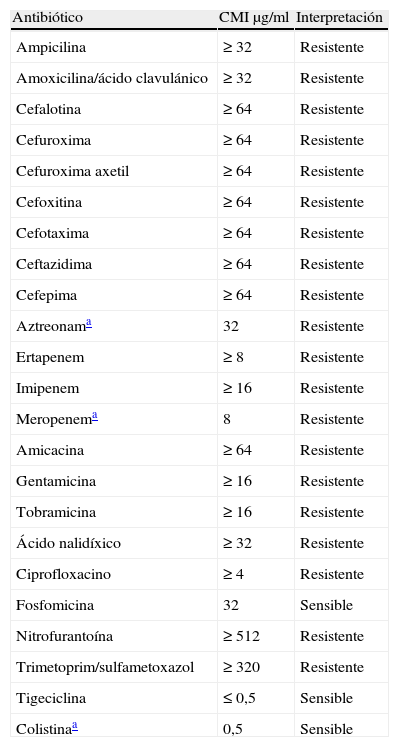
Un niño de 3 meses de edad, nacido en un hospital de Bombay (India), que fue adoptado, junto a su hermana gemela, por padres españoles, ingresó en la Unidad de Neonatología de nuestro hospital para confirmar un diagnóstico prenatal de hidronefrosis. En un urocultivo precistografía se obtuvo el crecimiento de más de 105UFC/ml de K. pneumoniae con un patrón de sensibilidad que se expresa en la tabla 1 (Vitek2®, bioMerieux, Francia).
Sensibilidad de la cepa aislada de Klebsiella pneumoniae portadora de NDM-1
| Antibiótico | CMI μg/ml | Interpretación |
| Ampicilina | ≥ 32 | Resistente |
| Amoxicilina/ácido clavulánico | ≥ 32 | Resistente |
| Cefalotina | ≥ 64 | Resistente |
| Cefuroxima | ≥ 64 | Resistente |
| Cefuroxima axetil | ≥ 64 | Resistente |
| Cefoxitina | ≥ 64 | Resistente |
| Cefotaxima | ≥ 64 | Resistente |
| Ceftazidima | ≥ 64 | Resistente |
| Cefepima | ≥ 64 | Resistente |
| Aztreonama | 32 | Resistente |
| Ertapenem | ≥ 8 | Resistente |
| Imipenem | ≥ 16 | Resistente |
| Meropenema | 8 | Resistente |
| Amicacina | ≥ 64 | Resistente |
| Gentamicina | ≥ 16 | Resistente |
| Tobramicina | ≥ 16 | Resistente |
| Ácido nalidíxico | ≥ 32 | Resistente |
| Ciprofloxacino | ≥ 4 | Resistente |
| Fosfomicina | 32 | Sensible |
| Nitrofurantoína | ≥ 512 | Resistente |
| Trimetoprim/sulfametoxazol | ≥ 320 | Resistente |
| Tigeciclina | ≤ 0,5 | Sensible |
| Colistinaa | 0,5 | Sensible |
Ante el dato epidemiológico del nacimiento del paciente en el subcontinente indio, se investigó la presencia de carbapenemasas, llevándose a cabo el test de Hodge modificado, que resultó positivo usando meropenem y ertapenem. Por otro lado, se empleó una técnica disco-placa y tiras de E-test en presencia de EDTA para la detección de MLB. Las zonas de inhibición en el primer caso se incrementaban en más de 8mm cuando el disco incluía imipenem/EDTA sobre los halos que presentaba el disco de imipenem solo. En el segundo caso, se demostraba una marcada elipse de inhibición alrededor de la tira de imipenem/EDTA. Finalmente, iniciadores específicos para el gen blaNDM-1 y la secuenciación posterior confirmaron la presencia del mismo, con la presencia añadida de una betalactamasa de espectro extendido, SHV-31 y una acetiltransferasa tipo AAC-6′ (Centro Nacional de Microbiología).
Aunque el recuento bacteriano en el urocultivo fue elevado, la ausencia de datos clínicos y un urocultivo posterior, que resultó negativo, indujeron a su consideración como colonización, no implantándose tratamiento antimicrobiano. Dos semanas más tarde se realizaron controles epidemiológicos dirigidos tanto al propio paciente como a su hermana gemela, utilizando placas de Mueller-Hinton con 8mg/l de imipenem, obteniéndose el crecimiento de K. pneumoniae en los coprocultivos con las mismas características fenotípicas que el primer aislamiento. En otros 2 controles posteriores no se aisló ninguna cepa productora de NDM-1.
No se pudo realizar el control epidemiológico ni en los padres adoptivos ni en los biológicos. En estos momentos, continúa el estudio de identidad molecular de las diferentes cepas aisladas.
En España, hasta el momento, solo existen 2 descripciones en la literatura. La primera, en 2011, de un paciente español con un cuadro diarreico tras un viaje a India y asistencia sanitaria en aquel país en el que a su regreso se aisló en el coprocultivo una cepa de E. coli portadora de un cointegrado con, al menos, 2 plásmidos que incluían los genes blaNDM-1 y blaCTX-M-154. La segunda, en 2012, de un paciente español con un absceso abdominal, producido por una K. pneumoniae productora de NDM-1, posterior a una hospitalización en la India por un cuadro de apendicitis perforada y peritonitis5.
El tratamiento de estas infecciones resulta extremadamente problemático. Hasta el momento solo colistina y/o tigeciclina se han empleado en estos casos, aunque la falta de información sobre su eficacia clínica convierten en azarosas estas actuaciones6.También se ha sugerido la posibilidad de tratamiento combinado con aztreonam y un nuevo inhibidor de betalactamasas, Avibactam®7–8.
Las medidas de control y detección de los microorganismos portadores de estas enzimas debe considerarse una actitud prioritaria ya que la aparición de sujetos colonizados ocasionalmente por estas cepas en una unidad clínica, como ha sido descrita recientemente en Israel, hace posible su presencia en sujetos que carezcan del antecedente epidemiológico de viaje al subcontinente indio9. Desde nuestro punto de vista, como microbiólogos clínicos, queremos resaltar la importancia en este terreno de una valoración cuidadosa del antibiograma en aquellas enterobacterias que presenten patrones de resistencia significativos, para poder proceder a técnicas fenotípicas específicas, aunque no definitivas, al alcance de la mayoría de los laboratorios clínicos6, como el test de Hodge modificado, las técnicas de difusión doble disco o el empleo de tiras de gradiente de difusión con quelantes, que sirvan para establecer una sospecha fundada en el diagnóstico temprano de estas situaciones y permitan posteriormente llevar a cabo otros métodos moleculares para confirmar definitivamente la identidad de estos determinantes de resistencia.
Agradecemos al Laboratorio de Antibióticos del Centro Nacional de Microbiología, Instituto de Salud Carlos III, Majadahonda, Madrid, España. (Dr.J. Campos, Dr. J. Oteo) la caracterización molecular del aislamiento.