El diagnóstico de la infección por el virus de la hepatitis C (VHC) en ocasiones es un hallazgo fortuito, sobre todo en el ámbito de la atención primaria (AP). En las pruebas de cribado de anticuerpos anti-VHC se aconseja la utilización de pruebas complementarias para confirmar las muestras positivas, excepto en los sueros marcadamente reactivos1. Los algoritmos diagnósticos utilizan varias pruebas (cribado, confirmatorias, moleculares)2 que retrasan semanas e incluso meses el informe definitivo. Recientemente ha salido al mercado una nueva prueba de detección de Ag de VHC en muestras de suero o plasma que utiliza la misma plataforma ARCHITECT empleada para la determinación de anticuerpos anti VHC; según algunos autores la incorporación de esta técnica puede suponer un cambio en el enfoque diagnóstico de la infección por el VHC3,4.
El objetivo del presente estudio ha sido evaluar la aportación de la prueba Architect HCV core Ag assay® (Abbott Diagnostics, Alemania) en el diagnóstico de la infección naïve por el VHC.
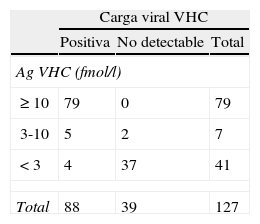
Durante los meses de abril a septiembre de 2011 se diagnosticaron serológicamente 140 nuevos casos de infección por VHC en pacientes procedentes de AP. Sobre la misma muestra clínica se realizó la determinación de Ag VHC. Por otro lado, con el fin de establecer la especificidad y la sensibilidad de la técnica de detección de Ag VHC, se analizaron 127 muestras procedentes de pacientes infectados, a las que previamente se les había determinado la carga viral VHC.
Del total de pacientes de AP (n=140), la técnica de Ag VHC fue positiva (>10fmol/l) en 93 casos, negativa (<3fmol/l) en 43 e indeterminada (3-10fmol/l) en 4 casos.
Respecto a los sueros de pacientes infectados (n=127), detectamos que 4 muestras con carga viral VHC (CV) entre 550-1.950UI/ml presentaron un resultado de Ag VHC negativo y 5 con CV 539-3.320UI/ml mostraron un resultado indeterminado; todas las muestras con niveles de Ag VHC>10fmol/l presentaron CV detectables. La interpretación de la técnica indica que reactividades por debajo de 3fmol/l deben considerarse negativas, y que las situadas entre entre 3 y 10fmol/l deben ser confirmadas. Si nosotros tomamos como punto de corte 10fmol/l encontramos una especificidad del 100% (IC95: 88,8-99,7) y una sensibilidad del 89,8% (IC95: 81,0-94,9), VPP del 100% (IC95: 88,8-99,8) y VPN del 81,25% (IC95: 66,9-90,6) frente a la detección de ARN VHC (tabla 1).
Antígeno VHC frente a carga viral en pacientes (n=127) con infección por virus de la hepatitis C
| Carga viral VHC | |||
| Positiva | No detectable | Total | |
| Ag VHC (fmol/l) | |||
| ≥ 10 | 79 | 0 | 79 |
| 3-10 | 5 | 2 | 7 |
| < 3 | 4 | 37 | 41 |
| Total | 88 | 39 | 127 |
Especificidad del 100% (IC95: 88,8-99,7) y sensibilidad del 89,8% (IC95: 81,0-94,9), VPP del 100% (IC95: 88,8-99,8) y VPN del 81,25% (IC95: 66,9-90,6) (umbral de positividad de AgVHC=10fmol/l).
Según algunos trabajos, niveles de 3-10fmol/l de antígeno se corresponden con 500-3.000UI/ml VHC RNA3, planteándonos el interrogante de si esta sensibilidad analítica es suficiente para el diagnóstico en pacientes naïve. Para responder a ello, revisamos nuestra base de datos de carga viral basal de los últimos pacientes (n=84) procedentes de AP diagnosticados de infección activa por VHC (datos no presentados) y comprobamos que ninguno tuvo una carga viral basal inferior a 3.000UI/ml, datos en concordancia con los descritos en estudios anteriores5,6.
Para diferenciar entre infección activa (crónica o aguda) e infección resuelta, normalmente los pacientes con anticuerpos anti VHC se remiten a atención especializada (AE), desde donde se continúa la investigación mediante técnicas moleculares (carga viral basal y genotipado) para posteriormente valorar la instauración de tratamiento. La demora media, según datos extraídos de 27 historias clínicas recientes de nuestros pacientes, es de 18 semanas (rango 11-40). Cada paciente genera una carga asistencial de 2 consultas de AE. Según nuestros resultados, el 30% de estas consultas las originarían pacientes con infección resuelta que además se han sometido a una angustia innecesaria.
El coste aproximado de una prueba de detección de Ag VHC es de 15euros, y el de una carga viral VHC, de 55euros. En nuestra serie, el gasto originado por la detección de AgVHC (140pacientes) hubiera sido de 2.100euros; se habrían descartado 43 pacientes con infección resuelta a los que no habría que hacerles determinación de CV VHC, generando un ahorro superior (2.365 euros), lo que mejoraría nuestra eficiencia.
Kesli et al.7 describen para esta técnica una especificidad del 100% y una sensibilidad del 96,3% respecto a la técnica de PCR; debido a que la sensibilidad no es del 100%, creemos que ante una alta sospecha clínico-epidemiológica de infección VHC sería aconsejable utilizar técnicas de biología molecular.
En resumen, creemos que la técnica de determinación de Ag VHC podría encajar en el algoritmo inicial del diagnóstico de hepatitis C, ofreciendo como grandes ventajas utilizar la misma muestra clínica que las pruebas serológicas y el mismo equipamiento; esto reduciría los tiempos de respuesta y evitaría, inicialmente, las técnicas moleculares que no están al alcance de todos. Desde el punto de vista asistencial mejoraría la gestión de consultas en AE y eliminaría angustias innecesarias a los pacientes.