De entre los pacientes con hepatitis C crónica, la coinfección con el virus de la inmunodeficiencia humana (VIH) implica una mayor dificultad en el tratamiento debido a su asociación con una mayor progresión del daño hepático y menor respuesta al tratamiento estándar1. La aprobación en 2011 de los nuevos inhibidores de la proteasa (IP) del virus de la hepatitis C (VHC) boceprevir (BOC) y telaprevir (TVR) para infección por genotipo 1 supone un cambio en el manejo de la infección por VHC, ya que su asociación a interferón pegilado y ribavirina (PEG-RBV) ha incrementado las tasas de respuesta viral sostenida (RVS) hasta un 68-75% en pacientes naïve y un 60-65% en pacientes pretratados2-5.
A pesar de que el BOC y el TVR todavía no están aprobados para pacientes coinfectados, los resultados de estudios en fase 2 han descrito beneficios similares en este subgrupo de pacientes6,7. Sin embargo, uno de los inconvenientes de estos IP es el gran potencial de interacciones que presentan con la medicación antirretroviral, dando lugar con frecuencia a interacciones impredecibles cuyo mecanismo no se ha establecido claramente. Por otro lado, dada su capacidad de inhibición potente del CYP3A4, presentan riesgo de aumentar la toxicidad de otros fármacos que sean sustrato de esta enzima8,9.
Con el objetivo de analizar la prevalencia de las interacciones potenciales entre un posible tratamiento con BOC o TVR y el tratamiento antirretroviral (TAR) en los pacientes coinfectados se realizó un estudio en un hospital universitario de tercer nivel. Se recogieron de forma retrospectiva todos los pacientes coinfectados por VIH y VHC genotipo 1 tratados con PEG-RBV entre los años 2003 y 2011.
Se realizó una búsqueda bibliográfica en Medline (Pubmed) introduciendo las palabras clave «boceprevir», «telaprevir», «anti-retroviral agents» y «drug interactions». Adicionalmente, se revisaron los abstracts disponibles a través de la American Association for the Study of Liver Diseases (AASLD) y la European Association for the Study of the Liver (EASL), las fichas técnicas de BOC y TVR actualizadas por la European Medicine Agency (EMA) y los ensayos clínicos a través de la base de datos clinicaltrial.gov.
Un total de 109 pacientes coinfectados se trataron para el VHC durante el periodo estudiado, de los cuales se excluyeron 32 (29,4%) por haber alcanzado la RVS y 11 (10,9%) por fallecimiento o pérdida de seguimiento. Los restantes 66 pacientes fueron incluidos en el estudio. La edad media fue de 49 años (rango: 28-70), y 52 (78,8%) eran hombres. Un total de 35 (53%) pacientes había presentado respuesta nula al tratamiento previo con PEG-RBV. Asimismo, 56 (84,8%) pacientes presentaron el ARN-VIH indetectable (<50copias/ml) y el resto inferior a 1.000copias/ml. Un total de 24 (36,2%) presentaba fibrosis significativa o avanzada (índice de Ishak: 3-6) en el momento del diagnóstico.
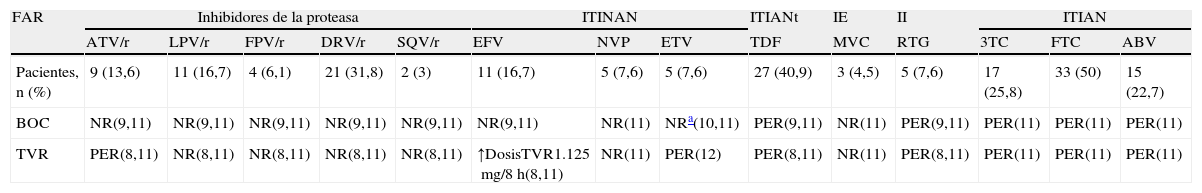
Al analizar el manejo del TAR tras la introducción de una potencial triple terapia se observó que, en caso de iniciar terapia triple con BOC, 62 (93,9%) de los pacientes presentarían como mínimo una asociación no recomendada. En el caso de utilizar TVR, los pacientes con asociación no recomendada serían 44 (66,7%) (p<0,001). Las interacciones potenciales de BOC y TVR con los fármacos antirretrovirales de la cohorte estudiada y el número de pacientes en tratamiento con cada fármaco aparecen en la tabla 1.
Pacientes en tratamiento con cada uno de los fármacos antirretrovirales e interacción descrita con boceprevir y telaprevir8-12
| FAR | Inhibidores de la proteasa | ITINAN | ITIANt | IE | II | ITIAN | ||||||||
| ATV/r | LPV/r | FPV/r | DRV/r | SQV/r | EFV | NVP | ETV | TDF | MVC | RTG | 3TC | FTC | ABV | |
| Pacientes, n (%) | 9 (13,6) | 11 (16,7) | 4 (6,1) | 21 (31,8) | 2 (3) | 11 (16,7) | 5 (7,6) | 5 (7,6) | 27 (40,9) | 3 (4,5) | 5 (7,6) | 17 (25,8) | 33 (50) | 15 (22,7) |
| BOC | NR(9,11) | NR(9,11) | NR(9,11) | NR(9,11) | NR(9,11) | NR(9,11) | NR(11) | NRa(10,11) | PER(9,11) | NR(11) | PER(9,11) | PER(11) | PER(11) | PER(11) |
| TVR | PER(8,11) | NR(8,11) | NR(8,11) | NR(8,11) | NR(8,11) | ↑DosisTVR1.125mg/8h(8,11) | NR(11) | PER(12) | PER(8,11) | NR(11) | PER(8,11) | PER(11) | PER(11) | PER(11) |
ABV: abacavir; ATV/r: atazanavir/ritonavir; BOC: boceprevir; DRV/r: darunavir/ritonavir; EFV: efavirenz; ETV: etravirina; FAR: fármacos antirretrovirales; FPV/r: fosamprenavir/ritonavir; FTC: emtricitabina; IE: inhibidor entrada; II: inhibidor integrasa; ITIAN: inhibidor de la transcriptasa inversa nucleósido; ITIANt: inhibidor de la transcriptasa inversa nucleótido; ITINAN: inhibidores de la transcriptasa inversa no nucleósidos; LPV/r: lopinavir/ritonavir; MVC: maraviroc; NR: asociación no recomendada; NVP: nevirapina; PER: asociación permitida; RTG: raltegravir; SQV/R: saquinavir/ritonavir; TDF: tenofovir; 3TC: lamivudina,TVR: telaprevir.
En 18 (27,3%) de los pacientes, el manejo sería diferente en caso de introducir BOC o TVR. Dada la potencial interacción con atazanavir (ATV), efavirenz (EFV) y etravirina (ETV) no se recomienda la asociación con BOC, mientras que su asociación con TVR está permitida. Solo 4 (6,1%) pacientes cuyo TAR incluía ITIAN, raltegravir o tenofovir no requerirían cambio de tratamiento al iniciar BOC o TVR.
El análisis de la prevalencia de interacciones potenciales derivadas del tratamiento con BOC o TVR en pacientes coinfectados en tratamiento antirretroviral ha mostrado la necesidad de sustitución de algún componente del TAR, debido a la presencia de alguna interacción que contraindicaría su uso, en la mayoría de los pacientes incluidos en el estudio. Además, el porcentaje de pacientes que requerirían modificación de algún fármaco sería significativamente mayor para BOC que para TVR.
Los IP del VIH fueron los fármacos más implicados en las asociaciones no recomendadas, tanto para BOC como para TVR. Por el momento, y a la espera de nuevos datos, solo se permite la asociación de TVR con ATV junto a una monitorización estrecha de los niveles de bilirrubina8. No obstante, la administración de BOC con ATV podría considerarse de forma individualizada en los casos en los que fuera estrictamente necesario9.
Los ITINAN inducen el metabolismo de BOC y TVR a nivel del CYP3A48,9. No se recomienda la administración de EFV junto con BOC, mientras que la asociación de TVR con EFV requiere un aumento en la dosis del IP, lo cual supone un incremento considerable del coste8,9. La administración de ETV con TEL no produce una interacción significativa y se ha observado una disminución en los niveles de ETV del 25% al asociarla a BOC, aunque su relevancia clínica no está establecida10.
El número de estudios disponibles es limitado, por lo que las recomendaciones establecidas en cuanto al manejo de estas interacciones son muy restrictivas ante la ausencia de datos11. Además, no siempre se puede predecir el resultado de acuerdo a las características farmacocinéticas de los fármacos implicados.
La reducción observada en los niveles de BOC al ser administrado junto con algunos IP del VIH no se asoció a una disminución en la tasa de respuesta viral en la semana 12 post-tratamiento BOC7,9. Ello sugiere la necesidad de analizar en profundidad la relación entre las concentraciones plasmáticas y el resultado clínico para optimizar las probabilidades de obtención de la RVS, evitar fracasos del TAR y minimizar la toxicidad farmacológica.
En conclusión, dada la multitud de cambios de TAR que sería necesario realizar a priori con los datos de que disponemos en la actualidad, es fundamental determinar la relevancia de estas interacciones, con el fin de realizar cambios farmacológicos únicamente en los pacientes en los que sea imprescindible.