La paracoccidioidomicosis es una micosis sistémica causada por Paracoccidioides brasiliensis, hongo dimorfo endémico en América Central y del Sur. El diagnóstico precoz es fundamental en la evolución de estos pacientes, ya que el retraso terapéutico aumenta la mortalidad, y puede llegar al 30% en las formas sistémicas1. Presentamos un caso de paracoccidioidomicosis diagnosticado en nuestro hospital y revisamos los casos publicados en España en los últimos 20 años (tabla 1).
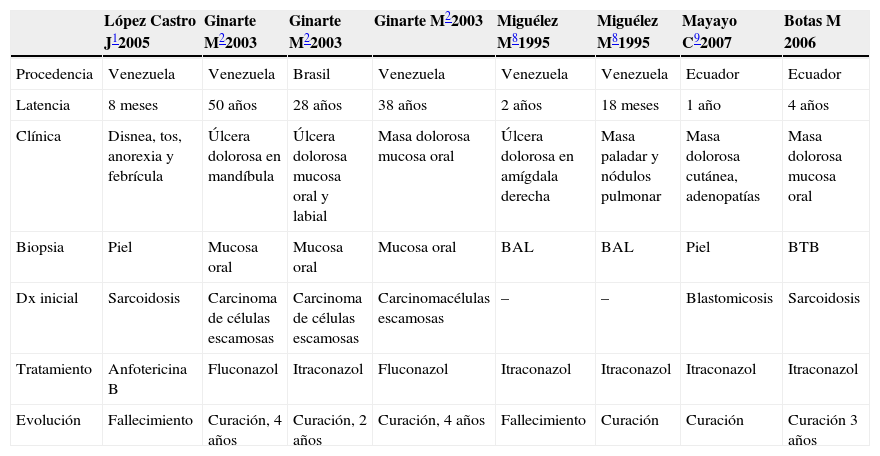
Características de los casos publicados en España
| López Castro J12005 | Ginarte M22003 | Ginarte M22003 | Ginarte M22003 | Miguélez M81995 | Miguélez M81995 | Mayayo C92007 | Botas M 2006 | |
| Procedencia | Venezuela | Venezuela | Brasil | Venezuela | Venezuela | Venezuela | Ecuador | Ecuador |
| Latencia | 8 meses | 50 años | 28 años | 38 años | 2 años | 18 meses | 1 año | 4 años |
| Clínica | Disnea, tos, anorexia y febrícula | Úlcera dolorosa en mandíbula | Úlcera dolorosa mucosa oral y labial | Masa dolorosa mucosa oral | Úlcera dolorosa en amígdala derecha | Masa paladar y nódulos pulmonar | Masa dolorosa cutánea, adenopatías | Masa dolorosa mucosa oral |
| Biopsia | Piel | Mucosa oral | Mucosa oral | Mucosa oral | BAL | BAL | Piel | BTB |
| Dx inicial | Sarcoidosis | Carcinoma de células escamosas | Carcinoma de células escamosas | Carcinomacélulas escamosas | – | – | Blastomicosis | Sarcoidosis |
| Tratamiento | Anfotericina B | Fluconazol | Itraconazol | Fluconazol | Itraconazol | Itraconazol | Itraconazol | Itraconazol |
| Evolución | Fallecimiento | Curación, 4 años | Curación, 2 años | Curación, 4 años | Fallecimiento | Curación | Curación | Curación 3 años |
BAL: lavado broncoalveolar; BTB: biopsia transbronquial; Dx inicial: diagnóstico inicial al ingreso, que posteriormente se demostró que era erróneo (en ningún caso la paracoccidioidomicosis se consideró como dignóstico inicial).
Varón de 43 años, natural de Ecuador, que acudió por tos, febrícula, pérdida de peso y masa retromolar izquierda que se biopsia. En la analítica se observó elevación de reactantes de fase aguda y en la radiografía de tórax, 2 nódulos milimétricos en ambos lóbulos superiores. La anatomía patológica de las biopsias de tejido retromolar se informó como granulomatosis no caseificante plasmocelular, y los cultivos (hongos y micobacterias) fueron negativos. La gammagrafía con galio mostró captación supraclavicular izquierda e hiliar bilateral. Ante la sospecha de sarcoidosis se inició tratamiento con corticoides, con mejoría inicial y empeoramiento posterior a la clínica. En la fibrobroncoscopia se observó mucosa edematizada y desaparición de la glotis y de los cartílagos aritenoides. Se tomaron nuevas biopsias en las que se identificó, mediante tinción de plata metenamina y Gomori-Grocott, P. brasiliensis. En el examen en fresco de las muestras de esputo y de tejido retromolar se observaron levaduras con morfología de P. brasiliensis, y en los cultivos en agar glucosado de Sabouraud se aisló su crecimiento. La serología para P. brasiliensis resultó positiva. El diagnóstico final fue paracoccidioidomicosis sistémica con afectación oral, laríngea y pulmonar. Se pautó itraconazol oral durante 9 meses, con mejoría clínica y desaparición de las lesiones orales y laríngeas.
La paracoccidioidomicosis es la micosis más prevalente en América del Sur2, sobre todo en Brasil3, donde la tasa de infecciones subclínicas supera el 60%4 y la incidencia de la enfermedad es de 1–3/1.000 habitantes4. El P. brasiliensis es un hongo dimorfo que, a temperatura ambiente, crece como colonias blancas filamentosas, y entre 35 y 37°C, en colonias cremosas cerebriformes. Al microscopio óptico se observan levaduras multigemantes4. El hombre es el único huésped susceptible de desarrollar la enfermedad4. La vía de transmisión es la inhalación de conidias4, que se transforman en levaduras en los tejidos; el contagio directo mucoso también se ha descrito, pero no la transmisión de persona a persona4, aunque la inmigración está produciendo un aumento de la incidencia. La infección se produce habitualmente antes de los 20 años2, aunque el período de latencia es muy prolongado, incluso más de 60 años4. Se ha establecido una clasificación de los estadios clínicos en5: 1) infección: jóvenes sanos, test cutáneos positivos; 2) enfermedad: aguda/subaguda (jóvenes de ambos sexos con inmunodepresión celular) y crónica (adultos varones, con afectación pulmonar, linfática y orofaríngea), y 3) enfermedad residual. Las formas crónicas afectan, fundamentalmente, a varones (30:1), de raza blanca, trabajadores del campo3, ya que se ha demostrado que los estrógenos inhiben in vitro la transformación a levaduras4. Las manifestaciones sistémicas más frecuentes6 son pérdida de peso (70,6%), clínica orofaríngea (59,5%), adenopatías (55,2%), tos (50,7%) y fiebre (45,5%). Para el diagnóstico es imprescindible la biopsia de la lesión. En el examen en fresco la tinción de Gomori-Grocott o plata metenamina7 es de elección, que identifican “imágenes en rueda de timón”3 características, que representan el hongo en multigemación. Para cultivo, el agar glucosado de Sabouraud es preferible al agar sangre, aunque su crecimiento es muy lento7. La serología es útil y facilita el diagnóstico precoz. La inmunoelectroforesis es la técnica más sensible (95,6%) y específica (100%)7. El tratamiento más efectivo son los antifúngicos azólicos, de elección el itraconazol (200mg/día, 6 meses), con buena respuesta4. La mortalidad en formas sistémicas puede alcanzar el 30%1, sobre todo si existe retraso en el diagnóstico.
En conclusión, queremos destacar que ante un cuadro de afectación granulomatosa de vías respiratorias o cutánea en un paciente procedente de zona endémica, debemos incluir la paracoccidioidomicosis en el diagnóstico diferencial de infecciones granulomatosas.