Varón de 62 años, pastor de profesión, bebedor de medio litro de vino al día y ex fumador desde hace 6 meses de 45 paquetes/año, sin otros antecedentes personales de interés, que acude a urgencias por un cuadro de anorexia de 2 semanas de evolución, sensación febril no termometrada, y cuadro de tos y expectoración no hemoptoica, que no había mejorado con tratamiento con amoxicilina-clavulánico.
A la exploración física en el servicio de urgencias, el paciente presentaba una temperatura de 39,7°C, presión arterial de 110/60mmHg. Eupneico y sudoroso. No se palpaban masas ni megalias. A la auscultación el paciente presentaba disminución generalizada del murmullo vesicular. El resto de la exploración fue normal.
La analítica de urgencia presentó los siguientes valores: leucocitos 6.800/ml con fórmula normal; hemoglobina 13,4g/dl; hematíes 4,6millones/ml; VCM 86,8; plaquetas 450.000/ml; glucosa 115; creatinina 1,3, y coagulación con valores dentro de la normalidad.
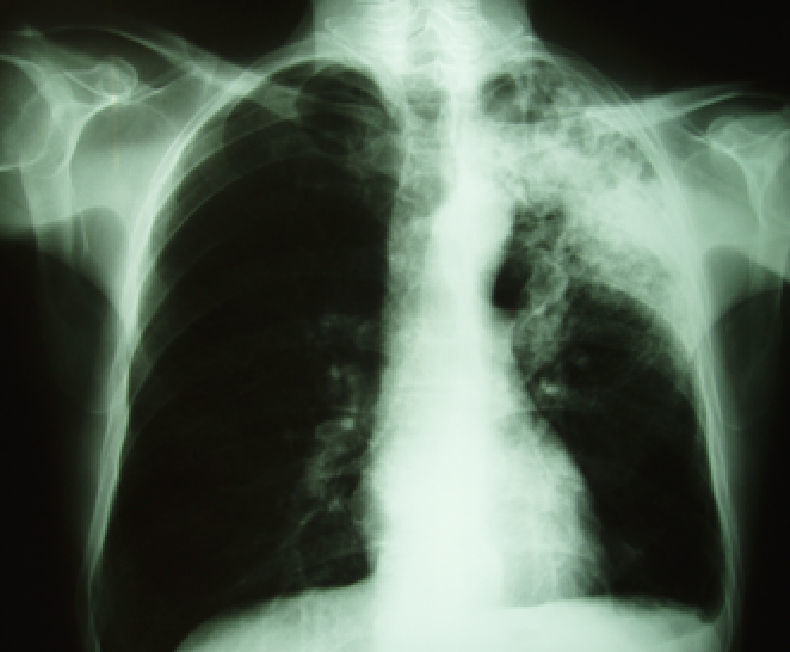
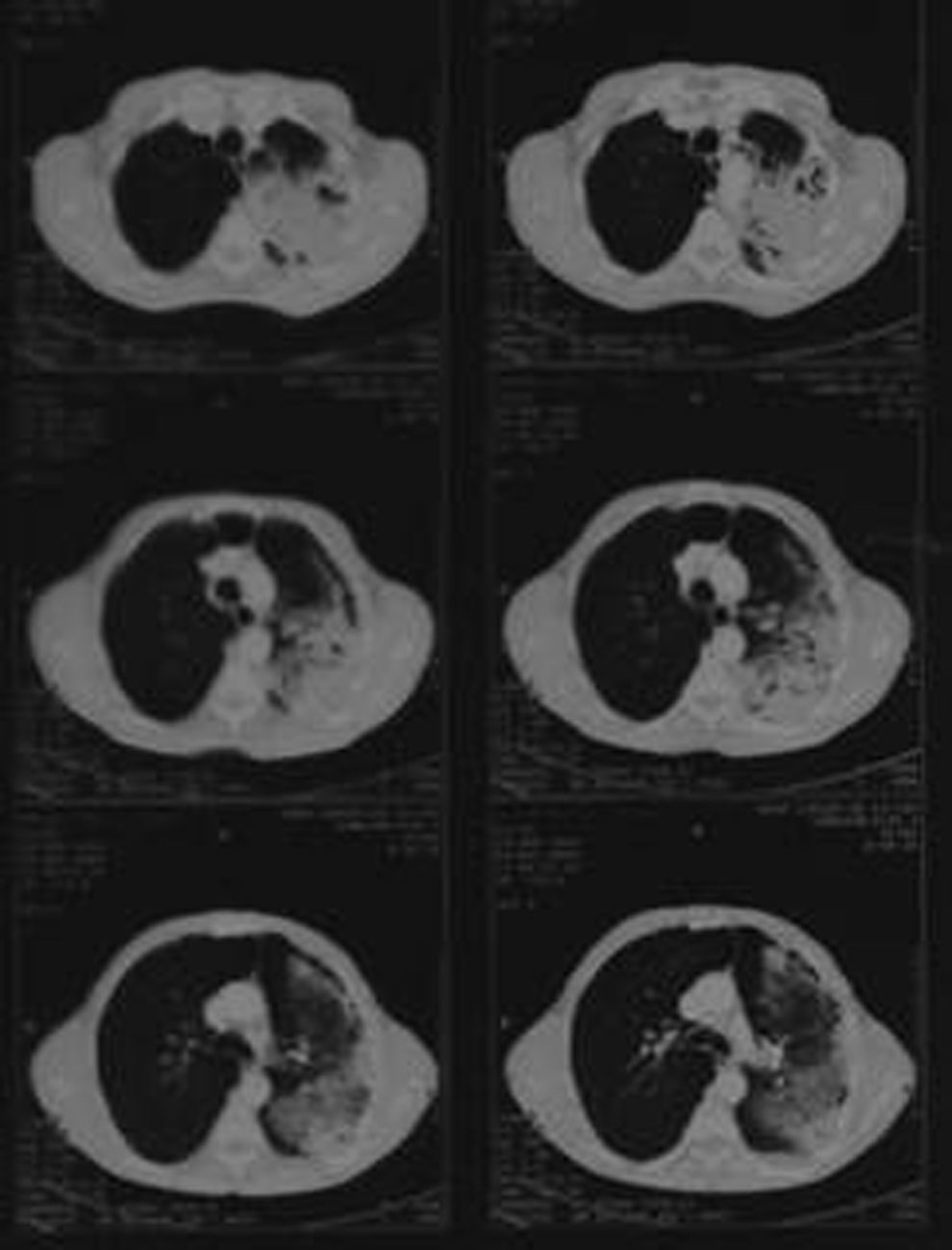
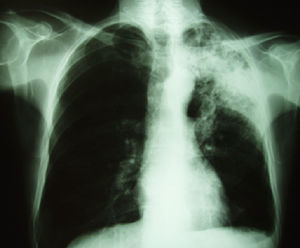
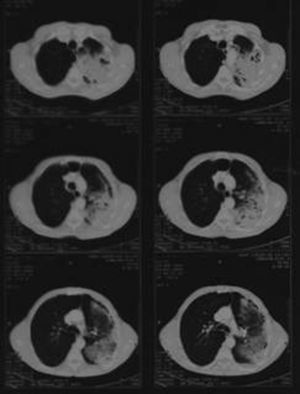
En la placa de tórax se observó una imagen de consolidación en el lóbulo superior izquierdo así como en la tomografía computarizada que se realizó durante el ingreso (figs. 1 y 2).
Los antígenos de Legionella y neumococo en orina fueron negativos, así como las serologías frente al virus de la inmunodeficiencia humana y perfil respiratorio que se realizó posteriormente y que incluía anticuerpos frente Chlamydophila pneumoniae, Mycoplasma pneumoniae y Coxiella burnetti.
En la tinción de auramina del esputo se observaron bacilos ácido-alcohol resistentes, por lo que se instauró tratamiento con tuberculostáticos: rifampicina, isoniacida y pirazinaminda.
EvoluciónEn el cultivo del esputo para micobacterias se obtuvo crecimiento. La cepa se envió al centro de referencia de Majadahonda, que identificó la micobacteria como Mycobacterium caprae por medio de técnicas de biología molecular.
La identificación se realizó en 3 pasos: a) PCR-RFLP del gen gyrB con la enzima RsaI1. Se obtuvieron 2 fragmentos de 480/360pb, patrón compartido por las especies M. bovis, M. caprae y M. bovis-BCG; b) PCR múltiple para determinar la presencia o ausencia de la región RD1, según el protocolo descrito por Talbot et al2 en 1997. El tamaño del amplificado fue de 150pb que indica la no deleción de esa región característica descrita en M. bovis y M. caprae; c) PCR-RFLP del gen gyrB con la enzima SacII1. Tras la digestión se obtuvieron 2 fragmentos de 780/240pb, patrón específico de la especie M. caprae. En las cepas de M. bovis no se produce digestión, por lo que genera un solo fragmento de 1.020pb.
En el estudio de sensibilidad antibiótica, la cepa resultó ser resistente a pirazinamida, lo que se confirmó mediante la secuenciación del gen pncA, y se encontró la mutación H57D. Esto hizo que se cambiara en el tratamiento la pirazinamida por etambutol, a pesar de que la evolución clínica del paciente estaba siendo favorable.
DiagnósticoTuberculosis pulmonar por M. caprae.
ComentarioM. caprae, recientemente definido como parte del complejo M. tuberculosis, es causa conocida de tuberculosis en animales3. En algunas ocasiones puede producir enfermedad en humanos, como se ha descrito en algunos países europeos4.
En su descripción inicial M. caprae fue incluida como subespecie de M. bovis, posteriormente se reconoció su diferencia molecular y se englobó directamente como miembro del complejo M. tuberculosis que incluye M. tuberculosis, M. bovis, M. caprae, M. africanum, M. microti y M. pinnipedii.
El cuadro clínico es análogo al producido por M. tuberculosis. En humanos se han descrito diferentes formas clínicas: pulmonar, linfática, urinaria, lupus vulgar y pericarditis4–7.
En un estudio retrospectivo realizado por Gutiérrez et al8 en España, se determinó por medio de spoligotyping que 3 de 112 cepas de M. bovis aisladas en humanos correspondían al genotipo caprino. Esto sugiere que algunas de las cepas identificadas como M. bovis, hasta la definición de M. caprae, podían corresponder realmente a esta especie.
Los aislados en animales tienen distintos orígenes y se ha aislado M. caprae en animales de granja, animales salvajes y en zoológicos9.
En gran parte de los casos en humanos descritos en la bibliografía se ha encontrado el antecedente epidemiológico de contacto con ganado o la ingesta de leche sin tratar, aunque en otros casos no se ha descrito el vínculo con animales10. Es muy probable que la infección de nuestro paciente se produjera a través de su exposición al ganado debida a su ocupación. La importancia en la epidemiología de esta enfermedad hace que la identificación molecular de los aislados sea fundamental para identificar la cadena infectiva, así como la detección de ganado infectado.