Describir el tiempo trascurrido desde el diagnóstico de la infección por el VIH hasta el inicio del seguimiento clínico en España y estimar los factores asociados al inicio de seguimiento correcto.
MétodosSe calculó la distribución del intervalo entre las fechas del diagnóstico de VIH y la primera determinación de CD4 (considerada la fecha de inicio de seguimiento) entre los nuevos diagnósticos notificados en 2010 en las 7 comunidades autónomas participantes. Se consideró «inicio correcto» si este intervalo era < 3 meses. Se estimaron mediante regresión logística los factores asociados al inicio correcto.
ResultadosDe los 1.769 nuevos diagnósticos del 2010, el 83,1% inició seguimiento en el primer año tras el diagnóstico y el 75,7% antes de 3 meses. Los usuarios de drogas inyectadas (UDI) tuvieron una probabilidad de inicio correcto significativamente menor (OR = 0,3; IC del 95%, 0,2-0,6).
ConclusiónEn España, el inicio del seguimiento clínico tras el diagnóstico de VIH se hace en un tiempo razonable, pero hay margen de mejora y los UDI están en desventaja.
To describe linkage to care among new HIV diagnoses in Spain; and to estimate factors associated to linkage to care within three months after diagnosis.
MethodsThe distribution of the time elapsing between the date of HIV diagnosis and the date of first determination of CD4 (considered to be the date of linkage to care) was calculated among new HIV diagnoses in 2010 in the seven Autonomous Regions participating, where data on date of CD4 count was available. Linkage to care was considered «correct» if done within three months after diagnosis. Factors associated to correct linkage to care were estimated using logistic regression.
ResultsA total of 1769 new HIV diagnoses were included. Of them, 83.1% had evidence of linkage to care within a year, and 75.7% were linked within three months after diagnosis. Being an injectable drug user (IDU) was the only factor inversely associated with linkage to care within 3 months (OR = 0.3; 95% CI: 0.2-0.6).
ConclusionIn Spain linkage to care after HIV diagnosis is good, but there is still room for improvement, especially among IDUs.
El diagnóstico temprano de las personas infectadas por VIH y su correcto seguimiento y tratamiento son esenciales en el control de la epidemia. Los pacientes diagnosticados tardíamente presentan mayor morbimortalidad y requieren más recursos que los que se identifican pronto; además, causan más episodios de transmisión, ya que no utilizan medidas de prevención al desconocer su infección y no se benefician de la reducción de la transmisión generada por la administración de tratamiento antirretroviral, que llega a ser del 96%1–4. Basándose en estos hechos, se ha propugnado que con la llamada estrategia «Detectar y tratar» («Test and Treat» en inglés) es posible controlar la epidemia de VIH5.
Según los datos del Sistema de Información de Nuevos Diagnósticos de VIH (SINIVIH), un 29 y un 46,5% de los nuevos diagnósticos de VIH realizados en 2011 en España presentaron, respectivamente, enfermedad avanzada y retraso diagnóstico6. Tanto en españoles como en inmigrantes, la enfermedad avanzada se asocia a ser varón, mayor de 30 años y haber adquirido la infección por compartir material para inyección de drogas o por mantener relaciones heterosexuales sin protección7.
Al igual que en otros países, la reducción del diagnóstico tardío es una prioridad en España8. Sin embargo, de nada sirve acelerar el diagnóstico si las personas diagnosticadas no acceden al seguimiento clínico y al tratamiento lo antes posible9. En los estudios publicados sobre el inicio de seguimiento, se considera generalmente que este debería producirse no más tarde de 3 meses tras el diagnóstico y para estimar ese intervalo, en la mayoría de casos, se ha calculado el tiempo transcurrido entre el diagnóstico de VIH y la primera determinación de CD4 o carga viral10,11.
En España, no existen estimaciones del tiempo que tardan las personas diagnosticadas de VIH en iniciar el seguimiento clínico. El SINIVIH recoge tanto la fecha de diagnóstico de VIH, como la de la primera determinación de la cifra de linfocitos CD4, por lo que es una fuente ideal para obtener esta información en nuestro país y monitorizar su evolución temporal.
El objetivo de este trabajo es describir, a partir de los datos del SINIVIH, el tiempo que transcurre desde el diagnóstico de la infección por el VIH hasta que se inicia el seguimiento en España en 2010 y estimar los factores asociados al inicio de seguimiento antes de 3 meses tras el diagnóstico.
MetodologíaEn total, 15 comunidades autónomas (CCAA), más las ciudades autónomas de Ceuta y Melilla, notificaron nuevos diagnósticos de VIH al SINIVIH en 2010, y todas ellas recogieron cifras de CD4 en la primera determinación tras el diagnóstico. Sin embrago, solo 7 CCAA (Asturias, Aragón, Canarias, Castilla y León, Madrid, Murcia y Navarra), que en conjunto suponen el 33% del total de la población española, disponían entonces de la variable «fecha de determinación de CD4» en un número significativo de casos y fueron las que se incluyeron en el estudio. El SINIVIH permite actualizar los registros anualmente para completar información, por lo que, para minimizar el retraso en la notificación y maximizar la exhaustividad de los datos, el análisis se realizó con datos actualizados a julio del 2012.
La fuente de información fueron los clínicos responsables de los pacientes y los laboratorios, y los datos se completaron revisando las historias clínicas. Se eliminaron las notificaciones duplicadas dentro de cada una de las CCAA participantes, pero no entre ellas, ya que los registros se envían sin identificadores personales al Centro Nacional de Epidemiología, donde se realizó el análisis.
Se utilizó como fecha de inicio del seguimiento la de la primera determinación de CD4 tras el diagnóstico y se definió como «inicio de seguimiento correcto» aquel en que el tiempo transcurrido entre la fecha de diagnóstico de VIH y la de la primera determinación de CD4 no superó los 3 meses.
Las variables incluidas en el análisis fueron las fechas de diagnóstico de VIH y de primera determinación de CD4 tras el diagnóstico, la edad, el sexo, la comunidad autónoma de notificación, la categoría de transmisión y la zona geográfica de origen.
En el análisis, se calculó el tiempo transcurrido entre la fecha del diagnóstico de VIH y la de la primera determinación de CD4; se calcularon los porcentajes de pacientes que iniciaron seguimiento en el mes 1, 2, 3, 6, 9, 12 y más de 12 tras el diagnóstico, y se realizó un análisis descriptivo según variables de persona, lugar y tiempo. Se utilizaron la prueba de la chi al cuadrado para comparar variables discretas y la odds ratio (OR) y su intervalo de confianza al 95% (IC del 95%) como medida de asociación. Se ajustó un modelo de regresión logística para analizar los factores asociados a inicio de seguimiento correcto. El análisis estadístico se realizó con el programa SPSS (versión 17).
ResultadosEn 2010 se notificaron 1.769 nuevos diagnósticos de VIH en las CCAA participantes. La mediana de edad al diagnóstico fue de 35 años (rango intercuartílico: 28-43) y la mayoría eran hombres (82,9%), nativos de España (58,7%), que se infectaron por mantener relaciones sexuales con otros hombres (HSH) (52,5%) (tabla 1). En 1.489 (84,1%) nuevos diagnósticos, se disponía de información sobre la fecha de la primera determinación de los CD4 tras el diagnóstico.
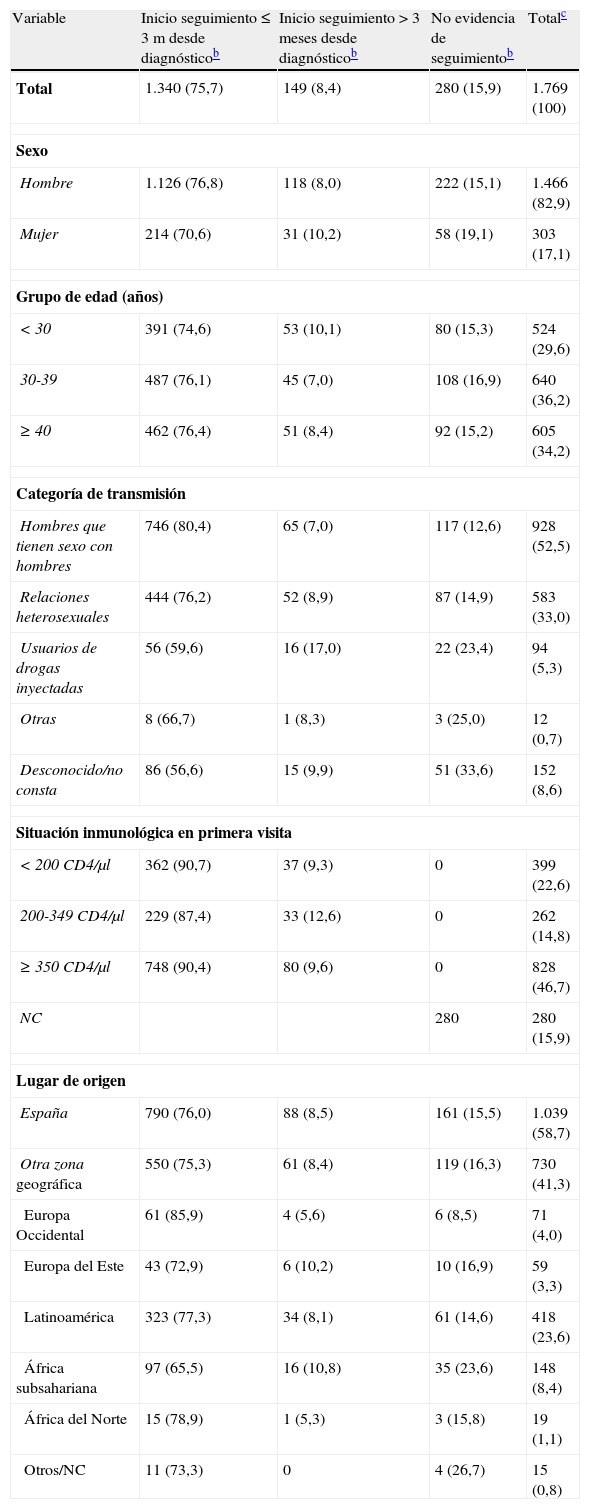
Tiempo transcurrido desde el diagnóstico de VIH hasta el inicio de seguimiento y características de la población de estudio, en los nuevos diagnósticos de VIH de 2010a
| Variable | Inicio seguimiento ≤ 3 m desde diagnósticob | Inicio seguimiento > 3 meses desde diagnósticob | No evidencia de seguimientob | Totalc |
| Total | 1.340 (75,7) | 149 (8,4) | 280 (15,9) | 1.769 (100) |
| Sexo | ||||
| Hombre | 1.126 (76,8) | 118 (8,0) | 222 (15,1) | 1.466 (82,9) |
| Mujer | 214 (70,6) | 31 (10,2) | 58 (19,1) | 303 (17,1) |
| Grupo de edad (años) | ||||
| < 30 | 391 (74,6) | 53 (10,1) | 80 (15,3) | 524 (29,6) |
| 30-39 | 487 (76,1) | 45 (7,0) | 108 (16,9) | 640 (36,2) |
| ≥ 40 | 462 (76,4) | 51 (8,4) | 92 (15,2) | 605 (34,2) |
| Categoría de transmisión | ||||
| Hombres que tienen sexo con hombres | 746 (80,4) | 65 (7,0) | 117 (12,6) | 928 (52,5) |
| Relaciones heterosexuales | 444 (76,2) | 52 (8,9) | 87 (14,9) | 583 (33,0) |
| Usuarios de drogas inyectadas | 56 (59,6) | 16 (17,0) | 22 (23,4) | 94 (5,3) |
| Otras | 8 (66,7) | 1 (8,3) | 3 (25,0) | 12 (0,7) |
| Desconocido/no consta | 86 (56,6) | 15 (9,9) | 51 (33,6) | 152 (8,6) |
| Situación inmunológica en primera visita | ||||
| < 200 CD4/μl | 362 (90,7) | 37 (9,3) | 0 | 399 (22,6) |
| 200-349 CD4/μl | 229 (87,4) | 33 (12,6) | 0 | 262 (14,8) |
| ≥ 350 CD4/μl | 748 (90,4) | 80 (9,6) | 0 | 828 (46,7) |
| NC | 280 | 280 (15,9) | ||
| Lugar de origen | ||||
| España | 790 (76,0) | 88 (8,5) | 161 (15,5) | 1.039 (58,7) |
| Otra zona geográfica | 550 (75,3) | 61 (8,4) | 119 (16,3) | 730 (41,3) |
| Europa Occidental | 61 (85,9) | 4 (5,6) | 6 (8,5) | 71 (4,0) |
| Europa del Este | 43 (72,9) | 6 (10,2) | 10 (16,9) | 59 (3,3) |
| Latinoamérica | 323 (77,3) | 34 (8,1) | 61 (14,6) | 418 (23,6) |
| África subsahariana | 97 (65,5) | 16 (10,8) | 35 (23,6) | 148 (8,4) |
| África del Norte | 15 (78,9) | 1 (5,3) | 3 (15,8) | 19 (1,1) |
| Otros/NC | 11 (73,3) | 0 | 4 (26,7) | 15 (0,8) |
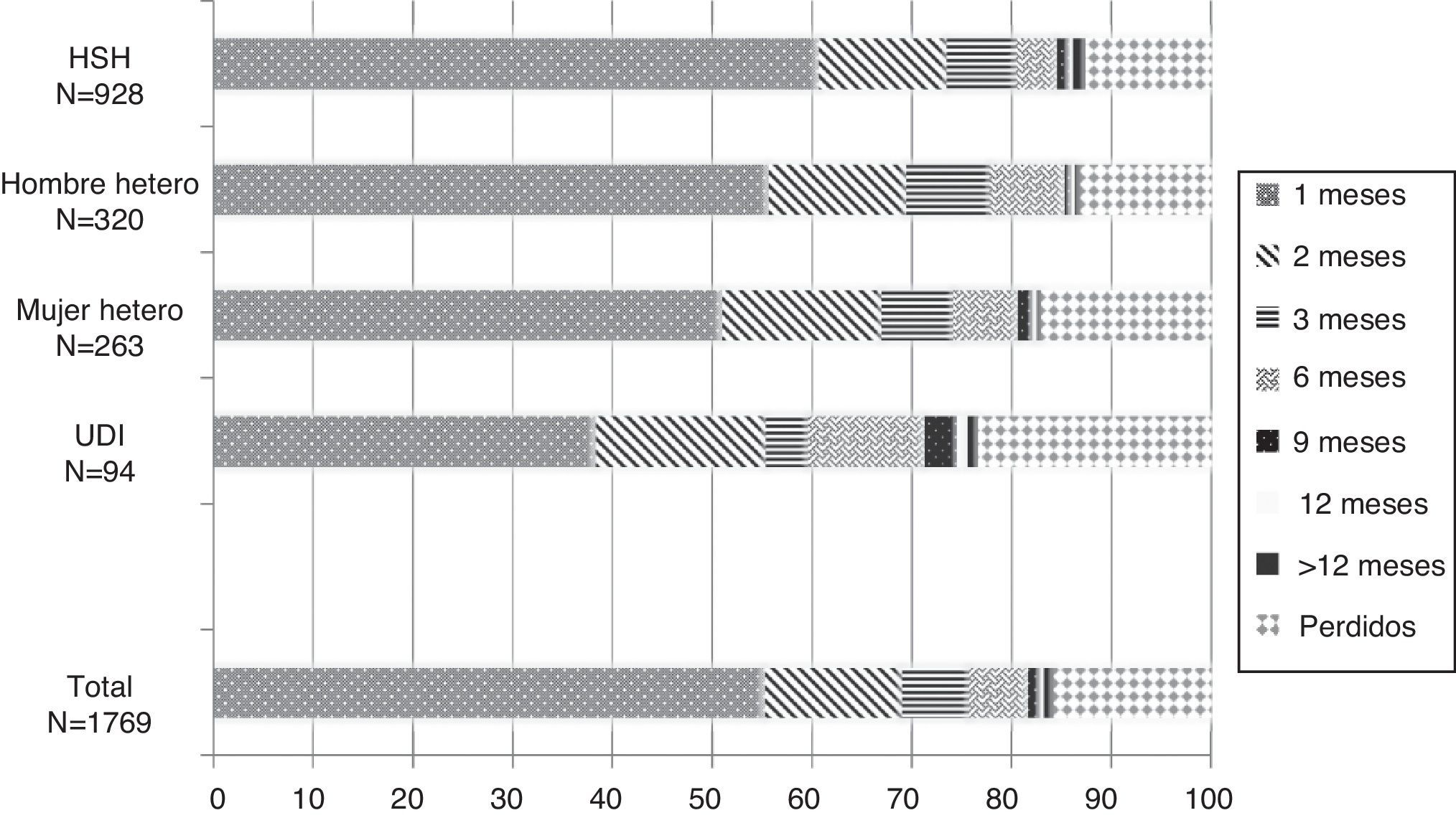
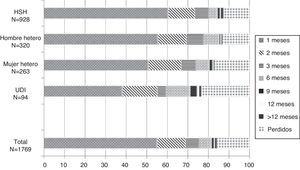
En total, 978 (55,3%) nuevos diagnósticos iniciaron su seguimiento antes de un mes, 1.220 (69,0%) antes de los 2 meses, 1.340 (75,7%) antes de los 3s, 1.443 (81,6%) antes de los 6, 1.466 (82,9%) antes de los 9 y 1.472 (83,1%) antes de los 12 meses. En un 1% adicional, constaba el inicio del seguimiento pasados los 12 meses y en el momento del análisis había 280 nuevos diagnósticos (15,9%), en los cuales se desconoce su situación. Desagregando por sexo y mecanismo de transmisión, el inicio de seguimiento fue más temprano entre los HSH y más tardío entre los UDI; entre estos últimos, se presentan solo los datos para hombres y mujeres conjuntamente dado el escaso número de mujeres UDI (n = 36) (fig. 1).
Distribución del tiempo transcurrido desde el diagnóstico de VIH hasta el inicio del seguimiento según categoría de transmisión. Año 2010, en Aragón, Asturias, Canarias, Castilla León, Madrid, Murcia, Navarra.
Hetero: relaciones heterosexuales; HSH: hombre que tiene relaciones sexuales con hombres; UDI: usuarios de drogas inyectadas; VIH: virus de la inmunodeficiencia humana.
El inicio del seguimiento fue «correcto» en un total de 1.340 (75,7%) pacientes. El 76,8% de los hombres y el 70,6% de las mujeres iniciaron su seguimiento antes de los 3 meses (p = 0,02), y el porcentaje de inicio correcto fue similar en españoles y en inmigrantes (76% frente al 75,3%; p = 0,74). Analizando los datos por modo de transmisión, se aprecia que la proporción de inicio correcto es superior en HSH (80,4%) que en heterosexuales y en UDI (el 76,2 y el 50,6%, respectivamente; p < 0,001) (tabla 1).
En el análisis multivariante, ajustando por edad, sexo, categoría de transmisión, cifra de CD4 en la primera visita, comunidad autónoma de notificación y zona geográfica de origen, se observó que la probabilidad de inicio de seguimiento clínico correcto es significativamente peor entre los UDI (OR = 0,3; IC del 95%, 0,2-0,6), sin que el resto de variables tuviera ningún efecto.
DiscusiónEn este estudio, se documenta por primera vez el patrón de inicio del seguimiento clínico tras el diagnóstico de VIH en España. Los resultados muestran que la gran mayoría de los pacientes infectados por VIH inicia su seguimiento en un tiempo correcto, con la única y notable excepción de los UDI.
Más del 84% de los pacientes en nuestro estudio tienen pruebas de estar en seguimiento clínico, pero un porcentaje no desdeñable carece de ellas. No se puede afirmar que estos pacientes realmente no hayan accedido al sistema sanitario pero, aunque esto habrá de confirmarse en estudios futuros, el hecho de que el porcentaje de pacientes sin información sobre CD4 sea mayor en UDI y personas subsaharianas apoya esta hipótesis. En todo caso, es importante que los profesionales que indican el test de VIH sigan insistiendo en la necesidad de iniciar el seguimiento lo antes posible ante un resultado positivo.
La cifra de seguimiento correcto en nuestro estudio es superior a la encontrada en estudios con definiciones similares en EE. UU., donde los valores oscilaron entre el 63,7% de inicio de seguimiento a los 3 meses en Nueva York en 200311 y el 72% a los 4 meses publicado en un metaanálisis con estudios comprendidos entre 1995 y 200912. En una provincia canadiense, el 92,2% de los pacientes iniciaron seguimiento tras el diagnóstico, pero no se ofrecen datos específicos a los 3 meses13.
En cuanto a los factores asociados a peor inicio de seguimiento, el hecho de ser UDI también se encontró relacionado con peor inicio de seguimiento en EE. UU11. Aunque actualmente en España este grupo supone poco más del 5% de los nuevos diagnósticos de VIH, la alta prevalencia de infección entre ellos y el hecho de que tengan barreras para acceder al seguimiento deberían ser motivos de preocupación, sobre todo considerando los recientes brotes de infecciones de VIH en UDI que se han producido en Grecia, atribuidos al deterioro de la situación económica14.
Por lo que respecta a los inmigrantes, al contrario que en EE. UU.11, en nuestro estudio no se encontraron diferencias en los inmigrantes, algo que cabe atribuir a las notables diferencias entre los sistemas sanitarios de ambos países. No obstante, entre los subsaharianos, tanto la cifra de inicio de seguimiento correcto como la proporción en la que no existe evidencia de seguimiento son peores, por lo que este grupo debería ser objeto de especial atención; además, el número de subsaharianos en este estudio no es muy grande, por lo que, en análisis futuros, habrá de verificarse si este resultado se confirma.
Este trabajo presenta algunas limitaciones que se espera poder subsanar en un futuro próximo, cuando se complete la implantación del SINIVIH. Aunque la provisión de servicios sanitarios para la infección por VIH es similar en todas las CCAA y no cabría esperar diferencias entre ellas en el acceso al seguimiento de los pacientes, los resultados del estudio pueden no ser extrapolables a las CCAA que no participaron; puesto que las CCAA que no recogían fecha de CD4 están empezando a hacerlo, se espera poder evitar pronto este problema. Por otra parte, actualmente, en el SINIVIH no se recogen datos sobre el tipo de servicio donde se prescribió la prueba de VIH que llevó al diagnóstico, variable clásicamente relacionada con el inicio de seguimiento. Una última limitación sería que no podemos descartar con seguridad que algunas personas que carecen de información sobre CD4 en nuestro registro estén realmente en seguimiento.
En conclusión, el objetivo de mejorar el cuidado de las personas infectadas y reducir la incidencia de nuevas infecciones ofrece oportunidades de intervención en todos y cada uno de los pasos que se producen entre el diagnóstico de la infección por VIH y la correcta administración del tratamiento a los infectados. El control de la epidemia exige evitar la replicación del virus en la mayoría de los pacientes, por lo que el seguimiento clínico de estos debe iniciarse lo antes posible tras su diagnóstico. Los resultados de este estudio muestran que aunque generalmente en España este proceso se hace en un tiempo razonable, todavía hay margen de mejora, sobre todo en el colectivo de UDI que presenta claras deficiencias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los profesionales que notificaron los casos y contribuyeron de una forma u otra a mejorar la calidad de los datos.