Actualización de las recomendaciones del Grupo de Estudio de Sida (GESIDA) y la Secretaría del Plan Nacional sobre el Sida (PNS) del año 2004 sobre prevención de las infecciones oportunistas en pacientes adultos y adolescentes infectados por el virus de la inmunodeficiencia humana (VIH).
MétodosLas recomendaciones han sido consensuadas por un grupo de expertos de GESIDA y/o del PNS tras la revisión del documento del año 2004 y las aportaciones científicas sobre la materia de los últimos 4 años. Para la clasificación de la fuerza y de la calidad de las recomendaciones se ha seguido el sistema utilizado por la Sociedad Americana de Enfermedades Infecciosas (IDSA) y el Servicio de Salud Pública de Estados Unidos (USPHS).
ResultadosEn este documento se realiza una revisión pormenorizada de las medidas para prevenir las infecciones causadas por parásitos, hongos, virus, micobacterias y bacterias en el contexto de la infección por el VIH y, dado el incremento de la inmigración en España, se han incorporado al documento las profilaxis de las infecciones importadas. Para cada grupo de patógenos se han dado recomendaciones para prevenir la exposición a los mismos y para su profilaxis primaria y secundaria.
También se han establecido unos criterios para la retirada de las profilaxis en pacientes que tienen una buena respuesta al tratamiento antirretroviral de gran actividad (TARGA).
ConclusionesEl TARGA es la mejor estrategia para prevenir las infecciones oportunistas en pacientes infectados por el VIH. Sin embargo, las profilaxis continúan siendo necesarias en los países con pocos recursos económicos y también en los países desarrollados en pacientes en los que se realiza un diagnóstico tardío de la infección por el VIH, en pacientes inmunodeprimidos que no desean o no pueden tomar TARGA, en aquellos en los que éste fracasa y en el pequeño grupo de infectados que son incapaces de recuperar cifras adecuadas de linfocitos T CD4+ a pesar de una buena inhibición de la replicación del VIH con TARGA.
To provide an update of 2004 Guidelines from the Spanish AIDS Study Group (GESIDA) and the National AIDS Plan (PNS) committee on the prevention of opportunistic infections in adult and adolescent HIV-infected patients.
MethodsThese consensus recommendations have been produced by a group of experts from GESIDA and/or the PNS after reviewing the 2004 document and the scientific advances in this field in the last four years. The system used by the Infectious Diseases Society of America and the United States Public Health Service has been used to classify the strength and quality of the data.
ResultsThis document provides a detailed review of the measures for the prevention of infections caused by parasites, fungi, viruses, mycobacteria and bacteria in the context of HIV infection. Due to the increase in recent years of HIV-infected immigrants, the prevention of tropical infections have been incorporated.
Recommendations are given for preventing exposure and for primary and secondary prophylaxis for each group of pathogens. In addition, criteria are established for the withdrawal of prophylaxis in patients who respond well to highly active antiretroviral therapy (HAART).
ConclusionsHAART is the best strategy for the prevention of opportunistic infections in HIV-positive patients. Nevertheless, prophylaxis is still necessary in countries with limited economic resources and also in developed countries, where late presenters are common, in immunosuppresed patients who refuse to take or who cannot take HAART, in those in whom HAART is not effective, and in the small group of infected patients with inadequate recovery of CD4+ T-lymphocyte counts despite good inhibition of HIV replication induced by HAART.
Durante muchos años las principales intervenciones para mejorar y prolongar la vida de las personas infectadas por el virus de la inmunodeficiencia humana (VIH) fueron la profilaxis de las infecciones oportunistas y la asistencia por profesionales con experiencia en sida1,2. Aunque en los países desarrollados la incidencia de estas infecciones se redujo de forma drástica coincidiendo con el uso del tratamiento antirretroviral de gran actividad (TARGA)3,4, en los países con pocos recursos económicos, estas infecciones son todavía muy frecuentes y constituyen la principal causa de mortalidad asociada al VIH.
Sabemos desde hace algunos años que la inhibición de la replicación viral por el TARGA evita el deterioro inmune en los pacientes infectados por el VIH. Además, en aquellos con enfermedad avanzada, estos tratamientos dan lugar, a partir de 3 a 6 meses, a un aumento paulatino de linfocitos T CD4+ naive y de memoria que tienen capacidad de proliferar in vitro y de generar citocinas en respuesta a patógenos oportunistas. Además, se recupera la respuesta retardada a antígenos y se normaliza progresivamente la activación inmune inespecífica5,6.
Sin género de dudas, el TARGA es la mejor estrategia para prevenir las infecciones oportunistas en estos enfermos; lo que no equivale a decir que debamos olvidarnos de las profilaxis. En la práctica clínica, estas últimas continúan siendo necesarias en los países con pocos recursos económicos y también en los países desarrollados en bastantes pacientes en los que se realiza un diagnóstico tardío de la infección por el VIH, en pacientes muy inmunodeprimidos hasta que el TARGA logra sus efectos, en los que no desean o no pueden tomar TARGA, en aquellos en los que éste fracasa y en el pequeño grupo de infectados que son incapaces de recuperar cifras adecuadas de linfocitos CD4 a pesar de una buena inhibición de la replicación viral con TARGA7. En un estudio efectuado por la Red de Investigación de Sida en España entre los años 2004 y 20058, un tercio de los nuevos pacientes diagnosticados de infección por el VIH tenían menos de 200 linfocitos CD4/μl y un 19% tenía criterios de sida, por lo que tendrían que recibir profilaxis primaria o secundaria de las infecciones oportunistas. Además, en los últimos años ha aumentado de forma notable la inmigración en España, y se calcula que el 29% de los nuevos pacientes infectados por el VIH son inmigrantes, por lo que los facultativos que atienden a estos pacientes deben conocer muy bien el manejo de las enfermedades infecciosas importadas.
Por todos los motivos antes expuestos y con el fin de publicar de forma simultánea estas recomendaciones con las de tratamiento de las infecciones oportunistas9, la Junta Directiva de GESIDA y la Secretaría del Plan Nacional sobre el Sida han considerado conveniente la actualización de sus recomendaciones del año 2004 sobre prevención de las infecciones oportunistas en pacientes adultos y adolescentes infectados por el VIH10, incorporando las aportaciones de estos últimos años así como las profilaxis de las infecciones importadas. Para la clasificación de la fuerza y de la calidad de las recomendaciones se ha seguido el sistema utilizado por la Sociedad Americana de Enfermedades Infecciosas (IDSA) y el Servicio de Salud Pública de Estados Unidos (USPHS) (tabla 1)11.
Sistema para la clasificación de las recomendaciones de guías de práctica clínica utilizado por la Sociedad Americana de Enfermedades Infecciosas (IDSA) y el Servicio de Salud Pública de Estados Unidos (USPHS)
| Fuerza de la recomendación | |
| A | Ofrecer siempre. Existen pruebas muy sólidas que avalan la eficacia y el beneficio clínico de la recomendación |
| B | Ofrecer por lo general. Las pruebas que avalan su eficacia a) no son muy sólidas o b) son sólidas pero el beneficio clínico de la recomendación es limitado |
| C | Opcional. a) No existen pruebas concluyentes que avalen la recomendación o que la refuten o b) las pruebas que avalan su eficacia no compensan los posibles efectos indeseables (toxicidad, interacciones medicamentosas), el precio o soluciones alternativas |
| D | No ofrecer por lo general. Existen pruebas, de moderada solidez, que muestran a) falta de eficacia o b) que existe el riesgo de efectos indeseables |
| E | No ofrecer nunca. Existen pruebas sólidas que muestran que la recomendación es ineficaz o supone un riesgo para el paciente |
| Calidad de las pruebas en las que se basa la recomendación | |
| I | Al menos un ensayo clínico aleatorizado y controlado bien diseñado |
| II | Al menos un ensayo clínico bien diseñado pero no aleatorizado o un estudio de cohortes o un estudio de casos y controles (preferiblemente multicéntrico) o múltiples series de casos o bien resultados espectaculares en estudios no controlados |
| III | Opiniones de profesionales con gran experiencia clínica en la materia, estudios descriptivos o recomendaciones de comités de expertos |
La mayoría de las enfermedades parasitarias en pacientes infectados por el VIH se deben a reactivaciones de infecciones latentes en situaciones de inmunodepresión profunda, y su incidencia refleja la prevalencia de los distintos parásitos en la población general12. Algunas de estas reactivaciones se pueden prevenir con quimioprofilaxis.
Pneumocystis jiroveci (antes Pneumocystis carinii) (tabla 2)P. jiroveci es un hongo, pero se incluye en este apartado porque su profilaxis y tratamiento se lleva a cabo con fármacos antiparasitarios y no con antifúngicos. La taxonomía del organismo ha cambiado. En la actualidad se reserva el nombre de P. jiroveci a la especie que infecta a los seres humanos y se denomina P. carinii a la especie que infecta a los roedores13; a pesar del cambio de nomeclatura, se puede mantener el acrónimo PCP. La neumonía por P. jiroveci puede aparecer cuando la cifra de linfocitos T CD4+ es inferior a 200/μl. Ha sido la enfermedad indicativa de sida más frecuente y la primera en la que se demostró la eficacia de la quimioprofilaxis. Aunque su incidencia ha disminuido con el TARGA3,15,16, sigue siendo la forma más común de manifestación de sida en pacientes que no saben que están infectados por el VIH. En los países que carecen de TARGA sigue teniendo una prevalencia muy elevada17.
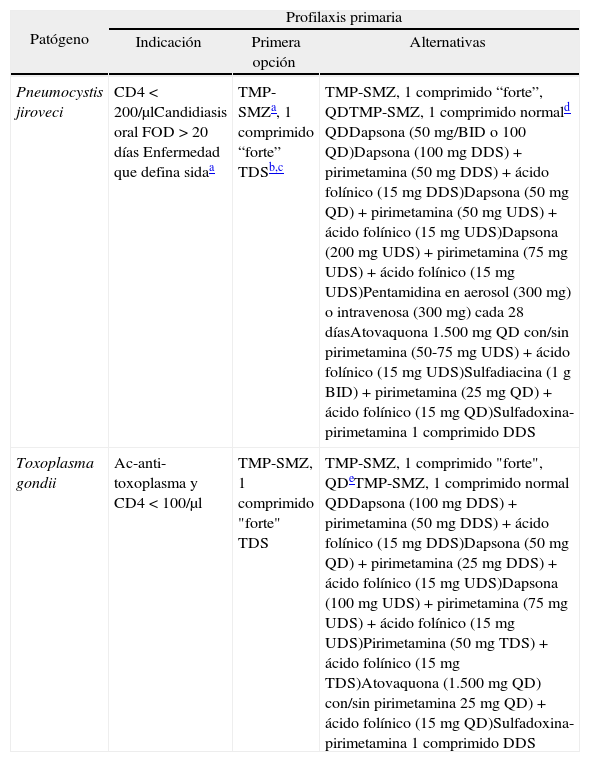
Profilaxis de enfermedades oportunistas producidas por parásitos en pacientes adultos y adolescentes infectados por el virus de la inmunodeficiencia humana (VIH)
| Patógeno | Profilaxis primaria | ||
| Indicación | Primera opción | Alternativas | |
| Pneumocystis jiroveci | CD4 < 200/μlCandidiasis oral FOD > 20 días Enfermedad que defina sidaa | TMP-SMZa, 1 comprimido “forte” TDSb,c | TMP-SMZ, 1 comprimido “forte”, QDTMP-SMZ, 1 comprimido normald QDDapsona (50 mg/BID o 100 QD)Dapsona (100 mg DDS) + pirimetamina (50 mg DDS) + ácido folínico (15 mg DDS)Dapsona (50 mg QD) + pirimetamina (50 mg UDS) + ácido folínico (15 mg UDS)Dapsona (200 mg UDS) + pirimetamina (75 mg UDS) + ácido folínico (15 mg UDS)Pentamidina en aerosol (300 mg) o intravenosa (300 mg) cada 28 díasAtovaquona 1.500 mg QD con/sin pirimetamina (50-75 mg UDS) + ácido folínico (15 mg UDS)Sulfadiacina (1 g BID) + pirimetamina (25 mg QD) + ácido folínico (15 mg QD)Sulfadoxina-pirimetamina 1 comprimido DDS |
| Toxoplasma gondii | Ac-anti-toxoplasma y CD4 < 100/μl | TMP-SMZ, 1 comprimido "forte" TDS | TMP-SMZ, 1 comprimido "forte", QDeTMP-SMZ, 1 comprimido normal QDDapsona (100 mg DDS) + pirimetamina (50 mg DDS) + ácido folínico (15 mg DDS)Dapsona (50 mg QD) + pirimetamina (25 mg DDS) + ácido folínico (15 mg UDS)Dapsona (100 mg UDS) + pirimetamina (75 mg UDS) + ácido folínico (15 mg UDS)Pirimetamina (50 mg TDS) + ácido folínico (15 mg TDS)Atovaquona (1.500 mg QD) con/sin pirimetamina 25 mg QD) + ácido folínico (15 mg QD)Sulfadoxina-pirimetamina 1 comprimido DDS |
| Patógeno | Profilaxis secundaria | ||
| Indicación | Primera opción | Alternativas | |
| Pneumocystis jiroveci | Neumonía por P. jiroveci | TMP-SMZ, 1 comprimido "forte" TDS TMP-SMZ, 1 comprimido "forte", QD | Dapsona (50 mg BID o 100 mg QD)Dapsona (50 mg QD) + pirimetamina (50 mg UDS) + ácido folínico (15 mg UDS)Pentamidina en aerosol (300 mg) o intravenosa (300 mg) cada 28 díasAtovaquona 1500 mg QD con/sin pirimetamina (50-75 mg UDS) + ácido folínico (15 mg UDS)Sulfadiacina (1 g BID) + pirimetamina (25 mg QD) + ácido folínico (15 mg QD)Sulfadoxina-pirimetamina 1 comprimido UDS |
| Toxoplasma gondii | Toxoplasmosis cerebral | Sulfadiacina (1 g BID) + pirimetamina (25 mg QD) + ácido folínico (15 mg QD)Sulfadiacina (1 g BID TDS) + pirimetamina (50 mg TDS) + ácido folínico (15 mg TDS) + | Clindamicina (600 mg/8 h) + pirimetamina (25 mg QD) + ácido folínico (15 mg QD)Azitromicina (500-1.000 mg QD) + pirimetamina (25 mg QD) + ácido folínico (15 mg QD)TMP-SMZ 1 comprimido "forte", BIDSulfadoxina-pirimetamina 1 comprimido DDS |
| Leishmania infantum | Leishmaniasis visceral | Anfotericina complejo lipídico 3 mg/kg i.v., cada 3 semanasAnfotericina liposomal 3-5 mg/kg i.v., cada 2-4 semanasAntimonio pentavalente 850 mg mensual | Anfotericina B desoxicolatofMiltefosina oralfPentamidina i.v. (300 mg cada 3-4 semanas)f |
| Isospora belli | Diarrea crónica | TMP-SMZ, 1 comprimido normal QDTMP-SMZ, 1 comprimido "forte" QD | Ciprofloxacino (500 mg TDS) |
Ac: anticuerpo; BID: dos veces al día; DDS: 2 días a la semana; FOD: fiebre de origen desconocido; i.v.: por vía intravenosa; QD: una vez al día; TDS: 3 días a la semana; TMP-SMZ: trimetoprima-sulfametoxazol; UDS: 1 día a la semana.
Los primeros estudios se llevaron a cabo con TMP-SMZ 1 comprimido "forte" al día pero posteriormente se ha demostrado que la tolerancia es mejor y la eficacia similar con tres comprimidos "forte" a la semana o con un comprimido "normal" todos los días.
Tradicionalmente se ha asumido que P. jiroveci penetra al organismo por vía respiratoria durante la infancia dando lugar a una infección latente que puede reactivarse en situaciones de inmunodepresión grave18. Se han comunicado datos que sugieren que la infección puede transmitirse de pacientes con neumonía por P. jiroveci a personas susceptibles, aunque la transmisión entre enfermos debe ser muy baja, si es que llega a ocurrir19,20. En conclusión, en el momento actual no se dispone de datos suficientes para recomendar el aislamiento respiratorio de pacientes con neumonía por P. jiroveci (CIII).
Profilaxis primariaDebe iniciarse cuando la cifra de linfocitos T CD4+ sea inferior a 200/μl o siempre que exista alguna enfermedad definitoria de sida, candidiasis oral o fiebre inexplicada de más de 20 días de duración (AI). Puede considerase la profilaxis cuando el porcentaje de linfocitos T CD4+ sea inferior al 14% o cuando la cifra de linfocitos T CD4+ esté entre 200 y 250/ml y no se pueda controlar al paciente cada 3 meses21 (BII). Se está describiendo con frecuencia creciente el desarrollo de infecciones oportunistas (por P. jiroveci o por otros microorganismos relacionados con estadios avanzados de la infección por el VIH) en las primeras semanas que siguen al inicio del TARGA: este fenómeno, conocido como síndrome inflamatorio de reconstitución inmune, aparece más frecuentemente en los pacientes que inician el TARGA en fases de inmunodepresión avanzada (habitualmente con recuentos de linfocitos CD4+ inferiores a 100/ml), hecho que en sí mismo ya justifica el inicio de profilaxis. Sin embargo, dicho síndrome se relaciona también muy especialmente con la caída brusca de la carga viral como consecuencia del TARGA recientemente iniciado9,22. Aunque no existen recomendaciones explícitas para aplicar profilaxis primaria en los pacientes en los que pueda esperarse un descenso rápido de la carga viral (> 2,5 log en el primer mes de TARGA) y cuyo recuento de linfocitos CD4+ no justifique el inicio de dicha profilaxis, en estos casos es recomendable mantener una actitud expectante ante posibles síntomas de infecciones oportunistas que puedan corresponder a este síndrome de reconstitución inmune9.
La combinación de trimetoprima-sulfametoxazol (TMP-SMZ) se considera el fármaco de elección por su eficacia, comodidad y relación entre coste y beneficio (AI). Los primeros estudios se llevaron a cabo con dosis diarias de TMP-SMZ de 160/800 mg (1 comprimido "forte")1 pero posteriormente se ha demostrado que la tolerancia es mejor y la eficacia similar con tres comprimidos "forte" a la semana (AI) o con un comprimido "normal" (80/400) todos los días (AI)23,24. Si se presentan reacciones de hipersensibilidad debe intentarse la desensibilización antes de prescribir un fármaco alternativo25. Como régimen profiláctico de segunda elección se considera la dapsona (BI)26 (aunque pertenece al grupo sulfa, no siempre se observa hipersensibilidad cruzada con sulfametoxazol) o dapsona/pirimetamina (BI)27,28. También existe amplia experiencia con la administración de pentamidina en aerosol (debe administrarse con un equipo especial, Respirgard® II o Fisoneb®) (BI)29, aunque este régimen es menos eficaz que el de TMP-SMZ o dapsona y no protege frente a formas extrapulmonares u otras infecciones, como toxoplasmosis30. Entre sus inconvenientes destacan el broncoespasmo y el sabor metálico. Además, puede ocasionar problemas en el entorno sanitario, con riesgo de diseminación de tuberculosis, por lo que el aerosol se debe de administar en un local aislado y bien ventilado. Cuando no puedan reunirse unas condiciones ambientales seguras para la administración de pentamidina en aerosol y el paciente presente intolerancia o alergia (refractaria a las medidas de desensibilización) a todos los derivados del grupo sulfa y al atavaquone, puede considerarse la administración de pentamidina intravenosa mensual (CIII)31.
La atovaquona puede ser otra alternativa a pacientes con intolerancia a las sulfamidas (BI)32,33. Otras alternativas válidas pero menos estudiadas son sulfadiazina-pirimetamina y sulfadoxina-pirimetamina (BII)34,35, que pueden requerir la administración de más de un fármaco, dificultando por tanto el cumplimiento de la profilaxis o el TARGA.
Profilaxis secundariaTras una neumonía por P. jiroveci se debe administrar profilaxis secundaria para prevenir recidivas (AI). El TMP-SMZ (un comprimido "forte" a diario o 3 días por semana) es más eficaz que la pentamidina en aerosol para prevenir recidivas locales y/o extrapulmonares36,37 (AI).
Retirada de las profilaxisLa profilaxis primaria se puede retirar en aquellos enfermos con TARGA durante más de 6 meses que tengan una carga viral indetectable y una cifra de linfocitos T CD4+ superiores a 200/μl durante al menos 3 meses (AI)38–42. Esos mismos criterios son válidos para la suspensión de la profilaxis secundaria (AI)38,39,42–46, pero si el episodio de PCP tuvo lugar con recuentos de linfocitos T CD4+ por encima de 200/μl, probablemente dicha profilaxis secundaria debería mantenerse indefinidamente (CIII)24. Por el contrario, en algunos estudios con un número reducido de pacientes se ha sugerido la posible retirada de la profilaxis (primaria o secundaria) en los pacientes que reciben TARGA con viremia del VIH indetectable de forma sostenida, pero cuyos recuentos de linfocitos T CD4+ se mantienen en una meseta por debajo de 200/μl47. Aunque esta recomendación se basa en el beneficio inmunológico que supone la supresión estable de la replicación viral, no existen datos suficientes para su establecimiento definitivo (CIII). La retirada de las profilaxis reduce la toxicidad farmacológica, simplifica el tratamiento y puede facilitar el cumplimiento del TARGA porque se reduce el número de pastillas. A largo plazo podría contribuir a reducir la prevalencia de PCP al preservar el TMP-SMZ, como fármaco de elección, para su utilización en condiciones más favorables en los pacientes con CD4+ por debajo de 200/μl42. Se han descrito algunos casos de recidiva de la enfermedad tras la retirada de la profilaxis. En general, estos pacientes tenían edad avanzada, habían desarrollado la neumonía por P. jiroveci con cifras de linfocitos T CD4+ superiores a 200/μl, tenían otro tipo de inmunosupresión (p. ej., linfoma) o habían abandonado el TARGA.
Reinicio de la profilaxisAunque no hay datos definitivos al respecto, se aconseja reanudar la profilaxis si la cifra de linfocitos T CD4+ desciende de 200/μl (AIII) o el paciente presenta un episodio de neumonía por P. jiroveci (CIII)48. Probablemente esta necesidad de reiniciar la profilaxis es aún más inevitable si la depresión inmunológica acontece en el contexto de un mal control de la replicación del VIH, frente a lo que sucede cuando el descenso de CD4+ obedece a otros factores (p. ej., tratamiento con interferón) junto con una viremia del VIH indetectable.
Finalmente, aunque se han descrito fracasos de la profilaxis debido a la aparición de mutaciones en el gen de la dihidropteroatosintasa (DHPS) de P. jiroveci, su prevalencia en España es baja y su significado clínico incierto49.
Toxoplasma gondii (tabla 2)La toxoplasmosis cerebral es la encefalitis más común en el sida y ocurre en pacientes cuya cifra de linfocitos T CD4+ es inferior a 100/μl. Esta infección puede complicar el curso de un 10-20% de los enfermos infectados por el VIH con serología positiva para T. gondii50 aunque su incidencia ha descendido por el uso de TMP-SMZ y TARGA.
Medidas para prevenir la exposición al patógenoT. gondii se adquiere por el consumo de carne, huevos, verduras y hortalizas contaminados y por exposición a heces de gato25,51. Los pacientes con serología negativa deben comer la carne bien hecha (el interior no debe estar rosado). Aquellos pacientes que no quieran renunciar a la carne poco hecha, pueden congelarla previamente a una temperatura inferior a -20 °C. También deben lavar bien la fruta y la verdura para evitar la infección (BIII). Se aconseja el lavado de manos tras haber tocado carne cruda, verduras o tierra (jardinería) (BIII). Si se tiene un gato como animal de compañía, se le debe alimentar con dietas comerciales y la carne que consuma también debe estar bien hecha. Además, se deben limpiar sus excretas a diario con guantes (BIII).
Profilaxis primariaDebe iniciarse el tratamiento profiláctico en enfermos con serología positiva (anticuerpos IgG anti-Toxoplasma) y cifras de linfocitos T CD4+ inferiores a 100/μl (AII), aunque algunos autores recomiendan iniciarla con un recuento de linfocitos T CD4+ menor de 200/μl (BII). Los primeros trabajos de profilaxis fueron estudios observacionales retrospectivos de enfermos con profilaxis para P. jiroveci con TMP-SMZ. La toxoplasmosis se puede prevenir con un comprimido diario normal de TMP-SMZ (80/400) o un comprimido "forte" (160/800) 3 días por semana (AII)27,51,53. Sin embargo, se aconseja un comprimido "forte" diario en pacientes con inmunodepresión grave, en los que reciben simultáneamente fármacos que pueden disminuir las concentraciones plasmáticas de TMP-SMZ (p. ej., rifampicina) y en los que tienen valores muy elevados de anticuerpos IgG anti-Toxoplasma (BII)54,55. En enfermos que no toleran el TMP-SMZ se puede administrar dapsona en combinación con pirimetamina y ácido folínico (BI), atovaquona (sola o en combinación con pirimetamina y ácido folínico) (CIII), pirimetamina (CI) o sulfadoxina-pirimetamina (BII)24,27,35,51,52,56,57. Es preciso recordar que ciertos regímenes activos frente a P. jiroveci (dapsona, pentamidina inhalada) no son eficaces frente a T. gondii y, por tanto, si se están administrando en pacientes con cifras de CD4+ por debajo de 100/μl y con serología positiva frente a T. gondii debe modificarse el régimen de profilaxis incluyendo una pauta activa contra este parásito (AII)58.
Profilaxis secundariaEn la época previa al TARGA, si no se administraba tratamiento de mantenimiento, la toxoplasmosis cerebral recidivaba en el 60-100% de los casos entre los 6 a 12 meses tras finalizar el tratamiento de inducción59. Hoy día aún persiste el riesgo de recidiva, lo que hace necesaria la administración de pautas de profilaxis secundaria. De éstas, la más eficaz es la combinación de pirimetamina con sulfadiacina, que puede administrase a diario o a días alternos (AI)37,60,61. En caso de que no se pueda administrar sulfadiacina, ésta se puede cambiar por clindamicina (BI), aunque la actividad frente a T. gondii es menor que con los regímenes que incluyen sulfadiazina, y se pierde la eficacia de éstos frente a P. jiroveci37,60. Si hay intolerancia a ambos fármacos, existe muy poca experiencia con otras alternativas. En estos enfermos se recomienda mantener el tratamiento con el fármaco que se ha usado en la fase aguda9,37,51,62–75: pirimetamina sola o asociada a atovaquona, azitromicina, minociclina o doxicilina, 5-fluorouracilo y clindamicina, y minociclina o doxiciclina con sulfadiacina (CIII). Igualmente, existe muy poca experiencia con dapsona y pirimetamina72 o con cotrimoxazol (CIII)62. También se ha utilizado claritromicina (1 g/12 h) en lugar de azitromicina, pero no se recomienda dado que la claritromicina a esas dosis se asoció con exceso de mortalidad en un estudio de profilaxis frente al Mycobacterium avium complex (MAC)76. En casos de intolerancia a la profilaxis de pirimetamina y sulfadiazina, o dificultades (por el elevado número de comprimidos) para combinar este régimen con el TARGA, y manteniendo viremia del VIH indetectable, en algunas ocasiones se ha sustituido dicha profilaxis por TMP/SMZ (1 comprimido "forte" de 160/800 mg dos veces al día) (CIII)62.
Retirada de las profilaxisAunque no se dispone de muchos estudios, se considera que la profilaxis primaria puede suspenderse cuando se cumplen los requisitos de retirada de la profilaxis primaria para P. jiroveci: TARGA durante al menos 6 meses, con respuesta inmunológica y virológica durante un mínimo de 3 meses (una cifra de linfocitos T CD4+ superior a 200/μl y la carga viral indetectable) (AI)77–80. Un ensayo clínico y varios estudios de cohorte demuestran que la profilaxis secundaria se puede suspender cuando se cumplan los mismos criterios de retirada de la profilaxis primaria y a ser posible después de al menos 12 meses de TARGA y manteniendo una estrecha vigilancia clínica y neurorradiológica después de retirar la profilaxis (BII)43,51,77,81–85 (tabla 3).
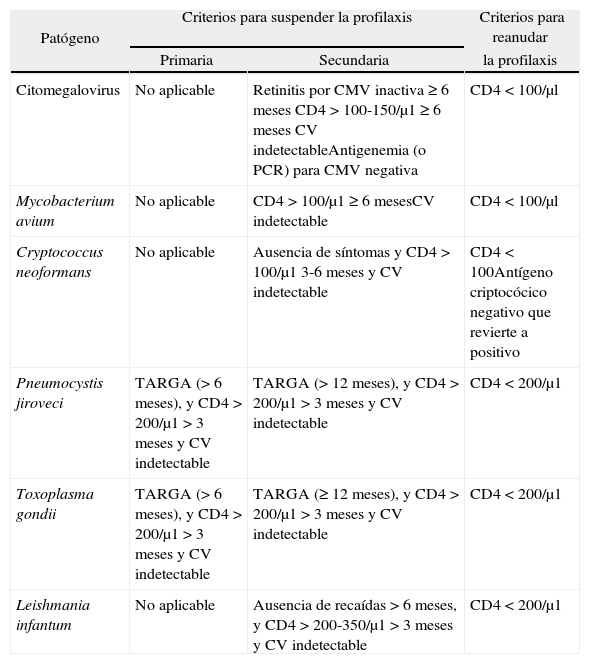
Criterios de retirada y reanudación de las profilaxis de infecciones oportunistas en pacientes adultos y adolescentes infectados por el virus de la inmunodeficiencia humana que reciben tratamiento antirretroviral de gran actividad
| Patógeno | Criterios para suspender la profilaxis | Criterios para reanudar | |
| Primaria | Secundaria | la profilaxis | |
| Citomegalovirus | No aplicable | Retinitis por CMV inactiva ≥ 6 meses CD4 > 100-150/μ1 ≥ 6 meses CV indetectableAntigenemia (o PCR) para CMV negativa | CD4 < 100/μl |
| Mycobacterium avium | No aplicable | CD4 > 100/μ1 ≥ 6 mesesCV indetectable | CD4 < 100/μl |
| Cryptococcus neoformans | No aplicable | Ausencia de síntomas y CD4 > 100/μ1 3-6 meses y CV indetectable | CD4 < 100Antígeno criptocócico negativo que revierte a positivo |
| Pneumocystis jiroveci | TARGA (> 6 meses), y CD4 > 200/μ1 > 3 meses y CV indetectable | TARGA (> 12 meses), y CD4 > 200/μ1 > 3 meses y CV indetectable | CD4 < 200/μ1 |
| Toxoplasma gondii | TARGA (> 6 meses), y CD4 > 200/μ1 > 3 meses y CV indetectable | TARGA (≥ 12 meses), y CD4 > 200/μ1 > 3 meses y CV indetectable | CD4 < 200/μ1 |
| Leishmania infantum | No aplicable | Ausencia de recaídas > 6 meses, y CD4 > 200-350/μ1 > 3 meses y CV indetectable | CD4 < 200/μ1 |
CMV: citomegalovirus; CV: carga viral: PCR: reacción en cadena de la polimerasa; TARGA: tratamiento antirretroviral de gran actividad.
Al igual que se indicaba en relación con la profilaxis de P. jiroveci y con argumentos de similar consistencia, en general se recomienda reiniciar la profilaxis frente a T. gondii cuando el recuento de linfocitos T CD4+ descienda por debajo de 100 o 200/μl o si se produce un episodio de toxoplasmosis cerebral (AIII)37,48,51.
Leishmania spp. (tabla 2)La leishmaniasis visceral es una de las parasitosis asociadas al VIH más frecuentes en España y otros países mediterráneos. Se presenta en individuos muy inmunodeprimidos y su prevalencia varía en función de la presencia de Leishmania infantum (agente causal) en los reservorios (en nuestro medio, cánidos). Existen algunas pruebas de que el TARGA ha modificado la incidencia de la leishmaniasis visceral86–88 y ha reducido sus recidivas en pacientes infectados por el VIH86,89. Sin embargo, pueden ocurrir recidivas en pacientes que permanecen con una cifra baja de linfocitos T CD4+ a pesar del TARGA89.
Medidas para prevenir la exposición al patógenoEs probable que la leishmaniasis pueda transmitirse de persona a persona por el intercambio de jeringuillas88,90, lo que constituye un argumento más para desaconsejar esa práctica (CIII). Por otra parte, en áreas donde los reservorios caninos presenten una elevada prevalencia de infección debería evitarse al perro como animal de compañía (CIII).
Profilaxis primariaNo se ha establecido ninguna profilaxis primaria para esta infección.
Profilaxis secundariaEn la época anterior al TARGA, la incidencia acumulada de recaídas tras un primer episodio de leishmaniasis visceral tratado correctamente era del 60% a los 6 meses y 90% a los 12 meses90,91. En la actualidad el riesgo de recidiva de leishmaniasis tras la curación de la infección inicial constituye todavía un problema no infrecuente en el manejo de estos pacientes. Sin embargo, se ha observado una reducción significativa de dicho riesgo, en relación con la administración completa del tratamiento de inducción anti-Leishmania, seguido de un régimen de profilaxis secundaria, junto con el TARGA, especialmente si éste se acompaña de un control óptimo de la replicación viral y una suficiente recuperación inmunológica (incremento de linfocitos CD4+ > 100 céls./μl)92,93 (BII). El valor de la profilaxis secundaria en pacientes infectados por el VIH ha sido probado en un estudio español, multicéntrico, prospectivo y aleatorizado que comparó la eficacia de anfotericina B complejo lipídico (3 mg/kg/día, cada 21 días) con otro grupo control. El análisis por intención de tratar a los 12 meses mostró que el 50% de los pacientes que recibieron profilaxis estaba libre de recidivas frente al 22% del grupo control (BI)94. También se ha evaluado en estudios observacionales la anfoterinina B liposomal con regímenes diversos95,96. En un estudio español que incluyó 17 pacientes, el 79% estaba libre de enfermedad a los 12 meses de seguimiento96. La dosis y la periodicidad de administración de las anfotericinas liposomales en la profilaxis secundaria de Leishmania no está bien definida, oscilando entre 3-5 mg/kg/día cada 14, 21 o 28 días (tabla 2) (BII). En un estudio retrospectivo no aleatorizado se encontró que la profilaxis secundaria con una dosis mensual de 850 mg de antimonio pentavalente (Glucantime) reducía la frecuencia de recidivas de leishmaniasis visceral en comparación con controles históricos y con un grupo tratado con alopurinol91, hallazgos que no han sido confirmados en estudios prospectivos. La miltefosina es un fármaco de administración oral de reciente introducción, con eficacia demostrada como tratamiento supresor de mantenimiento en animales de experimentación con deficiencia de la inmunidad celular97, que ha resultado tan eficaz como la anfotericina B para tratamiento de la leishmaniasis visceral en pacientes con o sin infección por el VIH98,99; sin embargo, existe muy poca experiencia en pacientes infectados por el VIH tanto para la fase aguda como para el mantenimiento. La dosis recomendada ha sido de 100 mg/día por vía oral (CIII). La pentamidina intravenosa mensual (300 mg) podría utilizarse como alternativa en casos de intolerancia a la anfotericina y/o antimoniales o en leismaniasis refractarias a estos u otros fármacos (CIII)100. No hay experiencia en profilaxis secundaria con paramomicina por vía parenteral101.
Retirada de la profilaxisNo se puede dar una clara recomendación para la retirada de la profilaxis secundaria frente a este patógeno, pero podría considerarse su aplicación en pacientes que logran permanecer al menos 6 meses sin recaídas y que con TARGA tienen una cifra de linfocitos T CD4+ superior a 200/μl y preferiblemente 350/μl con una carga viral en plasma indetectable102 y si es posible una determinación de PCR para Leishmania en sangre o de antígeno en orina negativas103,104 (CIII) (tabla 3).
Otros parásitos (tabla 2)Cryptosporidium spp.Es un protozoo intracelular que produce diarrea en animales y humanos. De las especies conocidas, C. parvum y otras especies (C. muris, C. maleagridis) infectan al ser humano105. El parásito se adquiere por vía digestiva al ingerir agua o alimentos contaminados y por contacto con animales o humanos infectados. Produce una diarrea crónica refractaria al tratamiento en pacientes infectados por el VIH con linfocitos T CD4+ inferiores a 100/μl. Su frecuencia varía entre el 10-15% en occidente y hasta el 50% en países en vías de desarrollo106,107. Una proporción menor de enfermos presenta afectación biliar. Para prevenir la criptosporidiasis debe informarse al paciente sobre la ubicuidad del parásito sobre todo en alimentos que se consumen crudos (verduras, ostras, etc.), agua y excretas. Además, se debe evitar el contacto con enfermos infectados o, en su defecto, extremar las medidas higiénicas (BIII)25,37. No existe quimioprofilaxis eficaz para esta infección25,37; sin embargo, se ha sugerido que la profilaxis para MAC con rifabutina o claritromicina podría reducir su incidencia, aunque los datos no son concluyentes108,109.
MicrosporidiosLa microsporidiasis ha sido la causa más común de diarrea crónica en enfermos con inmunodepresión grave sin patógeno demostrable por métodos convencionales110. La vía de transmisión no está aclarada y su prevalencia no se conoce bien dado lo difícil del diagnóstico. En nuestro medio se ha encontrado en el 22% de los enfermos con sida y diarrea crónica111. La mayoría de los episodios están causados por Enterocytozoon bieneusi y menos frecuentemente por Encephalitozoon intestinalis, que a su vez puede producir infecciones sistémicas. No existe quimioprofilaxis para esta infección25,37. El tratamiento prolongado con albendazol puede controlar la sintomatología9.
Isospora belliEra un agente causante de diarrea crónica durante los primeros años de la epidemia de sida, pero en la actualidad ha desaparecido prácticamente por la profilaxis con TMP-SMZ37,112,113. Tras una isosporidiasis se debe instaurar profilaxis secundaria con TMP-SMZ37,114 (BII); si existe intolerancia a este fármaco, puede emplearse como alternativa ciprofloxacino, aunque su eficacia es algo inferior (BII)114.
Profilaxis de las infecciones causadas por hongosCandida (tabla 4)Medidas para prevenir la exposición al patógenoLa candidiasis orofaríngea es la infección oportunista más frecuente en los pacientes con infección por el VIH. Candida albicans (C. albicans) –el principal patógeno en esta micosis– es un comensal del tracto digestivo en humanos, por lo que no cabe plantearse medidas para evitar su adquisición.
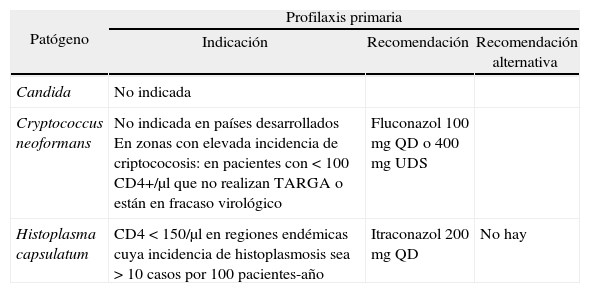
Profilaxis de enfermedades oportunistas producidas por hongos en pacientes adultos y adolescentes infectados por el virus de la inmunodeficiencia humana
| Patógeno | Profilaxis primaria | ||
| Indicación | Recomendación | Recomendación alternativa | |
| Candida | No indicada | ||
| Cryptococcus neoformans | No indicada en países desarrollados En zonas con elevada incidencia de criptococosis: en pacientes con < 100 CD4+/μl que no realizan TARGA o están en fracaso virológico | Fluconazol 100 mg QD o 400 mg UDS | |
| Histoplasma capsulatum | CD4 < 150/μl en regiones endémicas cuya incidencia de histoplasmosis sea > 10 casos por 100 pacientes-año | Itraconazol 200 mg QD | No hay |
| Patógeno | Profilaxis secundaria | ||
| Indicación | Recomendación | Recomendación alternativa | |
| Candida | Recidivas frecuentes de candidiasis orofaríngea o esofágica en pacientes con fracaso al TARGA | Fluconazol: 100-200 mg QD o 200 mg tres veces a la semana | Itraconazol en solución 100 mg BIDAnfotericina B i.v.: 1 mg/kg/UDS, en caso de resistencia a los azoles |
| Cryptococcus neoformans | Criptococosis documentada | Fluconazol 200 mg QD | Anfotericina B: 1 mg/kg UDSItraconazol: 200 mg/día |
| Histoplasma capsulatum | Histoplasmosis documentada | Itraconazol 200 mg BID | No hay |
| Coccidioides immitis | Coccidioidomicosis documentada | Fluconazol 400 mg QD | Anfotericina B: 1 mg/kg UDS o Itraconazol 200 mg QD |
| Penicillium marneffei | Peniciliosis documentada | Itraconazol 200 mg QD | No hay |
BID: dos veces al día; i.v.: por vía intravenosa; QD: una vez al día; TARGA: tratamiento antirretroviral de gran actividad; UDS: una vez a la semana.
No se recomienda profilaxis primaria para esta micosis (DII).
Profilaxis secundariaLas candidiasis orofaríngea y esofágica responden muy bien a los antifúngicos sistémicos, pero en situaciones de inmunodepresión avanzada, cerca del 80% de los pacientes sufre recaídas de las mismas en los primeros 3 meses después de haber finalizado el tratamiento. Diferentes estudios han demostrado que fluconazol o itraconazol en solución reducen las recidivas; sin embargo, no se recomienda su uso sistemático, dado que su incidencia se ha reducido drásticamente con el TARGA, revisten poca gravedad, implican un bajo riesgo de desarrollar enfermedad invasiva, pueden diagnosticarse fácilmente y responden bien al tratamiento (DII). Respecto a la posibilidad de que la profilaxis secundaria con fluconazol favorezca las infecciones por cepas de Candida resistentes a los azoles, en varios estudios controlados se ha observado que los pacientes que reciben profilaxis secundaria con fluconazol no presentan una mayor incidencia de candidiasis orofaríngea y/o esofágica resistentes a dicho fármaco que los que sólo realizan tratamiento de los episodios115–117. El TARGA es actualmente la mejor estrategia para evitar las candidiasis mucosas (AII)118. Cuando el TARGA fracasa y el paciente presenta frecuentes recidivas puede considerarse la profilaxis secundaria con dosis diarias (100-200 mg) o intermitentes (200 mg tres veces a la semana) de fluconazol115,119 (CIII). Algunos pacientes acaban desarrollando candidiasis resistente a azoles y requieren tratamiento supresor crónico con anfotericina B37 (CIII). En este escenario hay poca experiencia con los nuevos azoles (voriconazol o posaconazol) y equinocandinas (caspofungina, micafungina, anidulafungina).
Cryptococcus neoformans (tabla 4)Medidas para prevenir la exposición al patógenoLa criptococosis es la micosis más grave en pacientes infectados por el VIH. No se conocen medidas efectivas para evitarla, pese a que se sabe que en la mayoría de los casos el hongo penetra en el organismo por vía respiratoria. No obstante, y aunque la mayoría de los episodios se producen por reactivación de infecciones latentes, es prudente evitar el contacto habitual con aves, especialmente palomas, cuyas deposiciones contienen con frecuencia este hongo.
Profilaxis primariaEn numerosos trabajos se ha demostrado la reducción del riesgo de criptococosis con diversas dosis diarias o semanales de fluconazol. Pese a ello, tampoco se recomienda la profilaxis primaria para esta micosis sistémica en los países desarrollados porque: a) su incidencia es relativamente baja; b) no mejora la supervivencia de los pacientes119,120; c) tiene un alto coste económico; d) puede favorecer el desarrollo de micosis resistentes, y e) su mejor profilaxis es la repoblación de linfocitos T CD4+ inducida por el TARGA (DI). No obstante, en zonas de elevada incidencia de criptococosis (África subsahariana, Sudeste Asiático y algunos países de América Latina) parece razonable recomendar profilaxis primaria con fluconazol a los pacientes con < 100 CD4/μl que no realizan TARGA o están en situación de fracaso terapéutico121,122. En dichas zonas, dada la frecuencia de criptococosis como síndrome de reconstitución inmune, puede ser útil la determinación de antígeno criptocócico antes de iniciar el TARGA para diagnosticar y tratar infecciones subclínicas que pudieran causar dicho síndrome123.
Profilaxis secundariaAntes de la introducción del TARGA, las recaídas de criptococosis asociada al sida eran muy frecuentes tras finalizar el tratamiento de inducción y distintos estudios demostraron la eficacia de la profilaxis secundaria para prevenirlas. Posteriormente se observó que en los pacientes que se recuperan inmunológicamente con el TARGA disminuye en gran medida el riesgo de recidiva de criptococosis124,125. En cualquier caso, tras el tratamiento de la fase aguda de la criptococosis, todos los pacientes deben realizar profilaxis secundaria. La pauta de elección es fluconazol a dosis de 200 mg/día, que reduce la frecuencia de recaídas al 2-4% (AI)126. Las alternativas son: anfotericina B (1 mg/kg/semana), con un porcentaje de recaídas del 17%127, e itraconazol (200 mg/día), con un 23% de recaídas. En este escenario hay poca experiencia con las formulaciones lipídicas de anfotericina B y los nuevos azoles (voriconazol o posaconazol). Las equinocandinas no son activas.
Retirada de las profilaxisUn ensayo clínico128 y un estudio de cohortes129 indican que la retirada de la profilaxis secundaria puede llevarse a cabo con seguridad en pacientes que estén asintomáticos y tengan una cifra de linfocitos T CD4+ > 100/μl durante al menos 3-6 meses y una carga viral plasmática de VIH indetectable, sin que sea necesaria la negatividad del antígeno criptocócico (BII). Tras la retirada de la profilaxis secundaria los pacientes deben ser revisados periódicamente de forma clínica y analítica. Es prudente reanudar la profilaxis en caso de que se documente un descenso en la cifra de linfocitos T CD4+ o cuando un antígeno criptocócico negativo revierta a positivo37 (BIII).
Otros hongos (tabla 4)Histoplasma capsulatum
Es la micosis regional más frecuente en pacientes con sida. En zonas endémicas, la histoplasmosis se puede prevenir evitando actividades de riesgo como las visitas a cuevas, la exposición al polvo ambiental, el talado de árboles, la limpieza de gallineros y el derribo o desescombro de edificios (CIII). La profilaxis primaria con itraconazol a dosis de 200 mg/día sólo está indicada en pacientes con una cifra de linfocitos T CD4+ < 150/μl y con alto riesgo por exposición ocupacional o que vivan en zonas hiperendémicas en las que la incidencia de histoplasmosis es > 10 casos por 100 pacientes-año (AI)130,131. En nuestro país podría plantearse en inmigrantes infectados por el VIH originarios de países endémicos. Para la profilaxis secundaria se recomienda itraconazol a dosis de 200 mg/12 h (AII)132. Para la retirada de la profilaxis secundaria en pacientes que se recuperan inmunológicamente con el TARGA se exige una cifra de CD4+ > 150 céls./μl mantenida al menos durante 6 meses131,133 (CIII).
Penicillium marneffeiLa peniciliosis es una micosis endémica en el Sudeste Asiático que responde bien al tratamiento con anfotericina B o itraconazol. Aunque esta infección parece estar relacionada con la exposición a tierra, no se conoce bien el reservorio del hongo ni la puerta de entrada del mismo, por lo que no pueden recomendarse medidas concretas para evitar el contagio. En zonas endémicas, la profilaxis primaria con itraconazol reduce la incidencia de peniciliosis en pacientes con infección por el VIH e inmunosupresión grave (especialmente con linfocitos T CD4+ < 100/μl), pero no se ha demostrado que esta intervención prolongue la supervivencia de los pacientes (CII)134. Las recidivas tras el tratamiento son muy frecuentes, por lo que está indicada la profilaxis secundaria con itraconazol a dosis de 200 mg/día, según un estudio prospectivo, aleatorizado y controlado con placebo que ha demostrado su eficacia (AI)135. Existen evidencias de que la retirada de la profilaxis secundaria es segura en pacientes con TARGA y > 100 CD4+ /μl durante 6 meses o más y carga viral indetectable136,137.
MisceláneaPara la coccidiodomicosis se recomienda profilaxis secundaria con fluconazol (400 mg/día), itraconazol (200 mg/ 12 h) o anfotericina B (1 mg/kg/semana) (AII)138. No existen estudios acerca de la profilaxis secundaria para la aspergilosis, la blastomicosis ni la paracoccidioidomicosis37.
Profilaxis de las infecciones causadas por virusCitomegalovirus (tabla 5)Antes de la introducción del TARGA desarrollaban enfermedad por citomegalovirus (CMV) aproximadamente el 45% de los pacientes coinfectados por el VIH y CMV. Además, en aquellos coinfectados que tenían una cifra de linfocitos T CD4+ < 100/μl, el 22% desarrollaba en el plazo de 2 años una retinitis por CMV, un problema grave e incapacitante cuyas frecuentes recaídas y complicaciones podían llegar a ocasionar pérdida de la visión139.
Profilaxis de enfermedades oportunistas producidas por virus en pacientes adultos y adolescentes infectados por el virus de la inmunodeficiencia humana
| Patógeno | Profilaxis primaria | ||
| Indicación | Recomendación | Recomendación alternativa | |
| Citomegalovirus | CD4 ≤ 50/μl y serología positiva a CMV | TARGA con revisiones oftalmológicas periódicas -con o sin determinación de CMV en sangre por PCR-para detectar precozmente la enfermedad durante 3-4 meses (en caso de positividad valorar tratamiento anticipado con valganciclovir) | Valganciclovir v.o. 900 mg QD |
| Virus del herpes simple | No indicada | ||
| Virus de la varicela-zóster | Pacientes susceptibles a VVZ que han tenido contacto con personas con varicela o zóster diseminado | Ig anti-VVZ vía i.m. dentro de las 96 h posteriores al contacto. En < 50 kg 125 UI/10 kg y si > 50 kg 625 UI | Aciclovir 800 mg 5 veces al día v.o. durante 7 días |
| Virus A de la hepatitis | Pacientes sin IgG anti-VHA con linfocitos T CD4+ > 200/μlPacientes sin IgG anti-VHA y hepatitis crónica por VHC, independientemente de la cifra de linfocitos T CD4+ | Vacuna para la hepatitis A, 2 dosis (0 y 6 o 12 meses) | Vacuna para la hepatitis A 3 dosis (0,1 y 6 meses) en pacientes con linfocitos T CD4 200-300/μl |
| Virus B de la hepatitis | Personas HBsAg y anti-HBc negativos, que no se hayan vacunado previamente | Vacuna para la hepatitis B, 3 dosis (0,1 y 6 meses) con doble cantidad de antígeno (40 μg) | Vacuna para la hepatitis B, 4 dosis (0,1,2 y 6 meses) con doble cantidad de antígeno (40 μg) |
| Virus de la gripe | A todos los pacientes anualmente | Vacuna antigripal | |
| Patógeno | Profilaxis secundaria | ||
| Indicación | Recomendación | Recomendación alternativa | |
| Citomegalovirus | Pacientes con retinitis por CMV en remisión tras un ciclo de inducción | Valganciclovir v.o. 900 mg QD | Ganciclovir i.v. 5-6 mg/kg 5-7 días x semanaFoscarnet i.v. 90-120 mg/kg 5-7 días x semanaImplante de ganciclovirGanciclovir i.v. 10 mg/kg 3 días x semanaCidofovir i.v. 5 mg/kg cada 2 semanasFomivirsen 330 μg intravítreo al mes |
| Virus herpes simple | Recidivas frecuentes (> 6 al año) o graves | Aciclovir 400 mg v.o. TID o 800 mg v.o. BIDFamciclovir 500 mg v.o. BIDValaciclovir 500 mg v.o. BID | En cepas resistentes a aciclovir: foscarnet i.v. o cidofovir i.v. |
BID: dos veces al día; CMV: citomegalovirus; Ig: inmunoglobulina; i.m.: intramuscular; i.v.: vía intravenosa; QD: una vez al día; TARGA: tratamiento antirretroviral de gran actividad; TID: tres veces al día; VHA: virus A de la hepatitis; v.o.: vía oral; VVZ: virus de la varicela-zóster.
El TARGA redujo drásticamente la incidencia de esta enfermedad y cambió de forma espectacular su historia natural con prolongación de la supervivencia y disminución de las recaídas y complicaciones140–142. De hecho, en un gran ensayo clínico aleatorizado en donde se comparaban tres tratamientos anti-CMV, la frecuencia de nueva enfermedad por CMV fue menor en los pacientes que recibieron inhibidores de la proteasa (IP) independientemente del grupo terapéutico asignado143. Por estas razones se puede decir que el TARGA desempeña en la actualidad un papel de primer orden en la profilaxis y el tratamiento de la enfermedad por CMV independientemente del antivírico que estén recibiendo los pacientes. Un efecto adverso que conviene tener presente en los pacientes con retinitis por CMV que inician TARGA es la vitritis por recuperación inmune que en ocasiones produce una pérdida importante de la visión141,144,145.
Medidas para prevenir la exposición al patógenoLos pacientes que pertenezcan a grupos de población con baja frecuencia de infección por CMV y en los que no se pueda presumir la seropositividad frente al virus deben ser estudiados serológicamente para el CMV. Estos pacientes incluyen, entre otros, a los que nunca han consumido drogas por vía parenteral y a los varones que no han tenido relaciones homosexuales (BIII). Los pacientes con serología negativa a CMV no deben recibir trasfusiones de hemoderivados procedentes de pacientes con serología positiva a CMV (B3) y deben evitar los contactos sexuales sin preservativo (AII). El riesgo de adquisición de CMV puede disminuirse mediante buenas prácticas higiénicas, tales como el lavado de manos. Dichas prácticas higiénicas son particularmente importantes en ambientes como guarderías, donde el riesgo de contagiarse con CMV es mayor (B3)25.
Profilaxis primariaSe han publicado dos ensayos clínicos –prospectivos, aleatorizados, a doble ciego y controlados con placebo– de profilaxis primaria con ganciclovir por vía oral en pacientes coinfectados por VIH y CMV146,147. En el primero –con más de 700 pacientes con una cifra de linfocitos T CD4+ ≤ 50/μl o con una cifra < 100/μl y antecedente de infección indicativa de sida– la incidencia acumulada de enfermedad visceral por CMV a los 12 meses fue del 14% en el grupo de ganciclovir y del 26% en el grupo placebo, y la incidencia acumulada de retinitis por CMV fue del 12 y el 24%, respectivamente (riesgo relativo, 0,49; p < 0,001); no se detectaron diferencias en mortalidad146. El segundo, con más de 900 pacientes, difería del anterior en dos puntos importantes. En primer lugar el criterio de inclusión en el estudio respecto a la cifra basal de linfocitos T CD4+ era ≤ 100/μl. En segundo lugar, cuando el estudio estaba en marcha –tras conocerse los resultados del estudio anterior– se aceptó que todos los pacientes tuvieran acceso a ganciclovir. No se encontraron diferencias con respecto a la incidencia de enfermedad por CMV y la mortalidad hasta la fecha de modificación del estudio ni hasta el final del mismo. Sin embargo, se detectaron más efectos adversos –sobre todo neutropenia– en el grupo de ganciclovir que en el grupo de placebo147.
La profilaxis primaria con ganciclovir oral para la enfermedad por CMV no se recomienda debido a los resultados contradictorios respecto a su eficacia, el nulo impacto en la supervivencia, la posibilidad de desarrollo de resistencias, la toxicidad del fármaco y su coste (CI). La mejor estrategia preventiva es la administración de TARGA para restaurar el sistema inmunológico (AI).
Es muy importante tener presente que en los pacientes que inician TARGA con linfocitos T CD4+ < 50/μl existe un período de riesgo de 3 a 4 meses durante los cuales pueden sufrir retinitis por CMV incluso con cifras de linfocitos T CD4+ > 100/μl. En estos casos podría realizarse estudios de antigenemia o PCR de CMV, dado que la probabilidad de desarrollar retinitis por CMV es del 38% para los pacientes con una prueba positiva frente al 2% para los pacientes con una prueba negativa (p < 0,001) (CII)140. Los pacientes con una prueba positiva deben ser revisados mediante fundoscopia cada 2 o 4 semanas durante los primeros 3 meses para detectar precozmente la enfermedad (CIII). Además, varios estudios describen peor evolución clínica en los pacientes con viremia CMV, independiente de CD4+ o carga viral148.
En estos casos podría tener sentido administrar tratamiento anticipado anti-CMV, una intervención que se ha evaluado mediante un ensayo clínico aleatorizado (estudio ACTG A5030). En dicho estudio se incluyeron pacientes infectados por el VIH con serología positiva para CMV y con cifra de linfocitos T CD4+ < 100/μl a pesar del TARGA. Todos los pacientes fueron visitados cada 2 meses mediante PCR del ADN del CMV y cada 6 meses con una exploración oftalmológica. Aquellos en los que se detectó viremia de CMV fueron aleatorizados a recibir valganciclovir o placebo. No se encontró beneficio clínico del tratamiento anticipado con valganciclovir oral comparado con placebo en estos pacientes que ya estaban recibiendo TARGA, pero hay que tener en cuenta que el estudio fue suspendido debido a la baja inclusión de pacientes, que sólo se compararon 23 pacientes en cada grupo de tratamiento149, y que estudios previos han resaltado que el tratamiento anticipado podría ser coste-efectivo150.
Algunos autores aconsejan en pacientes con CD4 < 50/μl y serología positiva para CMV detectar precozmente la enfermedad realizando controles oftalmológicos periódicos durante los primeros 3-4 meses tras inicio del TARGA (CIII).
Profilaxis secundariaLa estrategia terapéutica de la retinitis por CMV está bien delineada desde hace años; consta de una fase de inducción que pretende controlar la infección seguida de una fase de mantenimiento para evitar o retrasar las recaídas139,151. Para esta segunda indicación disponemos de fármacos que se pueden administrar por vía intravenosa, como ganciclovir, foscarnet y cidofovir; fármacos que nunca han sido comparados entre sí y que tienen un perfil toxicológico diferente. Por vía oral se dispone de ganciclovir y de valganciclovir, que es el éster de valina del ganciclovir. La biodisponibilidad del ganciclovir por vía oral es muy pobre, lo que le resta eficacia con respecto al ganciclovir administrado por vía intravenosa y obliga a los pacientes a tomar un gran número de comprimidos152. El valganciclovir, sin embargo, se metaboliza por enzimas del tubo digestivo y se transforma prácticamente en un 100% en ganciclovir153. En un ensayo clínico aleatorizado y abierto llevado a cabo con 160 pacientes con sida y retinitis por CMV recién diagnosticada se comprobó que el valganciclovir oral es tan eficaz como el ganciclovir intravenoso como tratamiento de inducción y resulta muy cómodo y eficaz para la fase de mantenimiento143. Por vía tópica se dispone del implante de ganciclovir -sin rival para el tratamiento de la retinitis por CMV-aunque antes del TARGA necesitaba el uso concomitante de ganciclovir por vía oral para evitar tanto la enfermedad del ojo vecino como la extraocular154. En un estudio reciente en que se comparó el implante de ganciclovir con o sin ganciclovir por vía oral y el ganciclovir por vía intravenosa se comprobó que, en el subgrupo de pacientes tratados con TARGA, la incidencia de recaídas o de nueva enfermedad fue baja y de la misma magnitud en todos los grupos155. Por vía tópica también puede administrarse el fomivirsen, un oligonucleótido antisentido que inhibe la replicación del CMV y que se administra por inyección intravítrea. En la fase de mantenimiento la dosis es de 330 μg al mes. Los efectos indeseables son: aumento de la presión e inflamación ocular transitorios o reversibles con tratamiento esteroideo tópico; en la actualidad está indicado para el tratamiento de las recidivas156.
En vista de las numerosas opciones para la profilaxis secundaria de la retinitis por CMV lo recomendable es elegir el fármaco que mejor se adapte al paciente157, aunque dada su demostrada eficacia y su comodidad, podría considerarse al valganciclovir por vía oral como fármaco de elección (AI).
Retirada de la profilaxis secundariaEn los pacientes que se recuperan inmunológicamente con el TARGA, cabe la posibilidad de retirar la profilaxis secundaria anti-CMV158,159. Se han publicado cuatro estudios de retirada de la profilaxis secundaria anti-CMV. En el primero se incluyeron 14 pacientes y no se detectaron recaídas tras una mediana de seguimiento de 16,4 meses160. En el segundo estudio, 3 de 22 pacientes que suspendieron la profilaxis secundaria sufrieron una recidiva de la retinitis por CMV161. En los tres casos, los pacientes habían experimentado fracaso al TARGA y tenían una cifra de linfocitos T CD4+ < 50/μl en el momento de la recaída. El tercer estudio fue multinacional e incluyó a 48 pacientes, de los que dos sufrieron una recaída de la enfermedad por CMV: retinitis en un caso y neuropatía periférica en el segundo. Sorprendentemente, las cifras de linfocitos T CD4+ en el momento de la recaída fueron de 352 y de 106/μl, respectivamente162. Finalmente, en un cuarto estudio multicéntrico español, se retiró la profilaxis secundaria a 36 pacientes y tras una mediana de seguimiento de 90 semanas, no se observó reactivación o progresión de la retinitis en los 35 que tuvieron una buena respuesta al TARGA. Sin embargo, en un paciente con fracaso inmunológico se documentó recaída de la retinitis a las 44 semanas de haber suspendido la profilaxis y en el contexto de fracaso inmunológico. En el momento de la recaída la cifra de linfocitos T CD4+ era de 62/μl163.
Tomados en conjunto, los resultados de estos cuatro estudios avalan la seguridad de la interrupción de la profilaxis secundaria anti-CMV en pacientes con sida y retinitis por CMV inactiva que experimentan un incremento en la cifra de linfocitos T CD4+ con el TARGA. Sin embargo, se desconoce cuál es la cifra de linfocitos T CD4+ a partir de la cual resulta seguro suspender la profilaxis. Si se combinan los datos de los cuatro estudios (79 pacientes) se puede observar que la mediana de linfocitos T CD4+ en el momento de la retirada de la profilaxis fue de 269/μl con un rango intercuartílico de 167-360/μl. Más de dos tercios de los pacientes tenían linfocitos T CD4+ > 200/μl, menos de un tercio tenía linfocitos T CD4+ entre 100 y 200/μl y tan sólo 3 pacientes tenían linfocitos T CD4+ < 100/μl. Todo lo anterior permite concluir que la retirada de la profilaxis secundaria es una opción razonable y segura en pacientes con retinitis por CMV inactiva y que tienen una buena respuesta al TARGA caracterizada por una cifra de linfocitos T CD4+ > 200/μl durante al menos 6 meses (BII). En algunos casos puede considerarse la retirada de la profilaxis secundaria anti-CMV en pacientes que presentan una cifra de linfocitos T CD4+ entre 100 y 200/μl, dado que la mayoría de los pacientes que recayeron en los estudios mencionados tenían CD < 100/μl (CIII). Tras la retirada de la profilaxis secundaria, los pacientes pueden ser controlados con determinaciones periódicas de la cifra de linfocitos T CD4+ (BIII). En aquellos que experimenten fracaso inmunológico se debe optar o bien por revisiones oftalmológicas frecuentes o por reanudación de la profilaxis secundaria, dependiendo del riesgo que tengan de sufrir una pérdida irrecuperable de la visión (BIII) (tabla 3).
Otros virus (tabla 5)Los pacientes infectados por el VIH suelen presentar infección mucocutánea y digestiva por herpes virus simple (VHS), pero no se recomienda profilaxis primaria frente a este virus (DIII). Las recaídas responden bien al tratamiento, por lo que tampoco se aconseja instaurar tratamiento supresor exceptuando el herpes genital con recaídas frecuentes (≥ 6 recidivas al año) y/o graves (AI), para el cual se recomienda lo siguiente para pacientes infectados por el VIH: aciclovir (400-800 mg dos o tres veces al día)164, o famciclovir (500 mg dos veces al día) o valaciclovir (500 mg dos veces al día)164. En infecciones por cepas de VHS resistente a aciclovir debe usarse foscarnet intravenoso o cidofovir por vía intravenosa o tópica (AII). Dado que la frecuencia de recaídas se reduce con el tiempo en muchos pacientes, debe valorarse de forma periódica (p. ej., cada año) la retirada del tratamiento supresor (BII)164. Una ventaja adicional para el tratamiento supresor sería disminuir la excreción genital de VIH, como se ha encontrado con valaciclovir en mujeres africanas165.
No se debe vacunar con el virus de la varicela-zóster (VVZ) a personas infectadas por el VIH, pero sí a las que conviven con ellas en caso de que sean susceptibles al VVZ (aquellas sin anticuerpos específicos IgG) (BIII). Los pacientes con infección por el VIH susceptibles al VVZ deben evitar los contactos con personas con varicela o zóster (AII). Para la profilaxis postexposición en sujetos susceptibles se recomienda administrar gammaglobulina específica dentro de las 96 h siguientes al contacto (AIII). Otra opción más barata y logísticamente más sencilla es la administración de aciclovir oral (CIII), aunque la eficacia de esta medida sólo se ha probado en niños inmunocompetentes tras exposición domiciliaria25,166.
Se recomienda la vacunación frente al virus de la hepatitis A (VHA) para todos los pacientes infectados por el VIH que no tengan anticuerpos IgG anti-VHA con los mejores CD4 posibles (AIII)25,167. La tasa de respuesta es de alrededor del 50%168. En un ensayo clínico francés (estudio HEPAVAC) que comparaba 3 dosis (0, 4 y 24 semanas) con las 2 dosis convencionales (0 y 24 semanas) en pacientes con una cifra de linfocitos CD4 que oscilaban entre 200 y 500 céls./μl, se observó una mayor tasa de seroconversiones en la rama de 3 dosis (el 71 frente al 58%; p = 0,20), siendo sólo significativa en los pacientes con menos de 350 linfocitos CD4/μl (el 73 frente al 39%; p = 0,02)169. Por tanto, se pueden recomendar 3 dosis en los pacientes con menos de 350 linfocitos CD4/μl (BI). La vacunación frente al VHA se debe administrar a todos los pacientes con hepatopatía crónica por virus de la hepatits C (VHC) dado que existe riesgo de hepatitis fulminante y muerte en la superinfección por VHA170.
También se recomienda la vacunación frente al virus de la hepatitis B (VHB) a todos los pacientes infectados por el VIH que sean HBsAg y anti-HBc total negativos y que no se hayan vacunado previamente (AIII). La pauta estándar de vacunación frente al VHB son 3 inyecciones (0, 1 y 6 meses) con 20 μg de antígeno25,167. Sin embargo, la respuesta inmunogénica con la pauta estándar de administración de la vacuna del VHB está disminuida en los pacientes infectados por el VIH y guarda relación con la cifra de linfocitos T CD4+. La respuesta a la vacuna frente al VHB en pacientes inmunodeprimidos puede incrementarse con mayores dosis de antígeno171, aumentando el número de dosis172,173 o utilizando inmunomoduladores174,175. En un ensayo clínico a doble ciego controlado con placebo en el que se comparó la administración 3 dosis estándar (20 μg) con la doble dosis (40 μg) de vacuna frente al VHB en 210 pacientes infectados por el VIH171, se observó una mayor respuesta en los pacientes que recibieron la doble dosis, aunque sólo fue significativa en aquellos con menos de 350 linfocitos CD4. En otro estudio con 32 pacientes, la administración de una dosis adicional de vacuna aumentó la proporción de respondedores, pero sólo marginalmente172. Sin embargo, se observó un incremento por seis veces de la media del valor de anticuerpos en los respondedores. En un tercer estudio que incluyó a 9 pacientes no respondedores a la pauta convencional y a los que se duplicó el número de dosis de vacuna, se objetivó una respuesta en siete de ellos173. Finalmente, Cooper et al174,175 han demostrado en un ensayo clínico a doble ciego, controlado con placebo, que incluyó a no respondedores a la vacunación convencional, que el grupo de pacientes vacunado duplicando la dosis de vacuna y añadiendo un inmunomodulador (CPG 7909) tuvo una respuesta significativamente mejor que el grupo que sólo recibió doble dosis (p < 0,05). Sin embargo, el inmunomodulador aún no está comercializado. Por todo ello, este panel de expertos recomienda administrar una pauta de 3 dosis de la vacuna para el VHB (0, 1 y 6 meses) con doble cantidad de antígeno (40 μg en vez de 20 μg) (BI). Como alternativa, se podría administrar una pauta de 4 dosis (0, 1, 2 y 6 meses) con doble cantidad de antígeno (40 μg), tal como se recomienda en los pacientes dializados o inmunodeprimidos (CIII)176.
Como práctica general, se recomienda vacunar con los mejores CD4+ posibles o, en el caso de existir inmunodepresión importante, iniciar la vacunación tras haber iniciado el TARGA y negativizado la carga viral del VIH en plasma (CIII).
La administración de la vacuna recombinante con dosis fijas de antígeno frente al VHA y VHB (Twinrix®) no debería administrarse en los pacientes infectados por el VIH, ya que la dosis recombinante de antígeno del VHB no es la recomendada (DIII)167,176.
Se sabe poco acerca de la frecuencia y consecuencias de la coinfección por el VIH y el virus de la gripe. En algunos estudios retrospectivos se ha encontrado que la gripe tiene mayor morbimortalidad en pacientes infectados por VIH que entre la población general. Sin embargo, existen pruebas que nos indican que los ingresos hospitalarios por gripe han disminuido de forma significativa a partir de la introducción del TARGA alcanzando tasas similares a las de otros grupos de población considerados de "alto riesgo"177. Por estas razones, y dado que la vacunación antigripal puede producir un título de anticuerpos protectores en pacientes infectados por el VIH, se recomienda que todos ellos (incluso las mujeres embarazadas) reciban la vacuna con carácter anual (AIII)25,178.
El TARGA es la única intervención que puede prevenir la leucoencefalopatía multifocal progresiva (LMP) y que puede interrumpir el ciclo lítico del virus JC9,25,37. Según datos recientes, la mortalidad ha disminuido hasta el 30% aproximadamente y la mayoría experimenta mejoría en la función neurológica. La mortalidad es mayor en aquellos con cifra de linfocitos T CD4+ < 100/μl y el pronóstico es peor en los que desarrollan LMP como fracaso del TARGA9,179.
Profilaxis de las infecciones por micobacteriasMycobacterium tuberculosis (tabla 6)La infección por el VIH es el factor de riesgo más importante para la progresión de tuberculosis latente a tuberculosis activa y además favorece la progresión a enfermedad tuberculosa tras la infección de reciente adquisición180,181. Por este motivo, la notificación de casos de tuberculosis aumentó significativamente en los países con gran prevalencia de infección por el VIH. Afortunadamente, en diferentes países se ha constatado una disminución de casos de coinfección por el VIH y tuberculosis tras la introducción del TARGA182, aunque la incidencia sigue siendo muy superior a la de la población no infectada por el VIH, independientemente de las características basales de los pacientes183,184.
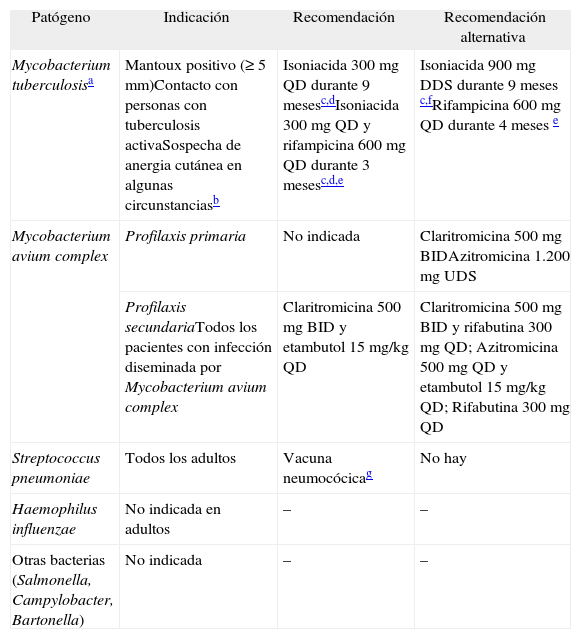
Profilaxis de enfermedades oportunistas producidas por bacterias y micobacterias en pacientes adultos y adolescentes infectados por el virus de la inmunodeficiencia humana
| Patógeno | Indicación | Recomendación | Recomendación alternativa |
| Mycobacterium tuberculosisa | Mantoux positivo (≥ 5 mm)Contacto con personas con tuberculosis activaSospecha de anergia cutánea en algunas circunstanciasb | Isoniacida 300 mg QD durante 9 mesesc,dIsoniacida 300 mg QD y rifampicina 600 mg QD durante 3 mesesc,d,e | Isoniacida 900 mg DDS durante 9 meses c,fRifampicina 600 mg QD durante 4 meses e |
| Mycobacterium avium complex | Profilaxis primaria | No indicada | Claritromicina 500 mg BIDAzitromicina 1.200 mg UDS |
| Profilaxis secundariaTodos los pacientes con infección diseminada por Mycobacterium avium complex | Claritromicina 500 mg BID y etambutol 15 mg/kg QD | Claritromicina 500 mg BID y rifabutina 300 mg QD; Azitromicina 500 mg QD y etambutol 15 mg/kg QD; Rifabutina 300 mg QD | |
| Streptococcus pneumoniae | Todos los adultos | Vacuna neumocócicag | No hay |
| Haemophilus influenzae | No indicada en adultos | – | – |
| Otras bacterias (Salmonella, Campylobacter, Bartonella) | No indicada | – | – |
BID: dos veces al día; DDS: dos días a la semana; QD: una vez al día; TID: tres veces al día; UDS: un día a la semana.
En caso de tuberculosis resistente a isoniacida utilizar las pautas cortas de rifampicina y pirazinamida o de rifampicina sola. Si se sospecha infección por cepa multirresistente escoger la profilaxis en función de la sensibilidad de la cepa. Si el antibiograma no se conoce,administrar pirazinamida y etambutol o una fluoroquinolona.
Antecedente de prueba de Mantoux positiva, historia de contacto estrecho y prolongado con personas con tuberculosis activa no tratada e historia de estancia prolongada en centro penitenciario sin haber recibido profilaxis adecuada.
Los pacientes infectados por el VIH deben recibir piridoxina (vitamina B6) junto con la isoniacida para evitar la neuropatía periférica por interferencia con el metabolismo de esta vitamina.
A la hora de decidir la pauta de quimioprofilaxis debe considerarse que existen preparados comerciales de isoniacida sola (2 comprimidos día) y de la combinación de isoniacida y rifampicina (2 comprimidos/día).
La rifampicina puede sustituirse por rifabutina cuando el paciente debe recibir un inhibidor de la proteasa (IP). En estos casos la dosis de rifabutina debe ser 150 mg QD o 300 mg 2 o 3 días por semana. También se debe aumentar la dosis de algunos IP: indinavir a 1.000 mg TID y nelfinavir 1.000 mg TID.
Las personas infectadas por el VIH deben ser informadas sobre cómo se transmite la tuberculosis, del riesgo que tienen de desarrollarla y del significado de la prueba de la tuberculina. En la medida de lo posible deben evitar trabajar en ambientes de alto riesgo, como centros penitenciarios, albergues para indigentes y unidades de hospitalización con enfermos con tuberculosis activa (BIII). También deben conocer la conveniencia de consultar a su médico cuando tengan síntomas sugestivos de tuberculosis o tras haber tenido contacto con una persona con tuberculosis pulmonar activa (BIII).
Profilaxis (tratamiento de la infección tuberculosa latente)Evaluación del riesgo de desarrollo de tuberculosisTras la primera visita es obligado realizar la prueba de la tuberculina (AI). En los últimos años se han comercializado dos métodos para la determinación de interferón-γ en sangre periférica que son más específicos que la tuberculina (evitarían los falsos positivos del bacilo de Calmette-Guérin [BCG] y micobacterias ambientales) y más sensibles (evitarían los falsos negativos de los pacientes anérgicos). La Food and Drug Administration (FDA) norteamericana ha aprobado el QuantiFERON-TB Gold en tubo® y la EMEA el T-SPOT.TB®. Se han efectuado algunos estudios en pacientes infectados por el VIH con ambos métodos185–188. Aunque no se han comparado entre sí, parece evidente que el ELISPOT es más sensible que el QuantiFERON en los pacientes inmunodeprimidos189,190. Sin embargo, en estos momentos aún no se puede recomendar para su uso sistemático en esta población, sustituyendo a la prueba de la tuberculina (CIII).
Hace años también se recomendaban las pruebas de anergia cutánea; sin embargo, diversos estudios han mostrado su escasa consistencia y fiabilidad, así como la falta de beneficio de la quimioprofilaxis en los pacientes anérgicos, especialmente si pueden recibir TARGA191–194. Por estos motivos no se recomienda actualmente realizar estas pruebas para tomar decisiones sobre el tratamiento de la infección tuberculosa latente (DII). Se están realizando estudios con los métodos que determinan interferón-7 en este tipo de pacientes. Tampoco existe fundamento para repetir la prueba de la tuberculina como medida de reconstitución inmune tras el TARGA. La prueba sí debe repetirse para evaluar el riesgo de conversión en personas que viven en zonas con alto riesgo de transmisión de tuberculosis activa (BIII).
Existen dos grupos de pacientes que –sin género de dudas– deben recibir tratamiento para la infección tuberculosa latente: los que tienen una prueba de la tuberculina positiva (≥ 5 mm) (AI) y los que han tenido contacto estrecho con una persona bacilífera (BII). No debe olvidarse que el riesgo de desarrollar tuberculosis en las personas con una prueba de tuberculina positiva sigue siendo muy alto aún con recuentos elevados de CD4 o de recibir tratamiento antirretroviral195,196. El riesgo de tuberculosis entre los pacientes anérgicos varía mucho de unos estudios a otros, por lo que no pueden darse recomendaciones universales197,199. La profilaxis está indicada en los pacientes con mayor riesgo de infección por M. tuberculosis, como son los que han tenido previamente una prueba de la tuberculina positiva, los que han estado en contacto estrecho y prolongado con personas con tuberculosis activa y los que han estado durante mucho tiempo en centros penitenciarios sin recibir profilaxis adecuada (CIII). Antes de iniciar la quimioprofilaxis es importante descartar tuberculosis activa mediante evaluación clínica y radiografía de tórax; ante la menor sospecha de enfermedad tuberculosa deben realizarse además estudios microbiológicos.
Fármacos y pautasPara la quimioprofilaxis antituberculosa en estos enfermos han demostrado eficacia la isoniacida a diario o 2 días por semana durante 6-12 meses200–205, rifampicina con pirazinamida durante 2 o 3 meses a diario204,206 o a días alternos207 e isoniacida con rifampicina durante 3 meses (AI)192,204,205,208,209. En la última actualización de las directrices de la American Thoracic Society (ATS) y los Centers for Disease Control and Prevention (DCD) se recomiendan pautas con isoniacida durante 9 meses y se desaconsejan las pautas de 6 o 12 meses210. Además, se recomienda la supervisión directa de la quimioprofilaxis cuando se administre a días alternos –especialmente en las pautas cortas– y también cuando se utilicen pautas de 6 meses de isoniacida en personas muy inmunodeprimidas. No existen datos que hagan pensar que la administración de isoniacida durante más de 12 meses o de por vida confiera ventajas adicionales, por lo que se desaconsejan estas estrategias (EIII).
Es importante señalar que con las pautas de rifampicina y pirazinamida se han descrito cuadros de hepatotoxicidad grave –en algunos casos mortales– mayoritariamente en pacientes no infectados por el VIH, aunque también algunos casos en pacientes con infección por el VIH. Debido a ello, tanto la ATS como los CDC y la Infectious Diseases Society of America (IDSA) recomiendan no utilizar esta pauta de profilaxis211, aunque en los ensayos clínicos las pautas de rifampicina y pirazinamida en pacientes infectados por el VIH no se asociaron a mayor incidencia de efectos adversos ni de mortalidad global que las pautas de isoniacida204,207,212. Sin embargo, la evidencia de que existen casos de hepatotoxicidad grave en los pacientes infectados por el VIH que recibieron la pauta de 2 meses de rifampicina y pirazinamida y que la monitorización de laboratorio puede no ser suficiente para evitarla213, junto con la aparición de otras pautas cortas que resultan eficaces y bien toleradas, hacen que no se pueda recomendar en la actualidad esta pauta para los pacientes con infección tuberculosa e infección por el VIH (DI).
En la actualidad, el Tuberculosis Trials Consortium (TBTC) del CDC está evaluando la eficacia y la seguridad de la combinación de isoniacida y rifapentina semanal durante 3 meses comparado con isoniacida diaria durante 9 meses (estudio 26) en un ensayo clínico de no inferioridad en el que se han aleatorizado 8.000 pacientes, incluyendo pacientes infectados por el VIH, que puede cambiar en un futuro la pauta de elección214.
En caso de infección por M. tuberculosis resistente a isoniacida o en pacientes con intolerancia o toxicidad a la isoniacida puede utilizarse rifampicina sola durante 4 meses25 (CIII). También podría contemplarse una pauta corta de rifampicina y pirazinamida, pero a la luz de lo comentado resulta prudente evitar esta pauta cuando se pueda utilizar algún otro régimen eficaz. Para contactos con pacientes con tuberculosis multirresistente no existen pautas firmemente establecidas. Se ha sugerido que una combinación de pirazinamida con etambutol u ofloxacino, administrada durante 12 meses, podría ser eficaz en la mayoría de estos casos (CIII).
Interacciones con fármacos antirretroviralesLa isoniacida puede administrarse con cualquier combinación de antirretrovirales. La rifampicina no debe administrarse simultáneamente con ningún IP (excepto ritonavir), tanto si es potenciado o no con ritonavir. Pueden administrarse con rifampicina todos los análogos de nucleósidos, ritonavir como único IP215 y los no nucleósidos nevirapina y efavirenz216–220. La rifabutina se recomienda como alternativa a la rifampicina en pacientes que reciben fármacos antirretrovirales que interaccionan con esta última; aunque conviene dejar claro que no existen estudios clínicos que avalen esta recomendación. Cuando se combine con IP, debe ajustarse la dosis de rifabutina y, en algunos casos, la de los IP. Dada la ausencia de estudios de eficacia en profilaxis y la necesidad de supervisar la administración de rifabutina e IP cuando se coadministran, debe evitarse el tratamiento de la infección tuberculosa con rifabutina (DIII).
La rifampicina aumenta el metabolismo hepático de la metadona y suele precipitar síntomas de abstinencia en personas en programa de deshabituación con este opiáceo. Es importante informar al paciente y al centro de dispensación sobre este efecto indeseable e incrementar la dosis de metadona hasta donde sea necesario.
Vacunación con BCGEsta vacuna está contraindicada en personas infectadas por el VIH por lo controvertido de su eficacia y por el riesgo de enfermedad diseminada por BCG221 (EIII).
Tratamiento de mantenimientoNo se recomienda tratamiento de mantenimiento en pacientes con tuberculosis documentada (EIII).
Mycobacterium avium complex (tabla 6)Medidas para prevenir la exposición al patógeno
El Mycobacterium avium complex (MAC) es un microorganismo ubicuo en el ambiente (incluyendo el agua y los alimentos) y no se conocen medidas eficaces para prevenir su adquisición.
Profilaxis primariaLa administración de claritromicina (500 mg/12 h) o azitromicina (1.200 mg, una vez por semana) previene la infección diseminada por MAC222,223 (AI). Sin embargo, esta estrategia no se recomienda en nuestro medio dada la baja incidencia de esta infección oportunista incluso antes de la introducción del TARGA (DIII). En un estudio de cohortes llevado a cabo en nuestro país en la era del TARGA que incluyó a 200 pacientes con cifras de linfocitos CD4+ menores de 50/μl la incidencia de infección diseminada por MAC fue de 2 casos por 100 pacientes/año. En situaciones especiales, por ejemplo en pacientes con cifras de linfocitos CD4+ persistentemente inferiores a 50/μl y sin posibilidad de recibir TARGA, puede contemplarse la profilaxis primaria con alguna de las pautas arriba mencionadas.
Profilaxis secundariaLos pacientes con infección diseminada por MAC deben recibir tratamiento con claritromicina (o azitromicina como alternativa) y etambutol mientras persistan con inmunosupresión grave37 (AI).
Retirada de las profilaxisLa profilaxis primaria puede interrumpirse con seguridad en pacientes que logran mantener con TARGA cifras de linfocitos CD4+ por encima de 100/μl y una carga viral indetectable durante períodos superiores a 3-6 meses224 (AI). Antes del TARGA se recomendaba mantener la profilaxis secundaria de por vida. En la actualidad puede contemplarse su retirada en pacientes que mantienen cifras de linfocitos CD4+ por encima de 100/μl durante más de 6 meses81,225–227 (BII) (tabla 3).
Otras bacterias (tabla 6)Streptococcus pneumoniae
En los países desarrollados, la introducción de TARGA ha sido la medida más eficiente en la disminución de la neumonía en los pacientes infectados por el VIH228. No obstante, la bacteriemia por S. pneumoniae se asocia todavía a una elevada morbimortalidad en estos pacientes. En un estudio español, la introducción de TARGA disminuyó la incidencia de bacteriemia por S. pneumoniae, sobre todo asociada con neumonía, de un 24,1/1.000 pacientes año a 8,2/1.000 pacientes año. Sin embargo, la mortalidad en la era TARGA ascendió del 8% al 26%, debido a la comorbilidad, sobre todo por cirrosis hepática229.
Ha existido controversia respecto a la recomendación de administrar la vacuna neumocócica de 23 valencias polisacárida polivalente (VPP) a personas infectadas por el VIH. En un estudio aleatorizado y doble ciego llevado a cabo en África no se encontró efecto beneficioso con la vacuna y se pudo observar una asociación entre la vacunación y un mayor riesgo de enfermedad neumocócica230. Sin embargo, en el seguimiento de dicho estudio durante 6 años no se demostró un aumento de la incidencia de la neumonía neumocócica y, de forma paradójica, se observó una disminución de la mortalidad en el 16% en el grupo vacunado231. El tema de VPP en África, con escaso acceso a TARGA, permanece sin resolver. Algunos estudios de casos y controles realizados en países desarrollados con acceso a TARGA, varios de ellos en nuestro país229,232, han mostrado protección frente a la infección neumocócica invasiva con VPP, incluso en pacientes con CD4 < 200/μl.
En cuanto a la vacunación con la vacuna conjugada de 9 valencias, su uso redujo de forma significativa la incidencia de neumonías y de infecciones invasivas en niños infectados por el VIH. Aunque los CDC han demostrado un efecto indirecto de esta vacuna, con una disminución en un 19% de las infecciones invasivas en adultos infectados por el VIH, carecemos de datos suficientes en adultos y no se trata de la vacuna conjugada disponible en el momento actual233,234.
Se recomienda la administración de la VPP en personas adultas o adolescentes con una cifra de linfocitos CD4+ superiores a 200/μl o incluso en personas con recuentos inferiores, aunque la respuesta puede ser incierta (AII). Es probable que sea necesaria la revacunación cada 5 años, pero no existen datos que apoyen esta recomendación.
Por otra parte, se debe recomendar no fumar (BII), ya que en numerosos estudios el tabaquismo es un factor de riesgo independiente para el desarrollo de neumonía bacteriana235.
Hemophilus influenzaeLos niños infectados por el VIH deben recibir vacuna frente a H. influenzae (Hib) según el calendario vacunal habitual25 (AI). Esta vacuna no está indicada, ni contraindicada, en adultos.
Neisseria meningitidisLos niños infectados por el VIH deben recibir la vacuna frente a N. meningitidis C según el calendario vacunal habitual25 (AI). No hay recomendaciones específicas para la inmunización en pacientes adultos.
MisceláneaEn la actualidad no se recomienda ninguna forma de profilaxis primaria ni secundaria de las infecciones por Samonella no-typhi, Campylobacter spp. o Bartonella spp. (EIII).
Profilaxis de las infecciones parasitarias importadasA diferencia de las infecciones oportunistas tradicionalmente asociadas al VIH, en la gran mayoría de las parasitosis importadas se carece de información sobre la necesidad de quimioprofilaxis. En general, la mejor actitud preventiva pasa por evitar ponerse en contacto con el patógeno junto con el diagnóstico y tratamiento tempranos. Salvo en casos muy concretos no producen infecciones crónicas latentes asintomáticas que se reactiven como consecuencia de la inmunosupresión. Por este motivo, los conceptos de profilaxis primaria y secundaria aplicados clásicamente a las infecciones oportunistas no se corresponden directamente con la mayoría de estas parasitosis. Esto no es óbice para que el curso clínico pueda ser más grave y la respuesta al tratamiento peor9.
Las medidas preventivas relacionadas con la exposición a las parasitosis importadas y los vectores que las transmiten se resumen en la tabla 7. Como normas generales, y especialmente si se viaja a zonas donde estas enfermedades son endémicas, se recomienda:
- –
Beber agua con garantías sanitarias y, si no es posible, agua embotellada.
- –
No ingerir alimentos crudos o poco cocinados, especialmente pescado, marisco, carne, huevos y leche no higienizada. Asegurarse de que las ensaladas, verduras y frutas que se consumen crudas se han lavado adecuadamente.
- –
No andar descalzo. Evitar el contacto directo de la piel con el suelo.
- –
Evitar bañarse en ríos o lagos, especialmente en África subsahariana.
- –
Evitar el contacto estrecho con animales.
- –
Prevenir las picaduras de artrópodos que pueden actuar como vectores. Utilizar repelentes de insectos (Relec®, Goibi Xtreme® o Aután activo®).
Profilaxis de enfermedades parasitarias en pacientes adultos y adolescentes infectados por el virus de la inmunodeficiencia humana
| Patógeno | Profilaxis primaria | Profilaxis secundaria | Prevención de la infección |
| Entamoeba histolytica | Para los portadores asintomáticos: Paramomicina v.o. 500 mg cada 8 h, durante 5-10 días.Alternativas: Furoato de diloxanida 500 mg cada 8 h durante 10 días. Iodoquinol 650 mg cada 8 h, durante 20 días | Control de agua y alimentos. Higiene personal adecuada, lavado de manos y relaciones sexuales seguras (especialmente si implican contacto oral-anal) | |
| Malaria por P. falciparum sensible a cloroquina, P. vivax, P. ovale y P. malariae | Para evitar la parasitación: Cloroquina v.o. 300 mg de base, una vez a la semana.Alternativa: Hidroxicloroquina v.o. 310 mg de base (400 mg de sal), una vez a la semana.En ambos casos, administrar una semana antes de la entrada en zona malárica, durante la estancia y hasta 4 semanas después de abandonar el área | Medidas antimosquito: manga larga y pantalón largo por la noche y en las últimas y primeras horas del día. Repelentes de insectos. Ropa tratada con repelentes. Calzado cerrado. Mosquiteras tratadas con repelentes o insecticidas | |
| Malaria por P. falciparum resistente a cloroquina | Mefloquinaa v.o. 250 mg de sal, una vez a la semana. Administrar una semana antes de la entrada en zona malárica, durante la estancia y hasta 4 semanas después de abandonar el área maláricaAtovaquona-proguanil v.o. un comprimido (250 mg atovaquona + 100 mg de proguanil) QD. Administrar un día antes de la entrada en zona malárica, durante la estancia y hasta 7 días después de abandonar el área maláricaDoxiciclinab v.o. 100 mg QD. Administrar una semana antes de la entrada en zona malárica, durante la estancia y hasta 4 semanas después de abandonar el áreaPrimaquina v.o. 30 mg de base QD. Administrar un día antes de la entrada en zona malárica, durante la estancia y hasta 7 días después de abandonar el área malárica | ||
| Trypanosoma cruzi | Tratamiento preventivo: Benznidazold v.o. 5 mg/kg día, dividido en 2 dosis de 60 a 90 días (o incluso 120 días)Alternativa: Nifurtimoxe v.o. 8 mg/kg día, dividido en 2-3 dosis de 60 a 90 días | Benznidazol v.o. 5 mg/kg día, dividido en 2 dosis, 3 veces/semana | Medidas antivector: repelentes de insectos. Mosquiteras tratadas con repelentes o insecticidas. Evitar los alojamientos rurales o dormir a la intemperie |
| Trypanosoma brucei gambiense | Tratamiento del infectado:
| Medidas antivector: manga larga y pantalón largo. No llevar ropa muy fina y de color claro. Los repelentes son poco eficaces. Evitar zonas con alta densidad de vector | |
| Trypanosoma brucei rhodesiense |
| ||
| Cyclospora cayetanensis | No indicada | Cotrimoxazol (160/800 mg) v.o., QD, 3 veces/semanaAlternativa: Ciprofloxacina 500 mg v.o. QD, 3 veces por semana | Control de agua y alimentos. Evitar baños en agua dulce potencialmente contaminada |
| Strongyloides stercoralis | Tratamiento preventivo: Ivermectina v.o. 200 μg/kg QD, repetir la dosis a la semana. Albendazolf v.o. 400 mg BID, durante 3-5 días, o Albendazol v.o. 800 mg BID, durante 3 días | Evitar andar descalzo o poner en contacto la piel desnuda con suelos potencialmente contaminados. Descartar esta parasitosis en pacientes que vayan a recibir tratamiento inmunosupresor (especialmente corticoides) o que estén infectados por el HTLV-1 | |
| Schistosoma sp. | Tratamiento del infectado: Praziquantelg v.o. 40 mg/kg en dosis única. En el caso de S. japonicum o S. mekongi administrar 2 dosis de 30 mg/kg separadas por 3 h.Alternativa: Metrifonato v.o. 10 mg/kg en dosis única | Evitar el baño y el contacto con agua de ríos o lagos infestados de cercaríasEn caso de contacto accidental, secar vigorosamente con una toalla las áreas húmedas y aplicar posteriormente alcohol al 70% | |
| Taenia solium Cisticercosis | Tratamiento del infectado: Esteroides para el control de los síntomas + Albendazolg v.o. 400 mg BID, durante 8-30 días. Praziquantel v.o. 100 mg/kg/día en 3 dosis, un día, seguido de 50 mg/kg/día en 3 dosis durante 29 días | Cisticercosis: Control de agua y alimentos. Higiene personal adecuada y lavado de manosTeniasis: No ingerir carne de cerdo cruda o poco hecha. La congelación a -5 °C durante 3 días destruye los cisticercos. | |
| Filariosis | |||
| Onchocerca volvulus | Tratamiento del infectado: Ivermectina v.o. 150 μg/kg, dosis única, cada 6-12 meses | Manga larga y pantalón largo. Según el vector, extremar las medidas preventivas en la noche y en las últimas y primeras horas del día. Repelentes de insectos. Ropa tratada con repelentes. Calzado cerrado. Mosquiteras tratadas con repelentes o insecticidas | |
| Loa loa | Dietilcarbamacina v.o. 6 mg/kg, en 3 dosis, durante 21 días. En casos de hipermicrofilaremia considerar iniciar antes albendazol v.o. 200 mg BID durante 21 días y luego administrar Ivermectina o DEC | ||
| Wuchereria bancrofti, Brugia malayi y B. timori | Dietilcarbamacina v.o. 6 mg/kg, en 3 dosis, durante 10-14 días | ||
| Mansonella perstans | Albendazol v.o. 400 mg BID, durante 10 días. Mebendazol v.o. 100 mg, BID, durante 30 días | ||
| Mansonella streptocerca | Dietilcarbamacina v.o. 6 mg/kg, en 3 dosis de 12-21 días | ||
| Mansonella ozzardi | Ivermectina v.o. 200 μg/kg, en dosis única | ||
| Larva migratoria cutánea | Tratamiento del infectado: Albendazol v.o. 400 mg BID, durante 3 días. Ivermectina v.o. 200 μg/kg QD, durante 1-2 días | Evitar andar descalzo o poner en contacto la piel desnuda con suelos potencialmente contaminados | |
| Larva migratoria visceral | Tratamiento del infectado: Albendazol v.o. 400 mg BID, durante 5 días. Mebendazol v.o. 100-200 mg, BID, durante 5 días | Precaución al manipular tierra potencialmente contaminada con heces de perro. Higiene personal adecuada especialmente en el contacto con perros |
BID: dos veces al día; QD: una vez al día; v.o.: vía oral.
cProfilaxis para casos especiales. La primaquina se utiliza como profilaxis y para eliminar las formas durmientes hepáticas de P. vivax y P. ovale y prevenir las recaídas. Dado que la primaquina puede causar anemia hemolítica grave en personas con déficit de G6PDH, los pacientes deben ser estudiados previamente a su administración.
La mefloquina puede iniciarse 3 o 4 semanas antes para evaluar la tolerabilidad y en caso de que sea mala cambiar a otro régimen profiláctico.
Entamoeba histolytica es un protozoo parásito de distribución mundial aunque su prevalencia es mayor en países con condiciones sanitarias deficientes. En los pacientes con infección por el VIH no se ha descrito peor respuesta al tratamiento ni una mayor tasa de enfermedad invasiva en los portadores asintomáticos.
Medidas para prevenir la exposición al patógenoLa amebiasis se transmite principalmente por ingestión de agua o alimentos contaminados con heces que contengan quistes, los cuales son bastante resistentes al cloro. Puede haber transmisión por contacto oral-anal o con personas portadoras en condiciones de higiene deficiente. Por eso, la principal forma de evitar la infección es una higiene adecuada y el control de agua y alimentos. En pacientes hospitalizados se recomiendan medidas de aislamiento entérico.
Profilaxis primaria y secundariaLa profilaxis primaria consistiría en el tratamiento de los portadores de quistes, ya que el riesgo de desarrollo de enfermedad invasora en portadores intestinales asintomáticos es del 3 al 10% al año. La terapia se basa en el uso de un amebicida con actividad en la luz intestinal236,237 (AII). De igual manera, aquellos pacientes que sufran una amebiasis invasiva, intestinal o extraintestinal, deberán recibir un amebicida de luz intestinal, ya que el metronidazol elimina menos del 50% de los quistes238–241 (AI).
Malaria (tabla 7)La malaria es una enfermedad que se distribuye por las área tropicales y subtropicales del mundo, produciéndose de 300 a 800 millones de casos anuales y entre 1 y 3 millones de muertes. Está producida por protozoos parásitos del género Plasmodium: P. falciparum, P. vivax, P. ovale, P. malariae y el más recientemente descrito P. knowlesi. La mayor parte de las muertes son producidas por P. falciparum. En los pacientes infectados por el VIH las manifestaciones clínicas suelen ser más graves, especialmente en las embarazadas, y la parasitemia mayor242,243.
Medidas para prevenir la exposición al patógenoLa malaria es transmitida por las hembras hematófagas de los mosquitos del género Anopheles. Por lo general pican por la noche, aunque hay especies que también lo hacen al atardecer y en las primeras horas de la mañana. La transfusión de sangre infectada, el trasplante de órganos o el uso de jeringas o material de inyección contaminado (como en el caso de adictos a drogas por vía parenteral) también puede transmitir la malaria244.
Las medidas de prevención van dirigidas a evitar la picadura del vector y, en el caso de que ésta se produzca, a impedir el desarrollo del parásito. En el primer caso se recomienda el uso de repelentes de insectos que contengan DEET (dietil toluamida) en concentraciones del 30 al 50%, o picaridina. Estos productos pueden ser usados por mujeres embarazadas. También puede rociarse la ropa con repelentes que contengan permetrina, cuyo efecto persiste hasta 2 semanas y es resistente a varios lavados. Como medida de barrera adicional deben usarse mosquiteras, idealmente impregnadas con insecticidas, si la picadura de los mosquitos es probable durante la noche245.
Profilaxis primaria y secundariaLa quimioprofilaxis en la malaria tiene como objetivo prevenir o suprimir los síntomas producidos por las formas hemáticas del parásito. Debe tomarse antes, durante y después de salir del área malárica (AI). La pauta dependerá del fármaco utilizado. En la indicación de la profilaxis hay que tener en cuenta el itinerario, la probabilidad y la frecuencia de exposición al parásito, así como la existencia de resistencia a los fármacos antipalúdicos241,245,246.
En la actualidad existe poca información acerca de posibles interacciones entre fármacos antirretrovirales y antipalúdicos247,248. Debido a sus características farmacocinéticas, podrían existir interacciones entre atovaquona y mefloquina con los inhibidores de proteasa, por lo que el uso simultáneo de estos agentes debe realizarse con precaución. En este sentido, tanto el lopinavir/r como el ritonavir a las dosis usadas para potenciar el efecto de otros IP, pueden disminuir los niveles de atovaquona. Hasta el momento no se ha establecido si este descenso tiene consecuencias clínicas, ni si hay que modificar la dosis de atovaquona cuando se administra junto a estos fármacos247. Aunque no se han encontrado interacciones farmacológicas significativas en la administración simultánea de mefloquina con indinavir o nelfinavir, se recomienda usarla con precaución junto a otros IP, sobre todo si no están potenciados con ritonavir, ya que la mefloquina podría disminuir sus concentraciones plasmáticas249. Aunque los niveles de artemether-lumefantrina (Riamet®) se ven aumentados por el uso concomitante de lopinavir/ritonavir (Kaletra®) (lo contrario no se verifica), no parece que sea necesario el ajuste de dosis salvo en casos de alteraciones de la conducción cardíaca preexistentes250.
El tratamiento correcto erradica la parasitación, por lo que no persisten formas crónicas latentes asintomáticas que pudieran reactivarse con la inmunosupresión. En algunos casos pueden existir parasitaciones subclínicas, especialmente en inmigrantes con inmunidad parcial, en las semanas siguientes a un tratamiento subóptimo o por un exceso en la respuesta inmune (esplenomegalia malárica hiperreactiva). En estos casos, la PCR para malaria es muy útil, ya que el frotis y la gota gruesa pueden no detectar la parasitemia. Una vez diagnosticada la malaria lo indicado es tratarla.
Tripanosomiasis americana o enfermedad de Chagas (tabla 7)Es una parasitosis endémica del continente americano producida por el protozoo parásito Trypanosoma cruzi. Es transmitida por chinches hematófagos de la familia Reduviidae (vinchucas, chinches besadoras o chipos) que una vez infectados transmiten este parásito de por vida. Otras vías descritas de infección son las transfusiones de sangre, el trasplante de órganos, vía transplacentaria y por la ingestión de zumos de fruta y jugo de caña de azúcar251.
Medidas para prevenir la exposición al patógenoEn ambientes domésticos y peridomésticos los chinches tienden a picar durante la noche. Además del uso de repelentes de insectos durante el día sería recomendable el uso de mosquiteras impregnadas con insecticida por la noche, especialmente en áreas rurales o con altas densidades del vector. A esto hay que sumar el control de la sangre para transfusión y los donantes de órganos.
Profilaxis primaria y secundariaLa enfermedad de Chagas tiene un comportamiento similar al de otras infecciones oportunistas en el paciente infectado por el VIH: sus manifestaciones son más graves, a menudo el comienzo se produce como una reactivación en sujetos con menos de 200 CD4/μl y la respuesta al tratamiento es peor9,252–256. Existe muy poca experiencia en relación con el tratamiento y la quimioprofilaxis de esta parasitación. A esto hay que sumar que a medida que se cronifica la respuesta al tratamiento es peor, que no se dispone de un método fiable de evaluación de la respuesta y que los fármacos con que contamos tampoco han demostrado inequívocamente su eficacia en la infección crónica. No obstante, dada la gravedad de los casos descritos257,258, y que en general también se indica para pacientes no infectados por el VIH, parece razonable el tratamiento preventivo de los individuos coinfectados con una PCR para T. cruzi positiva (AIII). La duración no está establecida, aunque hay autores que propugnan prolongar el tratamiento hasta el doble de lo habitual (120 días).
En cuanto a la profilaxis secundaria, la falta de información es aún mayor. Por sus similitudes con otras infecciones oportunistas y la gravedad de sus manifestaciones clínicas, podría considerarse el uso del benznidazol como profilaxis secundaria (CIII). No pueden hacerse recomendaciones en cuanto al tiempo durante el cual debería mantenerse o cuándo considerar su suspensión, pero parece razonable continuar la profilaxis mientras los linfocitos CD4 no superen los 200-350/μl y la carga vírica no sea indetectable con TARGA, como mínimo durante 6 meses.
Tripanosomiasis africana o enfermedad del sueño (tabla 7)Es una parasitosis endémica del África subsahariana que se transmite por la picadura de la mosca Tse-tse (Glossina sp.), aunque también es posible por transmisión directa por contaminación de sangre de la probóscide de tábanos o en accidentes de laboratorio. Está producida por dos subespecies de tripanosoma indistinguibles morfológicamente: Trypanosoma brucei rhodesiense y T. b. gambiense. Las formas más graves y de evolución más rápida se asocian al primero.
Medidas para prevenir la exposición al patógenoLos casos de infección por T. brucei son muy infrecuentes entre viajeros, pero se han descrito principalmente en África oriental asociados a safaris de recreo. Las moscas Tse-tse se ven atraídas por los colores oscuros y pican a través de ropa ligera. No les afectan los repelentes de insectos. La mejor prevención es evitar las áreas donde típicamente se localizan.
Profilaxis primaria y secundariaAunque no parece que haya una asociación epidemiológica entre la tripanosomiasis africana y la infección por el VIH, sí parece que la respuesta al tratamiento podría ser peor259,260. Además, hay que tener en cuenta que en el caso del Trypanosoma brucei gambiense los síntomas pueden presentarse hasta años después de la infección. Más que profilaxis primaria, en los pacientes potencialmente infectados, habría que hacer un diagnóstico temprano e instaurar tratamiento específico9,241,261–266 (AI-AII). No hay información acerca de si es necesaria la profilaxis secundaria.
Ciclosporiasis (tabla 7)Se produce por la parasitación de la porción proximal del intestino delgado por Cyclospora cayetanensis. En pacientes con infección por el VIH el cuadro clínico es similar al producido por Cryptosporidium sp., con recurrencias si no se instaura profilaxis secundaria.
Medidas para prevenir la exposición al patógenoSe transmite por vía fecal-oral, asociada a la ingesta de alimentos o baños en aguas contaminadas. Es resistente a la cloración. La prevención de la exposición se realiza a través de una higiene adecuada y el control de agua y alimentos.
Profilaxis primaria y secundariaLa profilaxis primaria no está indicada. La profilaxis secundaria se realiza con cotrimoxazol114,267 (AII) o alternativamente con ciprofloxacina114 (BII).
Estrongiloidiasis (tabla 7)Es una helmintiasis del duodeno y parte proximal del yeyuno producida por Strongyloides stercoralis. Su distribución es mundial, fundamentalmente en áreas tropicales y templadas, y se asocia a condiciones sanitarias deficientes. Aunque inicialmente se la consideró una infección oportunista, se ha visto que se relaciona principalmente por la inmunosupresión asociada al uso de corticoides268,269 y la infección por el HTLV-1.
Medidas para prevenir la exposición al patógenoFundamentalmente se resumen en una buena higiene personal y evitar andar descalzo o poner en contacto la piel con el suelo en áreas endémicas. De esta forma se evita el contacto con las larvas filariformes infectantes.
Profilaxis primaria y secundariaEsta infestación hay que sospecharla en individuos provenientes o que hayan viajado a áreas endémicas, sobre todo si presentan eosinofilia y es previsible que reciban corticoides u otro tratamiento inmunosupresor. En esos casos estaría indicado el tratamiento etiológico o empírico con albendazol8,241,270–275 (AII). No hay datos que indiquen la necesidad de profilaxis secundaria.
Esquistosomiasis (tabla 7)La esquistosomiasis está producida por trematodos del género Schistosoma que se distribuyen por las áreas tropicales y subtropicales de África, Oriente medio, Asia oriental, islas Filipinas y algunas regiones de Sudamérica. No hay claras evidencias de que la esquistosomiasis sea más grave o difícil de tratar en personas infectadas por el VIH.
Medidas para prevenir la exposición al patógenoLa infestación se adquiere a través de la piel, al vadear o bañarse en ríos y lagos de agua dulce donde está presente la fase larvaria libre (cercaria), por lo que debe evitarse el contacto con agua dulce en áreas endémicas. Se recomienda la realización de serología específica si se ha estado expuesto al parásito.
Profilaxis primaria y secundariaEn individuos con sospecha de infección por este parásito (síntomas sugerentes o eosinofilia con o sin confirmación parasitológica) provenientes o que hayan residido en áreas endémicas, estaría indicado el tratamiento con praziquantel9,276. La administración temprana de este fármaco (en el primer mes tras la exposición) no se ha mostrado eficaz en la prevención de la esquistosomiasis277 (DII). No hay datos que indiquen la necesidad de profilaxis secundaria.
Cisticercosis (tabla 7)La cisticercosis es una parasitación de distribución mundial, aunque su prevalencia es mayor en áreas donde las condiciones sanitarias son deficientes y se consume carne de cerdo cruda o poco cocinada (principalmente en África subsahariana, América Latina y Asia meridional). El cisticerco es la fase larvaria de la Taenia solium, cuyo huésped definitivo es el hombre. No obstante, los seres humanos pueden desarrollar la cisticercosis si ingieren proglótides o huevos de T. solium. En los pacientes infectados por el VIH no parece que esta enfermedad sea más grave, aunque sí más frecuentes las presentaciones atípicas278,279.
Medidas para prevenir la exposición al patógenoEvitar la ingestión de huevos mediante una adecuada higiene personal, y el control de agua y alimentos que podrían verse contaminados por el contacto con heces de portadores de T. solium. Evitar la infestación con el adulto al ingerir carne cruda o poco cocinada por la posibilidad de una autoinfestación.
Profilaxis primaria y secundariaEl tratamiento con albendazol y praziquantel ha mostrado eficacia en el tratamiento de la enfermedad sintomática8,241,280–286 (BI). Como profilaxis primaria, podría considerarse el tratamiento de los pacientes con quistes viables pero asintomáticos en previsión de futuras complicaciones si tienen menos de 200 linfocitos CD4/μl o es probable un deterioro inmunológico significativo (CIII).
Filariosis (tabla 7)Las filariosis son infestaciones por nematodos transmitidos por un insecto vector. Se distribuyen por zonas tropicales de África, Asia y Sudamérica. No se ha mostrado que sean más graves o la respuesta al tratamiento peor en pacientes con infección por el VIH.
Medidas para prevenir la exposición al patógenoEn general, la prevención de la infestación por estos gusanos pasa por evitar la picadura del insecto vector (mosquitos, tábanos y algunos tipos de moscas) mediante el uso de repelentes y ropa adecuada. No obstante, en general la transmisión por el vector no suele ser muy eficaz, por lo que se necesitan picaduras repetidas para que se establezca el parásito. En el caso concreto de la prevención de la infestación por Loa-loa, el uso de dietilcarbamacina en dosis de 300 mg semanales se ha mostrado eficaz en personas que van a estar largo tiempo en áreas endémicas287 (AI).
Profilaxis primaria y secundariaEl tratamiento de los pacientes infectados por el VIH se haría como en los VIH negativos. No hay datos que indiquen la necesidad de profilaxis secundaria.
Larva migratoria cutánea y visceralSon la consecuencia de la infestación por los estados larvarios de uncinarias (larva migratoria cutánea) o por la ingesta de huevos de áscaris (larva migratoria visceral) de perros y gatos. No hay evidencias de que en los pacientes infectados por el VIH se comporten de manera distinta que en el individuo inmunocompetente.
Medidas para prevenir la exposición al patógenoEn el caso de las uncinarias, evitar andar descalzo o el contacto de la piel desnuda con el suelo, mientras que para la larva visceral, hay que evitar la ingestión de huevos a través del contacto con suelo contaminado con heces de perro y el mantenimiento de una higiene adecuada en el contacto con perros.
Profilaxis primaria y secundariaHay que sospechar esta infestación cuando existen síntomas característicos o una eosinofilia no justificada por fármacos, procesos alérgicos u otras causas. A veces es necesario el tratamiento empírico. El tratamiento es como en los individuos inmunocompetentes9,241. No hay datos que indiquen la necesidad de profilaxis secundaria, ya que son parasitosis que pueden erradicarse del hospedador.
AgradecimientosA los Drs. Juan Emilio Losa (Hospital de Alcorcón, Madrid) y María Jesús Barberá (Unidad de Infecciones de Transmisión Sexual, CAP Drassanes, Barcelona) por su colaboración en la revisión crítica del manuscrito.
Relación de los miembros del Panel de expertos de GESIDA y Plan Nacional sobre el SidaCoordinador: José M. Miró (Hospital Clínic-IDIBAPS, Universidad de Barcelona, Barcelona).
Redactores: José Sanz (Hospital Universitario Príncipe de Asturias, Alcalá de Henares), Fernando Lozano (Hospital de Valme, Sevilla), Josep Mallolas (Hospital Clínic-IDIBAPS, Universidad de Barcelona, Barcelona), Santiago Moreno (Hospital Universitario Ramón y Cajal, Madrid), Koldo Aguirrebengoa (Hospital de Cruces, Bilbao) y José Pérez-Molina (Hospital Universitario Ramón y Cajal, Madrid).
Revisores: Daniel Podzamczer (Hospital de Bellvitge-IDIBELL, Universidad de Barcelona, L'Hospitalet de Llobregat), Rafael Rubio (Hospital 12 de Octubre, Madrid), José López-Aldeguer (Hospital La Fe, Valencia), Jaime Cosín (Hospital Universitario General Gregorio Marañón, Madrid), Félix Gutiérrez (Hospital de Elche, Alicante), Julio Arrizabalaga (Hospital Ntra. Sra. de Aránzazu, San Sebastián), José Luis Casado (Hospital Universitario Ramón y Cajal, Madrid), Juan Carlos López Bernardo de Quirós (Hospital Universitario General Gregorio Marañón, Madrid), Juan Berenguer (Hospital Universitario General Gregorio Marañón, Madrid), José Baraia-Etxaburu (Hospital de Basurto, Bilbao), José María Kindelán (Hospital Reina Sofía, Córdoba), Ana Menasalvas (Hospital Universitario Morales Meseguer, Murcia), José A. Iribarren (Hospital Ntra. Sra. de Aránzazu, San Sebastián), Federico Pulido (Hospital 12 de Octubre, Madrid), Esteban Ribera (Hospital Universitari Vall d'Hebron, Barcelona), M. Paloma Geijó (Hospital Virgen de la Luz, Cuenca), Carlos Barros (Hospital de Móstoles, Madrid), Miguel Ángel von Wichman (Hospital Ntra. Sra. de Aránzazu, San Sebastián), Rosario Palacios (Hospital Virgen de la Victoria, Málaga), Juan F. Lorenzo (Hospital General Yagüe, Burgos), Javier Ena (Hospital Marina Baixa, Villajoyosa, Alicante), Miguel Cordero (Hospital Universitario de Salamanca, Salamanca), Juan Luis Gómez-Sirvent (Hospital Universitario de Canarias, Santa Cruz de Tenerife) y Rosa Polo (Secretaría del Plan Nacional sobre el Sida, Madrid).