La neumonía es la segunda complicación infecciosa en frecuencia en el medio hospitalario, y ocupa el primer lugar en los servicios de medicina intensiva (unidades de cuidados intensivos [UCI]). El 80% de los episodios de neumonía nosocomial se produce en pacientes con vía aérea artifical y se denomina neumonía asociada a la ventilación mecánica (NAV). La NAV es la causa más frecuente de mortalidad entre las infecciones nosocomiales en las UCI, principalmente si son debidas a Pseudomonas aeruginosa y Staphylococcus aureus resistente a meticilina (MRSA). Además, incrementa los días de ventilación mecánica y la estancia media en la UCI y el hospital. A pesar de las pruebas disponibles, el diagnóstico de una NAV sigue siendo clínico. La presencia de una opacidad en la radiografía de tórax y secreciones traqueales purulentas son condiciones imprescindibles para su diagnóstico. Además, deberemos evaluar su estado y los factores de riesgo para patógenos de difícil tratamiento. Si la NAV es temprana y no existen estos factores de riesgo, la mayoría de las pautas empíricas presentan una cobertura correcta de la flora que nos encontraremos. Sin embargo, si el diagnóstico de NAV se realiza en un paciente con más de 1 semana de ventilación mecánica, en tratamiento antibiótico o con factores de riesgo, deberemos individualizar la pauta.
The second most important infectious complication in hospitalised patients is pneumonia, and it hits first place in the Intensive Care Unit (ICU). Almost 80% of the episodes of health-care pneumonia happens when patient is under mechanical ventilation, causing ventilator-associated pneumonia (VAP). VAP is associated with the highest rates of mortality in ICU infections, mainly if due to Pseudomonas aeruginosa and methicillin-resistant Staphylococcus aureus (MRSA). It also increases days under mechanical ventilation and the length of stay in ICU and hospital. Although all the diagnostic procedures, the diagnosis of VAP is based basically in the clinics: X-ray infiltrates and purulent endotracheal secretions are the cornerstone of the diagnosis. We should evaluate and screen any risk factor for multirresistant pathogens. If we have an early VAP and no risk factors, the majority of empiric antibiotic strategies are useful, but if we have a patient with more than one week under mechanical ventilation, previous antibiotic use, and risk factors for multirresistant pathogens, we should then individualize empiric antibiotic treatment.
Las infecciones nosocomiales son la complicación hospitalaria más frecuente relacionada con la asistencia sanitaria. Como en otras infecciones nosocomiales, la existencia de dispositivos es el principal factor de riesgo de presentar una neumonía. La neumonía es la segunda complicación infecciosa en frecuencia en el medio hospitalario, y ocupa el primer lugar en los servicios de medicina intensiva (unidades de cuidados intensivos [UCI]), cuyo riesgo está aumentado más de 20 veces por la presencia de la vía aérea artificial1. El 80% de los episodios de neumonía nosocomial se produce en pacientes con vía aérea artifical y se denomina neumonía asociada a la ventilación mecánica (NAV)2. La NAV afecta hasta el 50% de los pacientes, según la patología de ingreso, que ingresan en UCI, y presenta una densidad de incidencia que varía entre 10 y 20 episodios por cada 1.000 días de ventilación mecánica3, con un riesgo diario de entre el 1 y el 3%4. Este riesgo es mayor en los primeros días, y es especialmente alto en pacientes ingresados en coma, donde se puede llegar a diagnosticar hasta en el 50% de los pacientes5. Las enfermedades de base y condiciones que aumentan el riesgo de presentar una NAV se pueden apreciar en la tabla 1 y factores de riesgo en la tabla 2.
Enfermedades y condiciones que aumentan el riesgo de presentar neumonía asociada a ventilación mecánica
| Enfermedad de base |
|
| Condiciones |
|
Factores asociados a la respuesta clínica
| A. Dependientes del huésped |
Tempranos
|
Tardíos
|
| B. Dependientes del medio |
Tempranos
|
Tardíos
|
EPOC: enfermedad pulmonar obstructiva crónica; APACHE: acute physiology and cronic health evaluation; PEEP: presión positiva al final de la espiración; UCI: unidad cuidados intensivos.
La NAV conlleva un aumento en la estancia hospitalaria6, con un coste por cada NAV superior a los 4.000 dólares en Estados Unidos7 y, sobre todo, ante algunas etiologías también se ha relacionado con un aumento en la mortalidad, que puede ser de hasta el 70%8.
FisiopatologíaAunque clásicamente se han venido distinguiendo cuatro vías patogénicas para el desarrollo de NAV (aspiración de secreciones colonizadas procedente de la orofaringe, por contigüidad, por vía hematógena, y a través de los circuitos o tubuladuras), la aspiración de secreciones procedentes de la orofaringe es la vía mayoritaria y casi única. La vía aérea inferior es una zona habitualmente estéril en personas sanas; la excepción se limita a pacientes con enfermedades crónicas pulmonares. En los pacientes con ventilación mecánica, la intubación endotraqueal, en cambio, rompe el aislamiento de la vía aérea inferior. El neumotaponamiento del tubo endotraqueal es un sistema diseñado para aislar la vía aérea, evitando pérdidas de aire y la entrada de material a los pulmones, pero no es completamente estanco. Por encima del neumotaponamiento se van acumulando secreciones que, provenientes de la cavidad oral, están contaminadas por los patógenos que colonizan la orofaringe. Estas secreciones contaminadas pasan alrededor del neumotaponamiento y alcanzan la vía aérea inferior. Esta cantidad o inóculo será escaso si existen pocas secreciones acumuladas, pero si la integridad del sistema está alterada, el inóculo que pueda llegar al parénquima pulmonar será mayor. Cuando este inóculo supera la capacidad de defensa del huésped, se produce la reacción inflamatoria cuya expresión histológica es la aparición de infiltrado agudo con leucocitos polimorfonucleares. Externamente apreciaremos la existencia de secreciones endobronquiales, que son aspiradas con sondas de aspiración por dentro del tubo endotraqueal. Se ha comprobado que una baja presión del neumotaponamiento, que permitiría un mayor paso de secreciones, se puede asociar al desarrollo de NAV9. Por otro lado, una presión mayor afectaría a la circulación en la mucosa respiratoria y podría llegar a lesionarla. Por todo ello, se recomienda que la presión del neumotaponamiento se mantenga entre 25 y 30 cm de H2O9. Así, se entiende que las medidas dirigidas al cuidado de la vía aérea para evitar la presencia de secreciones, su contaminación o el paso de ellas a la vía aérea inferior son potenciales objetivos para la prevención de la NAV, de la que se hablará más adelante.
MicrobiologíaLos factores que influyen en la etiología de la NAV son el tiempo de ventilación mecánica10, la administración previa de antibioterapia11, además de algunos factores dependientes del huésped, como la presencia de enfermedad pulmonar obstructiva crónica (EPOC)12 o el coma5. Además, hay que destacar que la etiología depende en gran medida de factores locales13,14. Así, la etiología difiere entre las diferentes UCI de diferentes hospitales13 e incluso entre las distintas UCI de un mismo hospital14. La etiología microbiológica más frecuente se resume en la tabla 315,16.
Microbiología de las muestras respiratorias en los episodios de neumonía asociada a la ventilación mecánica
| Kollef16 (n = 398) (%) | Agbath15 (n = 313) (%) | |
| Grampositivos | ||
| MSSA | 35 (8,8) | 68 (21,7) |
| MRSA | 59 (14,8) | 25 (8,0) |
| Streptococcus pneumoniae | 24 (7,7) | |
| Otros Streptococcus spp. | 13 (4,2) | |
| Gramnegativos | ||
| Haemophilus influenzae | 52 (16,6) | |
| Pseudomonas aeruginosa | 57 (14,3) | 43 (13,7) |
| Acinetobacter baumannii | 8 (2,0) | 10 (3,2) |
| Escherichia coli | 12 (3,0) | 16 (5,1) |
| Enterobacter spp. | 13 (3,3) | 12 (3,8) |
| Klebsiella spp. | 13 (3,3) | 24 (7,7) |
| Proteus spp. | 12 (3,8) | |
| Serratia marcescens | 7(2,2) | |
| Morganella morganii | 5(1,6) | |
| Stenotrophomonas maltophilia | 2 (0,6) | |
| Número patógenos aislados por episodio | 1,57 | |
MSSA: Staphylococcus aureus sensible a meticilina;
MRSA: Staphylococcus aureus resistente a meticilina.
Los episodios de NAV se han clasificado desde hace mucho tiempo en NAV temprana y tardía, según si se diagnostican antes o después del quinto día. Esta diferenciación tiene la ventaja de agrupar los microorganismos en dos grupos de etiología con implicaciones terapéuticas. Los episodios de NAV tempranos suelen estar producidos por patógenos como Streptococcus pneumoniae, Haemophilus influenzae y Staphylococcus aureus sensible a meticilina (MRSA). Estos patógenos no suelen presentar problemas para su tratamiento antibiótico, y la mayoría de las pautas de tratamiento empírico aseguran que serán fármacos activos contra ellos. En contraste, los pacientes con episodios de NAV tardíos suelen presentar riesgo de que esta infección esté producida por microorganismos con un perfil de resistencia antibiótica diferente. Entre estos se encuentran Pseudomonas aeruginosa, Acinetobacter baumannii y MRSA, sobre todo, aunque también pueden existir otros bacilos gramnegativos. Además, la etiología puede estar modulada por la existencia de enfermedades de base (EPOC, inmunodepresión), tratamiento antibiótico previo o factores locales (alta presión de colonización por algún patógeno), favoreciendo primero la colonización y posteriormente la presencia de episodios por algunos de los microorganismos de difícil tratamiento.
Clínica y diagnósticoLa situación clínica ante la que sospecharemos una NAV es un paciente en ventilación mecánica que presenta fiebre y secreciones purulentas por el tubo endotraqueal. El diagnóstico no ha cambiado, en esencia, en los últimos años. La presencia de una opacidad en la radiografía de tórax, junto con evidencia de infección local (secreciones purulentas por el tubo endotraqueal) y sistémica (fiebre y/o leucocitosis), nos da el diagnóstico clínico.
Aunque esta definición no aportaría mayores problemas en pacientes no ventilados, el hecho de que haya muchas entidades que cursen con infiltrados radiológicos (síndrome de distrés respiratorio agudo, edema agudo de pulmón, atelectasias, embolia pulmonar, infiltración neoplásica) en pacientes que puedan ya presentar fiebre y/o leucocitosis por otras razones, complican el diagnóstico. Para determinar la posibilidad de presentar neumonía se diseñó un índice de probabilidad, el Clinical Pulmonary Infection Score (CPIS), aunque en estudios recientes no se ha obtenido beneficio alguno de este índice como herramienta de sospecha de NAV. En estas condiciones, en la actualidad se sigue considerando el criterio clínico como el método de diagnóstico válido.
Otro punto de controversia durante años ha sido el método de diagnóstico etiológico. Una vez realizado el diagnóstico clínico, la recomendación es realizar una prueba de diagnóstico etiológico antes de iniciar o cambiar el tratamiento antibiótico, sin que esto comporte un retraso en el inicio de su administración17. En el momento actual, en las UCI europeas los métodos realizados con fibrobroncoscopio no son mayoritarios18, se realizan en el 23% de los pacientes con NAV, mientras que en el 62% se realiza broncoaspirado traqueal cuantitativo.
La existencia de una vía aérea artificial comporta que la esterilidad de la vía aérea inferior se pierde a las pocas horas de intubar a un paciente19. Así, las muestras microbiológicas cualitativas, como el broncoaspirado traqueal simple, casi siempre nos mostrarán la existencia de microorganismos sin que ello implique un papel patogénico en la NAV que presente el paciente en ese momento. Por otro lado, el cultivo negativo debe hacer cuestionar el diagnóstico de NAV, sobre todo si recientemente no ha habido introducción o cambio de antibiótico. La realización de muestras mediante fibrobroncoscopio nos permite acceder al tracto respiratorio inferior, y en muestras de buena calidad, diagnosticar la etiología de la NAV con mayor seguridad. La realización de cultivos cuantitativos en las muestras microbiológicas extraídas mediante fibrobron-coscopio es común, como tendría que ser el examen de la calidad de la muestra. Cuando se realiza la obtención mediante catéter telescopado protegido, una muestra de calidad deberá presentar menos del 1% de células epiteliales (un número mayor sugeriría colonización orofaríngea) y más de 10 neutrófilos por campo20. En el lavado broncoalveolar (LBA) de pacientes con neumonía, la presencia de neutrófilos es un hallazgo constante, aunque no exclusivo, ya que puede encontrarse en otras entidades, como el síndrome de distrés respiratorio agudo. En cambio, en broncoaspirados traqueales, el número de leucocitos polimorfonucleares tiene menor valor como discriminante en cuanto a presencia o no de neumonía20, a diferencia de la valoración de un esputo de buena calidad en pacientes con neumonía comunitaria (menos de 10 células epiteliales y más de 25 leucocitos por campo)21, aunque se suelen considerar los mismos valores para determinar su calidad22.
Manejo y tratamientoSi el diagnóstico ha sido un campo abonado a la controversia, el manejo presenta muchas diferencias en el enfoque, pero se ha reflejado en menor grado en la literatura.
El manejo conlleva dos tratamientos simultáneos. Por un lado, el tratamiento de soporte, y por otro, el tratamiento antibiótico. La NAV es una infección que suele afectar a pacientes en una situación clínica deteriorada con una repercusión que puede llegar a ser grave sobre el paciente. El tratamiento de soporte se inicia con una ventilación mecánica ajustada a las necesidades del paciente. De entrada, un paciente que desarrolla una NAV no está, al menos el primer día, en condiciones de ser extubado. Si se estabiliza rápidamente podrá ser reevaluado. La ventilación mecánica irá dirigida a buscar la mejor oxigenación de los tejidos con el menor daño secundario. Para ello, será importante no olvidar que la mejor fracción inspirada de oxígeno (FiO2) es la menor FiO2, ya que el oxígeno a altas concentraciones puede ser tóxico. De hecho, en los pacientes con infección pulmonar, cifras de FiO2 tan bajas como del 50% pueden ser tóxicas. La administración de presión positiva al final de la espiración (PEEP) ayuda a mejorar la oxigenación, pero hay que buscar un equilibrio entre la oxigenación, la ausencia de sobredistensión pulmonar y las necesidades del paciente.
Respecto al tratamiento antibiótico, se ha demostrado claramente que el tratamiento empírico inicial inadecuado conlleva una mayor mortalidad23, lo que parece muy razonable para cualquier infección grave, y las diferencias de abordaje intentan minimizar los tratamientos antibióticos inadecuados iniciales.
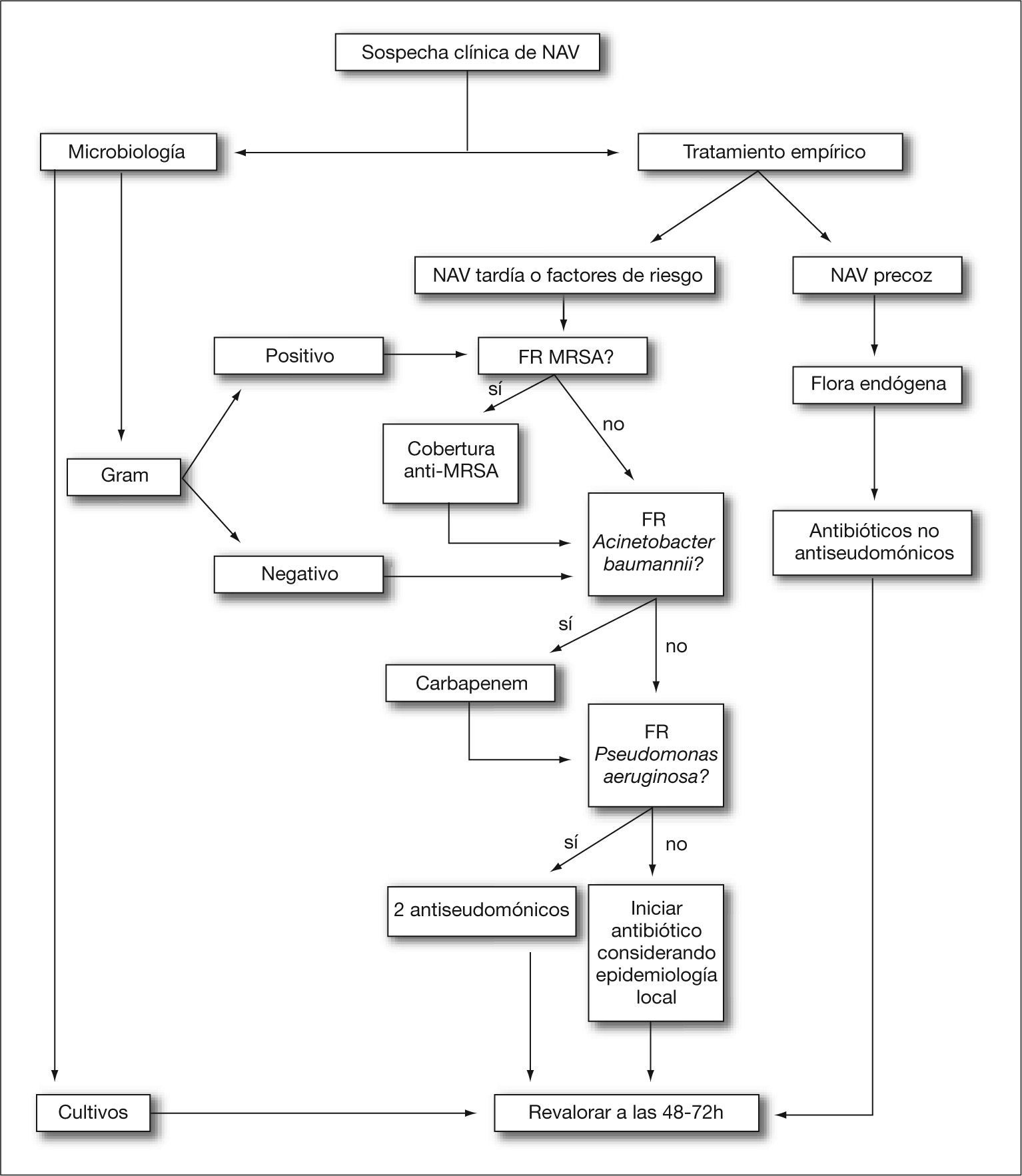
En esencia, el diagnóstico de una NAV en un paciente requiere una evaluación de su estado y de los factores de riesgo para patógenos de difícil tratamiento (fig. 1). Si la NAV es temprana y no existen estos factores de riesgo, la mayoría de las pautas empíricas presentan una cobertura correcta de la flora que nos encontraremos. Sin embargo, si el diagnóstico de NAV se realiza en un paciente con más de 1 semana de ventilación mecánica, en tratamiento antibiótico o con factores de riesgo, deberemos individualizar la pauta. Si se realiza una prueba de diagnóstico etiológico y disponemos de la información de la tinción de Gram, nos servirá para orientar el tratamiento empírico. Si no disponemos de esta prueba hemos de ponernos en la siguiente situación. Si el paciente está colonizado por MRSA o en el área existen varios pacientes colonizados o infectados por MRSA, la pauta empírica debe contemplar su tratamiento. Si no es así, pero existe riesgo de Acinetobacter baumannii, especialmente con una alta densidad de colonización, se debe tratar empíricamente. Por último, además, hay que considerar que con o sin estos dos patógenos previamente revisados, en las condiciones previas, se ha de tener en cuenta que la etiología puede deberse a Pseudomonas aeruginosa.
PrevenciónUno de los puntos de mayor potencial repercusión es la prevención. Dado que en la patogenia la aspiración de secreciones de la orofaringe al tracto respiratorio tiene un papel crucial, la prevención se basará principalmente en reducir la colonización orofaríngea, el inóculo o ambas24. Esta prevención se puede articular en dos grupos de medidas: generales y específicas. Estas medidas se pueden apreciar en la tabla 4. Las medidas generales son aplicables en la prevención de todas las infecciones nosocomiales. Entre éstas figuran la existencia de un programa para el control de la infección nosocomial, la higiene de manos y el uso de guantes y bata para la atención de pacientes ingresados en las UCI. Estas medidas tienen el objetivo de detectar problemas puntuales y minimizar la posibilidad de transmisión cruzada de patógenos. Entre las medidas específicas en el cuidado de la vía aérea artificial figura la reducción de la colonización orofaríngea o del inóculo que llegará al tracto respiratorio inferior. El lavado de la cavidad oral con clorhexidina y la descontaminación digestiva intestinal buscan reducir la colonización orofaríngea. La mayoría de prácticas preventivas van encaminadas a la reducción del volumen de secreciones orofaríngeas que llegarán al tracto respiratorio inferior. Así, la posición semiincorporada, el mantenimiento de la presión del neumotaponamiento entre 25 y 30 cm de H2O, el drenaje de secreciones subglóticas y el drenaje del condensado en las tubuladuras del ventilador, permiten una potencial disminución del volumen de secreciones que alcanzará el tracto respiratorio inferior. El uso de antibióticos tiene un papel bimodal. Su administración como profilaxis en pacientes en coma, en dos únicas dosis en el momento de la intubación y 12 h después, se ha asociado con una reducción de la NAV5. Esta medida no conllevaría una selección de patógenos. En cambio, la administración de antibioterapia favorecería una selección de patógenos como MRSA, Acinetobacter baumannii o Pseudomonas aeruginosa.
Medidas de prevención de la neumonía asociada a la ventilación mecánica
| Medidas generales | Efectividad |
| Presencia de programa de control de infecciones | Sí |
| Higiene de manos antes y después del contacto con el paciente | Sí |
| Uso de guantes y gorros | Indeterminada |
| Nutrición adecuada | Sí |
| Medidas específicas | Efectividad |
| Retirada de sonda nasogástrica y tubo endotraqueal de forma temprana | Sí |
| Posición semiincorporada | Sí |
| Evitar sobredistensión gástrica | Sí |
| Intubación oral en lugar de nasal | Sí |
| Aspiración continua de secreciones subglóticas | Sí |
| Mantenimiento de presión adecuada en el neumotaponamiento | Sí |
| Evitar el cambio de tubuladuras antes de una semana de uso | Sí |
| Uso de ventilación mecánica no invasiva | Sí |
| Cambio rutinario de sistemas de succión cerrados | No |
| Fisioterapia respiratoria | No |
| Humidificación con intercambiador calor-humedad | Indeterminada |
| Cambios posturales | Indeterminada |
| Medidas farmacológicas | Efectividad |
| Descontaminación digestiva selectiva | Indeterminada |
| Uso preventivo de antibióticos | Sí, en el momento de la intubación |
| Higiene oral con clorhexidina | Sí, en cirugía cardíaca |
| Sucralfato en lugar de ranitidina | Igual de eficaces |
| Evitar sedación profunda y relajantes musculares | Sí |
El avance reciente en la prevención de la NAV ha venido de la aplicación de una serie de medidas en el cuidado de los pacientes. Así, Resar et al25 han demostrado que la implementación de un paquete de medidas -care bundle-puede asociarse a una disminución del número de NAV. En el estudio de Resar et al25 las medidas adoptadas fueron: profilaxis de las úlceras de estrés, profilaxis de la trombosis venosa profunda, elevación de la cabecera de la cama, retirada diaria de la sedación y valoración de la capacidad de ser extubado o no (sedation vacation). En este estudio multicéntrico, las UCI que cumplieron las medidas presentaron una reducción media del número de NAV del 44,5%. Este enfoque se ha mostrado también válido para la reducción de la bacteriemia relacionada con el cateterismo venoso central26.
Nuestro grupo ha coordinado un proyecto multicéntrico basado en la aplicación de un paquete de cinco medidas para la prevención de la NAV. Estas cinco medidas fueron las siguientes: higiene de manos, comprobación de la presión del neumotaponamiento, higiene de la cavidad oral con clorhexidina, aplicación de un protocolo de extubación o retirada diaria de la sedación y evitar el cambio de tubuladuras antes de 1 semana.
El uso de la traqueostomía como forma de prevención de la NAV se ha evaluado en varios estudios27–30. En los tres primeros estudios se realizó aleatorización entre traqueostomía temprana o tardía con un total de 289 pacientes, su uso no se asoció a una disminución de la NAV (riesgo relativo 0,80; IC 95% 0,70-1,10). Más recientemente, Rumbak et al30, en un estudio aleatorizado en pacientes con expectativa de tiempo de ventilación mecánica superior a 14 días apreciaron una reducción en mortalidad, tiempo en UCI, tiempo en ventilación mecánica y frecuencia acumulada de neumonía. Este estudio, sin embargo, presenta unos resultados controvertidos que no han sido corroborados por otros grupos de investigadores hasta el momento.
Los episodios de NAV posteriores a la realización de la traqueostomía suelen deberse a Pseudomonas aeruginosa31.
ConclusiónLa neumonía es la primera complicación infecciosa en los pacientes graves de UCI, y es la causa más frecuente de mortalidad de las infecciones nosocomiales. Esta morbimortalidad asociada es mayor si se debe a patógenos multirresistentes. El diagnóstico de la NAV es fundamentalmente clínico, y se basa en la presencia de secreciones purulentas y en la aparición de infiltrados en la radiografía de tórax. El tratamiento antibiótico empírico se deberá basar en las comorbilidades del paciente, el tiempo de hospitalización, el uso previo de antibóticos y, sobre todo, en la epidemiología local. Las pruebas de diagnóstico etiológico nos van a permitir revalorar la pauta antibiótica, permitiendo la desescalación.