Streptococcus pneumoniae causa enfermedades graves en la población susceptible. La vacuna neumocócica conjugada (PCV) 13-valente (PCV13) se incluyó en el calendario infantil en 2011. Este estudio analiza la evolución de los serotipos de neumococo y de sus resistencias tras la PCV13.
MétodosSe incluyeron los neumococos serotipados en Galicia en 2011-2021. Se estudió la sensibilidad antibiótica siguiendo criterios EUCAST. Se analizaron los datos en 3 subperíodos: inicial (2011-2013), medio (2014-2017) y final (2018-2021). Se calcularon las prevalencias de los serotipos y el porcentaje de resistencia a los antibióticos más representativos.
ResultadosSe incluyeron 2.869 aislados. Inicialmente el 42,7% presentaba tipos capsulares incluidos en la PCV13, frente al 15,4% al final. Los incluidos en la PCV20 y no en la PCV13 y PCV15 fueron el 12,5% inicialmente y el 41,3% al final. El 26,4% de los serotipos a lo largo del estudio no estaban incluidos en ninguna vacuna. La prevalencia del serotipo 8 se multiplicó casi por 8 y la del 12F se triplicó. El serotipo 19A fue el más resistente inicialmente. La resistencia de los serotipos 11A y 15A aumentó a lo largo del estudio.
ConclusionesLa introducción de la PCV13 en la población infantil determinó un cambio en los serotipos de neumococo hacia los incluidos en la PCV20 y los no incluidos en ninguna vacuna. El serotipo 19A inicialmente fue el más resistente, y el 15A, no incluido en ninguna vacuna, merece un especial seguimiento. El serotipo 8, que fue el que más se incrementó, no mostró resistencia destacable.
Streptococcus pneumoniae causes serious diseases in the susceptible population. The 13-valent pneumococci conjugate vaccine (PCV13) was included in the children's calendar in 2011. The objective of the study was to analyze the evolution of pneumococcal serotypes and their resistance after PCV13.
MethodsThis study included the pneumococci serotyped in Galicia in 2011-2021. Antibiotic susceptibility was analyzed following EUCAST criteria. The data was analyzed in 3 sub-periods: initial (2011-2013), middle (2014-2017) and final (2018-2021). The prevalence of serotypes and their percentage of resistance to the most representative antibiotics were calculated.
ResultsA total of 2.869 isolates were included. Initially, 42.7% isolates presented capsular types included in PCV13, compared to 15.4% at the end. Those included in PCV20 and not in PCV13 and PCV15 were 12.5% at baseline and 41.3% at the end; 26.4% of the isolates throughout the study had serotypes not included in any vaccine. The prevalence of serotype 8 multiplied almost by 8 and that of 12F tripled. The 19A serotype was initially the most resistant, while the resistance of serotypes 11A and 15A increased throughout the study.
ConclusionsThe introduction of PCV13 in the pediatric population determined a change in pneumococcal serotypes towards those included in PCV20 and those not included in any vaccine. Serotype 19A was initially the most resistant and the 15A, not included in any vaccine, deserves special follow-up. Serotype 8, which increased the most, did not show remarkable resistance.
Streptococcus pneumoniae (neumococo) es un microorganismo clasificado en diferentes serotipos según las propiedades antigénicas de los polisacáridos de su cápsula externa1,2, que produce infecciones leves (otitis, sinusitis o bronquitis) y enfermedad neumocócica invasiva (ENI) grave, como bacteriemia, meningitis o neumonía. De hecho, la neumonía neumocócica se considera una de las enfermedades graves más prevalentes, tanto en países desarrollados como en aquellos en vías de desarrollo3. Esta enfermedad afecta principalmente a niños menores de 2 años, adultos mayores de 65 años y personas inmunodeprimidas.
Para prevenir la enfermedad neumocócica (EN) se desarrollaron diferentes vacunas, que tienen tantas valencias como serotipos contra los que van dirigidas: la vacuna antineumocócica conjugada 7-valente (PCV7), la conjugada 13-valente (PCV13), las vacunas antineumocócicas conjugadas 15-valente (PCV15), 20-valente (PCV20) y la polisacárida 23-valente (PPV23).
El acuerdo técnico favorable al inicio de un estudio piloto para evaluar el impacto de la vacuna PCV13 en la ENI, propició la introducción gratuita de esta vacuna en el calendario vacunal infantil gallego en enero de 20114. La vacuna PCV13 se ofreció a todos los niños nacidos a partir del 1 de noviembre de 2010, y a todos los niños nacidos a partir del 1 de enero de 2010 que habían comenzado la vacunación con PCV7. La pauta fue de 3 dosis (a los 2, 4 y 12 meses) y las coberturas alcanzadas para las 3 dosis fueron, entre los nacidos de 2010 a 2015, del 93%. El estudio finalizó en 2015 y, una vez evaluado el impacto de la vacuna en la incidencia de ENI5, se decidió consolidar la vacuna PCV13 en el calendario vacunal infantil (febrero 2015) e introducirla también gratuitamente en el del adulto (julio de 2017)6.
La vigilancia de la ENI sigue siendo fundamental porque la introducción de la vacuna induce cambios en los serotipos circulantes, basados en el efecto indirecto de la vacunación7,8. Recientemente, Houseman et al.9 publicaron un artículo en el que mostraban un aumento de ENI asociado a serotipos exclusivos de PPV23 y a serotipos no vacunales, y destacaban la necesidad de nuevas investigaciones para comprobar si este fenómeno era un resultado puntual o generalizado debido a cambios en el programa de vacunación.
Por otra parte, tras la vacunación con la PCV7 aumentó la prevalencia de aislados del serotipo 19A, muchos de ellos multirresistentes, y aunque el serotipo 19A está cubierto por la PCV13, se puede crear un nicho para otros serotipos. Varios autores han señalado un aumento de prevalencia de los serotipos 15A y 35B resistentes a múltiples antibióticos10.
El objetivo principal de este trabajo fue analizar la evolución de la ENI por serotipos PCV13 y serotipos no PCV13 en Galicia, así como estudiar la evolución de las resistencias a los antibióticos en las cepas de los serotipos identificados.
MétodosEste estudio se realizó en Galicia, una región situada en el noroeste de España que en 2021 tenía 2.695.645 habitantes.
Se incluyeron en el estudio todos los aislamientos de neumococo en muestras invasivas enviados a serotipar, en el período de 2011 a 2021, al laboratorio de referencia de nuestra comunidad autónoma en el Servicio de Microbiología del Hospital Universitario de Ferrol. El serotipado se realizó mediante aglutinación con látex y/o reacción de Quellung11 (Statens Serum Institut, Copenhague, Dinamarca). Además, se estudió la sensibilidad antibiótica a la penicilina, la cefotaxima, la vancomicina, la eritromicina, el levofloxacino, el cloranfenicol, la tetraciclina, el cotrimoxazol y la clindamicina. Para la interpretación de los resultados se siguieron los criterios de EUCAST de 202212 y se analizaron los datos cuando el resultado del antibiograma se interpretaba como resistente.
El serotipado se realizó con el apoyo de los laboratorios Pfizer, y durante los primeros meses, para validar la técnica, se enviaron las muestras al Centro Nacional de Microbiología.
Los diferentes serotipos se estratificaron para el análisis en 6 grupos en función de su inclusión en las diferentes vacunas: serotipos incluidos en la PCV7 (4, 6B, 9V, 14, 18C, 19F y 23F), PCV13 que no están en la PCV7 (1, 3, 5, 6A, 7F y 19A), incluidos en la PCV15 que no están en la PCV13 (22F y 33F), incluidos en la PCV20 que no están en la PCV15 (8, 10A, 11A, 12F y 15B), incluidos en la PPV23 que no están en la PCV-20 (2, 9N, 17F y 20) y serotipos que no están en ninguna vacuna.
Los grupos de edad definidos para los análisis fueron: pacientes menores de 5 años, de 5 a 44, de 45 a 64 y de 65 años y mayores. El período de estudio se dividió, a su vez, en 3 subperíodos: inicial, entre 2011 y 2013; medio, entre 2014 y 2017 y final entre 2018 y 2021.
En cada período se calcularon las prevalencias de los serotipos y el porcentaje de resistencia de los neumococos serotipados a los distintos antibióticos.
Para la gestión y análisis de los datos se empleó el programa Stata v16.1.
ResultadosEn el período 2011-2021 se enviaron a serotipar desde los diferentes hospitales de Galicia 2.869 cepas de neumococos aisladas en muestras invasivas (el 89,5% de estas en muestras de sangre, el 5,4% en el LCR, el 2,3% en el líquido pleural y el 2,8% en otro tipo de muestras).
El número anual de aislamientos varió entre 211 en 2014 y 293 en 2017 en los 2 primeros períodos, pero en los años 2018 y 2019 se superaron los 350 aislamientos y en 2020 y 2021 descendieron a 172 y 107, respectivamente.
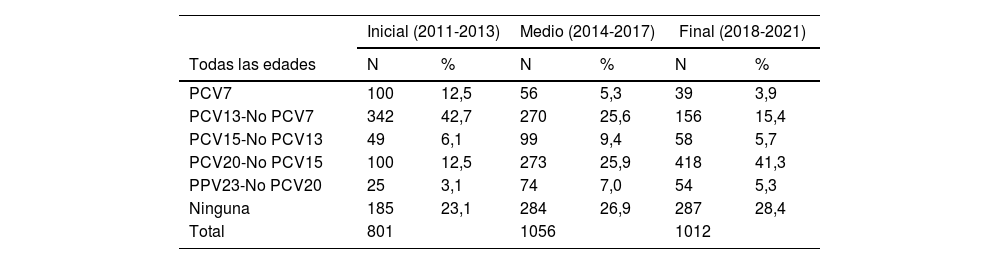
En la tabla 1 se muestran las prevalencias de los serotipos en Galicia entre 2011 y 2021, por grupo de edad, para cada uno de los 3 períodos analizados. Los serotipos incluidos en la PCV13 pasaron del 55,2% en la etapa inicial al 19,3% en la etapa final, y la disminución se mostró en todos los grupos de edad. Los serotipos incluidos en la vacuna PCV20 y no incluidos en la PCV13 o en la PCV15, pasaron del 12,5% inicial hasta el 41,3% en el período final, y el aumento también se mostró en todos los grupos de edad. Un total de 756 aislamientos (26,4%) fueron serotipos no incluidos en ninguna vacuna, y ese porcentaje se incrementó desde el 23,1% (n=185) en el período inicial hasta el 28,4% (n=287) en el período final.
Prevalencias de los serotipos de neumococos tipificados en Galicia desde 2011 a 2021, por períodos y grupos de edad
| Inicial (2011-2013) | Medio (2014-2017) | Final (2018-2021) | ||||
|---|---|---|---|---|---|---|
| Todas las edades | N | % | N | % | N | % |
| PCV7 | 100 | 12,5 | 56 | 5,3 | 39 | 3,9 |
| PCV13-No PCV7 | 342 | 42,7 | 270 | 25,6 | 156 | 15,4 |
| PCV15-No PCV13 | 49 | 6,1 | 99 | 9,4 | 58 | 5,7 |
| PCV20-No PCV15 | 100 | 12,5 | 273 | 25,9 | 418 | 41,3 |
| PPV23-No PCV20 | 25 | 3,1 | 74 | 7,0 | 54 | 5,3 |
| Ninguna | 185 | 23,1 | 284 | 26,9 | 287 | 28,4 |
| Total | 801 | 1056 | 1012 | |||
| 0-4 años | N | % | N | % | N | % |
|---|---|---|---|---|---|---|
| PCV7 | 2 | 5,7 | 7 | 10,9 | 0 | 0,0 |
| PCV13-No PCV7 | 16 | 45,7 | 10 | 15,6 | 2 | 5,3 |
| PCV15-No PCV13 | 4 | 11,4 | 6 | 9,4 | 3 | 7,9 |
| PCV20-No PCV15 | 2 | 5,7 | 16 | 25,0 | 14 | 36,8 |
| PPV23-No PCV20 | 0 | 0,0 | 3 | 4,7 | 0 | 0,0 |
| Ninguna | 11 | 31,4 | 22 | 34,4 | 19 | 50,0 |
| Total | 35 | 64 | 38 |
| 5-44 años | N | % | N | % | N | % |
|---|---|---|---|---|---|---|
| PCV7 | 14 | 12,3 | 9 | 5,6 | 5 | 3,7 |
| PCV13-No PCV7 | 55 | 48,2 | 44 | 27,2 | 15 | 11,2 |
| PCV15-No PCV13 | 6 | 5,3 | 14 | 8,6 | 2 | 1,5 |
| PCV20-No PCV15 | 19 | 16,7 | 61 | 37,7 | 85 | 63,4 |
| PPV23-No PCV20 | 8 | 7,0 | 11 | 6,8 | 3 | 2,2 |
| Ninguna | 12 | 10,5 | 23 | 14,2 | 24 | 17,9 |
| Total | 114 | 162 | 134 |
| 45-64 años | N | % | N | % | N | % |
|---|---|---|---|---|---|---|
| PCV7 | 29 | 13,5 | 15 | 5,5 | 18 | 5,9 |
| PCV13-No PCV7 | 93 | 43,3 | 70 | 25,5 | 31 | 10,2 |
| PCV15-No PCV13 | 10 | 4,7 | 19 | 6,9 | 15 | 5,0 |
| PCV20-No PCV15 | 31 | 14,4 | 84 | 30,5 | 150 | 49,5 |
| PPV23-No PCV20 | 3 | 1,4 | 21 | 7,6 | 24 | 7,9 |
| Ninguna | 49 | 22,8 | 66 | 24,0 | 65 | 21,5 |
| Total | 215 | 275 | 303 |
| ≥65 años | N | % | N | % | N | % |
|---|---|---|---|---|---|---|
| PCV7 | 55 | 12,6 | 25 | 4,5 | 16 | 3,0 |
| PCV13-No PCV7 | 177 | 40,6 | 146 | 26,3 | 108 | 20,1 |
| PCV15-No PCV13 | 29 | 6,7 | 60 | 10,8 | 38 | 7,1 |
| PCV20-No PCV15 | 48 | 11,0 | 112 | 20,2 | 169 | 31,5 |
| PPV23-No PCV20 | 14 | 3,2 | 39 | 7,0 | 27 | 5,0 |
| Ninguna | 113 | 25,9 | 173 | 31,2 | 178 | 33,2 |
| Total | 436 | 555 | 536 |
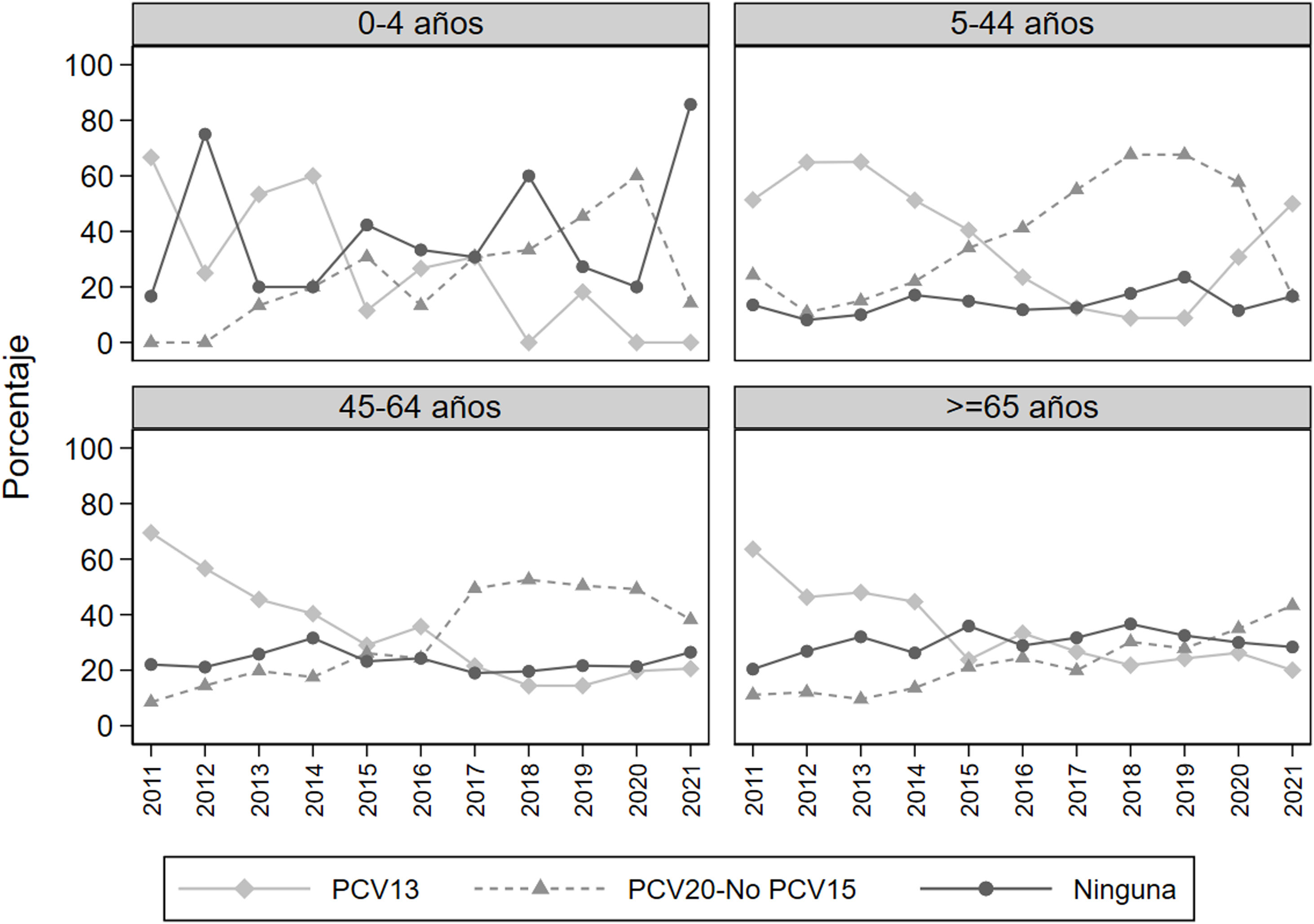
En la figura 1 se muestra, para cada grupo de edad, la evolución anual del porcentaje de serotipos en los 3 grupos vacunales con mayores prevalencias. La prevalencia de serotipos PCV13 disminuyó a lo largo del período de estudio en todos los grupos de edad, pero en el año 2019 hubo un repunte que se mantuvo en los años 2019 y 2020, sobre todo en el grupo de edad de 5 a 44 años. Los serotipos no incluidos en ninguna vacuna muestran, en los mayores de 5 años, una tendencia estable o levemente creciente, pero en el grupo de 0 a 4 años se observa un aumento brusco en el año 2021.
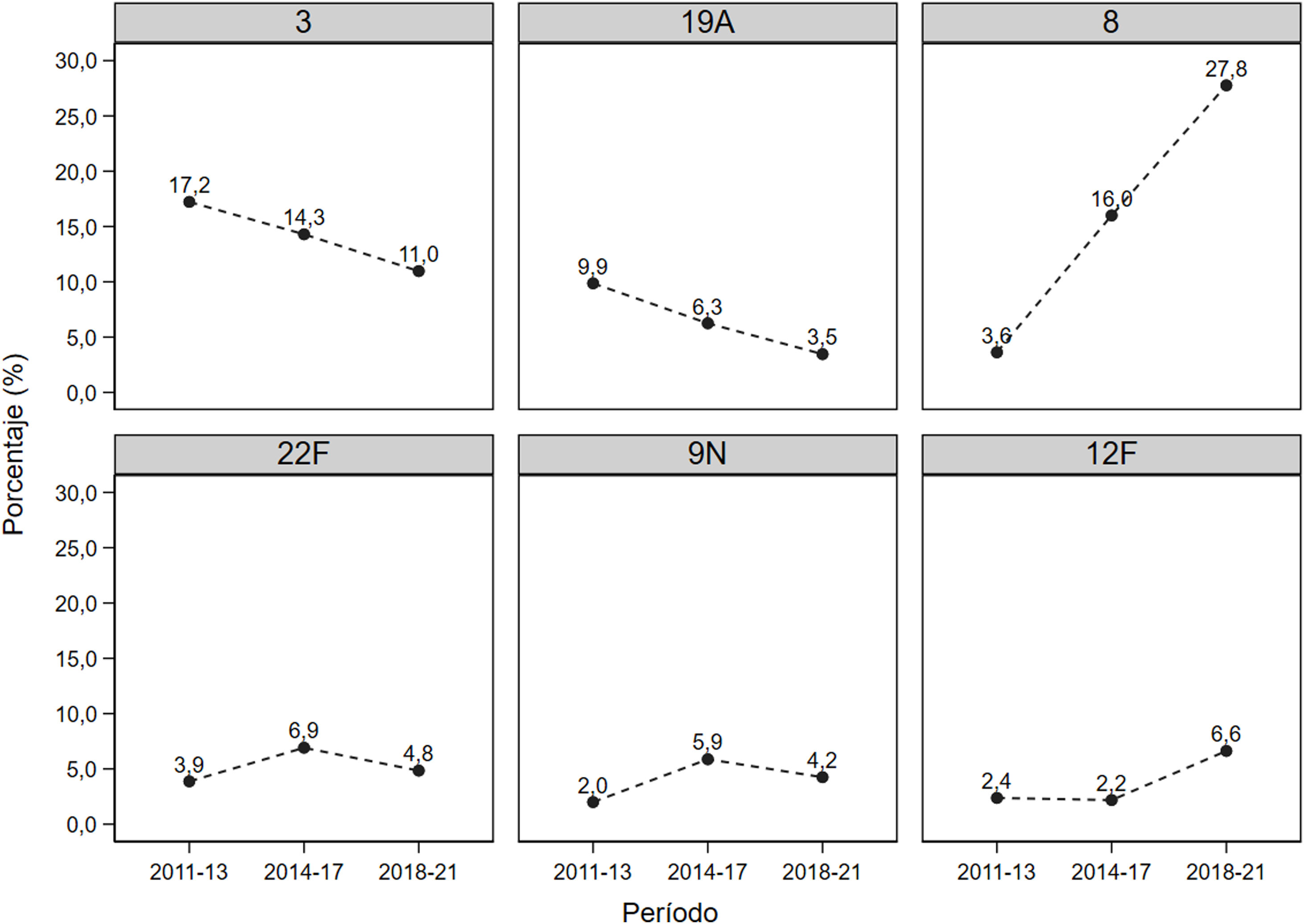
En la figura 2 se muestra la evolución en las prevalencias de los serotipos más frecuentes. Puede observarse que los serotipos 3 y 19A, incluidos en la PCV13, eran predominantes en el período inicial tras la introducción de la vacuna, pero fueron disminuyendo a lo largo del estudio, pasando del 17,2% inicial al 11,0% en el período final, y de 9,9% a 3,5%, respectivamente. En cuanto al serotipo 8 su prevalencia se multiplicó casi por 8 durante el período de estudio, pasando de un 3,6% inicial al 27,8% al final del estudio. El serotipo 12F casi triplicó su prevalencia del primer período al último, pasando de un 2,4% a un 6,6%.
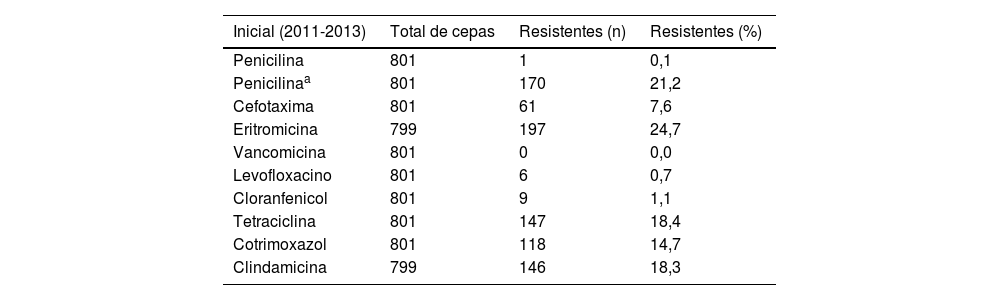
Respecto a la sensibilidad de los neumococos serotipados, los porcentajes de resistencias en cada uno de los periodos definidos se muestran en la tabla 2. Todas las cepas serotipadas fueron sensibles a vancomicina y apenas se detectaron resistencias a levofloxacino (n=22), cloramfenicol (n=45) y penicilina con criterios no meníngeos (n=11). El porcentaje de neumococos resistentes a penicilina con criterios meníngeos, cefotaxima, eritromicina, tetraciclinas y cotrimoxazol se redujo entre 4 y 6 puntos porcentuales en el período de estudio, mientras que la resistencia a clindamicina se redujo 2 puntos porcentuales al comparar el período inicial y el final. Se analizaron los fenotipos de resistencia de eritromicina y clindamicina, de modo que el fenotipo M supuso el 15,4% (n=96), el fenotipo MLSBc el 83,7% (n=522) y el fenotipo MLSBi el 1% (n=6).
Porcentaje de cepas de neumococo resistentes durante el período del estudio
| Inicial (2011-2013) | Total de cepas | Resistentes (n) | Resistentes (%) |
|---|---|---|---|
| Penicilina | 801 | 1 | 0,1 |
| Penicilinaa | 801 | 170 | 21,2 |
| Cefotaxima | 801 | 61 | 7,6 |
| Eritromicina | 799 | 197 | 24,7 |
| Vancomicina | 801 | 0 | 0,0 |
| Levofloxacino | 801 | 6 | 0,7 |
| Cloranfenicol | 801 | 9 | 1,1 |
| Tetraciclina | 801 | 147 | 18,4 |
| Cotrimoxazol | 801 | 118 | 14,7 |
| Clindamicina | 799 | 146 | 18,3 |
| Medio (2014-2017) | Total de cepas | Resistentes (n) | Resistentes (%) |
|---|---|---|---|
| Penicilina | 1.054 | 5 | 0,5 |
| Penicilina* | 1.054 | 199 | 18,9 |
| Cefotaxima | 1.055 | 38 | 3,6 |
| Eritromicina | 1.055 | 249 | 23,6 |
| Vancomicina | 1.056 | 0 | 0,0 |
| Levofloxacino | 1.056 | 6 | 0,6 |
| Cloranfenicol | 1.054 | 25 | 2,4 |
| Tetraciclina | 1.056 | 221 | 20,9 |
| Cotrimoxazol | 1.056 | 117 | 11,1 |
| Clindamicina | 1.054 | 213 | 20,2 |
| Final (2018-2021) | Total de cepas | Resistentes (n) | Resistentes (%) |
|---|---|---|---|
| Penicilina | 1.012 | 5 | 0,5 |
| Penicilinaa | 1.012 | 170 | 16,8 |
| Cefotaxima | 1.011 | 25 | 2,5 |
| Eritromicina | 1.012 | 188 | 18,6 |
| Vancomicina | 1.012 | 0 | 0,0 |
| Levofloxacino | 1.012 | 10 | 1,0 |
| Cloranfenicol | 1.012 | 11 | 1,1 |
| Tetraciclina | 1.012 | 145 | 14,3 |
| Cotrimoxazol | 1.012 | 96 | 9,5 |
| Clindamicina | 1.012 | 164 | 16,2 |
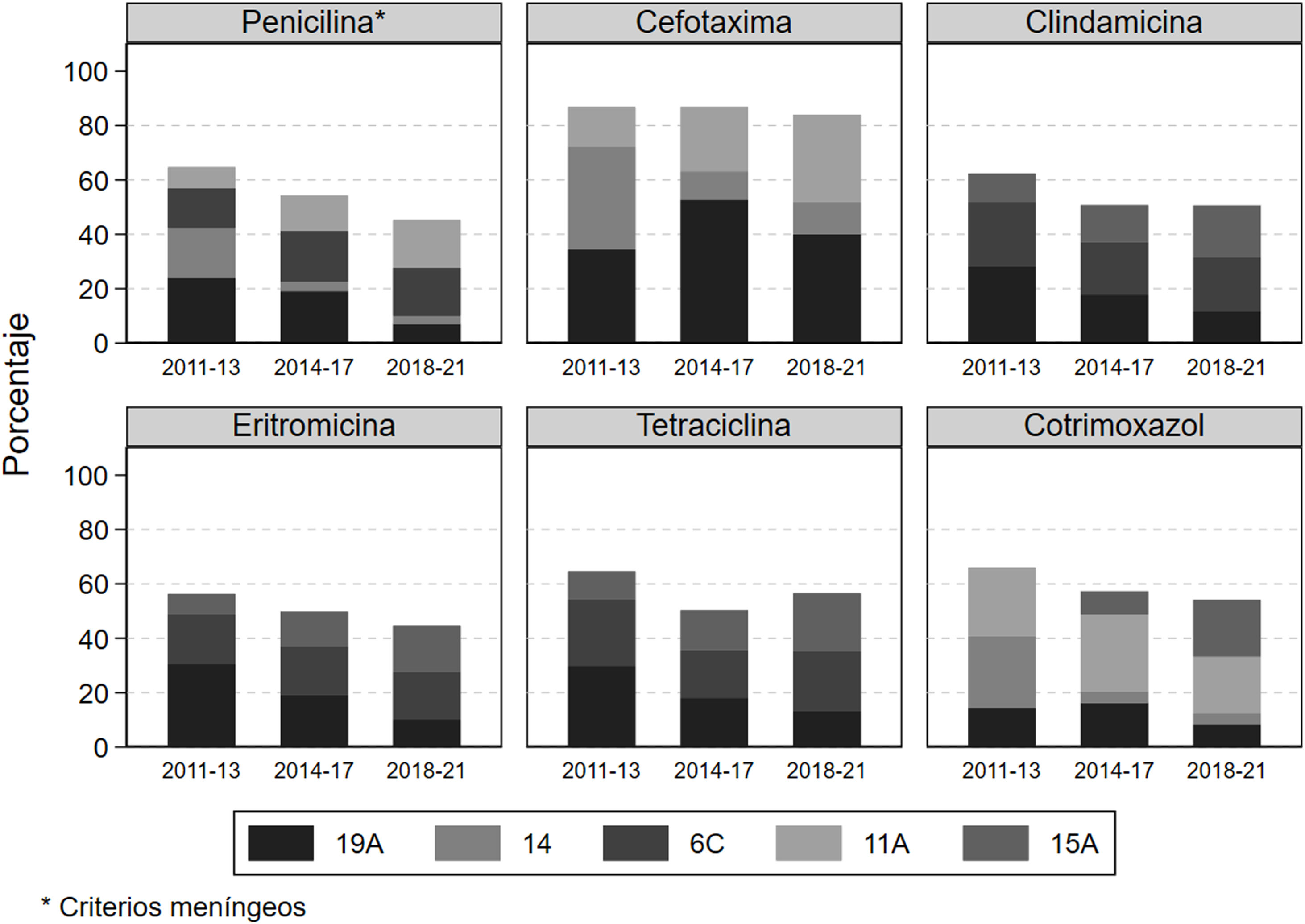
En la figura 3 se muestra la distribución de los neumococos resistentes a cada antibiótico en función de los serotipos más frecuentes. En la etapa inicial tras la vacunación el serotipo 19A fue el que presentó mayor resistencia para todos los antibióticos analizados, excepto para la cefotaxima y el cotrimoxazol, para los que presentó mayor resistencia el serotipo 14 con un 37,7% y un 26,3%, respectivamente. Pasado el primer período la frecuencia del serotipo 19A entre las cepas resistentes se redujo en todos los antibióticos, excepto para la cefotaxima, en la que aumentó del 34,4% al 40,0%. En el período final respecto al inicial destaca el ascenso en la frecuencia de resistencias a penicilina y a cefotaxima del serotipo 11A (incluido en la PCV20) que se multiplicaron por más de 2. Respecto al serotipo 15A, que no está incluido en ninguna vacuna, su frecuencia entre las cepas resistentes aumentó a lo largo del período de estudio a cefotaxima, clindamicina, eritromicina, tetraciclina y cotrimoxazol. El serotipo 8, que fue el que más aumentó durante el seguimiento, no presentó una resistencia destacable.
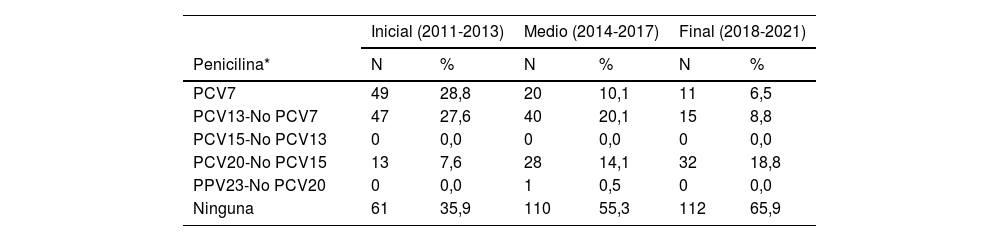
En la tabla 3 se muestra la distribución de neumococos resistentes por serotipos según su inclusión en las diferentes vacunas, excluyendo los antibióticos con nulo o bajo porcentaje de resistencias. Pueden identificarse 2 grupos de antibióticos con un comportamiento similar. Por un lado, los serotipos resistentes a penicilina (criterios meníngeos), cefotaxima y cotrimoxazol son, mayoritariamente, serotipos incluidos en la PCV13, en la PCV20-No PCV15 o no incluidos en ninguna vacuna. Por otro lado, los serotipos resistentes a eritromicina, tetraciclina y clindamicina se reparten entre todos los grupos de serotipos, con presencia residual en la PCV23-No PCV20. Los serotipos incluidos en la PCV13 y los que no están en ninguna vacuna suponen conjuntamente el 80% o más de los resistentes a estos antibióticos en todos los períodos. Para todos los antibióticos disminuyó el porcentaje de serotipos resistentes incluidos en la PCV13 entre un 27% para la cefotaxima y un 73% para la penicilina, y aumentó el porcentaje de serotipos resistentes no incluidos en ninguna vacuna entre un 46% para la cefotaxima y un 290% para el cotrimoxazol.
Distribución de cepas resistentes por serotipo en cada período
| Inicial (2011-2013) | Medio (2014-2017) | Final (2018-2021) | ||||
|---|---|---|---|---|---|---|
| Penicilina* | N | % | N | % | N | % |
| PCV7 | 49 | 28,8 | 20 | 10,1 | 11 | 6,5 |
| PCV13-No PCV7 | 47 | 27,6 | 40 | 20,1 | 15 | 8,8 |
| PCV15-No PCV13 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| PCV20-No PCV15 | 13 | 7,6 | 28 | 14,1 | 32 | 18,8 |
| PPV23-No PCV20 | 0 | 0,0 | 1 | 0,5 | 0 | 0,0 |
| Ninguna | 61 | 35,9 | 110 | 55,3 | 112 | 65,9 |
| Cefotaxima | N | % | N | % | N | % |
|---|---|---|---|---|---|---|
| PCV7 | 26 | 42,6 | 7 | 18,4 | 4 | 16,0 |
| PCV13-No PCV7 | 21 | 34,4 | 20 | 52,6 | 10 | 40,0 |
| PCV15-No PCV13 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| PCV20-No PCV15 | 9 | 14,8 | 9 | 23,7 | 8 | 32,0 |
| PPV23-No PCV20 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Ninguna | 5 | 8,2 | 2 | 5,3 | 3 | 12,0 |
| Eritromicina | N | % | N | % | N | % |
|---|---|---|---|---|---|---|
| PCV7 | 24 | 12,2 | 19 | 7,6 | 14 | 7,4 |
| PCV13-No PCV7 | 68 | 34,5 | 54 | 21,7 | 23 | 12,2 |
| PCV15-No PCV13 | 17 | 8,6 | 24 | 9,6 | 14 | 7,4 |
| PCV20-No PCV15 | 15 | 7,6 | 25 | 10,0 | 15 | 8,0 |
| PPV23-No PCV20 | 1 | 0,5 | 2 | 0,8 | 4 | 2,1 |
| Ninguna | 72 | 36,5 | 125 | 50,2 | 118 | 62,8 |
| Tetraciclina | N | % | N | % | N | % |
|---|---|---|---|---|---|---|
| PCV7 | 14 | 9,5 | 16 | 7,2 | 8 | 5,5 |
| PCV13-No PCV7 | 46 | 31,3 | 51 | 23,1 | 22 | 15,2 |
| PCV15-No PCV13 | 12 | 8,2 | 16 | 7,2 | 4 | 2,8 |
| PCV20-No PCV15 | 12 | 8,2 | 24 | 10,9 | 9 | 6,2 |
| PPV23-No PCV20 | 1 | 0,7 | 3 | 1,4 | 1 | 0,7 |
| Ninguna | 62 | 42,2 | 111 | 50,2 | 101 | 69,7 |
| Cotrimoxazol | N | % | N | % | N | % |
|---|---|---|---|---|---|---|
| PCV7 | 48 | 40,7 | 14 | 12,0 | 11 | 11,5 |
| PCV13-No PCV7 | 18 | 15,3 | 19 | 16,2 | 8 | 8,3 |
| PCV15-No PCV13 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| PCV20-No PCV15 | 35 | 29,7 | 38 | 32,5 | 22 | 22,9 |
| PPV23-No PCV20 | 0 | 0,0 | 2 | 1,7 | 1 | 1,0 |
| Ninguna | 17 | 14,4 | 44 | 37,6 | 54 | 56,3 |
| Clindamicina | N | % | N | % | N | % |
|---|---|---|---|---|---|---|
| PCV7 | 17 | 11,6 | 17 | 8,0 | 13 | 7,9 |
| PCV13-No PCV7 | 44 | 30,1 | 42 | 19,7 | 20 | 12,2 |
| PCV15-No PCV13 | 17 | 11,6 | 24 | 11,3 | 8 | 4,9 |
| PCV20-No PCV15 | 5 | 3,4 | 16 | 7,5 | 11 | 6,7 |
| PPV23-No PCV20 | 0 | 0,0 | 2 | 0,9 | 4 | 2,4 |
| Ninguna | 63 | 43,2 | 112 | 52,6 | 108 | 65,9 |
En Galicia la vacunación con la PCV13 está incluida en el calendario de vacunación infantil desde 2011 y en población adulta desde 2017.
En este estudio se pone de manifiesto cómo los serotipos incluidos en la PCV13 disminuyeron como causa de ENI una vez que se instauró la vacunación en la población infantil, lo cual puede demostrar una protección de rebaño en todos los grupos de edad. La disminución de serotipos incluidos en la PCV13 como causa de ENI también fue descrita por otros autores en España, Europa y EE. UU.:7,8,13–15. Hay que destacar el incremento de estos serotipos en el grupo de 5 a 44 años en los años 2020 y 2021, pero este aumento podría deberse al escaso número de aislamientos serotipados en esos años, por lo que debería confirmarse si se mantiene el aumento con datos posteriores a 2021. Entre los serotipos incluidos en la PCV13 los más frecuentes fueron el 3 y el 19A, y se redujeron, aunque no fueron los que más disminuyeron. El serotipo 19A, que era el más frecuente entre los resistentes a los antibióticos estudiados, mostró una reducción para todos los antibióticos estudiados, excepto para la cefotaxima. Esa diminución del serotipo 19A tras la PCV13 también la documentaron otros autores en Japón y en España8,16. Por otra parte, diferentes estudios en España y Portugal14 encontraron que el serotipo 3 se mantenía a pesar de la vacunación. Concretamente en Portugal14 se introdujo la PCV13 en el calendario de vacunación infantil en 2015 e hicieron el análisis con datos entre 2015 y 2018, observando una modesta reducción de los serotipos incluidos en la PCV13 o incluso una estabilización, pero quizás debieran estudiar este efecto a más largo plazo. En nuestro estudio se analizan datos 11 años después de la vacunación infantil con la PCV13, lo cual es más generalizable.
Por otra parte, a lo largo del estudio se observó cómo a la vez que disminuyeron los serotipos incluidos en la PCV13 aumentaron los serotipos no incluidos15,17,18, sobre todo el serotipo 8, cuya prevalencia se multiplicó casi por 8 durante el período del estudio. El aumento del serotipo 8 también lo observaron otros autores7,13,19–21. El serotipo 8 está incluido en la PCV20, por lo cual esta vacuna podría ayudar a mitigarlo. En este estudio no se analizaron las causas de gravedad clínica de la ENI que pudiera relacionar ese serotipo con mayor patogenicidad, como hicieron Sá-Leao et al.22, que lo describieron como uno de los asociados a enfermedad invasiva. Sin embargo, este serotipo no manifestó resistencia a los antibióticos.
Otro serotipo destacable es el 12F, que triplicó su prevalencia a lo largo del estudio. Ese serotipo también está incluido en la PCV20 y, al igual que el serotipo 8, tampoco presentó resistencia destacable a los antibióticos estudiados.
El serotipo 11A, también incluido en la PCV20 y relacionado según algún estudio23 con el estado de portador, multiplicó por más de 2 su frecuencia entre los serotipos resistentes a penicilina y cefotaxima entre el período inicial y el final.
En el grupo de 0 a 4 años destaca el abrupto incremento de la prevalencia de ENI por serotipos no incluidos en ninguna vacuna, que por otra parte aumentaron en todos los grupos de edad, salvo en el de 45 a 64 años, en donde se mantuvieron estables. Estos serotipos, analizados en conjunto, aumentaron su porcentaje de resistencias un 46% a cefotaxima y un 290% a cotrimoxazol, y dentro de estos destaca el serotipo 15A. Este serotipo debe ser especialmente vigilado y esto también lo reseñan Nakano et al.24, quienes en Japón asocian al clon 15A-ST9084 con urgencia de alta resistencia y Shepard et al. en el Reino Unido10, quienes advirtieron del aumento de este serotipo multirresistente y no incluido en ninguna vacuna.
Este estudio pone de manifiesto la influencia de la vacunación con la PCV13 en la población gallega, ya que la muestra es representativa de toda la comunidad, dado que el laboratorio autonómico de referencia para el serotipado de neumococos recibe muestras de todas las áreas sanitarias de la comunidad. Además, el período del estudio (2011-2021) fue suficientemente amplio para sacar conclusiones sobre la evolución de los serotipos y su resistencia a los antibióticos.
Una limitación del estudio fue que no permitió calcular incidencias, que podrían indicar un reemplazamiento de serotipos, ya que en los años 2020 y 2021 se redujo el número de neumococos serotipados, y se desconoce si esto fue debido a una disminución en la incidencia de la ENI, o si fue porque las cepas de neumococo no se enviaron a serotipar debido a la pandemia de la COVID-19.
Como conclusión, a lo largo del período del estudio se evidencia que desde la introducción de la vacuna PCV13 en la población infantil hubo un cambio en los serotipos de neumococo en Galicia hacia los serotipos incluidos en la PVC20, y no en la PVC15 y hacia los no incluidos en ninguna vacuna, tanto en la población infantil vacunada como en los de 65 y más años. Aunque con los datos disponibles no se calcularon tasas de incidencia y no podemos hablar de reemplazamiento de serotipos, sí que se observa cómo los serotipos incluidos en la PCV13 fueron los predominantes en el período inicial analizado, mientras que en el resto del período fueron los serotipos 8 y 12F, ambos incluidos en la PCV20. Todas las cepas de neumococo fueron sensibles a vancomicina y el 99% lo fueron a levofloxacino. El serotipo 19A fue el más resistente durante la etapa inicial tras la vacunación con la PCV13, mientras que el serotipo 15A, no incluido en ninguna vacuna, fue aumentando su resistencia a lo largo del estudio y merece un especial seguimiento. El serotipo 8, que se hizo predominante progresivamente durante el período analizado, no mostraba unos porcentajes de resistencia destacables.
Consideraciones éticasEste estudio fue realizado conforme a la Declaración de Helsinki sobre los principios éticos para las investigaciones médicas en seres humanos. El derecho a la confidencialidad se mantuvo en todo momento. Para esta publicación no se manejó ningún dato personal de los pacientes salvo el grupo de edad.
FinanciaciónEste trabajo presenta los resultados de un proyecto de investigación liderado por el Servizo de Microbioloxía del Complexo Hospitalario Universitario de Ferrol y con participación de la Dirección Xeral de Saúde Pública de Galicia.
Fue patrocinado por la empresa farmacéutica Pfizer. N.° Expediente: AAB-VAC-2015-01. Entidad Financiadora: Pfizer. S.L U.
Conflicto de interesesPedro Miguel Juiz González y Susana Méndez Lage han sido contratados a cargo del proyecto y Andrés Agulla Budiño fue el investigador principal del mismo. Isabel Losada Castillo y Alberto Malvar Pintos fueron investigadores colaboradores del proyecto. El resto de los autores no tiene ningún conflicto de intereses.
María Rodríguez-Mayo. Complexo Hospitalario Universitario de A Coruña.
Gema Barbeito-Castiñeiras. Complexo Hospitalario Universitario de Santiago.
Francisco José Vasallo-Vidal. Complexo Hospitalario Universitario de Vigo.
Isabel Paz-Vidal. Complexo Hospitalario Universitario de Ourense.
Pedro Alonso-Alonso. Hospital Comarcal de Monforte.
Marta Serrano-López. Hospital da Mariña de Burela.
Victoria Pulián-Morais. Complexo Hospitalario Universitario de Pontevedra.
María Domínguez González. Hospital Comarcal de Valdeorras.
Patricia Capón González. Hospital Universitario Lucus Augusti.