Una de las posibles etiologías de la rabdomiólisis son los fármacos, y entre ellos, las estatinas. Especialmente simvastatina y lovastatina tienen un elevado metabolismo hepático, por lo que están más sujetas a interacciones con otros fármacos que puedan reducir su metabolismo y aumentar su toxicidad.
Pacientes y métodosSe describe un caso clínico de una paciente infectada por el VIH en tratamiento antirretroviral que desarrolló rabdomiólisis, insuficiencia renal y hepatotoxicidad grave tras la sustitución de atorvastatina por simvastatina. Se revisan los casos descritos en la literatura.
ResultadosLa paciente requirió ingreso hospitalario y evolucionó favorablemente tras hidratación y alcalinización de la orina, recuperando su estado basal. Existen 4 casos publicados, de los cuales uno falleció.
ConclusionesLas interacciones farmacológicas pueden aumentar el riesgo de rabdomiólisis por estatinas. Para evaluarlas es necesario que los facultativos de todos los niveles asistenciales conozcan todos los fármacos que reciben los pacientes y las asociaciones contraindicadas.
Drugs like statins may induce rhabdomyolysis. Simvastatin and lovastatin have a high hepatic metabolism and their potential toxicity could be increased by interactions with other drugs that reduce their metabolism.
Patients and methodsA case-report is presented of an HIV-infected patient treated with antiretroviral drugs who developed a rhabdomyolysis-induced renal failure and liver toxicity when simvastatin was substituted for atorvastatin. A literature review is also presented.
ResultsThe patient required hospital admission and showed a favorable response after hydration and urine alkalinization. There were 4 additional cases published of which there was one death.
ConclusionsDrug-drug interactions can increase the risk of statin induced rhabdomyolysis. In order to evaluate them properly, physicians at all levels of clinical care should be aware of all drugs prescribed to their patients and the contraindicated combinations.
La rabdomiólisis en adultos se presenta clínicamente por debilidad muscular, mialgias y mioglobinuria, eventualmente complicada con insuficiencia renal y coagulación intravascular diseminada, conllevando riesgo de muerte. Las causas más comunes de rabdomiólisis son la ingesta de alcohol, un tiempo prolongado de inconsciencia, lesiones por aplastamiento, convulsiones generalizadas y algunos fármacos, como las estatinas1.
Los principales efectos adversos de las estatinas son la toxicidad musculoesquelética y la toxicidad hepática. Las manifestaciones de la toxicidad musculoesquelética pueden ir desde mialgias (2-11%) y miositis aguda (0,5%) hasta reacciones más graves y menos frecuentes, como la rabdomiólisis (<0,1%)2. La rabdomiólisis asociada a estatinas es dependiente de la dosis, incrementándose el riesgo 10 veces al administrarse junto con inhibidores del CYP3A4 hepático, que disminuyen su eliminación3.
En cuanto a la toxicidad hepática, se han observado aumentos de las transaminasas con una incidencia de hasta un 1%, que suelen producirse durante los 3 primeros meses de tratamiento1. Se ha descrito también una reacción idiosincrásica poco frecuente con daño hepático de mayor gravedad, no relacionada con alteraciones previas en las pruebas de función hepática y no asociada a niveles plasmáticos elevados ni a interacciones farmacológicas. Existe poca información y solo se han descrito algunas series de casos1.
Material y métodosDescribimos el caso de una paciente que presentó rabdomiólisis y hepatotoxicidad grave por interacción entre ritonavir y simvastatina. Revisamos los casos publicados en la literatura hasta septiembre de 2013.
Caso clínicoMujer de 52 años, caucásica, sin alergias medicamentosas conocidas, sin hábitos tóxicos y parcialmente dependiente para las actividades básicas de la vida diaria por movilidad restringida. Diagnosticada de infección por el virus de la inmunodeficiencia humana (VIH) en 1992. Inició tratamiento con zidovudina ese mismo año, habiendo recibido distintas pautas de tratamiento antirretroviral (TAR). Como complicaciones asociadas al VIH había presentado herpes zóster del nervio trigémino izquierdo en 1993, leucoencefalopatía multifocal progresiva en 1996 con hemiparesia derecha residual y epilepsia secundaria en tratamiento anticomicial. Como complicaciones secundarias al TAR, desarrolló en 1998 hipercolesterolemia e hipertrigliceridemia, iniciando tratamiento con atorvastatina 10mg/24h en marzo de 2005. Desde enero de 2001 presentaba diabetes mellitus tipo 2 bien controlada. En el último control, realizado hacía 3 meses, presentaba un recuento de linfocitos CD4 de 366células/mL y una carga viral de 37 copias ARN/μL. Su tratamiento habitual consistía en darunavir potenciado con ritonavir 600/100mg c/12h, lamivudina 300mg c/24h y raltegravir 400mg c/12h como TAR. Adicionalmente tomaba clonazepam 0,125mg c/12h, ácido valproico 500mg c/12h, alprazolam 0,25mg c/24h, atorvastatina 20mg c/24h e insulina lantus 28UI por la noche.
Quince días antes de su ingreso en nuestra institución, el 6 de diciembre de 2011, inició un cuadro de lumbalgia derecha de características mecánicas que progresó hasta limitar gravemente su movilidad. La paciente evolucionó muy desfavorablemente, a pesar de tratamiento sintomático con analgésicos y relajantes musculares, con un importante deterioro del estado funcional y anuria, por lo que consultó el 18 de diciembre al Servicio de Urgencias de otro centro. Una analítica del 19 de diciembre mostraba creatinina 0,94mg/dL, sodio 144mEq/L y potasio 5,7mEq/L, perfil hepático alterado con bilirrubina total 0,5mg/dL, GOT 1.238U/L, GPT 787U/L, LDH 4.630U/L y creatina cinasa (CK) de 34.960U/L. Tras iniciar sueroterapia intensiva se trasladó a la paciente a nuestro centro el día 19 de diciembre por la posibilidad de requerimiento de hemodiálisis.
A su llegada, la paciente estaba afebril y hemodinámicamente estable, sin signos de uremia. Presentaba poliuria posnecrosis tubular aguda (orina de 24h de 4.000mL) y proteinuria de 772mg/d. Anictérica, sin hepatomegalia, con afasia de expresión y hemiparesia derecha residuales. Entre los parámetros analíticos destacaban: creatinina 0,86mg/dL, GOT 1.879U/L, GPT 1.087U/L, LDH 6.627U/L, CK 67.216U/L y PCR 9,50mg/dL. Se le practicó una ecografía abdominal, que mostró un hígado homogéneo sin lesiones, riñones de tamaño y ecoestructura normal, y vía urinaria no dilatada; resto de estructuras sin anomalías.
En un nuevo interrogatorio se descubrió que 3 semanas antes del inicio de la sintomatología, el 15 de noviembre de 2011, su médico de familia le había cambiado su medicación hipolipemiante de atorvastina 20mg/día a simvastatina 40mg/día, siguiendo las recomendaciones establecidas por el CatSalut a partir de criterios de coste-efectividad en el uso de estatinas. Se orientó el cuadro clínico y biológico como una rabdomiólisis con toxicidad hepática secundaria a la interacción de simvastatina con ritonavir.
Se inició tratamiento con abundante sueroterapia y alcalinización de la orina con bicarbonato sódico. Se suspendieron la simvastatina y el ácido valproico, este último de forma temporal debido a la alteración del perfil hepático. Se mantuvo el resto de su tratamiento habitual. La paciente evolucionó favorablemente, permaneciendo estable su función renal durante su estancia hospitalaria, con corrección progresiva de los valores de CK y del perfil hepático. Estos habían alcanzado valores máximos 35 días después del inicio de simvastatina, que había dejado de tomar 3 días antes (CK 128.300U/L, AST 2.135U/L y ALT 1.326U/L). Al alta, presentaba CK 1.668U/L, creatinina 0,71mg/dL, AST 174U/L, ALT 370U/L y LDH 1.732U/L. Tras un programa intensivo de rehabilitación, recuperó su movilidad habitual a los 3 meses del alta. A los 12 meses del alta, la paciente se encontraba bien, seguía tomando el mismo TAR, la carga vírica del VIH era indetectable, la cifra de CD4 era de 369cél/mm3 y se habían normalizado por completo las alteraciones físicas y analíticas.
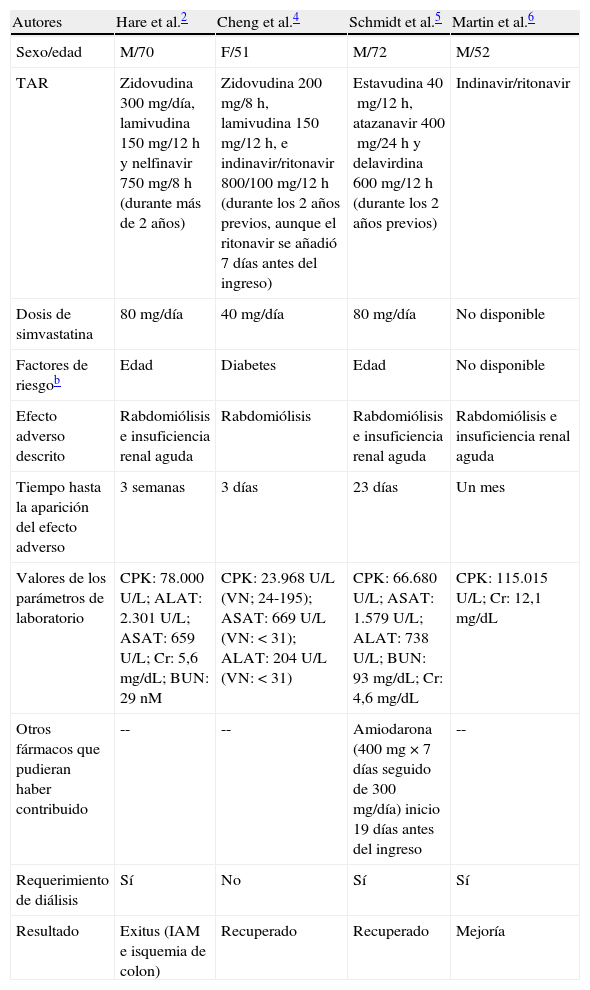
ResultadosEn nuestro caso, aplicando el algoritmo de Karsh-Lasagna para valorar la imputabilidad de una reacción adversa a un fármaco, encontramos una relación probable. Existen otros 4 casos descritos de rabdomiólisis por posible interacción entre simvastatina e inhibidores de la proteasa del VIH, que se revisan en la tabla 12,4–6. La secuencia temporal entre la administración de la estatina y la aparición de miopatía varía entre unas semanas hasta más de 2 años1. En nuestro caso fue de 3 semanas. Tres de los 4 casos presentaron insuficiencia renal aguda secundaria a la rabdomiólisis, con requerimiento de diálisis. Esta frecuencia parece mayor a la observada en la literatura. Según Khan7, aproximadamente un 33% de los pacientes desarrolla fallo renal agudo asociado a rabdomiólisis. En nuestro caso, la paciente mantuvo la función renal conservada.
Resumen de los casos clínicos descritos de rabdomiólisis por posible interacción entre simvastatina e inhibidores de la proteasa del virus de la inmunodeficiencia humanaa
| Autores | Hare et al.2 | Cheng et al.4 | Schmidt et al.5 | Martin et al.6 |
| Sexo/edad | M/70 | F/51 | M/72 | M/52 |
| TAR | Zidovudina 300mg/día, lamivudina 150mg/12h y nelfinavir 750mg/8h (durante más de 2 años) | Zidovudina 200mg/8h, lamivudina 150mg/12h, e indinavir/ritonavir 800/100mg/12h (durante los 2 años previos, aunque el ritonavir se añadió 7 días antes del ingreso) | Estavudina 40mg/12h, atazanavir 400mg/24h y delavirdina 600mg/12h (durante los 2 años previos) | Indinavir/ritonavir |
| Dosis de simvastatina | 80mg/día | 40mg/día | 80mg/día | No disponible |
| Factores de riesgob | Edad | Diabetes | Edad | No disponible |
| Efecto adverso descrito | Rabdomiólisis e insuficiencia renal aguda | Rabdomiólisis | Rabdomiólisis e insuficiencia renal aguda | Rabdomiólisis e insuficiencia renal aguda |
| Tiempo hasta la aparición del efecto adverso | 3 semanas | 3 días | 23 días | Un mes |
| Valores de los parámetros de laboratorio | CPK: 78.000U/L; ALAT: 2.301U/L; ASAT: 659U/L; Cr: 5,6mg/dL; BUN: 29nM | CPK: 23.968U/L (VN; 24-195); ASAT: 669U/L (VN:<31); ALAT: 204U/L (VN:<31) | CPK: 66.680U/L; ASAT: 1.579U/L; ALAT: 738U/L; BUN: 93mg/dL; Cr: 4,6mg/dL | CPK: 115.015U/L; Cr: 12,1mg/dL |
| Otros fármacos que pudieran haber contribuido | -- | -- | Amiodarona (400mg×7 días seguido de 300mg/día) inicio 19 días antes del ingreso | -- |
| Requerimiento de diálisis | Sí | No | Sí | Sí |
| Resultado | Exitus (IAM e isquemia de colon) | Recuperado | Recuperado | Mejoría |
ALAT: alanina transaminasa; ASAT: aspartato transaminasa; BUN: nitrógeno ureico en sangre; CPK: creatinfosfocinasa; Cr: creatinina plasmática; F: sexo femenino; IAM: infarto agudo de miocardio; M: sexo masculino; TAR: tratamiento antirretroviral; VN: valores normales de los parámetros de laboratorio (si se indican en los respectivos artículos).
Inhibidores de la proteasa del VIH: atazanavir (Reyataz®), darunavir (Prezista®), fosamprenavir (Telzir®), indinavir (Crixivan®), lopinavir/ritonavir (Kaletra®), nelfinavir (Viracept®), ritonavir (Norvir®), saquinavir (Invirase®), tipranavir (Aptivus®).
Factores de riesgo: edad avanzada, sexo femenino, insuficiencia renal o hepática, alteraciones metabólicas tales como diabetes o hipotiroidismo, estado físico debilitado, traumatismos, cirugía mayor, ejercicio físico intenso, enolismo y fármacos concomitantes como antifúngicos imidazólicos, inhibidores de la proteasa del VIH, delavirdina, nefazodona, ciclosporina, danazol, verapamilo y amiodarona. Tomado de Bellosta et al.1.
Algunas estatinas tienen un importante metabolismo hepático mediado por la isoenzima CYP3A4 del citocromo P450, especialmente simvastatina y lovastatina, por lo que son más propensas a presentar interacciones que afecten a su metabolismo. En cambio, pravastatina, pitavastatina o rosuvastatina presentan menos riesgo porque se eliminan por otras vías. Atorvastatina presenta un riesgo intermedio y se ha descrito un caso de rabdomiólisis en combinación con lopinavir/ritonavir8. Según la ficha técnica de simvastatina9, está contraindicada su asociación con inhibidores potentes de la isoenzima CYP3A4, como los inhibidores de la proteasa del VIH8–10, antifúngicos imidazólicos (itraconazol, ketoconazol, posaconazol o voriconazol), inhibidores de la proteasa del virus de la hepatitis C (boceprevir o telaprevir), macrólidos (eritromicina, claritromicina o telitromicina), zumo de pomelo9 y cobicistat. Simvastatina debe administrarse con precaución con otros inhibidores menos potentes de la CYP3A4: se recomienda no sobrepasar una dosis de 20mg/día en combinación con amiodarona, amlodipino, verapamilo o diltiazem. Con fibratos, en general se recomienda no sobrepasar los 10mg/día de simvastatina, excepto con gemfibrozilo (contraindicado) y fenofibrato (dosis habitual: no hay indicios de aumento del riesgo de miopatía). También se ha descrito rabdomiólisis en la asociación de estatinas con otros fármacos, entre ellos sildenafilo, warfarina, digoxina, niacina y tacrolimus1. En relación con el incremento del riesgo de toxicidad muscular, está contraindicada la asociación de simvastatina a gemfibrozilo, ciclosporina o danazol.
En el caso descrito pensamos que el efecto adverso es compatible con la inhibición del metabolismo de simvastatina por ritonavir. A pesar de que la paciente recibía también ácido valproico, este es un inhibidor débil del CYP3A4 en comparación con los inhibidores de la proteasa del VIH8.
Otros autores han revisado extensamente el tema de las interacciones entre antirretrovirales y estatinas11.
En conclusión, aunque la toxicidad por estatinas es poco frecuente, puede ser grave. Las interacciones pueden aumentar el riesgo de rabdomiólisis. Este caso clínico pretende alertar a los prescriptores sobre el riesgo del empleo de asociaciones contraindicadas. Es posible que el entorno de crisis económica en el que nos encontramos suponga una mayor presión acerca del uso más eficiente de los medicamentos y recursos sanitarios. En Cataluña, uno de los indicadores del CatSalut para la evaluación de la prescripción de estatinas, tanto en atención primaria como especializada, es el porcentaje de uso de simvastatina respecto al total de estatinas. Este está basado en criterios de coste-efectividad12. Los protocolos establecen las excepciones a tener en cuenta respecto al uso de simvastatina13. El caso clínico expuesto viene a enfatizar la necesidad de mejora en las herramientas de comunicación entre atención primaria y especializada, dado que, para evaluar posibles interacciones, es fundamental disponer de la información sobre la prescripción de medicamentos de uso hospitalario. Asimismo, es fundamental proporcionar a los pacientes las claves para identificar posibles síntomas de toxicidad por estatinas, de manera que se detecte precozmente, evitando así complicaciones graves.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.