Este documento de consenso ha sido elaborado por un panel de expertos del Grupo de Estudio de Sida (GESIDA) y del Plan Nacional del Sida (PNS). El documento actualiza las recomendaciones sobre tratamiento de la tuberculosis (TB) en personas infectadas por el VIH incluidas en el documento de recomendaciones de tratamiento de infecciones oportunistas publicado por GESIDA y PNS en 2008. Su objetivo es facilitar el manejo y el tratamiento de los pacientes infectados por el VIH con TB en España. El documento incluye apartados y recomendaciones específicas sobre el tratamiento de la TB en pacientes infectados por el VIH, tanto de la TB sensible a fármacos antituberculosos como de la MDR-TB y la XDR-TB y recomendaciones sobre el tratamiento de la TB en pacientes infectados por el VIH en situaciones especiales como hepatopatía crónica, embarazo, insuficiencia renal y trasplante. Este documento incluye recomendaciones sobre el momento y las pautas de inicio del tratamiento antirretroviral en pacientes con TB y sobre el síndrome de reconstitución inmune (SRI) en pacientes con infección por el VIH con TB y tratamiento antirretroviral. Estas recomendaciones no cubren los aspectos relacionados con el diagnóstico de la TB, el diagnóstico o tratamiento de la TB latente, ni el tratamiento de la TB en niños. Para la valoración de la calidad de la evidencia y la graduación de las recomendaciones se ha utilizado el sistema Grading of Recommendations Assessment, Development and Evaluation (GRADE).
This consensus document was prepared by an expert panel of the Grupo de Estudio de Sida (GESIDA [Spanish AIDS Study Group]) and the Plan Nacional sobre el Sida (PNS [Spanish National AIDS Plan]). The document updates current guidelines on the treatment of tuberculosis (TB) in HIV-infected individuals contained in the guidelines on the treatment of opportunistic infections published by GESIDA and PNS in 2008. The document aims to facilitate the management and treatment of HIV-infected patients with TB in Spain, and includes specific sections and recommendations on the treatment of drug-sensitive TB, multidrug-resistant TB, and extensively drug-resistant TB, in this population. The consensus guidelines also make recommendations on the treatment of HIV-infected patients with TB in special situations, such as chronic liver disease, pregnancy, kidney failure, and transplantation. Recommendations are made on the timing and initial regimens of antiretroviral therapy in patients with TB, and on immune reconstitution syndrome in HIV-infected patients with TB who are receiving antiretroviral therapy. The document does not cover the diagnosis of TB, diagnosis/treatment of latent TB, or treatment of TB in children. The quality of the evidence was evaluated and the recommendations graded using the approach of the Grading of Recommendations Assessment, Development and Evaluation Working Group.
La combinación de tuberculosis (TB) e infección por el virus de la inmunodeficiencia humana (VIH) sigue siendo uno de los mayores problemas de salud a nivel mundial1. Según datos de la Organización Mundial de la Salud (OMS), en 2011 se produjeron 8,7millones de nuevos casos de TB, de los que el 13% estaban coinfectados por el VIH, y la TB fue la causante de 1,4millones de muertes (430.000coinfectados por VIH)1.
En España, y también según datos de la OMS, el 9% de los nuevos diagnósticos de TB se producen en personas con infección por el VIH1. Este dato supone una importante reducción sobre la proporción de personas con infección por VIH entre los nuevos casos de TB registrados en la época previa a la utilización del tratamiento antirretroviral (TAR) combinado, con porcentajes en 1993-1994 de hasta el 36% en algunas regiones2, lo que da idea del importante impacto del TAR sobre la coinfección.
A pesar de que la recuperación inmune obtenida tras la instauración del TAR conlleva una disminución de la incidencia de TB, esta sigue siendo elevada. La incidencia de coinfección TB-VIH en 2011, según estimaciones de la OMS, fue de 1,4casos por 100.000habitantes, lo que supone unos 660 nuevos casos de TB en pacientes con infección por VIH al año1. En un reciente análisis de la cohorte española prospectiva CoRIS, con 6.811pacientes con infección por VIH (17.004pacientes-año de seguimiento), la incidencia de TB se estima en 15,2 por 1.000personas-año3, lo que supone una incidencia 100veces superior a la de la población general en España (15 por 100.000)1. En pacientes en seguimiento que reciben TAR la incidencia es algo inferior (entre 3 y 8 por 1.000personas-año)4, pero sigue siendo muy superior a las de la población general. Esta elevada incidencia se concentra fundamentalmente en grandes ciudades y con frecuencia se asocia con otra problemática sociosanitaria —como la toxicomanía o el deterioro social— que dificulta el abordaje terapéutico.
Las bases del tratamiento de la TB en pacientes coinfectados son, en esencia, similares a las de la población general, utilizándose las mismas combinaciones de fármacos con el propósito de erradicar las diferentes poblaciones bacilares y evitar la aparición de resistencias secundarias, y han sido revisadas en un documento de consenso de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) con la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)5. Sin embargo, la presencia de la infección por el VIH confiere a este tratamiento algunas peculiaridades, fundamentalmente derivadas de la posible inmunodeficiencia asociada y de la interacción con el TAR, que obligan a realizar consideraciones y recomendaciones específicas6.
Objetivos y alcanceEste documento, que actualiza las recomendaciones sobre tratamiento de la TB en personas infectadas por el VIH incluidas en el documento de recomendaciones de tratamiento de infecciones oportunistas publicado por GESIDA y el Plan Nacional sobre el Sida en 20086, pretende facilitar el manejo y el tratamiento de los pacientes con coinfección TB-VIH en España, haciendo especial referencia a la interacción con el TAR, y va dirigido a todos los profesionales que atienden o que en algún momento puedan atender a pacientes con infección por el VIH.
Estas recomendaciones no cubren los aspectos relacionados con el diagnóstico de la TB, el diagnóstico o tratamiento de la TB latente, ni el tratamiento de la TB en niños.
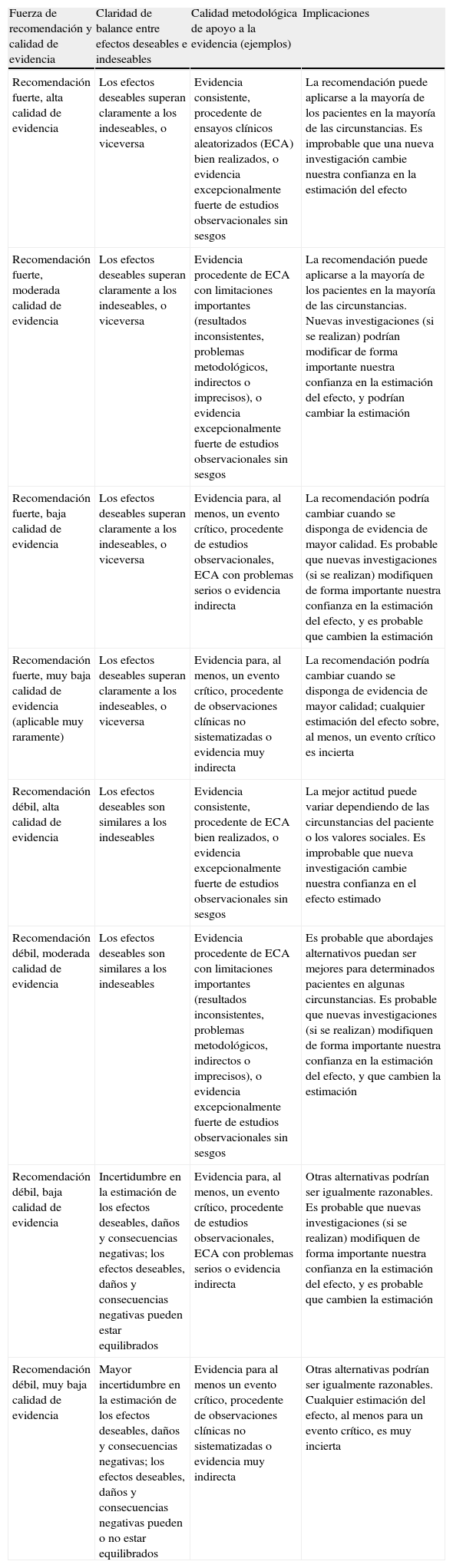
MetodologíaPara la valoración de la calidad de la evidencia y la graduación de las recomendaciones se ha utilizado el sistema Grading of Recommendations Assessment, Development and Evaluation (GRADE)7-12 (tabla 1).
Fuerza de las recomendaciones y calidad de evidencias según el sistema GRADE7-12
| Fuerza de recomendación y calidad de evidencia | Claridad de balance entre efectos deseables e indeseables | Calidad metodológica de apoyo a la evidencia (ejemplos) | Implicaciones |
| Recomendación fuerte, alta calidad de evidencia | Los efectos deseables superan claramente a los indeseables, o viceversa | Evidencia consistente, procedente de ensayos clínicos aleatorizados (ECA) bien realizados, o evidencia excepcionalmente fuerte de estudios observacionales sin sesgos | La recomendación puede aplicarse a la mayoría de los pacientes en la mayoría de las circunstancias. Es improbable que una nueva investigación cambie nuestra confianza en la estimación del efecto |
| Recomendación fuerte, moderada calidad de evidencia | Los efectos deseables superan claramente a los indeseables, o viceversa | Evidencia procedente de ECA con limitaciones importantes (resultados inconsistentes, problemas metodológicos, indirectos o imprecisos), o evidencia excepcionalmente fuerte de estudios observacionales sin sesgos | La recomendación puede aplicarse a la mayoría de los pacientes en la mayoría de las circunstancias. Nuevas investigaciones (si se realizan) podrían modificar de forma importante nuestra confianza en la estimación del efecto, y podrían cambiar la estimación |
| Recomendación fuerte, baja calidad de evidencia | Los efectos deseables superan claramente a los indeseables, o viceversa | Evidencia para, al menos, un evento crítico, procedente de estudios observacionales, ECA con problemas serios o evidencia indirecta | La recomendación podría cambiar cuando se disponga de evidencia de mayor calidad. Es probable que nuevas investigaciones (si se realizan) modifiquen de forma importante nuestra confianza en la estimación del efecto, y es probable que cambien la estimación |
| Recomendación fuerte, muy baja calidad de evidencia (aplicable muy raramente) | Los efectos deseables superan claramente a los indeseables, o viceversa | Evidencia para, al menos, un evento crítico, procedente de observaciones clínicas no sistematizadas o evidencia muy indirecta | La recomendación podría cambiar cuando se disponga de evidencia de mayor calidad; cualquier estimación del efecto sobre, al menos, un evento crítico es incierta |
| Recomendación débil, alta calidad de evidencia | Los efectos deseables son similares a los indeseables | Evidencia consistente, procedente de ECA bien realizados, o evidencia excepcionalmente fuerte de estudios observacionales sin sesgos | La mejor actitud puede variar dependiendo de las circunstancias del paciente o los valores sociales. Es improbable que nueva investigación cambie nuestra confianza en el efecto estimado |
| Recomendación débil, moderada calidad de evidencia | Los efectos deseables son similares a los indeseables | Evidencia procedente de ECA con limitaciones importantes (resultados inconsistentes, problemas metodológicos, indirectos o imprecisos), o evidencia excepcionalmente fuerte de estudios observacionales sin sesgos | Es probable que abordajes alternativos puedan ser mejores para determinados pacientes en algunas circunstancias. Es probable que nuevas investigaciones (si se realizan) modifiquen de forma importante nuestra confianza en la estimación del efecto, y que cambien la estimación |
| Recomendación débil, baja calidad de evidencia | Incertidumbre en la estimación de los efectos deseables, daños y consecuencias negativas; los efectos deseables, daños y consecuencias negativas pueden estar equilibrados | Evidencia para, al menos, un evento crítico, procedente de estudios observacionales, ECA con problemas serios o evidencia indirecta | Otras alternativas podrían ser igualmente razonables. Es probable que nuevas investigaciones (si se realizan) modifiquen de forma importante nuestra confianza en la estimación del efecto, y es probable que cambien la estimación |
| Recomendación débil, muy baja calidad de evidencia | Mayor incertidumbre en la estimación de los efectos deseables, daños y consecuencias negativas; los efectos deseables, daños y consecuencias negativas pueden o no estar equilibrados | Evidencia para al menos un evento crítico, procedente de observaciones clínicas no sistematizadas o evidencia muy indirecta | Otras alternativas podrían ser igualmente razonables. Cualquier estimación del efecto, al menos para un evento crítico, es muy incierta |
Se realizó una revisión bibliográfica incluyendo artículos referenciados en MEDLINE hasta octubre de 2012 inclusive (indexados bajos los epígrafes «Tuberculosis/therapy» y «HIV infections») y en los libros y bases de datos de resúmenes de congresos internacionales sobre infección por el VIH (de 2009 a 2012 inclusive). Se priorizó la información proveniente de ensayos clínicos. Cuando no existía información procedente de ensayos clínicos con diseño adecuado se revisaron los estudios observacionales, las revisiones sistemáticas y las guías nacionales e internacionales de tratamiento de la TB. Las revisiones sistemáticas y las guías de tratamiento se utilizaron como fuentes secundarias en la revisión bibliográfica.
Tratamiento de la tuberculosis sensible a fármacos en pacientes con infección por el virus de la inmunodeficiencia humana¿Cuántos y qué fármacos usar?La decisión de iniciar un tratamiento antituberculoso con 3 o 4 fármacos depende básicamente de la probabilidad de que exista resistencia previa a uno de los fármacos, generalmente a la isoniazida. Se considera que esta probabilidad es elevada cuando la prevalencia de resistencia primaria a la isoniazida en la comunidad es mayor del 4%, o el paciente ha recibido tratamiento previo con fármacos antituberculosos, o procede de un país con alta prevalencia de resistencia, o ha estado expuesto a un caso de TB resistente13.
A nivel mundial, la tasa media ponderada de resistencia primaria a la isoniazida (excluyendo la TB multirresistente) es del 7,4%14. Datos recientes en algunas poblaciones españolas parecen indicar que esta prevalencia podría situarse algo por encima del 4%, aunque existe cierta discordancia en diferentes estudios locales15-17. En un análisis transversal realizado en 2008, con 1.083muestras procedentes de 120laboratorios de toda España, la tasa de resistencia primaria a la isoniazida fue del 4,9%15.
En el caso de los inmigrantes, como colectivo, las tasas de resistencia primaria son sistemáticamente superiores15,18-20, aunque la prevalencia es variable en función de la existente en el país de origen.
La presencia de subgrupos con mayor prevalencia dificulta establecer con seguridad el origen de la cepa infectante y hace recomendable instaurar un tratamiento inicial con 4fármacos, al menos hasta disponer de un estudio de resistencias que confirme la sensibilidad a los fármacos de primera línea.
En el tratamiento de la TB sensible a los antituberculosos de primera línea se recomienda utilizar siempre una combinación que incluya isoniazida (H) y rifampicina (R). En el momento actual los fármacos de elección en el tratamiento de inicio siguen siendo la isoniazida, la rifampicina, la pirazinamida (Z) y el etambutol (E).
Se ha postulado el uso de rifabutina (Rb) como alternativa a la rifampicina con objeto de minimizar las posibles interacciones con algunos antirretrovirales (véase, más adelante, el apartado «¿Qué régimen de TAR usar?»). Sin embargo, la evidencia de su eficacia en pacientes coinfectados se basa en pequeños estudios y series de casos21,22. Además, incrementa la complejidad del tratamiento antituberculoso al impedir el uso de combinaciones coformuladas y requiere un ajuste de la dosis de rifabutina, que en ausencia de control de los niveles plasmáticos de fármaco o en caso de mala adherencia selectiva al TAR podría facilitar la selección de resistencia a las rifamicinas23,24. Por este motivo, la utilización de rifabutina en lugar de rifampicina solo debería considerarse una alternativa en el caso de que sea absolutamente imprescindible el uso de inhibidores de proteasa en el TAR. Se dispone también de ensayos clínicos que utilizan rifapentina como rifamicina de elección con resultados similares en pacientes con o sin infección por el VIH, pero con esta rifamicina tenemos los mismos problemas que con la rifabutina y su uso no está aprobado por la Agencia Europea del Medicamento (EMA).
Completados 2meses de tratamiento, se suspenderá la administración de pirazinamida y etambutol una vez confirmada la mejoría clínica, y tras asegurar que se han tomado todas las dosis prescritas, revisar la sensibilidad a la isoniazida y a la rifampicina, y recoger (si son accesibles) muestras para repetir los cultivos, se continuará el tratamiento con HR (fase de mantenimiento) durante 4-7meses más (véase, más adelante, el apartado «¿Cuánto tiempo debe mantenerse el tratamiento?»).
El tratamiento debe administrarse diariamente (7días por semana) siempre que sea posible25. Una revisión sistemática muestra una incidencia de recidiva y fracaso del tratamiento antituberculoso 2 y 2,2 veces superior en pacientes con infección por VIH que recibieron tratamiento antituberculoso intermitente desde el inicio, comparado con los pacientes que lo recibieron a diario durante ese periodo, aunque las diferencias solo alcanzan significación estadística en los pacientes que no reciben TAR26. La dosificación utilizando pautas administradas 3 o 5veces por semana solo debería utilizarse una vez completada la fase de inducción, y cuando existe algún problema para realizar una administración diaria y está garantizada la supervisión de la toma de medicación27. La utilización de pautas con rifampicina o rifabutina administradas 2veces por semana se ha asociado a un riesgo inaceptable de recidiva y de selección de resistencia a rifamicinas, especialmente en pacientes con recuento de linfocitos CD4+ inferiores a 100/μl28-31. Por el mismo motivo, tampoco se recomienda utilizar pautas basadas en rifapentina administrada una vez por semana en pacientes infectados por el VIH32.
Un ensayo clínico reciente apoya la recomendación del uso de combinaciones fijas, demostrando su no inferioridad respecto a la administración de fármacos por separado, independientemente de la presencia o no de coinfección por el VIH33. Siempre que sea posible se recomienda el uso de formulaciones combinadas, tanto de fármacos antituberculosos como antirretrovirales, con objeto de simplificar el tratamiento y evitar la selección de resistencias como consecuencia de una mala adherencia selectiva25.
En el caso habitual de utilizar isoniazida, es necesario suplementar el tratamiento con piridoxina (vitamina B6) a una dosis de 10-50mg/día para evitar el desarrollo de neuropatía periférica5.
No existe evidencia de que el uso sistemático de corticoides en el tratamiento de la TB pulmonar o pleural en pacientes infectados por el VIH aporte ventajas en cuanto a supervivencia o curación, y parece incrementar el riesgo de efectos adversos, como hipertensión, hiperglucemia y sarcoma de Kaposi34-36, por lo que no se recomienda su uso generalizado.
En la población general se recomienda el uso de corticoides en algunas manifestaciones extrapulmonares de la TB, como la TB meníngea, espinal o pericárdica5. En pacientes con infección por el VIH, sin embargo, no existe suficiente evidencia que permita confirmar o descartar esa recomendación37. Un ensayo clínico realizado en Vietnam en pacientes con TB meníngea no encontró ventajas con el uso de corticoides en la supervivencia del subgrupo de 98pacientes con infección por VIH38, aunque el reducido número de pacientes coinfectados no permite descartar que existan diferencias relevantes. Además, ninguno de estos pacientes recibió TAR. Dada la elevada mortalidad y la posibilidad de secuelas de esta forma de TB, junto al elevado riesgo derivado de la aparición de un síndrome inflamatorio de reconstitución inmune, mientras no haya mejor información disponible debe procederse como en la población no infectada por VIH y administrar corticoides en esta situación.
Respecto al uso de corticoides en la TB pericárdica en pacientes infectados por el VIH, las evidencias también son escasas y discordantes. En un estudio aleatorizado que incluyó 58pacientes infectados por VIH con sospecha de TB pericárdica, los pacientes que recibieron prednisolona durante 6semanas junto al tratamiento antituberculoso presentaron una menor mortalidad y mejoría más rápida del incremento de presión venosa, hepatomegalia, ascitis y actividad física, pero no de la respuesta radiológica ni electrocardiográfica39. En otro estudio algo más reciente pero también demasiado pequeño como para obtener conclusiones definitivas, el uso de corticoides no demostró ventajas clínicas sobre el placebo40. De nuevo, a falta de datos que permitan una recomendación en pacientes infectados por VIH, consideramos que se debe aplicar el criterio utilizado en la población general.
Existe evidencia, sin embargo, para recomendar el uso de corticoides en pacientes con TB pulmonar e infección por VIH que presentan un síndrome inflamatorio de reconstitución inmune41 (véase, más adelante, el apartado «Síndrome de reconstitución inmune en pacientes con infección por el virus de la inmunodeficiencia humana con tuberculosis y tratamiento antirretroviral»). En un ensayo clínico aleatorizado, el uso de prednisona (1,5mg/kg/día durante 2semanas, seguido de 0,75mg/kg/día otras 2semanas) se asoció con un menor requerimiento de hospitalización e intervenciones terapéuticas, y mayor rapidez en la resolución de la sintomatología41.
Recomendaciones- 1.
Se recomienda iniciar el tratamiento de la TB con 4fármacos (HRZE), pudiéndose interrumpir el etambutol si se demuestra la sensibilidad de la cepa a los fármacos de primera línea. (Recomendación fuerte, baja calidad de evidencia.)
- 2.
Solo si es imposible utilizar rifampicina, se puede considerar el uso de rifabutina. (Recomendación fuerte, baja calidad de evidencia.)
- 3.
El tratamiento antituberculoso se debe administrar a diario, al menos durante la fase de inducción. No se recomiendan en ningún caso las pautas administradas 2veces por semana, que están absolutamente contraindicadas en pacientes con recuento de linfocitos CD4<100/μl). (Recomendación fuerte, moderada calidad de evidencia.)
- 4.
Siempre que sea posible, se deben utilizar combinaciones coformuladas de los fármacos antituberculosos. (Recomendación fuerte, moderada calidad de evidencia.)
- 5.
No se recomienda el uso rutinario de corticoides en la TB pulmonar o pleural. (Recomendación fuerte, moderada calidad de evidencia.)
- 6.
Se recomienda el uso de corticoides en el tratamiento de la TB meníngea y pericárdica. (Recomendación fuerte, baja calidad de evidencia.)
- 7.
Se recomienda el uso de corticoides para el tratamiento del síndrome inflamatorio de reconstitución inmune asociado a TB. (Recomendación fuerte, moderada calidad de evidencia.)
La duración total del tratamiento antituberculoso en personas no infectadas por el VIH es de 6meses (2meses de tratamiento de inducción con 3 o 4fármacos y 4meses más con HR)5,25. La duración adecuada del tratamiento antituberculoso en pacientes infectados por el VIH sigue siendo controvertida42, pues aunque las tasas de respuesta27,29,43-48 o de supervivencia49 no parecen diferir cuando se comparan las pautas de 6 y 9meses, numerosos estudios han comunicado mayores tasas de recidiva en pacientes VIH+ tratados menos de 9meses27,29,43-45. Una revisión sistemática y metaanálisis reciente ha intentado clarificar la influencia de la duración del tratamiento en las tasas de respuesta y recidiva en pacientes con infección por el VIH26. En este análisis, las tasas de respuesta al tratamiento antituberculoso son similares cuando se utilizan pautas de 6meses o más largas. Las tasas de recidiva son, sin embargo, 2,4veces mayores con los regímenes de 6meses. No obstante, en la mayoría de los estudios analizados no se utilizaba TAR ni se distinguía entre recidivas y reinfecciones. Un análisis teniendo en cuenta el uso o no de TAR encuentra mayores tasas de recidiva en los pacientes que no recibían TAR (odds ratio 3,1) pero no en los que sí lo utilizaron. Una relación entre el uso de TAR, con el consiguiente incremento de linfocitos CD4, y la disminución en la frecuencia de recidivas se ha descrito también en un estudio brasileño50.
Otros factores relacionados con el riesgo de recidiva que pudieran tener un impacto en la duración del tratamiento son un bajo recuento de linfocitos CD4+ (<100/μl)30,43 y una adherencia subóptima42.
Aunque la disyuntiva no queda cerrada, a falta de ensayos clínicos realizados en el contexto de TAR, estimamos que la recomendación de tratar 6meses (HRZE 2meses + HR 4meses) es adecuada para la mayoría de los pacientes con infección por el VIH.
Posibles excepciones, en las que sería prudente prolongar el tratamiento antituberculoso al menos 9meses, serían: la persistencia de cultivos positivos tras 2meses de tratamiento antituberculoso (en ese caso se debería también descartar la posibilidad de resistencias o de mala adherencia); los pacientes con linfocitos CD4 bajos (<100/μl) en los que no se prevea una adecuada recuperación inmunológica, ya sea por los antecedentes de falta de recuperación inmunológica con TAR previo o por la no disponibilidad de un TAR suficientemente efectivo; los pacientes con problemas de adherencia en los que no sea posible establecer un tratamiento supervisado que garantice la toma de todas las dosis de medicación. A ese respecto, se ha sugerido que se debe asegurar la toma de al menos 182dosis de isoniazida y rifampicina y 56dosis de pirazinamida: las dosis de la fase inicial deberían tomarse en un periodo no superior a 3meses y las de la fase de continuación en un periodo no superior a 6meses, con lo que un tratamiento de 6meses se podría completar en un periodo de 6 a 9meses13,51. En el caso de TB que afecta al sistema nervioso central (meningitis, tuberculoma), se recomienda prolongar el tratamiento al menos hasta completar 9-12meses52. No se dispone de información generada en ensayos clínicos que permita precisar más la duración del tratamiento en este escenario.
Recomendaciones- 1.
El tratamiento de la TB pulmonar en pacientes infectados por el VIH que reciben TAR y con evidencia de cumplimiento correcto o bajo tratamiento supervisado durará un total de 6meses de tratamiento efectivo (2meses HRZE + 4meses HR). (Recomendación fuerte, moderada calidad de evidencia.)
- 2.
En pacientes con cultivos positivos tras 2meses de tratamiento, el tratamiento se prolongará hasta 9meses, tras descartar la existencia de resistencia. (Recomendación fuerte, baja calidad de evidencia.)
- 3.
En pacientes con bajo recuento de linfocitos CD4+ en los que no se prevea una respuesta inmunológica adecuada, y en los pacientes en los que no se pueda asegurar una toma adecuada de todas las dosis prescritas, el tratamiento se prolongará hasta 9meses. (Recomendación débil, baja calidad de evidencia.)
- 4.
En el caso de TB con afectación del sistema nervioso central, el tratamiento se prolongará al menos 9-12meses. (Recomendación fuerte, baja calidad de evidencia.)
La coexistencia de una hepatopatía crónica, ya sea por virus de la hepatitis C o B, por alcohol u otro motivo, es frecuente en los pacientes con infección por el VIH y TB y debe ser evaluada antes de iniciar el tratamiento antituberculoso. En esta situación, el riesgo de hepatotoxicidad como consecuencia del uso del tratamiento antituberculoso se incrementa53,54. En pacientes que además reciben TAR, el deterioro hepático puede deberse también a la toxicidad por antirretrovirales o a un síndrome inflamatorio de reconstitución inmune, lo que complica el diagnóstico y el manejo.
La existencia de una hepatopatía crónica de base no contraindica por sí sola la indicación del tratamiento antituberculoso habitual, pero sí obliga a intensificar el seguimiento para detectar precozmente el posible deterioro de la función hepática.
En el caso de hepatopatías crónicas avanzadas (cirrosis hepáticas B o C de Child) o incrementos de transaminasas por encima de 3-5veces los valores basales25 se debe valorar la utilización de un régimen con menor potencial hepatotóxico. Para preservar el uso de rifampicina e isoniazida, la primera opción es la de utilizar HRE 9meses (suspendiendo el etambutol a partir del segundo mes tras confirmar la sensibilidad a HR)25. Si el fármaco a evitar es la isoniazida, se podría utilizar RZE 2meses + RE 10meses. Solo en el caso de que sea imprescindible evitar todos los fármacos hepatotóxicos se podría utilizar una pauta basada en una quinolona + estreptomicina o un aminoglucósido inyectable + etambutol, durante 18-24meses5,25, aunque no existe evidencia que apoye esta recomendación.
Se debe informar al paciente de las manifestaciones clínicas que pudieran indicar una toxicidad hepática (náuseas, vómitos, dolor abdominal o ictericia) para que informen de ello de inmediato y sea posible evaluar la función hepática.
Pacientes con insuficiencia renalNi la rifampicina ni la isoniazida se metabolizan por el riñón, por lo que no es necesario modificar su dosis. La pirazinamida y el etambutol pueden requerir ajuste de dosis según la función renal. En ese caso puede ser conveniente administrar pirazinamida y etambutol 3veces por semana utilizando la misma dosis que en su administración diaria25. El moxifloxacino puede ser una alternativa a estos fármacos, puesto que se metaboliza fundamentalmente en el hígado.
En pacientes en hemodiálisis los fármacos deben administrarse inmediatamente tras la diálisis.
Especial precaución debe tenerse si se coadministra estreptomicina o un aminoglucósido con tenofovir, puesto que esta combinación puede incrementar el riesgo de nefrotoxicidad55.
Mujeres embarazadasLos 4fármacos antituberculosos recomendados en el tratamiento habitual de la TB pueden ser utilizados durante el embarazo de forma segura. Sin embargo, en las pacientes infectadas por el VIH se plantea el problema adicional de la necesidad de evitar el uso de efavirenz por su posible efecto teratógeno.
A toda mujer infectada por el VIH a la que se diagnostica TB se le debe realizar un test de embarazo. En caso de ser negativo, es recomendable aconsejar a la mujer que evite el embarazo mientras dura el tratamiento antituberculoso, por seguridad del feto y para que no interfiera con las opciones de TAR concomitante.
Si la mujer se queda embarazada durante el tratamiento antituberculoso se puede valorar la posibilidad de posponer el TAR hasta finalizar el tratamiento de la TB (esta opción únicamente es aceptable si se prevé finalizar el tratamiento antituberculoso en menos de 4meses, para permitir una duración aceptable del TAR previo al parto).
Si la mujer ya está embarazada cuando se diagnostica la TB, el tratamiento antituberculoso debe necesariamente coexistir con el TAR. En ese caso el TAR de elección será una pauta con 2nucleósidos y nevirapina siempre que el recuento de linfocitos CD4+ sea menor de 250células/μl. En caso contrario se debe valorar la posibilidad de utilizar pautas alternativas, como 2nucleósidos y raltegravir o 2nucleósidos y efavirenz (una vez pasado el primer trimestre de embarazo). No existen datos que permitan comparar el riesgo/beneficio de estas pautas entre sí. Con respecto al uso de efavirenz, existen datos de una cohorte prospectiva de 76mujeres embarazadas tratadas con efavirenz, 33de las cuales recibían rifampicina como tratamiento de la TB. No se encontraron diferencias en los niveles sanguíneos de efavirenz, ni en la eficacia virológica en las tratadas de TB en el subgrupo con TB y rifampicina. No hubo ningún caso de transmisión materno-fetal56.
Pacientes trasplantados de órgano sólidoEn el caso de los pacientes infectados por el VIH que desarrollan TB tras recibir un trasplante de órgano sólido el problema de las posibles interacciones farmacológicas se hace más complejo, pues tanto la rifampicina como muchos antirretrovirales presentan interacciones con el tratamiento inmunosupresor, dificultando su manejo e incrementando el riesgo de rechazo o toxicidad. Para el manejo de esta situación remitimos al lector a un reciente documento elaborado por el grupo de estudio de las infecciones en el paciente trasplantado (GESITRA) de la SEIMC57.
Recomendaciones- 1.
En pacientes con hepatopatía avanzada y que no toleren la pauta habitual se puede valorar el uso de pautas alternativas de tratamiento antituberculoso que presenten menor riesgo de hepatotoxicidad. (Recomendación débil, baja calidad de evidencia.)
- 2.
En pacientes con insuficiencia renal avanzada, se deben ajustar las dosis de pirazinamida y etambutol, administrándose 3veces por semana. (Recomendación fuerte, baja calidad de evidencia.)
- 3.
Las mujeres embarazadas que desarrollan TB deben recibir conjuntamente el tratamiento antituberculoso y antirretroviral. Para ello se puede utilizar la pauta antituberculosa habitual (2meses HRZE + 4meses HR). El TAR de elección en esta situación, cuando el recuento de CD4 es inferior a 250células/μl, salvo que exista alguna contraindicación, consiste en 2nucleósidos y nevirapina. (Recomendación fuerte, muy baja calidad de evidencia.) Otras alternativas, como las basadas en raltegravir, no disponen de datos suficientes de seguridad y farmacocinética en gestación para recomendar su uso. Solo se usarán cuando los beneficios teóricos superen los riesgos. (Recomendación débil, muy baja calidad de evidencia.)
El tratamiento de la TB en personas infectadas por el VIH debería realizarse por personal conocedor de ambas enfermedades y su tratamiento, o en su defecto por un equipo coordinado en el que haya médicos con experiencia en TAR y en TB, con objeto de adecuar ambos tratamientos de forma que se minimice el riesgo de fracaso de cualquiera de ellos. En pacientes toxicómanos es especialmente importante establecer mecanismos de supervisión del tratamiento, que en el caso de los heroinómanos deberían coordinarse con un programa de tratamiento sustitutivo con metadona. En el caso de los tratamientos iniciados en instituciones penitenciarias, se debe garantizar la coordinación con los programas extrapenitenciarios58.
Una vez instaurado el tratamiento se debe garantizar el control clínico adecuado que permita: a)asegurar la correcta toma de la medicación antituberculosa y antirretroviral; b)detectar precozmente posibles toxicidades relacionadas con el tratamiento; c)monitorizar la eficacia de ambos tratamientos; d)diagnosticar la posible aparición de un cuadro inflamatorio de reconstitución inmune, y e)registrar el resultado final del tratamiento de acuerdo con los criterios utilizados internacionalmente (tabla 2)25.
Definiciones de respuesta al tratamiento25
| Situación | Definición |
| Curación | Paciente con esputo o cultivo positivo al inicio del tratamiento que es negativo en el último mes de tratamiento y en al menos otra ocasión previa |
| Tratamiento completo | Paciente que completó el tratamiento con buena respuesta clínica pero que no se dispone de resultados de esputo o cultivo en el último mes y en otra ocasión previa |
| Fallo de tratamiento | Paciente que presenta esputo o cultivo positivo tras 5 o más meses de tratamiento. Incluye también a pacientes en los que se aísla una cepa multirresistente en cualquier momento del tratamiento |
| Fallecido | Paciente que muere, por cualquier causa, durante el tratamiento |
| Abandono | Paciente cuyo tratamiento se ha interrumpido durante 2 o más meses consecutivos sin indicación médica |
| Transferido | Paciente que continúa seguimiento en otro centro y del que no se dispone de información de la respuesta al tratamiento |
| Tratamiento exitoso | Incluye tanto los pacientes curados como a los que han recibido tratamiento completo |
- 1.
Valoración de la infección por el VIH: recuento de linfocitos CD4 y porcentaje; carga viral; historial de TAR y estudio de resistencia a antirretrovirales, incluyendo test de tropismo del VIH.
- 2.
Valoración de la TB: confirmar que se han procesado para cultivo todas las muestras relevantes; estudio de sensibilidad a antituberculosos de primera línea.
- 3.
Valoración de coinfecciones: serología de virus de la hepatitis B y C.
- 4.
Valoración de la situación hepática (transaminasas, bilirrubina y fosfatasa alcalina); renal (creatinina y estimación del filtrado glomerular) y hematológica (hemograma y recuento leucocitario).
- 5.
En mujeres en edad fértil, test de embarazo.
- 6.
Radiografía de tórax (si no se dispone de una radiografía en el mes previo).
Se considera adecuado hacer una primera revisión clínica programada a las 2semanas, que se repetirá mensualmente en ausencia de complicaciones hasta confirmar la estabilidad clínica, y posteriormente cada 2meses hasta completar el tratamiento. En cada revisión clínica se evaluará el grado de cumplimiento terapéutico, la tolerancia al tratamiento y la respuesta clínica.
Los controles microbiológicos (baciloscopia y cultivo de esputo) deben repetirse en cada visita, en el caso de que persista expectoración, hasta confirmar la negatividad de 2muestras consecutivas. También se debe procesar una muestra, si está disponible, al finalizar el tratamiento. En el caso de TB exclusivamente extrapulmonar, el seguimiento microbiológico dependerá de la accesibilidad de las muestras inicialmente positivas.
El control analítico para vigilar una posible toxicidad hepática o hematológica se realizará en cada visita.
Una vez iniciado el TAR, se debe hacer una valoración de eficacia con determinación de carga viral y linfocitos CD4+ al mes. Así mismo se vigilará el correcto cumplimiento de la toma de medicación, la posible aparición de intolerancia o toxicidad a los fármacos y la aparición de manifestaciones clínicas de un cuadro inflamatorio de reconstitución inmune. La carga viral se repetirá mensualmente hasta confirmar la indetectabilidad (<50copias/ml), y posteriormente, al finalizar el tratamiento antituberculoso.
Manejo de interrupciones del tratamientoLas interrupciones del tratamiento son un problema frecuente en el tratamiento antituberculoso de pacientes infectados por el VIH. Su detección obliga a investigar las causas y establecer medidas para reforzar la adherencia, recomendándose la instauración de medidas de supervisión del tratamiento si no se puede conseguir una adherencia adecuada.
Tras una interrupción se debe intentar obtener las muestras biológicas oportunas para determinar si siguen siendo positivas para TB y realizar un estudio de sensibilidad.
No existen estudios que aporten evidencia para establecer recomendaciones de actuación en estos casos. Los Centers for Disease Control and Prevention (CDC) y la Sociedad Americana de Tórax (ATS) sugieren actuar de la siguiente manera13:
- -
Si la interrupción se produce en la fase inicial del tratamiento (fase de inducción) y tiene una duración mayor de 14días, el tratamiento debe reiniciarse desde el principio.
- -
Si la interrupción se produce en la fase inicial del tratamiento y tiene una duración menor de 14días, se puede continuar, asegurando que se completan todas las dosis de esa fase (56 en total) en un periodo no superior a 3meses.
- -
Si la interrupción se produce en la fase de mantenimiento del tratamiento y es superior a 3meses, se debe reiniciar el tratamiento completo (e intentar asegurar que no se han seleccionado resistencias).
- -
Si la interrupción se produce en la fase de mantenimiento del tratamiento y es de menos de 3meses, se puede continuar con el tratamiento hasta completar el total de dosis (182) en un periodo no superior a los 9meses.
- 1.
El tratamiento de la TB en personas infectadas por el VIH debería realizarse por personal conocedor de ambas enfermedades. (Recomendación fuerte, muy baja calidad de evidencia.)
- 2.
Los pacientes infectados por el VIH con TB deben tener un seguimiento clínico más frecuente del habitual en pacientes con infección por el VIH sin TB. (Recomendación fuerte, baja calidad de evidencia.)
Establecer el tiempo óptimo para iniciar el TAR en pacientes infectados por el VIH con TB ha sido durante largo tiempo motivo de controversia59. En la actualidad disponemos de información procedente de ensayos clínicos aleatorizados diseñados con este objetivo que han arrojado luz sobre esta cuestión60-63.
El estudio SAPiT60 es un ensayo clínico aleatorizado, abierto, llevado a cabo en Sudáfrica, cuyo objetivo fue comparar la influencia que tiene en la mortalidad el momento de iniciar el TAR en pacientes infectados por el VIH con TB. Se incluyeron en el estudio 642pacientes infectados por el VIH con TB y cifras de linfocitos CD4+ inferior a 500células/μl que fueron distribuidos aleatoriamente a recibir un régimen de TAR basado en la asociación ddI+3TC+efavirenz, administrado a las 4semanas de iniciado el tratamiento de la TB (grupo1), tras la finalización de la fase intensiva del tratamiento de la TB (grupo2) o tras finalizar el tratamiento de la TB (grupo3).
Las características basales de los grupos de tratamiento integrado y secuencial (mediana de linfocitos CD4+ 150 y 140 células/μl, proporción de pacientes con menos de 200CD4+/μl 63,6 y 64,8%, grupo C de los CDC 4,9 y 4,7%, mediana de ARN-VIH: 5,2 y 5,2 log, respectivamente) fueron similares. Se observó una mayor mortalidad en el grupo de tratamiento secuencial que en el de tratamiento integrado (5,4 versus 12,1 muertes/100pacientes-año, p=0,003). Esta diferencia se apreció tanto entre pacientes con cifras de linfocitos CD4+ inferior a 200células/μl (8,2 versus 15,3 muertes/100pacientes-año, p=0,04), como entre pacientes con más de 200linfocitos CD4+/μl (1,1 versus 7,0 muertes/100pacientes-año, p=0,02). El TAR integrado redujo en un 56% el riesgo de muerte respecto al secuencial y se identificó como un factor independiente de menor riesgo de muerte.
Posteriormente se publicaron los resultados finales del estudio SAPiT61, en el que se compararon las 2ramas de TAR integrado, es decir, el grupo1 (TAR integrado precoz, n=214) versus el grupo2 (TAR integrado tardío, n=215). Globalmente no se apreciaron diferencias en mortalidad y/o progresión a sida entre los 2grupos de tratamiento (6,9 versus 7,8 muertes/100pacientes-año, p=0,73). Sin embargo, al evaluar al subgrupo de pacientes con cifras basales de linfocitos CD4+ inferiores a 50células/μl (n=72) se observó una reducción del 68% de la mortalidad en el grupo de pacientes que recibió TAR precoz respecto al que recibió TAR tardío (8,5 versus 26,3muertes/100pacientes-año, p=0,06). Sin embargo, en el grupo de pacientes que recibió TAR tardío la incidencia de efectos adversos por el TAR o de síndrome de reconstitución inmune (SRI) fue inferior al grupo de TAR precoz, en todos los estratos de linfocitos CD4+.
El estudio CAMELIA62 es un ensayo clínico aleatorizado, abierto, realizado en Camboya, cuyo objetivo fue comparar la influencia en la mortalidad del momento de inicio del TAR en pacientes infectados por el VIH con TB. Se incluyeron en el estudio 661pacientes infectados por el VIH con TB y cifras de linfocitos CD4+ inferior a 200células/μl que fueron distribuidos aleatoriamente a recibir un régimen de TAR basado en la asociación d4T+3TC+efavirenz, administrado a las 2semanas de iniciado el tratamiento de la TB (grupo1, tratamiento precoz, 332pacientes) o tras la finalización de la fase intensiva del tratamiento antituberculoso (grupo2, tratamiento tardío, 329pacientes). Las características basales de los grupos de tratamiento integrado y secuencial fueron similares, destacando el hecho de que la mediana de linfocitos CD4+ fue de 25células/μl. Se observó una menor mortalidad en el grupo de tratamiento temprano que en el de tratamiento tardío (8,28 versus 13,77 muertes/100pacientes-año, p=0,002). El TAR de inicio temprano redujo en un 34% el riesgo de muerte respecto al TAR de inicio tardío.
El ACTG-522163 es un ensayo clínico aleatorizado y abierto cuyo objetivo fue comparar la influencia del momento de iniciar el TAR en pacientes infectados por el VIH con TB en la mortalidad. Se incluyeron en el estudio 806pacientes infectados por el VIH con TB y cifras de linfocitos CD4+ inferior a 250células/μl que fueron distribuidos aleatoriamente a recibir un régimen de TAR basado en la asociación tenofovir+3TC+efavirenz, administrado a las 2semanas de iniciado el tratamiento de la TB (TAR precoz, grupo1), o tras la finalización de la fase intensiva del tratamiento de la TB (TAR tardío, grupo2). Los pacientes fueron estratificados según cifras basales de linfocitos CD4+ (mayor o menor de 50células/μl). La variable principal del estudio fue la incidencia de muerte o sida a las 48semanas. Globalmente no se apreciaron diferencias en la mortalidad y/o progresión a sida entre 2grupos de tratamiento (13 versus 16,1% muertes o sida/100pacientes-año, p=0,45). Sin embargo, al evaluar al subgrupo de pacientes con cifras basales de linfocitos CD4+ inferiores a 50células/μl (n=72) se observó una reducción del 68% de la mortalidad en el grupo de pacientes que recibió TAR precoz respecto al que recibió TAR tardío (15,5 versus 26,6 muertes/100pacientes-año, p=0,02). Sin embargo en el grupo de pacientes que recibió TAR tardío la incidencia de efectos adversos por el TAR o de SRI fue inferior al grupo de TAR precoz, en todos los estratos de linfocitos CD4+.
Sin embargo, y a pesar de que los ensayos clínicos aleatorizados comentados anteriormente y diseñados para definir el tiempo óptimo de inicio del TAR durante la TB60-63 y otras infecciones oportunistas64 han mostrado que el inicio precoz el TAR es beneficioso en términos de mortalidad, este hecho no ha sido comprobado en un estudio realizado en pacientes con meningitis tuberculosa. Así, en un ensayo clínico doble ciego, controlado con placebo, realizado en Vietnam65, 253pacientes infectados por el VIH con meningitis tuberculosa fueron aleatorizados a recibir TAR en la primera semana del inicio del tratamiento de la TB (TAR inmediato, n=127) o 2meses después (TAR diferido, n=126) para determinar si el inicio inmediato del TAR reducía el riesgo de muerte. Todos los pacientes recibieron tratamiento antituberculoso estándar, dexametasona, profilaxis con cotrimoxazol y un régimen de TAR consistente en zidovudina, lamivudina y efavirenz. Un total de 76 (60%) y 70 (56%) pacientes en los grupos de TAR inmediato y diferido, respectivamente, fallecieron durante el estudio. El TAR de inicio inmediato no se asoció con una reducción del riesgo de muerte o desarrollo de nuevo evento-sida. Se comprobó una mayor incidencia de efectos adversos grado4 en el grupo de pacientes que recibieron TAR inmediato (102 vs 87, p=0,04). Para los autores, los resultados del estudio apoyan el retraso del inicio del TAR en pacientes con meningitis tuberculosa. Sin embargo, las conclusiones de este estudio deben ser interpretadas con cautela. En primer lugar el estudio se realizó en una cohorte de pacientes que recibió el cuidado estándar de la meningitis tuberculosa en un área de bajos recursos, y la alta mortalidad observada en él pudiera no corresponderse con la obtenida en áreas con distintos recursos. En segundo lugar, en el estudio se incluyeron pacientes con un avanzado estado de gravedad de la meningitis, como lo demuestra el hecho de que 85 (58,2%) de las 146muertes ocurrieron en el primer mes del seguimiento. Por último, y en tercer lugar, el prolongado intervalo entre el comienzo de los síntomas y el inicio del tratamiento (mediana 21 días) puede haber influido negativamente en el pronóstico de los pacientes. Por tanto, no disponemos de las evidencias necesarias para conocer el momento óptimo de inicio del TAR en pacientes con meningitis TB. Sin embargo, en este escenario parece razonable extrapolar los resultados obtenidos en los ensayos clínicos anteriormente comentados y recomendar que el inicio del TAR en la TB meníngea se realice siguiendo los criterios utilizados en el tratamiento para la TB no meníngea.
Por último, es necesario puntualizar que los estudios que han evaluado el momento óptimo de inicio del TAR en pacientes con TB60-63 incluyeron fundamentalmente pacientes con TB pulmonar y que, por tanto, disponemos de poca experiencia en el escenario de TB extrapulmonar. Sin embargo, en esta situación parece razonable extrapolar los resultados obtenidos en dichos estudios al escenario de la TB extrapulmonar.
Por tanto, de los ensayos clínicos analizados anteriormente se pueden inferir las siguientes conclusiones:
- 1.
Iniciar el TAR durante el tratamiento de la TB reduce el riesgo de muerte en pacientes infectados por el VIH.
- 2.
Este beneficio se observa en todos los estratos de linfocitos CD4+.
- 3.
En pacientes con cifras de linfocitos CD4+ inferiores a 50células/μl, iniciar el TAR en las 4 primeras semanas del tratamiento de la TB reduce el riesgo de muerte.
- 4.
En pacientes con cifras de linfocitos CD4+ superiores a 50células/μl iniciar el TAR una vez finalizada la fase de inducción del tratamiento de la TB reduce el riesgo de efectos adversos y SRI sin comprometer la supervivencia.
Por último, en áreas con recursos limitados en los que no sea posible disponer de recuento de linfocitos CD4+, la OMS recomienda iniciar TAR en todo paciente con TB tan pronto como sea posible tras el inicio del tratamiento de la TB, una vez que se haya comprobado que este es adecuadamente tolerado, y no más tarde de 8semanas después del inicio del tratamiento de la TB25,66.
Recomendaciones- 1.
En pacientes con infección por el VIH con TB se debe iniciar el TAR durante el tratamiento de la TB, ya que reduce el riesgo de muerte, observándose este beneficio en todos los estratos de linfocitos CD4+. (Recomendación fuerte, alta calidad de evidencia.)
- 2.
En pacientes con infección por el VIH con TB y cifras de linfocitos CD4+ inferiores a 50células/μl se debe iniciar el TAR a las 2semanas del tratamiento de la TB y una vez comprobada la buena tolerancia al tratamiento antituberculoso, ya que reduce el riesgo de muerte y desarrollo de sida. (Recomendación fuerte, alta calidad de evidencia.)
- 3.
En pacientes con infección por el VIH con TB y cifras de linfocitos CD4+ superiores a 50células/μl se debe iniciar el TAR una vez finalizada la fase intensiva del tratamiento de la TB, ya que reduce el riesgo de efectos adversos y SRI sin comprometer la supervivencia (Recomendación fuerte, alta calidad de evidencia.)
- 4.
Aunque se desconoce el momento óptimo de inicio del TAR en pacientes con meningitis tuberculosa, se recomienda utilizar en este escenario los criterios anteriores. (Recomendación fuerte, baja calidad de evidencia.)
En pacientes con infección por el VIH, el tratamiento concomitante del propio retrovirus y de la TB conlleva un buen número de problemas. Las interacciones entre fármacos antirretrovirales y antituberculosos, el solapamiento de toxicidad, el desarrollo o la presencia de resistencia y el elevado número de fármacos necesarios son alguno de los problemas que limitan las opciones terapéuticas y dificultan el adecuado tratamiento simultáneo de ambas enfermedades.
La interacción más relevante entre el TAR y el tratamiento antituberculoso es motivada porque las rifamicinas son potentes inductores del CYP3A4, uno de los sistemas enzimáticos más importantes para el metabolismo de la mayoría de las familias de fármacos antirretrovirales, como inhibidores de la proteasa (IP), inhibidores de la transcriptasa inversa no análogos de los nucleósidos (ITINN), raltegravir y maraviroc67,68.
La interacción entre rifamicinas e inhibidores de la transcriptasa inversa análogos de los nucleósidos (ITIAN) no resulta clínicamente significativa y, por tanto, el uso concomitante de estos fármacos no requiere ajuste de sus dosis67,68. Sin embargo, en la actualidad no se recomienda el uso de regímenes de TAR basados exclusivamente en combinaciones de ITIAN67-69. Además, pese a las ventajas teóricas que supondría evitar las interacciones del TAR con rifampicina, no se dispone de evidencias sobre la eficacia y seguridad del TAR basado en ITIAN en pacientes con TB, por lo que su uso en esta situación debe reservarse para situaciones especiales.
La rifampicina induce el metabolismo de los ITINN provocando una disminución de sus concentraciones plasmáticas69-73. Entre los ITINN, la rifampicina afecta más a la farmacocinética de la nevirapina74-76 que a la del efavirenz77-79. En un ensayo clínico aleatorizado80, 142pacientes infectados por el VIH-1, con TB y tratamiento con rifampicina, fueron aleatorizados a recibir un régimen de TAR basado en dosis estándar de efavirenz (600mg/día) o nevirapina (400mg/día). A las 12semanas de tratamiento el 3,1% de los pacientes que recibían efavirenz y el 21,3% de los pacientes que recibieron nevirapina presentaron concentraciones plasmáticas de estos fármacos inferiores a las concentraciones mínimas recomendadas (p=0,002). En un análisis por intención de tratar el 73,2 y el 71,8% de los pacientes con efavirenz y nevirapina, respectivamente, alcanzaron ARN-VIH-1 inferior a 50copias/ml a las 48semanas de tratamiento. En un análisis multivariante, presentar concentraciones plasmáticas inadecuadas de ITINN incrementó en 3,6 veces el riesgo de fracaso del tratamiento.
El efavirenz, a dosis de 600mg/día, es el fármaco de cuyo uso se dispone de mayor experiencia e información en pacientes con TB, ya que ha sido el fármaco utilizado en los estudios diseñados para evaluar el momento óptimo de inicio del TAR61-63,65. Este es un argumento adicional para recomendar regímenes basados en efavirenz como de uso preferente en pacientes infectados por VIH-1 con TB y considerar los regímenes de TAR basados en nevirapina como alternativos. En esta situación no se considera necesario incrementar la dosis de efavirenz a 800mg/día.
La rifampicina tiene un efecto inductor sobre la enzima responsable de la degradación de rilpivirina y etravirina, lo que provoca una reducción significativa del AUC de ambos fármacos. Por este motivo no se recomienda el uso de estos junto a la rifampicina81,82.
La rifampicina tiene un efecto inductor sobre la enzima responsable de la degradación de raltegravir, la UDP-glucuronosiltransferasa, reduciendo el AUC de raltegravir en un 40%67,68. En un estudio realizado en voluntarios sanos se comprobó que aumentando la dosis de raltegravir a 800mgBID se podía compensar el efecto de la rifampicina proporcionando un pequeño incremento del AUC de raltegravir (27%) en comparación con la dosis de 400mgBID sin rifampicina83.
Sin embargo, los ensayos clínicos en fase ii de búsqueda de dosis de raltegravir demostraron una potencia antiviral similar en el rango de dosis de 100-600mgBID84. Ello sugiere que una exposición moderadamente menor a la conseguida por la dosis estándar autorizada de raltegravir (400mgBID) podría conseguir una eficacia antiviral adecuada. Por este motivo no se considera clínicamente relevante la interacción entre raltegravir y otros fármacos antirretrovirales como efavirenz85, etravirina86 o tipranavir87, que provocan una disminución en las concentraciones plasmáticas de raltegravir (36, 34 y 24%, respectivamente), y no se recomienda el ajuste de la dosis de raltegravir67-69.
En un ensayo clínico en fase ii se incluyeron 155 pacientes infectados por el VIH sin TAR previo diagnosticados de TB y tratados con un régimen que incluyó HRZE durante 2meses seguido de HR durante 4meses más. Los pacientes fueron aleatorizados a recibir tenofovir/emtricitabina junto a efavirenz (600mg/día), raltegravir (400mgBID) o raltegravir (800mgBID). A las 24semanas de inicio del TAR, el 67, el 78 y el 76% de los pacientes alcanzaron ARN-VHC indetectable, respectivamente, en cada una de las ramas del estudio. El uso de raltegravir (400mgBID o 800mgBID) resultó seguro. Se detectaron mayor número de mutaciones de resistencias a inhibidores de integrasa y a ITIAN en el brazo de 400mgBID de raltegravir (comparables a las detectadas en el brazo de efavirenz) que en el de 800mgBID de raltegravir. Los resultados preliminares de este estudio sugieren que el raltegravir puede ser una alternativa al efavirenz en pacientes VIH con TB. Sin embargo, los resultados preliminares de este ensayo clínico no han permitido definir la dosis óptima de raltegravir en pacientes tratados con rifampicina. Los resultados del seguimiento a 48semanas y del subestudio famacocinético de este ensayo clínico permitirán aclararlo88. Hasta ese momento el uso de raltegravir en pacientes con TB tratados con rifampicina debe considerarse alternativo. En estos casos, las agencias reguladoras (FDA y EMEA) recomiendan aumentar la dosis de raltegravir a 800mgBID89,90.
No se recomienda el uso conjunto de rifampicina con elvitegravir/cobicistat por la existencia de una interacción farmacocinética significativa91. Sin embargo, los resultados de un ensayo clínico en fasei llevado a cabo en voluntarios sanos seronegativos al VIH, diseñado para evaluar el efecto de la rifampicina en el metabolismo del dolutegravir, sugieren que el dolutegravir a dosis de 50mg cada 12h puede ser coadministrado con rifampicina92.
El maraviroc es un inhibidor del correceptor CCR5 que inhibe la entrada del VIH en la célula67-69. La rifampicina induce el metabolismo del maraviroc, por lo que para su uso conjunto se recomienda incrementar la dosis de maraviroc a 600mg/12h67-70,93. La limitada experiencia de maraviroc en pacientes con TB, junto con la necesidad de determinar el tropismo viral para su uso y el elevado coste de la dosis necesaria (600mg/12h), son factores que limitan su uso. Por este motivo, solo se recomienda el uso de maraviroc en situaciones especiales, en casos en los que no pueda ser usada ninguna de las opciones preferentes o alternativas.
El uso combinado de IP/r con rifampicina plantea serios problemas de toxicidad94-96, por lo que el uso concomitante de ambos se encuentra contraindicado67,68.
El uso de rifabutina en lugar de rifampicina para permitir el uso de IP/r es una posible estrategia no exenta de problemas. En primer lugar, la propia rifabutina requiere ajuste de dosis. La dosis óptima de rifabutina cuando se usa junto a IP/r no ha sido claramente establecida, siendo la dosis más habitual de 150mg cada 2días para la mayoría de los fármacos67,68. Se han descrito fracasos de tratamiento antituberculoso con aparición de resistencias en pacientes con inmunodepresión avanzada tratados con IP/r y rifabutina a dosis de 150mg/48h o 3veces por semana23,24. Ello plantea serias dudas sobre la eficacia de la combinación. La determinación de los niveles de rifabutina, que podría ayudar a realizar el ajuste de dosis, no está disponible en la mayoría de hospitales. También hay que tener en cuenta que los niveles de rifabutina son muy «sensibles» a la omisión de una/s dosis de IP por el paciente. Por último, el uso de rifabutina incrementa la complejidad del tratamiento antituberculoso al impedir el uso de formulaciones galénicas de combinaciones de fármacos antituberculosos. Por todos estos motivos se recomienda evitar el uso simultáneo de rifabutina e IP/r y, si es posible, valorar otras alternativas terapéuticas67.
Recomendaciones- 1.
En pacientes con infección por el VIH con TB en tratamiento estándar se recomienda como régimen de TAR de uso preferente la combinación de tenofovir/emtricitabina (dosis habituales) o abacavir/lamivudina (dosis habituales) más efavirenz a dosis de 600mg/día. (Recomendación fuerte, alta calidad de evidencia.)
- 2.
Se recomiendan como regímenes alternativos, por orden de preferencia, tenofovir/emtricitabina o abacavir/lamivudina más nevirapina (dosis habituales) (Recomendación fuerte, moderado calidad de evidencia) o tenofovir/emtricitabina o abacavir/lamivudina + raltegravir (800mg cada 12h). (Recomendación fuerte, baja calidad de evidencia.)
- 3.
Se recomienda que otros regímenes de TAR, como tenofovir/emtricitabina o abacavir/lamivudina + maraviroc (a dosis de 600mg cada 12h), solo sean usados en situaciones especiales en las que no sea posible utilizar ninguno de los regímenes anteriores. (Recomendación fuerte, muy baja calidad de evidencia.)
El tratamiento simultáneo de la TB y la infección por el VIH están asociados con un aumento del riesgo de síndrome de reconstitución inmune (SRI)97. El SRI supone uno de los obstáculos más importantes para iniciar TAR en pacientes con infección por el VIH con TB. El SRI es el resultado de la restauración de la capacidad del sistema inmunitario para poner en marcha mecanismos inflamatorios después de iniciar el TAR o el tratamiento antituberculoso98, y se manifiesta comúnmente en 2 escenarios: SRI desenmascarador, en el cual se identifica TB poco después de iniciado el TAR, y SRI paradójico, en el que se produce un deterioro clínico paradójico de los pacientes con TB a pesar de recibir un tratamiento adecuado98,99. El conocimiento de su incidencia real es dificultoso, ya que depende tanto de la definición de SRI como del grado de monitorización de los pacientes. De este modo, su incidencia varía ampliamente (del 8 al 40%) entre distintos estudios99,100. Se han identificado diversos factores predictivos de SRI en pacientes con TB, como recuento de linfocitos CD4<50células/μl, aumento del recuento de linfocitos CD4+ tras el inicio del TAR, alta carga viral basal del VIH, gravedad de la TB e inicio precoz del TAR101-103. La mayor parte de los casos de SRI ocurren dentro de los 3 primeros meses del inicio del tratamiento antituberculoso102,103.
En un subestudio del ensayo clínico SAPiT cuyo objetivo era evaluar la incidencia, la gravedad y la evolución del SRI en relación con el momento de inicio del TAR101, la incidencia de SRI fue de 19,5 (n=43), 7,5 (n=18) y 8,1 (n=19) casos por 100personas-año en el grupo1 (TAR integrado precoz), en el grupo2 (TAR integrado tardío) y en el grupo3 (TAR tras finalizar tratamiento de la TB), respectivamente. Entre pacientes con cifras de linfocitos CD4 basales menores a 50células/μl la incidencia de SRI fue respectivamente de 45,5, de 9,7 y de 19,7 casos por 100personas-año. La incidencia fue mayor en el grupo1 que en el grupo2 (RR, 2,6 [IC95%, 1,5-4,8], p<0,001) y que en el grupo 3 (RR, 2,4 [IC95%, 1,4-4,4], p<0,01). Del mismo modo se produjeron más casos de SRI grave en el grupo1 que en los otros 2grupos (35% vs. 19%, p=0,179), con mayor frecuencia de hospitalización (42% vs. 14%, p=0,007) y mayor tiempo hasta la resolución de los síntomas (70,5 vs. 29,0 días, p<0,001). Los resultados de este estudio sugieren que retrasar el inicio del TAR desde las 2 a las 8 semanas reduce la incidencia de SRI. Sin embargo, la posible ventaja de retrasar el TAR que supone disminuir la incidencia y la gravedad del SRI debe ser balanceada con el potencial beneficio que sobre la progresión de la enfermedad y la mortalidad supone el inicio precoz del TAR.
En un estudio prospectivo que incluyó a 34pacientes con meningitis TB que iniciaron TAR a las 2semanas de iniciado el tratamiento de la TB y que recibieron prednisona como tratamiento adyuvante, el 47% (16/34) de los pacientes desarrollaron SRI. En el momento del diagnóstico los pacientes con SRI presentaron mayor recuento de PMN en el LCR (mediana, 50 versus 3células/ml, p=0,02) y mayor frecuencia de aislamiento de Mycobacterium tuberculosis en los cultivos de LCR que los pacientes que no desarrollaron SRI104.
Los pacientes con síntomas de SRI leves o moderados pueden ser tratados sintomáticamente con antiinflamatorios no esteroideos. En los pacientes con SRI moderado-grave, un ensayo clínico aleatorizado y controlado con placebo demostró que el uso de corticosteroides produce menos ingresos y procedimientos invasivos por SRI y no tuvo efectos adversos41.
En pacientes que no mejoran tras la instauración de tratamiento con corticosteroides no existen evidencias que permitan recomendar el uso de otros fármacos. En esta situación, pequeñas series de casos han sugerido que el uso de talidomida podría ser útil105.
Recomendaciones- 1.
En presencia de SRI no debe discontinuarse ni el tratamiento antituberculoso ni el TAR. (Recomendación fuerte, baja calidad de evidencia.)
- 2.
Formas leves o moderadas de SRI deben manejarse con antiinflamatorios no esteroideos. (Recomendación fuerte, baja calidad de evidencia.)
- 3.
El tratamiento con corticosteroides de SRI con manifestaciones moderadas-graves mejora los síntomas sin provocar efectos adversos añadidos. (Recomendación fuerte, moderada calidad de evidencia.)
La TB resistente a fármacos antituberculosos (FAT) supone un problema mundial de primera magnitud que constituye una dificultad para el control de la enfermedad y entraña un aumento de su morbimortalidad106. La presencia de resistencia a un único fármaco se denomina monorresistencia, y la resistencia a más de un fármaco que no incluya la combinación de H y R se llama polirresistencia. El término multirresistencia (MDR) se reserva para designar la presencia de resistencia al menos a H y R107,108, y el de resistencia extendida (XDR), para definir a la resistencia a H, R, fluoroquinolonas y al menos a uno de los siguientes fármacos de uso parenteral: amikacina, kanamicina o capreomicina109.
Principios básicos del tratamiento de la tuberculosis resistenteNo existen evidencias procedentes de ensayos clínicos aleatorizados que permitan establecer recomendaciones firmes sobre la mejor pauta de tratamiento en pacientes con MDR-TB y XDR-TB. Tampoco existe el nivel de evidencia necesario para definir la duración óptima del tratamiento de la MDR-TB y XDR-TB. Las recomendaciones realizadas por el panel en este punto se realizan asumiendo estas limitaciones106-110.
- 1.
El cambio de tratamiento en un paciente con TB resistente debe estar siempre guiado por los resultados del estudio basal de sensibilidad a FAT. Además hay que considerar siempre la posibilidad de que el paciente haya podido realizar monoterapia o biterapia encubiertas durante el tratamiento inicial y que ello haya podido originar el desarrollo de resistencia a alguno de los FAT inicialmente sensibles que el paciente hubiera recibido.
- 2.
Añadir un nuevo FAT a un régimen de tratamiento que ha fracasado puede originar la realización de monoterapia encubierta y el desarrollo de resistencias a los nuevos FAT utilizados, comprometiendo el éxito de futuras terapias. En este sentido tampoco es recomendable reducir el número de FAT del régimen de tratamiento antes de disponer del estudio basal de sensibilidad, especialmente en pacientes sin respuesta al tratamiento.
- 3.
El tratamiento apropiado para MDR-TB y XDR-TB requiere la utilización de al menos 4fármacos activos no utilizados previamente, incluyendo siempre que sea posible un fármaco de uso parenteral.
- 4.
Es fundamental que el tratamiento de la TB resistente a fármacos esté dirigido o supervisado por un experto.
- 5.
Diagnóstico precoz de resistencia.
Aunque como hemos comentado anteriormente no existe el nivel de evidencia necesario para establecer recomendaciones firmes respecto a la duración óptima del tratamiento de la MDR-TB y la XDR-TB, consideramos que el tiempo mínimo de tratamiento debe ser de 12-18meses tras la esterilización de los cultivos, debiéndose mantener el agente inyectable, si es posible, hasta 6meses después de la negativización de los mismos y continuar con un mínimo de 3fármacos orales activos hasta el final del tratamiento110.
Aunque las posibles combinaciones de resistencias a FAT son múltiples, de forma práctica distinguiremos 2escenarios en función del número de FAT utilizados en el régimen inicial110:
- a.
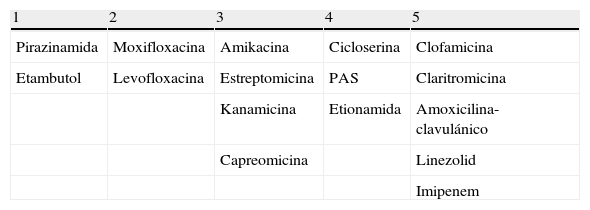
Pacientes tratados inicialmente con un régimen que incluía 3FAT (HR y Z o E). En esta situación hay que considerar que el paciente ha realizado monoterapia con Z o E y que muy probablemente haya desarrollado resistencia a dicho fármaco. En esta situación se debe suspender todo el régimen que ha fracasado y sustituirlo por una combinación de 4FAT activos seleccionados con el siguiente orden de prioridad (tabla 3).
- 1.
Incluir si es posible por el perfil de resistencia basal el FAT de primera línea no utilizado previamente (E o Z).
- 2.
Incluir una fluoroquinolona (preferiblemente M).
- 3.
Incluir un FAT de administración parenteral (estreptomicina, kanamicina, capreomicina o amikacina).
- 4.
Incluir FAT de segunda línea (cicloserina, PAS y etionamida) hasta completar 4fármacos activos.
- 5.
Si con los 4pasos anteriores no se consigue seleccionar el número de FAT activos deseados, incluir fármacos de tercera línea hasta conseguirlo (linezolid, clofamicina, amoxicilina-clavulánico, claritromicina, imipenem).
- 1.
- b.
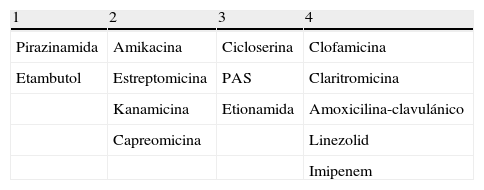
Pacientes tratados inicialmente con un régimen que incluía 4FAT (HRZE). En esta situación hay que considerar que el paciente ha realizado biterapia con ZE y que la población bacilar necesaria para desarrollar mutantes resistentes frente a estos fármacos es de 108, lo que puede haber provocado el desarrollo de resistencia a ambos fármacos, especialmente si el tiempo de tratamiento ha sido prolongado y el paciente presentaba TB cavitada. En esta situación se debe suspender HR y construir un nuevo régimen con al menos 4fármacos activos seleccionados con el siguiente orden de prioridad: 1) Incluir si es posible por el perfil de resistencia basal ZE, pese a la comentada posibilidad de resistencia secundaria. Seguir los pasos 2, 3, 4 y 5 del supuesto anterior.
La selección del nuevo régimen debe ser constituida por una combinación de al menos 4FAT activos seleccionados con el siguiente orden de prioridad110: 1) Incluir si es posible por el perfil de resistencia basal el E o Z. 2) Incluir, si el perfil de resistencia lo permite, un FAT de administración parenteral (estreptomicina, kanamicina, capreomicina o amikacina). 3) Incluir FAT de segunda línea (cicloserina, PAS y etionamida). 4. Incluir FAT de tercera línea (linezolid, clofamicina, amoxicilina-clavulánico, claritromicina, imipenem) hasta alcanzar al menos 4FAT activos (tabla 4). En el futuro el tratamiento de pacientes con MDR y XDR-TB puede cambiar sustancialmente merced al desarrollo de nuevos FAT, entre ellos Bedaquilina (previamente TMC-207, Janssen), el primer fármaco de la familia de diarylquinolina, que ha demostrado una potente actividad frente a MDR-TB en ensayos clínicos controlados con placebo111,112; PA-824 (TB Alliance) y Delamanid (previamente OPC-67683, Otsuka), nitroimidazoles activos frente a cepas de MDR-TB113, y Sutezolid (previamente PNU-100480, Pfizer), una nueva oxazolidinona activa frente a MDR-TB114,115.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.