Existen pocos datos sobre la eficacia de etravirina (ETV) en la práctica clínica.
MétodosEstudio observacional retrospectivo para evaluar su uso, su eficacia y su tolerabilidad.
ResultadosLos principales motivos de uso de ETV en 151pacientes pretratrados fueron toxicidad y fracaso virológico. La tolerancia fue buena, y tras 16meses, el 76,16% tienen carga viral indetectable. Los pacientes con carga viral detectable al inicio tuvieron mayor riesgo de fracaso (31,7% vs 18%; p=0,05).
ConclusionesETV puede considerarse un fármaco seguro, eficaz y duradero.
There are limited data on etravirine (ETV) use in routine clinical practice.
MethodsThe reasons, efficacy and tolerability of its use are retrospectively reviewed.
ResultsOverall, 151patients started a regimen containing ETV. The main reasons for prescription were toxicity and virological failure. After a median follow-up of 16months 76.2% of the patients had an undetectable viral load. Patients with detectable HIV-RNA at baseline had a greater risk of failure (31.7% vs 18%; P=.05).
ConclusionETV is safe, effective and durable.
La disponibilidad de un gran número de tratamientos antirretrovirales (TAR) frente al virus de la inmunodeficiencia humana (VIH) permite prescribir distintas combinaciones, tanto en pacientes naïve como en pacientes pretratados. Los diferentes regímenes tienen ventajas y limitaciones en términos de eficacia, tolerabilidad, posología y coste1,2. La etravirina (ETV) es un fármaco no análogo de nucleósido (NAN) de segunda generación eficaz en el tratamiento del VIH-1, con aprobación de uso para pacientes pretratados3. Con el fin de evaluar su eficacia y su tolerabilidad, se diseñó el presente estudio observacional retrospectivo. En él se recogieron los datos de todos los pacientes que iniciaron tratamiento con ETV en un hospital de Madrid desde su disponibilidad en la práctica clínica hasta el 31 de diciembre de 2011.
Pacientes y métodosTodos los pacientes incluidos en el estudio cumplían los criterios siguientes:
- 1.
Edad igual o superior a los 18años con infección por VIH-1 confirmada.
- 2.
Inicio de TAR con cualquier pauta que incluyera ETV en el período comprendido entre el 1 enero de 2007 y el 31 de diciembre de 2011, hubieran o no discontinuado la terapia.
- 3.
Tener al menos una visita de seguimiento tras el inicio del tratamiento con ETV.
El protocolo fue presentado al Comité Ético del Hospital y a la agencia española de medicamentos y productos sanitarios, clasificándose como «Estudio PostAutorización con Otros Diseños diferentes al de seguimiento prospectivo» (abreviado como EPA-OD) y recibiendo el código EUL-ETR-2012-01. La información se recogió, de forma retrospectiva, en las consultas externas del Servicio de Enfermedades Infecciosas del Hospital Carlos III a partir de las historias clínicas y/o bases de datos disponibles de los pacientes incluidos según los criterios de selección.
Las variables a estudiar fueron: edad, sexo, raza, conducta de riesgo para la adquisición del VIH, país de origen, nadir de linfocitos CD4+ por mm3 y recuento de los mismos en el momento del cambio, carga viral del VIH en situación basal y porcentaje de pacientes con carga viral <50copias/ml al inicio y al final del estudio, historia de TAR previo y descripción de efectos adversos, presencia de mutaciones de resistencia, infección crónica por el virus de la hepatitisB (VHB), presencia de anticuerpos frente al virus de la hepatitisC (VHC) y carga viral del mismo, evolución tras el inicio de ETV y causas de discontinuación de la misma.
Para el análisis estadístico se utilizó el paquete estadístico SPSS versión 17.0. Las variables cualitativas se dan como número absoluto y porcentaje. Las cuantitativas como media y desviación estándar. La comparación de grupos se hizo con la prueba de chi cuadrado y t de Student, según correspondía. Se realizó un análisis de regresión lineal multivariante para determinar los factores relacionados con tener una evolución favorable: carga viral <50 y continuar con ETV al final del seguimiento.
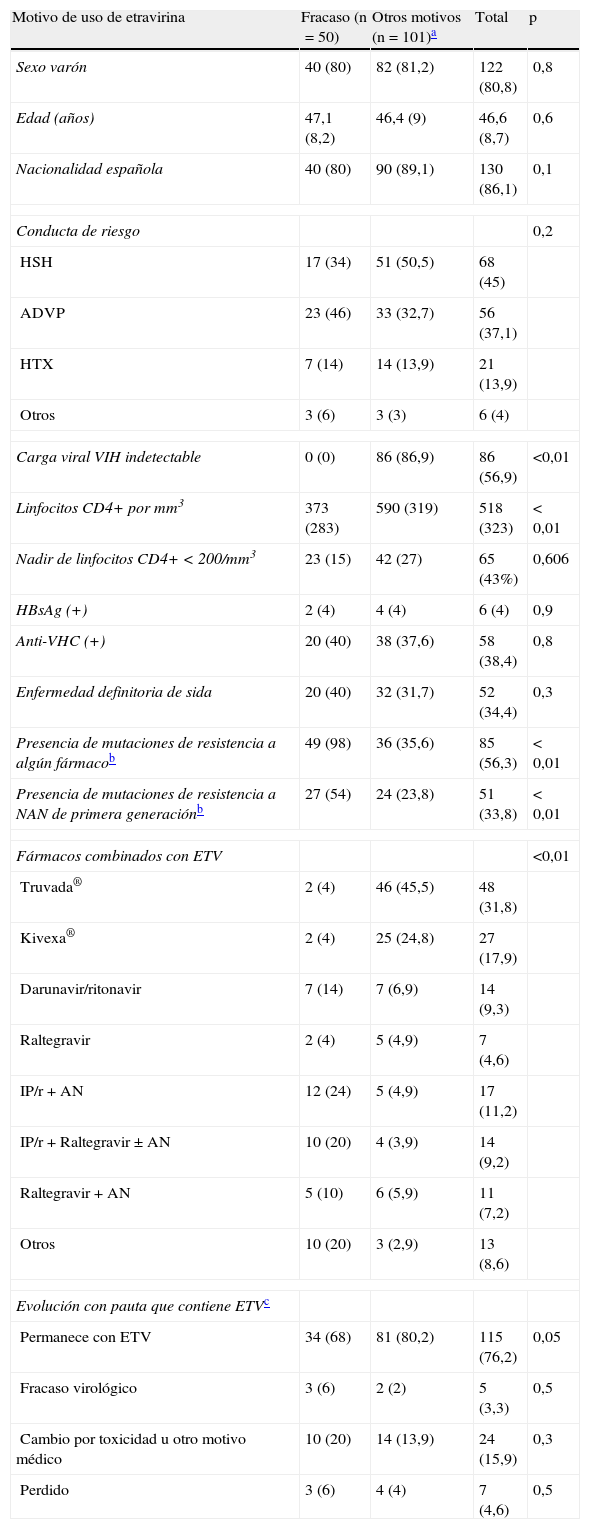
ResultadosDurante el periodo del estudio iniciaron tratamiento con ETV 151pacientes pretratados. Los principales motivos por los que se administró ETV fueron la toxicidad de la pauta previa en 78pacientes (51,7%), el fracaso terapéutico en 50 (33,1%) y una estrategia de simplificación en 12 (7,9%). El 80% eran varones y la edad media era de 46,5años. El 38,4% tenían anticuerpos frente al VHC (29,1% con carga viral detectable de VHC) y el 4% tenían una hepatitis B crónica. La tabla 1 muestra las características basales y la evolución de los pacientes que recibieron ETV. Puesto que el grupo que recibió ETV por fracaso tenía diferencias respecto al resto de pacientes, se muestran por separado ambos grupos.
Características basales y evolución de los 151 pacientes que recibieron etravirina (ETV) según el motivo de su indicación (fracaso vs otras causas)
| Motivo de uso de etravirina | Fracaso (n=50) | Otros motivos (n=101)a | Total | p |
| Sexo varón | 40 (80) | 82 (81,2) | 122 (80,8) | 0,8 |
| Edad (años) | 47,1 (8,2) | 46,4 (9) | 46,6 (8,7) | 0,6 |
| Nacionalidad española | 40 (80) | 90 (89,1) | 130 (86,1) | 0,1 |
| Conducta de riesgo | 0,2 | |||
| HSH | 17 (34) | 51 (50,5) | 68 (45) | |
| ADVP | 23 (46) | 33 (32,7) | 56 (37,1) | |
| HTX | 7 (14) | 14 (13,9) | 21 (13,9) | |
| Otros | 3 (6) | 3 (3) | 6 (4) | |
| Carga viral VIH indetectable | 0 (0) | 86 (86,9) | 86 (56,9) | <0,01 |
| Linfocitos CD4+ por mm3 | 373 (283) | 590 (319) | 518 (323) | < 0,01 |
| Nadir de linfocitos CD4+ <200/mm3 | 23 (15) | 42 (27) | 65 (43%) | 0,606 |
| HBsAg (+) | 2 (4) | 4 (4) | 6 (4) | 0,9 |
| Anti-VHC (+) | 20 (40) | 38 (37,6) | 58 (38,4) | 0,8 |
| Enfermedad definitoria de sida | 20 (40) | 32 (31,7) | 52 (34,4) | 0,3 |
| Presencia de mutaciones de resistencia a algún fármacob | 49 (98) | 36 (35,6) | 85 (56,3) | < 0,01 |
| Presencia de mutaciones de resistencia a NAN de primera generaciónb | 27 (54) | 24 (23,8) | 51 (33,8) | < 0,01 |
| Fármacos combinados con ETV | <0,01 | |||
| Truvada® | 2 (4) | 46 (45,5) | 48 (31,8) | |
| Kivexa® | 2 (4) | 25 (24,8) | 27 (17,9) | |
| Darunavir/ritonavir | 7 (14) | 7 (6,9) | 14 (9,3) | |
| Raltegravir | 2 (4) | 5 (4,9) | 7 (4,6) | |
| IP/r+AN | 12 (24) | 5 (4,9) | 17 (11,2) | |
| IP/r+Raltegravir±AN | 10 (20) | 4 (3,9) | 14 (9,2) | |
| Raltegravir+AN | 5 (10) | 6 (5,9) | 11 (7,2) | |
| Otros | 10 (20) | 3 (2,9) | 13 (8,6) | |
| Evolución con pauta que contiene ETVc | ||||
| Permanece con ETV | 34 (68) | 81 (80,2) | 115 (76,2) | 0,05 |
| Fracaso virológico | 3 (6) | 2 (2) | 5 (3,3) | 0,5 |
| Cambio por toxicidad u otro motivo médico | 10 (20) | 14 (13,9) | 24 (15,9) | 0,3 |
| Perdido | 3 (6) | 4 (4) | 7 (4,6) | 0,5 |
ADVP: adictos a drogas por vía parenteral; AN: análogos de nucleósidos; anti-VHC: anticuerpos frente al VHC; HBsAg: hepatitis crónica B; HSH: hombres que tienen sexo con hombres; HTX: heterosexual; IP/r: inhibidor de la proteasa potenciado con ritonavir; NAN: no análogos de nucleósidos.
Las variables cualitativas se expresan como valor absoluto (%), y las variables continuas, como media (desviación estándar).
Los pacientes que recibieron ETV por fracaso se diferenciaban del resto porque todos tenían carga viral VIH detectable (frente al 13,1% del resto), tenían menos linfocitos CD4 por mm3 (373 vs 590) y tenían más resistencias actuales o archivadas frente a cualquier familia de antirretrovirales (98% vs 35,6%) o fármacos NAN de primera generación (54% vs 23,8%). En total, 51pacientes tenían alguna mutación que confería resistencia a NAN de primera generación: en 29 casos existía la K103N, en 12 la G190A, en 11 la Y181C, en 5 la V106A, en 3 la L100I y en uno la P225H.
ETV se usó con otros antirretrovirales en más de 15combinaciones diferentes. Las combinaciones variaban dependiendo de si el fármaco se usaba en fracaso o por otra causa. Así, en pacientes en fracaso se combinó en un 24% con un inhibidor de la proteasa potenciado (IP/r) más uno o 2 análogos de nucleósidos (AN). Otra pauta frecuente (20%) fue IP/r+AN+raltegravir (RAL). Por el contrario, cuando la ETV no se puso por fracaso, lo más frecuente fue administrarla junto a 2AN: Truvada® y Kivexa® fueron los únicos acompañantes en el 45,5 y el 17,9% de los pacientes, respectivamente. En 21pacientes con opciones terapéuticas limitadas (por toxicidad o resistencias) ETV se administró en biterapia: junto a DRV/r en 14casos y junto a RAL en 7. Hay que reseñar que de estos 21pacientes tan solo fracasó uno que desarrolló mutaciones de resistencia al RAL.
Después de una mediana de seguimiento de 16meses, 115 (76,2%) pacientes continúan en tratamiento con ETV y con carga viral indetectable (evolución favorable). Se observó menor tendencia a tener una evolución favorable en pacientes que recibieron ETV como estrategia de rescate respecto al resto, rayando la diferencia la significación estadística (68% vs 80%; p=0,05).
Se realizó un análisis multivariante para estudiar los factores relacionados con evolución favorable. En él se incluyó el sexo, la nacionalidad, los CD4 actuales, el antecedente de un nadir de CD4+ <200 por mm3, carga viral detectable al inicio, motivo de uso de ETV, presencia de hepatitis crónicaB o C y presencia de mutaciones previas a fármacos antirretrovirales. Los únicos factores que se relacionaron con tener evolución favorable fueron el sexo varón (OR=2,29; IC95%, 1,04-5,03; p=0,04) y el tener carga viral VIH indetectable basal (OR=2,68; IC95%, 1,09-6,58; p=0,03).
En 36pacientes hubo que retirar ETV, pero solo en 5ocasiones fue por fracaso virológico. En 15pacientes se retiró el fármaco por toxicidad (9,9%), siendo el motivo más frecuente toxicodermia. Uno de estos pacientes presentaba antecedente previo de exantema por efavirenz (EFV). En 2pacientes que previamente habían presentado neurotoxicidad por EFV hubo que retirar también la ETV por persistencia de la misma sintomatología (cefalea, insomnio, mareo). Dos pacientes a los que se cambió a ETV por hepatotoxicidad secundaria a nevirapina normalizaron las transaminasas tras el cambio.
DiscusiónLos objetivos del TAR son conseguir una supresión máxima y prolongada de la carga viral para restablecer o conservar la función inmunológica. Sin embargo, alcanzar dichos puntos con el menor número de efectos secundarios es en ocasiones muy difícil, y la toxicidad es, hoy por hoy, una de las principales causas de cambio del TAR4,5.
La ETV aporta una mayor barrera genética y un mejor perfil de toxicidad que los NAN de primera generación, lo que permite su utilización en un mayor número de escenarios6,7. Así, en nuestra serie, basada en la vida real, mantuvo la supresión virológica en más del 75% de los pacientes después una mediana de seguimiento de 16meses. Es más, fue un fármaco eficaz tanto en pacientes que usaban el fármaco por toxicidad o simplificación como en los que lo usaron como terapia de rescate. En los primeros se utilizó fundamentalmente asociada a Truvada® o Kivexa®, mientras que en enfermos en fracaso virológico se utilizaron múltiples combinaciones, algunas de ellas libres de análogos, como la asociación con DRV/r y RAL. Esta pauta, cuya eficacia se comprobó en el estudio TRIO8, fue utilizada en el 8% de los casos y no hubo ningún fracaso virológico.
Tras los escasos fracasos virológicos no aparecieron nuevas mutaciones de resistencia, excepto en un paciente que desarrolló resistencia a RAL, lo que no limita nuevas opciones terapéuticas con NAN. La tolerancia, tal como sucede en otros estudios9,10, fue buena y solo se retiró por toxicidad en menos del 10% de los pacientes.
En resumen, en nuestro estudio, aunque con las limitaciones inherentes a no ser prospectivo ni comparativo, se describe la evolución de un amplio número de pacientes tratados con ETV en la práctica clínica diaria, siendo la toxicidad y el fracaso virológico los motivos más frecuentes para su administración. Se observa, además, que las combinaciones que asocian ETV son seguras y eficaces en un amplio grupo de pacientes pretratados independientemente de la pauta utilizada, y que en los que tienen limitadas opciones terapéuticas, utilizada sin análogos y en biterapia puede ser una alternativa eficaz y durable.
Conflicto de interesesLas Dras. M. Eulalia Valencia, Victoria Moreno y Luz Martín Carbonero declaran haber recibido financiación por su participación en conferencias y en reuniones de asesoría por parte de los siguientes laboratorios: Abbott, Boehringer, Bristol, Jansen, Gilead y ViiV.