Introducción
La infección por citomegalovirus (CMV) continúa siendo una complicación importante en receptores de un trasplante de órgano sólido (TOS) o de progenitores hematopoyéticos (TPH). A los efectos directos de la infección se pueden sumar numerosos efectos indirectos como el rechazo del injerto o el desarrollo de otras infecciones. En los últimos años se han producido notables avances en su tratamiento diagnóstico, profiláctico y terapéutico que han supuesto una reducción en su morbilidad y mortalidad. El Grupo Español para el Estudio de la Infección en el Trasplante (GESITRA) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), en colaboración con el Subcomité de complicaciones infecciosas y no infecciosas del Grupo Español de Trasplante Hematopoyético (GETH) han decidido elaborar unas recomendaciones de tratamiento de esta infección que resuman de forma sistematizada todos estos avances. Este documento se ha desarrollado siguiendo las recomendaciones internacionales en la elaboración de documentos de consenso 1. Las recomendaciones se han calificado siguiendo la clasificación de los Centers for Disease Control and Prevention (CDC) americanos que se expone en la tabla 1.
Definiciones
Existe una notable variabilidad en la nomenclatura utilizada en esta infección. Consideramos importante estandarizar las definiciones utilizadas, que han sido recientemente revisadas 2.
Se define "infección activa" (en lo sucesivo "infección por CMV") como el aislamiento del virus o la detección de proteínas virales o ADN/ARN mensajero del CMV en cualquier líquido o tejido del cuerpo. La infección es "primaria" cuando el CMV se detecta en un individuo que previamente era CMV seronegativo. "Infección recurrente" es la nueva detección de CMV al menos 4 semanas después de controlar la primera infección. La infección recurrente puede resultar de la reactivación de un virus latente (endógeno) o por reinfección (exógeno). La "reactivación" se define por la detección de una cepa de CMV igual que la que causa la infección original y la "reinfección" por la detección de una cepa distinta.
La "viremia" se define como el aislamiento de CMV por cultivo de la sangre del paciente. La "antigenemia" consiste en la detección directa del antígeno pp65 de CMV en leucocitos de sangre periférica, fundamentalmente neutrófilos. "ADNemia" y "ARNemia" se definen como la detección de ADN y ARN, respectivamente, en muestras de plasma, sangre completa o leucocitos.
Se considera que existe "enfermedad por CMV" cuando el paciente infectado presenta síntomas o signos (síndrome viral o afectación de órgano). El síndrome viral o síndrome por CMV se define por la presencia de fiebre (> 38 °C) durante al menos 2 días en un período de 4 días, acompañada de neutropenia, trombocitopenia o elevación de transaminasas, y de la detección de infección por CMV en sangre. En el TPH se recomienda evitar el empleo de este término, ya que puede ser confuso.
El CMV puede causar enfermedad de órgano. Las más comunes son la neumonía, la enfermedad digestiva, la hepatitis, la encefalitis, la retinitis, la nefritis, la cistitis, la miocarditis y la pancreatitis. El diagnóstico de certeza se hace por la presencia de un cuadro clinicoanalítico compatible y la demostración de lesiones histológicas en una biopsia y/o cultivo positivo para CMV (la detección de CMV por reacción en cadena de la polimerasa [PCR] en una muestra de tejido no es diagnóstica). En la neumonía se acepta la detección de CMV en el lavado broncoalveolar (LBA). Para diagnosticar la enfermedad neurológica se acepta la detección de CMV por cultivo o PCR en muestras de LCR. El diagnóstico de retinitis se basa en la presencia de lesiones típicas en el fondo de ojo. La presencia de CMV en la orina de pacientes con disfunción renal o síndrome miccional es insuficiente para diagnosticar la enfermedad de órgano.
La "profilaxis" consiste en administrar un antiviral eficaz para prevenir el desarrollo de infección y/o enfermedad por CMV a un paciente en ausencia de sospecha clínica y datos microbiológicos de infección. El "tratamiento anticipado" (preemptive treatment o preemptive therapy) consiste en el inicio de un tratamiento antiviral ante la positividad de determinadas pruebas microbiológicas que indiquen infección en pacientes aún asintomáticos.
Diagnóstico y monitorización virológica
Los pacientes trasplantados deben ser monitorizados virológicamente para detectar la infección por CMV (AI). No existe una técnica con validez universal 3-8. La elección debe estar basada en el objetivo clínico perseguido, en las características clínicas del paciente y en las peculiaridades técnicas del método.
Evaluación pretrasplante
Es importante conocer el estado serológico frente a CMV (IgG) de donante y receptor, pues tiene implicaciones en el riesgo de desarrollar infección activa (AII). Se recomienda utilizar los métodos de enzimoinmunoanálisis o de aglutinación con látex, dada su buena sensibilidad y sencillez. No se recomienda utilizar, con carácter general, la serología para el diagnóstico y el seguimiento postrasplante (DII).
Monitorización virológica para realizar tratamiento anticipado
La técnica que se utilice debe ser sensible, cuantificable, rápida y reproducible (BIII). Los métodos de cultivo (convencional o en shell vial) no deben ser utilizados para guiar este tipo de tratamiento (DII). Se recomienda utilizar la antigenemia o la ADNemia cuantitativa (AIII) 3-8. No existen datos de superioridad de una sobre la otra. Los centros que no dispongan de estas técnicas no debieran utilizar el tratamiento anticipado (BIII).
La monitorización de la infección por CMV debe hacerse en sangre. Cuando se utiliza la PCR cuantitativa puede utilizarse plasma o sangre total. No existe suficiente evidencia para poder recomendar una de ellas, aunque la determinación en plasma es más simple y sus resultados se correlacionan bien con los obtenidos en sangre total (BII). Cuando se utiliza sangre total se recomienda que el anticoagulante empleado sea el ácido etilendiaminotetraacético. La heparina interfiere con la PCR. No se recomienda utilizar muestras de saliva o de orina.
No existe un valor umbral tajante a partir del cual indicar tratamiento. Este valor tiene que establecerlo cada centro en función del riesgo del paciente y de la propia experiencia (AIII). A modo orientativo se pueden considerar valores de antigenemia igual o superior a 20 cél. CMV+/10 5 leucocitos en el trasplante de órgano sólido (BII). Si se detecta una antigenemia de bajo nivel, se recomienda repetirla en un corto plazo de tiempo. En el TPH se suele utilizar como criterio cualquier positividad de la antigenemia. En el caso de la PCR cuantitativa el valor umbral puede variar entre 400 y 5.000 copias/ml (BII). La presencia de leucopenia (< 1.000 leucocitos/μl) dificulta la interpretación de la antigenemia, lo que puede ser una razón para utilizar ADNemia (BIII). No obstante, el riesgo de enfermedad depende no sólo del valor umbral, sino también de otros parámetros indicativos de la cinética viral (p. ej., incremento semanal de la carga viral).
La experiencia con las técnicas de amplificación en tiempo real es insuficiente, pero muy prometedora. Mientras no existan métodos comerciales no es posible realizar recomendaciones sobre valores umbrales.
Se recomienda que la monitorización se realice al menos semanalmente mientras el paciente se encuentra ingresado. Una vez dado de alta, y en función del riesgo particular de cada paciente, el esquema de monitorización debe ajustarse a los controles clínicos del paciente. En el TOS es deseable que el esquema real se acerque lo máximo posible a los controles habituales del paciente. En el TPH alogénico es imprescindible continuar con el control semanal y en casos de alto riesgo puede ser recomendable el control bisemanal. La falta de cumplimiento del esquema de monitorización indicado (controles clínicos muy espaciados, fallos a la visita de control) pueden hacer fracasar el tratamiento anticipado. En estos casos puede ser preferible utilizar profilaxis universal.
Técnicas de laboratorio para el diagnóstico de enfermedad por citomegalovirus
Debido a su rapidez y fiabilidad las técnicas de elección para el diagnóstico de enfermedad por CMV son la antigenemia y la ADNemia (AII) 9. El diagnóstico de síndrome viral exige la demostración de infección activa por CMV en sangre. La enfermedad focal requiere la detección con métodos histopatológicos en el tejido afectado y/o cultivo. No se recomienda aceptar el diagnóstico de enfermedad focal de certeza basado tan sólo en la detección del virus en tejido por PCR del tejido debido a su bajo valor predictivo positivo (EIII). La detección en sangre puede ser indicativa, pero su sensibilidad es insuficiente para el diagnóstico de certeza, especialmente en la afectación digestiva.
No se recomienda utilizar el cultivo convencional en el diagnóstico de enfermedad por su lentitud y baja sensibilidad. Aunque la rapidez del método de cultivo ha mejorado con la variante shell vial tampoco consideramos que sea el método diagnóstico de elección en este momento.
Monitorización de la respuesta al tratamiento
Se recomienda una monitorización, al menos, semanal del tratamiento. El descenso de la antigenemia y de la ADNemia no es inmediato tras el inicio del tratamiento. Incluso es posible observar aumentos de esta cifra en la primera semana de tratamiento sin que sea un indicador de fracaso terapéutico (BII). El objetivo es que al final de la 2 o 3 semana de tratamiento la antigenemia o la ADNemia sean negativas, aunque no siempre se consigue. El aumento o el mantenimiento prolongado en los valores de antigenemia o ADNemia en el curso del tratamiento puede ser un indicador que haga sospechar la aparición de resistencia a los antivirales, aunque también puede traducir factores dependientes del huésped (BIII).
Al finalizar el tratamiento se debe continuar aplicando el protocolo de monitorización establecido. Si la antigenemia o ADNemia se hacen de nuevo positivas se debe volver a evaluar cuidadosamente al paciente (BI).
Estudio de resistencias a los antivirales
La resistencia viral depende de mutaciones en el genoma del virus y debe diferenciarse de la falta de respuesta al tratamiento debido a factores del paciente (resistencia clínica). El estudio de la resistencia viral debe realizarse en laboratorios especializados mediante pruebas genotípicas o fenotípicas. El estudio mediante ensayos fenotípicos exige el aislamiento previo del CMV y por tanto, es una de las pocas indicaciones actuales del cultivo. El desarrollo de la tecnología de secuenciación del ADN permite disponer de técnicas genotípicas para el diagnóstico de las mutaciones más frecuentes que confieren resistencia a ganciclovir. La detección genotípica de la resistencia a otros antivirales (foscarnet, cidofovir) es más difícil.
Prevención de la infección por CMV en el trasplante de progenitores hematopoyéticos
La prevención de la enfermedad por CMV es un aspecto básico de cualquier programa de TPH. La elección de las distintas estrategias de prevención se debe hacer de acuerdo con los factores de riesgo de cada caso que a continuación se comentan.
Factores de riesgo de infección por CMV
El riesgo de la infección por CMV, y en algunos tipos de TPH la supervivencia, dependen de la serología pretrasplante del receptor y del donante 10-13. Por lo tanto, es importante conocer el estado serológico (IgG) del donante y receptor antes del trasplante (AIII). Los receptores seronegativos tienen bajo riesgo de infección por CMV con un tratamiento correcto.
Los pacientes que carecen de respuesta inmunitaria específica hacia CMV tienen un riesgo incrementado de desarrollar enfermedad por este virus 14,15. Todos los factores que reduzcan esta respuesta específica (corticoides, "depleción" T, el uso de antivirales como profilaxis universal, la enfermedad injerto contra huésped [EICH] grados II-IV) incrementan el riesgo de infección. La seropositividad del donante puede estimular la respuesta específica al citomegalovirus 14.
La EICH aguda incrementa el riesgo de infección por CMV 16. No se puede descartar que ello sea debido al efecto inmunosupresor de los fármacos empleados en su tratamiento.
El riesgo de enfermedad por CMV es mayor en el trasplante alogénico que en el autólogo, independientemente del riesgo de infección 17,18. Entre los principales factores que explican este fenómeno se encuentran la diferente alorreactividad y reconstitución inmunitaria de ambos procedimientos. En cada uno de ellos se pueden dar situaciones que incrementan el riesgo de padecer una infección por este virus. Se considera que un trasplante alogénico es de alto riesgo cuando existe:
Depleción de células T del inóculo.
Donante no emparentado.
Antígeno de histocompatibilidad (HLA) no idéntico (una o más diferencias en HLA A, B, C, DRB1, Ag o alélica).
Empleo de corticoides a dosis elevadas (> 1 mg/kg).
Tratamiento con alemtuzumab y análogos de purina.
Aunque el riesgo de enfermedad por CMV del TPH autólogo es bajo, existen pacientes de riesgo elevado:
Receptores de inóculos con selección CD34+.
Pacientes tratados con y análogos de purina (fludarabina o 2CA).
Uso de corticoides en dosis elevadas (> 1 mg/kg).
Se considera que la reactivación del virus es predictiva del desarrollo de síntomas (enfermedad). La carga viral en la fase inicial de infección activa así como la tasa de incremento de la carga viral se correlacionan con este riesgo 19. La hemoterapia no filtrada o no seronegativa supone un factor de riesgo de enfermedad. En pacientes seronegativos con donante seronegativos debe evitarse la transfusión de productos sanguíneos no filtrados o de donantes seropositivos 20.
Profilaxis de infección por CMV en TPH
Las medidas profilácticas recomendadas en TPH han sido recientemente revisadas por el European Group for Blood and Marrow Transplantation (EBMT) y por los CDC americanos en colaboración con diversas sociedades científicas 21,22.
Medidas pretrasplante, selección de candidatos y medidas higiénicas
En todos los candidatos a TPH se debe conocer su estado serológico (IgG) frente al CMV antes del trasplante (AIII). En los receptores seronegativos toda la hemoterapia pretrasplante administrada debe ser CMV seronegativa o filtrada (AI) para evitar la transmisión del CMV. Así mismo, deben evitar cualquier otra situación que incremente el riesgo de primoinfección por vía oral o sexual (CIII).
Si el receptor es seronegativo se debería emplear un donante seronegativo cuando sea posible (AI). Si el receptor es CMV seropositivo la elección del donante en función de la serología CMV es una cuestión controvertida. Existen evidencias recientes que indican que el uso de donantes CMV seropositivos mejora la supervivencia de los receptores CMV seropositivos que reciben un TPH de un donante no relacionado y sin depleción de células T 13.
Hemotratamiento e inmunoglobulinas
En el TPH alogénico, los pacientes CMV seronegativos con donantes CMV seronegativos deben recibir solamente productos sanguíneos CMV seronegativos o pobres en leucocitos (filtrada) (AI). Cuando el paciente es CMV seropositivo esta medida no es necesaria. Cuando el paciente es CMV seronegativo y el donante es CMV seropositivo la transfusión de productos seronegativos o leucodepletados podría ser beneficiosa (CIII), en particular en los pacientes considerados de alto riesgo de enfermedad por CMV. Los receptores de TPH autólogos CMV seronegativos podrían beneficiarse de la transfusión de productos seronegativos o leucodepletados (CIII), en particular aquellos pacientes considerados de alto riesgo para el desarrollo de enfermedad por CMV. Hay que tener en cuenta que un cierto número de receptores de TPH autólogo recibirán posteriormente un TPH alogénico por lo que conviene minimizar en lo posible la exposición al CMV en todos los autólogos CMV negativos. No se recomienda en ningún caso el empleo de inmunoglobulinas para la prevención de la infección o enfermedad por CMV (DII).
Prevención con fármacos antivirales
Hay dos estrategias de eficacia probada en la prevención de la enfermedad por CMV en el TPH: la profilaxis con ganciclovir intravenoso (AI) y el tratamiento anticipado de la infección (AI). Ambas estrategias presentan una eficacia similar en la prevención del CMV, pero la profilaxis tiene mayor toxicidad, una mayor dificultad logística derivada de la necesidad de una administración intravenosa prolongada y un mayor impacto negativo en la reconstitución inmunitaria frente al CMV.
La estrategia recomendada depende del riesgo del paciente. En el TPH alogénico de bajo riesgo se recomienda utilizar tratamiento anticipado (BI) siempre que se pueda garantizar el cumplimiento del protocolo de monitorización virológica. También puede indicarse en los pacientes de alto riesgo CMV seronegativos con donante CMV seropositivo (BII). Se recomienda utilizar la profilaxis con ganciclovir intravenoso cuando el protocolo de monitorización no se pueda cumplir (BII) o cuando se trata de un TPH alogénico de alto riesgo (v. definiciones previas). En el TPH autólogo de bajo riesgo no está indicada la prevención del CMV. En el TPH autólogo de alto riesgo está indicado el tratamiento anticipado (BII).
La profilaxis con ganciclovir intravenoso se suele iniciar al prendimiento del paciente y se mantiene hasta el día +100 (AI). También puede emplearse un curso breve pretrasplante (CIII). No se recomienda el uso de ganciclovir oral profiláctico (DIII). No se dispone de datos de eficacia de la profilaxis con valganciclovir en el TPH. No obstante, los datos farmacocinéticos disponibles permiten afirmar que con su administración oral se pueden obtener concentraciones sanguíneas de ganciclovir similares a las obtenidas con la formulación intravenosa. Ello permitiría realizar profilaxis de forma ambulatoria cuando esta forma de prevención esté indicada 23.
El aciclovir o valaciclovir puede utilizarse como profilaxis frente al CMV en los receptores de TPH alogénico (BI). Cuando se utilice, debe hacerse siempre combinado con supervisión y tratamiento precoz de la infección por CMV (AI).
Cuando esté indicado el tratamiento anticipado, la monitorización en sangre se debe hacer al menos semanalmente desde el postrasplante (días 0-10) hasta al menos el día +100 (AI). No es necesario iniciar la monitorización antes del TPH (AIII). Se recomienda una monitorización más prologada en pacientes con EICH grave, reactivación de la infección por CMV, TPH de donante no emparentado o HLA no idéntico y en los mini-alo TPH (BII). En los TPH autólogos no se recomienda la monitorización del CMV salvo en pacientes de alto riesgo en los que esté indicado el tratamiento anticipado. No se recomienda el empleo del LBA o de otras muestras distintas de la sangre como marcador de tratamiento anticipado (LBA) (DII).
El tratamiento anticipado con ganciclovir intravenoso y foscarnet es equivalente en eficacia pero se diferencian en su perfil de toxicidad. La elección dependerá del riesgo de toxicidad que tenga el paciente, del antiviral que haya podido recibir anteriormente y de la cifra de neutrófilos basal. El cidofovir puede considerarse para el tratamiento de segunda línea (BII). El valganciclovir es un fármaco atractivo para el tratamiento anticipado porque su excelente farmacocinética por vía oral puede permitir el tratamiento ambulatorio. Son necesarios estudios que validen su eficacia en esta situación. Desde luego estaría indicado en los pacientes en los que la colocación o mantenimiento de una vía venosa sea problemática (CIII).
No existe una pauta de tratamiento anticipado universalmente aceptada. No obstante, la elegida será empleada independientemente del tipo de trasplante o del día en que aparece la infección. Algunos centros diferencian la dosis en función de que sea una pauta de inducción o de mantenimiento (tabla 2). Se recomienda dar una dosis de inducción durante al menos 2-3 semanas. Si la antigenemia o la PCR se ha negativizado en este período se puede dar por concluido el tratamiento, aunque algunos centros prolongan el tratamiento 1 o 2 semanas más. Si la antigenemia o la PCR no se negativiza durante la fase de inducción se puede indicar la continuación del tratamiento con una dosis de mantenimiento.
Un aumento de la carga viral durante la primera semana no implica que el tratamiento haya fracasado. Sí pueden indicar fracaso terapéutico los incrementos de carga viral a partir de la segunda semana de tratamiento. En estos casos sería aconsejable realizar pruebas de resistencia genotípica o fenotípica, si se dispone de ellas (CIII). Si ello no es posible puede indicarse el cambio de antiviral. No es infrecuente que un paciente muy inmunodeprimido precise cursos repetidos de tratamiento anticipado.
No se recomienda el empleo combinado de ganciclovir y foscarnet a mitad de dosis en el tratamiento anticipado (DI). Esta pauta no ha mostrado ser más eficaz y sí más tóxica 24.
Todos los antivirales requieren ajuste de dosis según la función renal, en particular el foscarnet y el cidofovir. Cuando se utiliza ganciclovir se recomienda controlar el número de neutrófilos al menos semanalmente (BIII). Esta debe mantenerse siempre por encima de 1.000/μl (BII). Cuando los neutrófilos descienden entre 500-1.000/μl se puede intentar mantener el ganciclovir administrando factor estimulante de colonias de granulocitos (G-CSF) y sólo cambiarlo si la cifra de neutrófilos no se incrementa o estabiliza en 24 h. No se recomienda mantener el tratamiento con ganciclovir si el número de neutrófilos desciende por debajo de 500/μl. Cuando se tenga que suspender el ganciclovir por toxicidad puede estar indicado el tratamiento con foscarnet, controlando convenientemente la función renal (nefrotoxicidad). Cuando al comienzo del tratamiento la cifra de neutrófilos sea inferior a 1.000/μl puede estar indicado utilizar foscarnet. Cuando no sea posible su utilización o no se tolere se puede emplear el ganciclovir junto a G-CSF valorando la evolución (tabla 2).
Prevención de la infección por CMV en el trasplante de órgano sólido
Factores de riesgo de infección por CMV en trasplante de órgano sólido
Aspectos generales
La infección por CMV aparece en el 30-80% de los pacientes sometidos a un TOS, aunque su incidencia y la presencia de enfermedad sintomática varían dependiendo del tipo de trasplante, de la presencia de factores de riesgo asociados y de las estrategias de prevención utilizadas 25,26.
El período de mayor riesgo corresponde entre el primero y sexto mes, con una máxima incidencia entre el segundo y el tercer mes.
En la infección primaria, la falta de inmunidad específica del receptor permite una gran replicación de CMV (tasa de crecimiento de 1,82 U/día). Esta se suele asociar con una infección sintomática (enfermedad por CMV), a veces muy grave, que se presenta aproximadamente el 50-60% de los pacientes 27. En las reactivaciones, la propia inmunidad humoral y celular del receptor disminuyen la dinámica de replicación del virus (0,61 U/día) 27, con lo que se disminuye la incidencia y gravedad de la enfermedad, que aparece en el 10-20% de los pacientes.
Aunque la infección por CMV se presenta en todos los TOS, su incidencia y gravedad varía según el tipo de trasplante. La aparición de enfermedad es más frecuente, y habitualmente más grave, en los trasplantes de intestino, páncreas y pulmón que en los de hígado, corazón y riñón.
Pacientes de alto riesgo
El trasplante de un órgano seropositivo a un receptor seronegativo (D+/R) es el principal factor de riesgo para la enfermedad por CMV y se ha demostrado en todos los tipos de trasplante 28-32.
Los inmunosupresores antilinfocitarios, como las globulinas antilinfocíticas o antitimocíticas, o los anticuerpos monoclonales OKT3 se acompañan de la producción y secreción de citocinas, en particular el factor de necrosis tumoral, que desencadena la cascada inflamatoria y estimula de forma intensa la replicación de CMV 33,34.
Otros factores de riesgo
Las elevadas dosis de corticoides, las cargas virales elevadas de CMV, la estimulación alogénica, las coinfecciones por otros herpes virus, el micofenolato mofetil, otros inmunosupresores, la hipotermia intraoperatoria y el estrés asociado a situaciones críticas son otros factores asociados a un mayor riesgo de replicación de CMV 35-37.
Medidas preventivas de la infección por CMV en el trasplante de órgano sólido
Medidas pretrasplante, selección de candidatos y medidas higiénicas
En todos los candidatos a TOS se debe conocer su estado serológico (IgG) frente al CMV antes del trasplante (AIII). En los receptores seronegativos de donantes seronegativos (situación D/R) o desconocidos es aconsejable que la hemotratamiento postrasplante sea CMV seronegativa o filtrada (AI) para evitar la transmisión del CMV. No es criterio de exclusión la utilización de injertos de donantes seropositivos para receptores seronegativos en ningún trasplante, aunque en trasplante intestinal no urgente se recomienda la utilización de donantes seronegativos para receptores seronegativos (CIII).
Trasplantes de riñón, corazón e hígado
Las frecuencias de infección y enfermedad por CMV en este tipo de trasplantes son inferiores a las que tiene lugar en trasplantados de pulmón, páncreas o intestino. En general, en este tipo de trasplantes se recomienda la realización de profilaxis en las situaciones de alto riesgo: a) situación D+/R, y b) utilización de anticuerpos antilinfocitarios (globulinas antilinfocíticas o antitimocíticas, o anticuerpos monoclonales OKT3). En los pacientes seropositivos para CMV la prevención se basa en el tratamiento anticipado guiada por antigenemia o PCR, siempre que se pueda garantizar el cumplimiento del protocolo de monitorización virológica.
La gammaglobulina anti-CMV no ha demostrado su eficacia en la prevención de la enfermedad por CMV en pacientes con trasplante renal o hepático de alto riesgo al ser comparado con placebo 38,39. Sin embargo, estudios retrospectivos han mostrado algún beneficio en trasplantados cardíacos de alto riesgo (reducción significativa de la enfermedad y muerte por CMV y de la enfermedad vascular del injerto) y siempre en combinación con ganciclovir intravenoso 40,41.
A pesar de sus buenos resultados y su amplia utilización en los últimos años, ganciclovir oral no está disponible en la actualidad para su uso comercial. Por este motivo, aunque se analiza el papel de ganciclovir oral en diferentes estudios, este fármaco no aparece en ninguna de las recomendaciones finales para su uso en la actualidad (tablas 3 y 4).
Trasplante de riñón
Profilaxis. En pacientes D+/R la profilaxis con valaciclovir, cuando se compara con placebo, ha confirmado una reducción significativa de la enfermedad 42. Los trabajos que han comparado la profilaxis universal con ganciclovir intravenoso frente a valganciclovir 43 o ganciclovir oral frente a valganciclovir 44 no han mostrado diferencias significativas respecto a la reducción de enfermedad; sin embargo, en todos estos trabajos la frecuencia de enfermedad se mantuvo por debajo del 15%, claramente inferior a la obtenida con placebo (40-50%).
La profilaxis con ganciclovir intravenoso durante la administración de anticuerpos antilinfocitarios reduce de manera significativa la frecuencia de enfermedad por CMV en el trasplante renal 45,46.
Aunque algunos estudios han demostrado reducción significativa de infección y enfermedad con ganciclovir oral en relación a aciclovir oral en profilaxis 47, esta estrategia es poco recomendable en pacientes de bajo riesgo, debido a la baja tasa de enfermedad por CMV que existe en el trasplante renal en estos pacientes (generalmente < 10%).
Tratamiento anticipado. En trasplante renal la utilización de tratamiento anticipado con ganciclovir oral, guiada con antigenemia, administrado durante 12 semanas y comparada con placebo, no modificó las tasas de infección, pero redujo considerablemente la frecuencia de enfermedad (0 % frente a 24%) durante la utilización del tratamiento, si bien la frecuencia de enfermedad a los 3 y 12 meses fue similar en ambos grupos 48.
En pacientes con insuficiencia renal severa postrasplante (aclaramiento de creatinina < 10 ml/min) el uso de ganciclovir o valganciclovir debe realizarse con precaución, dado que la vía de eliminación es exclusivamente renal. Razonablemente, la profilaxis se puede diferir hasta que el aclaramiento sea superior a 10 ml/min.
Recomendaciones para el trasplante renal. En situación D+R, se recomienda la profilaxis con valganciclovir oral, 900 mg/día o valaciclovir oral, 2 g/6 h, o ganciclovir intravenoso, 6 mg/kg/día, si el paciente no tolera por vía oral (AI), hasta completar un máximo de 3 meses postrasplante, todos ellos ajustados a función renal. No están bien evaluadas duraciones inferiores a este tiempo. Se recomienda la utilización de ganciclovir intravenoso, 5 mg/kg/día, ajustado a la función renal, al menos durante 2 semanas durante el tratamiento con sueros antitimocíticos, plasmaféresis o anticuerpos anti-CD20 (BI).
En situación R+ existen datos favorables a la utilización de tratamiento anticipado con ganciclovir intravenoso (5 mg/kg/12 h) ajustado a función renal, durante 2 semanas y monitorizar (BI). Es deseable que los parámetros de replicación sean negativos o presenten clara reducción del título. No es infrecuente que los valores de PCR se mantengan positivos más tiempo que las determinaciones de antigenemia. La buena biodisponibilidad de valganciclovir oral y sus buenos resultados en pacientes de alto riesgo hacen plausible su eficacia con éxito en esta indicación, en dosis de 900 mg/12 h, ajustada a la función renal, aunque existen aún pocos casos publicados (CIII). En trasplantados renales de bajo riesgo y valores bajos de replicación puede estar recomendado un intento de reducción de inmunosupresión, posibilitando con esta medida en algunos casos evitar el uso de tratamiento anticipado.
Trasplante hepático
Profilaxis. Ganciclovir oral, 3 g/día, durante 90 días, es más eficaz que placebo en pacientes de bajo y alto riesgo (15% frente a 44%) 49. Igualmente, las pautas con ganciclovir intravenoso 50,51 u oral 52 han demostrado superioridad frente al aciclovir en pacientes de alto y bajo riesgo.
Con una administración de ganciclovir intravenoso durante los primeros 14 días, ganciclovir oral, 3 g/día durante 100 días, es tan eficaz como ganciclovir intravenoso, 6 mg/kg/día durante 100 días, en pacientes de alto riesgo 53.
En el estudio de Paya et al, ganciclovir oral, 3 g/día durante 100 días fue más eficaz que valganciclovir oral, 900 mg/día durante 100 días, en pacientes de alto riesgo (12% frente a 19% de enfermedad por CMV y 3% frente a 14% de enfermedad invasora) 44,54. Sin embargo, este estudio se diseñó como de no inferioridad y para ello se estimó un número determinado de trasplantes (hígado, riñón, corazón y páncreas). El análisis d e subgrupos, en este caso trasplante hepático, incluye un número insuficiente de casos para estimar diferencias.
El desarrollo de enfermedad tardía por CMV es una consecuencia demostrada de la profilaxis prolongada con ganciclovir. En el estudio de Paya et al, el 28% de los pacientes del grupo de ganciclovir oral y el 30% de valganciclovir recibieron tratamiento para la enfermedad por CMV después de finalizar los 100 días de profilaxis 44. La resistencia al ganciclovir es un riesgo de la profilaxis prolongada con ganciclovir oral en los receptores de trasplante.
Tratamiento anticipado. La aplicación de tratamiento anticipado es una medida eficaz en pacientes de bajo riesgo; sin embargo, el 78% de los pacientes de alto riesgo que reciben tratamiento anticipado pueden llegar a necesitar un nuevo ciclo por confirmarse nueva replicación viral en el seguimiento 55. La utilización de ganciclovir oral en tratamiento anticipado, en dosis de 3 g/día, administrado durante 6 semanas ha mostrado resultados similares a los obtenidos con ganciclovir intravenoso, 5 mg/kg/12 h, administrado durante 7 días 55. Aunque se ha comunicado éxito en algunas estrategias basadas en tratamiento anticipado en pacientes de alto riesgo en estos trasplantes, estas obligan a controles muy estrechos y con una frecuente utilización de tratamientos anticipados 56, 57.
El desarrollo de enfermedad tardía por CMV es excepcional en los pacientes incluidos en los estudios con tratamiento anticipado y también la resistencia a ganciclovir, si bien es cierto que la experiencia con el tratamiento anticipado es menor que con la profilaxis universal.
Recomendaciones para el trasplante hepático. Los pacientes de alto riesgo deben recibir profilaxis (AI). Mientras el paciente esté ingresado puede administrarse ganciclovir intravenoso (durante las primeras 2-3 semanas). Posteriormente, al dar el alta al paciente, dado que no está disponible ganciclovir oral, se puede utilizar valganciclovir oral hasta un máximo de 3 meses (pendientes de datos que ratifiquen definitivamente esta indicación) (CIII). En pacientes que no toleren la vía oral, ganciclovir por vía intravenosa, 5 mg/kg/día durante 100 días, es igualmente eficaz (AI). En pacientes que reciban profilaxis prolongada debe tenerse muy en cuenta que la incidencia de enfermedad tardía es elevada y posible el desarrollo de resistencias a ganciclovir.
En receptores positivos y en el seguimiento posprofilaxis de los seronegativos, el tratamiento anticipado con ganciclovir intravenoso (BII) o valganciclovir oral (CIII) constituyen la estrategia más eficiente para la prevención de la enfermedad por CMV en los receptores de trasplante hepático. La duración de este tratamiento no está claramente establecida, pero en general se debe mantener durante 2 semanas, realizando posteriormente control de carga viral o antigenemia.
Trasplante cardíaco
Profilaxis. Resultados obtenidos de estudios que comparan ganciclovir intravenoso con placebo en pacientes de alto riesgo (D+/R) demuestran el beneficio de la profilaxis cuando esta se realiza de forma prolongada, durante 6 semanas y 14 días después de cada episodio de rechazo 58. Por el contrario, la profilaxis con dosis plenas de ganciclovir (5 mg/kg/12 h) no es superior a placebo si sólo de administra durante 4 semanas en este tipo de pacientes, si además reciben inducción con OKT3 durante 2 semanas 59.
Esta profilaxis en pacientes de alto riesgo se puede llevar a cabo de forma eficaz con pautas orales. Se han demostrado buenos resultados con valganciclovir (900 mg/día) comparado con ganciclovir oral (3 g/día) durante los primeros 100 días postrasplante 44. En este trabajo se incluyeron 56 trasplantes cardíacos y la proporción de enfermedad por CMV fue de 6% frente a 10%.
La profilaxis también es recomendable en pacientes que reciben anticuerpos antitimocíticos. Aguado et al 60 realizaron un estudio prospectivo, aleatorizado y abierto en que se incluyeron 31 pacientes seropositivos que habían recibido inducción con OKT3 durante 14 días. La administración de 14 días de ganciclovir intravenoso a dosis plenas fue más eficaz que gammaglobulina anti-CMV en la prevención de enfermedad, aunque no hubo diferencias en la incidencia de infección. En 1995 se publicó un estudio retrospectivo estudiando la utilidad de añadir profilaxis con 14 días de ganciclovir intravenoso en pacientes seropositivos tratados con OKT3 que ya recibían aciclovir oral durante 3 meses y gammaglobulina anti-CMV. Este estudio, que incluyó 115 pacientes, demostró que un ciclo corto de ganciclovir lograba una reducción importante, aunque no estadísticamente significativa, de la enfermedad en D+/R 61.
Existen dos estudios retrospectivos que incluyen trasplantes cardiopulmonares, que han obtenido buenos resultados combinando la administración de gammaglobulinas anti-CMV y ganciclovir intravenoso durante los primeros 21-28 días postrasplante 40,41, con reducción significativa de la enfermedad, de muerte relacionada y de enfermedad vascular del injerto. En este sentido, hay autores que recomiendan la administración de profilaxis universal con el objeto de reducir la infección por CMV y la enfermedad vascular del injerto.
Tratamiento anticipado. En pacientes seropositivos para CMV que no reciben anticuerpos antitimocíticos las medidas preventivas suelen basarse en tratamiento anticipado. Recientemente se ha publicado un estudio en el que se incluyeron 37 trasplantes cardíacos con antigenemia positiva que recibieron ganciclovir intravenoso o gammaglobulina anti-CMV, sin que ninguno desarrollara enfermedad 62. Otros autores han publicado también resultados favorables administrando ganciclovir intravenoso en esta situación 63-65. Se han publicado experiencias favorables, aunque con un reducido número de pacientes con el uso de valganciclovir oral en tratamiento anticipado 66.
Recomendaciones en trasplante cardíaco. Los pacientes con situación D+/R deben recibir profilaxis (AI). Puede iniciarse tratamiento con ganciclovir intravenoso y utilizar posteriormente valganciclovir oral (900 mg/día), hasta un máximo de 3 meses.
Los pacientes que reciban inducción con OKT3 durante períodos prolongados o que los necesiten por un rechazo corticorresistente deben recibir ganciclovir intravenoso (5 mg/kg/día) durante, al menos, 14 días (BI).
En pacientes R+ no existe una pauta ideal de prevención. Se recomienda la monitorización secuencial cuantitativa de CMV en pacientes que no reciban profilaxis. Si la monitorización resulta positiva se recomienda la utilización de ganciclovir intravenoso, a dosis de 5 mg/kg/12 h, durante 2 semanas (BII), aunque se podrían valorar pautas con valganciclovir oral (BII). Se recomienda descartar la presencia de hipogammaglobulinemia, sobre todo en pacientes con enfermedad por CMV recidivante (BIII).
Trasplantes de pulmón, corazón-pulmón, páncreas-riñón e intestino
Como consecuencia de su riqueza en tejido linfoide y la elevada inmunosupresión a que son sometidos estos pacientes, la importancia y repercusión de CMV en estos tipos de trasplante es cualitativamente superior a la del resto. Por ello, suelen tener más implantación en estos pacientes las medidas profilácticas universales frente a CMV.
Trasplante pulmón
Profilaxis. La incidencia de infección y enfermedad por CMV siguen siendo muy elevadas, con porcentajes cercanos al 60 y al 40%, respectivamente 67. Es difícil realizar recomendaciones en este tipo de trasplante puesto que la mayoría de estudios son de cohorte y no existen estudios aleatorizados, bien controlados. En general, estos estudios demuestran que la profilaxis con ganciclovir intravenoso retrasa la aparición de la enfermedad por CMV pero no la evita, observándose enfermedad por CMV tardía (hasta 2 años), incluso tras profilaxis mantenidas durante los primeros 6 meses postrasplante 68,69. Algunos estudios con ganciclovir oral (3 g/día) han mostrado una incidencia de enfermedad similar a la formulación intravenosa, aunque con una mayor viremia de brecha y mayor frecuencia de resistencia 70. Por el contrario, un estudio realizado en el Hospital Vall d'Hebron de Barcelona confirmó una incidencia de enfermedad por CMV superior en los pacientes en los que se utilizó ganciclovir oral, siendo el ganciclovir intravenoso un factor protector frente a la enfermedad por CMV en el estudio multivariado de factores de riesgo 71.
La excelente biodisponibilidad de valganciclovir permite obviar la necesidad de utilizar la vía intravenosa durante períodos largos de tiempo, manteniendo concentraciones plasmáticas elevadas después de su administración oral. Zamora et al 72 determinaron la seguridad y eficacia de valganciclovir en receptores de un trasplante de pulmón. Noventa receptores de un trasplante de pulmón que sobrevivían más de 30 días recibieron gammaglobulina anti-CMV asociada a ganciclovir intravenoso y, cuando se iniciaba la ingesta oral, valganciclovir 450 mg/12 h hasta completar 180, 270 o 365 días, respectivamente, como profilaxis. Posteriormente los pacientes fueron controlados y tratados al diagnosticarse una infección significativa. Los resultados se compararon con un grupo histórico (140 pacientes) que recibieron dosis alta de aciclovir después de ganciclovir intravenoso más gammaglobulina anti-CMV. La enfermedad por CMV fue significativamente menor en el grupo con valganciclovir (2,2% frente a 20%; p < 0,01). No se observaron diferencias al prolongar más de 180 días la duración de la profilaxis.
Aunque hay algún estudio de la década de los noventa que parece demostrar que la gammaglobulina anti-CMV administrada en solitario disminuye la incidencia de enfermedad por CMV 73,74, un estudio reciente demuestra que no disminuye ni la neumonitis ni la viremia cuando se administra en solitario 75. No obstante, estudios recientes parecen demostrar que la combinación de gammaglobulina anti-CMV con ganciclovir intravenoso, disminuye la incidencia de enfermedad por CMV. Valantine et al 40 demostraron una menor incidencia de enfermedad por CMV, rechazo agudo y evolución a rechazo crónico a los 12 y 24 meses en aquellos pacientes en los que se usó la combinación en comparación con los que se administró ganciclovir en solitario. Otros estudios, con controles históricos, también han comunicado resultados favorables con la combinación 76. Estos resultados podrían corresponder a la alta incidencia de situaciones de riesgo de infección primaria (D+/R) en Estados Unidos, que es diferente a lo que sucede en nuestro medio.
Tratamiento anticipado. Diferentes estudios parecen demostrar que esta estrategia puede ser válida en el trasplante de pulmón de forma secuencial a la utilización inicial de profilaxis universal. Si bien estos están realizados en una población muy pequeña de trasplantados y es difícil tomarlos como definitivos 77,78. En el trasplante de pulmón el seguimiento debe realizarse durante un tiempo muy prolongado; algunos pacientes no siguen los controles oportunos y, en estos, el tratamiento anticipado puede ser un riesgo para el desarrollo de neumonitis 78.
Recomendaciones en el trasplante de pulmón. La profilaxis universal constituye la mejor estrategia para la prevención de la enfermedad por CMV en los receptores de trasplante de pulmón (BII). Se recomienda ganciclovir intravenoso en dosis de 5 mg/kg/12 h hasta que se tolere la vía oral, y después un cambio a valganciclovir en dosis de 900 mg/día hasta un máximo de 3 meses después del trasplante (BII). La utilización de gammaglobulina intravenosa, siempre en asociación con ganciclovir por la misma vía, puede constituir un beneficio en pacientes de alto riesgo (CII).
A partir de este momento se recomienda iniciar monitorización de antigenemia o carga viral por PCR y tratamiento anticipado con ganciclovir intravenoso (5 mg/kg/12 h) o valganciclovir (900 mg/12 h) en caso de infección significativa (CII). La monitorización debería ser semanal al menos hasta el sexto mes, y posteriormente en cada visita médica hasta el segundo año postrasplante. El tratamiento anticipado se realizará cuando exista replicación significativa. En situación D+/R o en pacientes sobreinmunodeprimidos se podrá valorar la posibilidad de tratamiento anticipado siempre que exista evidencia de replicación viral (CIII).
La duración del tratamiento anticipado no se ha establecido, pero es recomendable una duración no inferior a 15 días.
Trasplante páncreas-riñón
En ausencia de profilaxis la incidencia de enfermedad por CMV en este tipo de trasplante oscila entre el 29-50%, siendo mayor como siempre en los casos de una combinación D+/R 79,80.
No se han realizado en el trasplante de páncreas estudios comparativos sobre la eficacia de diferentes estrategias de profilaxis. De hecho, la mayor parte de la información publicada describe la experiencia de grupos individuales con un número de pacientes reducido, en estudios no comparativos, y en los que a menudo se producen durante la realización del trabajo importantes modificaciones en el tratamiento inmunosupresor y en la misma profilaxis frente a CMV.
La experiencia en el Hospital 12 de Octubre de Madrid, tras 52 trasplantes de páncreas-riñón, es la siguiente (Dr. Lumbreras, comunicación personal). En los primeros 35 pacientes se utilizó ganciclovir intravenoso durante 3 semanas seguido de tratamiento anticipado con ganciclovir intravenoso en los R+ y de profilaxis con ganciclovir oral, hasta completar 3 meses, en la situación D+/R. En ese período la incidencia de enfermedad por CMV fue del 11% (4/35). Tras la aparición de valganciclovir, en un intento de unificar las profilaxis de riñón y páncreas/riñón y coincidiendo con una disminución de la intensidad de la inmunosupresión, se suprimió los 21 días iniciales de ganciclovir intravenoso y se administró valganciclovir como tratamiento anticipado en los R+, y profilaxis durante 3 meses en D+/R con el mismo fármaco. En los últimos 15 pacientes con esta estrategia la incidencia de enfermedad por CMV se ha incrementado al 33% (5/15).
Recomendaciones en el trasplante de páncreas-riñón. Administración universal de ganciclovir intravenoso, 5 mg/kg/12 h, o valganciclovir, 900 mg/12 h, con ajuste de acuerdo a la función renal, durante las primeras 3 semanas (CIII).
En los pacientes que hayan recibido más de 3 días de ATG u OKT3 o en la situación de D+/R se recomienda valganciclovir 900 mg/día durante 3 meses (CIII).
En el resto de los pacientes se hará tratamiento anticipado con valganciclovir tras la tercera semana postrasplante. El dintel de antigenemia o PCR será marcado en cada centro. En los pacientes que superen el dintel se administrará ganciclovir intravenoso, 5 mg/kg/12 h, o valganciclovir, 900 mg/12 h, ajustados a función renal, durante un mínimo de 2 semanas, con monitorización posterior (CIII).
Trasplante intestinal
El trasplante intestinal es uno de los trasplantes de órgano sólido más afectado por CMV, posiblemente como consecuencia de su riqueza en tejido linfoide. Además de la infección por CMV, en el trasplante intestinal es especialmente importante el control de la infección por virus de Epstein-Barr (VEB). Se estima que la incidencia de enfermedad linfoproliferativa en el trasplante intestinal es del 20% 82,83, mucho más elevada que la observada en otros trasplantes.
No existe ningún ensayo clínico ni protocolo terapéutico que evalúe la eficacia de las diferentes opciones de profilaxis en estos pacientes. La única evidencia científica es la derivada de la descripción de la experiencia publicada por los centros.
La mayoría de centros utiliza ganciclovir, 5 mg/kg/12 h, durante 2-3 semanas, y después el mantenimiento es variable, habitualmente con ganciclovir oral, 15 mg/kg/8 h, hasta mes +3 84 o +6 85.
La utilización de gammaglobulina anti-CMV es una práctica generalizada en todos los grupos de trasplante sin poder estimar suficientemente el peso de esta medida.
Se recomienda la monitorización periódica mediante PCR cuantitativa para ambos virus, CMV y VEB.
Recomendaciones en trasplante intestinal. Datos observacionales aconsejan la utilización universal de ganciclovir durante las primeras 2 o 3 semanas en dosis de 5 mg/kg/12 h, por vía intravenosa (CIII).
Posteriormente, si la funcionalidad del injerto lo permite, se recomienda proseguir la profilaxis con valganciclovir oral 900 mg/día durante un período no inferior a 3 meses. Las bajas tasas de infección conseguidas por los grupos que prolongan a 6 meses (experiencias con ganciclovir oral) pueden justificar su uso, al menos en pacientes de alto riesgo (D+/R o con utilización de anticuerpos antitimocíticos) (CIII).
Posteriormente, se recomienda la monitorización prospectiva de CMV y VEB mediante PCR (o antigenemia en CMV). Ante un resultado significativo de replicación en cualquiera de los dos virus se recomienda la administración de ganciclovir intravenoso (5 mg/kg/12 h) o valganciclovir (900 mg/12 h) hasta la negativización (CIII). La monitorización debería ser semanal al menos hasta el sexto mes, y posteriormente en cada visita médica hasta el segundo año postrasplante.
La utilización de gammaglobulina específica anti-CMV es generalizada en los grupos de trasplante intestinal, en dosis de 150 mg/kg, en semanas 0, 2, 4, 6 y 8, seguido de 100 mg/kg en semanas 12 y 16. Aunque algunos grupos han demostrado reducción de la infección por CMV con la utilización de dosis muy elevadas de gammaglobulina es difícil estimar su impacto, dado que se ha realizado en combinación con otras medidas eficaces (CIII).
No es criterio de exclusión la utilización de injertos de donantes seropositivos para receptores seronegativos, aunque en trasplante intestinal no urgente se recomienda la utilización de donantes seronegativos para receptores seronegativos (CIII) (tabla 3).
Tratamiento de la enfermedad por CMV
Trasplante de progenitores hematopoyéticos
La enfermedad por CMV en particular la neumonitis sigue siendo causa de elevada morbimortalidad. Puede aparecer en cualquier momento después del TPH (en la actualidad, hasta en el 50% de los casos después del día 100 después del TPH). La enfermedad por CMV es rara después del TPH autólogo, pero si ocurre se asocia a una elevada morbimortalidad. De hecho, el desarrollo de la enfermedad por CMV se debe considerar como un fracaso de la estrategia de prevención.
Pautas de elección
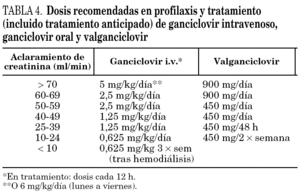
No existen estudios controlados del tratamiento de la enfermedad por CMV. Sin embargo, la pauta terapéutica establecida para la neumonía por CMV es la combinación de ganciclovir intravenoso en dosis de 5 mg/kg cada 12 h y altas dosis de gammaglobulinas inespecíficas por vía intravenosa (500 mg/kg/día a días alternos-total 7 a 10 dosis) (BII) 86. No existe evidencia de que la denominada gammaglobulina hiperinmunitaria CMV sea superior a la inespecífica y en cambio es considerablemente más cara. Tampoco existe evidencia que para las demás localizaciones de enfermedad por CMV la adición de las gammaglobulinas inespecíficas al tratamiento antiviral sea eficaz (BII). Aunque no esté bien contrastado en la literatura médica, parece lógico que en pacientes con pancitopenia se pueda sustituir el ganciclovir por foscarnet a dosis de 60 mg/kg/8 h o 90 mg/kg/12 h. La duración del tratamiento tampoco está establecida pero la mayoría de autores recomiendan de 21 a 28 días para el tratamiento de inducción seguido de tratamiento de mantenimiento (ganciclovir 5 mg/kg/día + gammaglobulina 500 mg/kg/día semanal) durante otras 4 semanas (tabla 4).
Pautas alternativas
Como tratamiento de segunda línea se recomienda, o bien cidofovir (de 3 a 5 mg/kg a la semana junto a probenecid e hidratación abundante) 87, o la combinación de ganciclovir y foscarnet (cada uno de ellos a dosis plenas) (BII). No se debería emplear la combinación de foscarnet y cidofovir por el alto riesgo de nefrotoxicidad grave.
Otras pautas
El fomivirsen es un fármaco activo frente a CMV resistentes al ganciclovir, foscarnet o cidofovir. El fomivirsen está disponible para el tratamiento intravítreo de retinitis del sida. Se aprobó por la Food and Drug Administration (FDA) en agosto de 1998 para esta indicación 88.
Trasplante de órgano sólido
Pautas de elección
Ganciclovir intravenoso. No existen estudios controlados. No obstante, debido a su buena respuesta constituye el tratamiento de elección, a dosis de 5 mg/kg cada 12 h (ajustado a la función renal) 89,90 (A-II).
Foscarnet. Recomendado en pacientes con clínica persistente a pesar de tratamiento con ganciclovir, aparición de sintomatología en paciente bajo profilaxis de larga duración con ganciclovir o valganciclovir y en pacientes que por presentar leucopenia grave no se pueda utilizar ganciclovir. Se administra a dosis de 60 mg/kg cada 8 h o bien 90 mg/kg/12 h (BII) 89.
Valganciclovir oral. A pesar de que se ha demostrado la eficacia de valganciclovir en el tratamiento de la retinitis por CMV en el paciente con infección por VIH 91, no existen estudios clínicos aleatorios publicados en los que se compruebe su eficacia en el tratamiento de enfermedad por CMV en trasplantados. Un estudio sobre 21 pacientes trasplantados renales con signos de enfermedad por CMV (síndrome viral), recibieron valganciclovir oral a dosis ajustadas a su función renal hasta la resolución de la antigenemia. La evolución fue satisfactoria y no hubo recidiva 92 (B-II). En pacientes con trasplante hepático, se ha evaluado la farmacocinética del valganciclovir. Una dosis de 900 mg de valganciclovir oral es equiparable (área bajo la curva a una dosis de 5 mg/kg de ganciclovir intravenoso.
Pautas alternativas
Cidofovir. No existen datos en pacientes con trasplante de órgano sólido. Los estudios de eficacia clínica están relacionados con retinitis en pacientes con infección por el VIH y enfermedad por CMV en trasplante de progenitores hematopoyéticos 93,87. Este último estudio incluye pacientes con tratamiento previo con ganciclovir y/o foscarnet y enfermedad por CMV. La dosis utilizada fue de 1 a 5 mg/kg semanal. Aun así, lo más habitual es de 3-5 mg/kg. Todos los pacientes recibieron probenecid e hidratación. La mitad de los 20 pacientes respondieron favorablemente y una tercera parte presentó algún tipo de toxicidad. Se considera fármaco de segunda línea en pacientes en los que ha fallado el tratamiento con los otros fármacos (BII).
Otras pautas
Leflunomida. Fármaco inmunosupresor con actividad frente al CMV que entre sus propiedades destaca que puede administrarse por vía oral y que es de bajo coste. La experiencia clínica es escasa. Cuatro pacientes con trasplante renal en la India, recibieron el fármaco durante 3 meses, con resultados favorables 94 (BIII).
Otros antivirales en estudio
Benzimidazol 95, adefovir 96, lobucavir 97y maribavir 98. No existen en la actualidad estudios clínicos. Otros fármacos como CMV423, tomeglovir y formulaciones orales de cidofovir están en desarrollo preclínico.
Asociación de fármacos
Ganciclovir más foscarnet. Existen estudios en el que se demuestra la sinergia in vitro99. Sin embargo, su asociación desde el punto de vista clínico en casos en los que no se ha demostrado resistencia no aporta ventajas al tratamiento con monoterapia. Un estudio prospectivo y aleatorio compara a pacientes trasplantados de médula ósea y órgano sólido el tratamiento anticipado con ganciclovir a dosis habituales con la asociación de ganciclovir y foscarnet de mitad dosis. La asociación no es superior a la monoterapia con ganciclovir en cuanto al descenso significativo de la carga viral, y además comporta una mayor toxicidad 24 (DI). Sin embargo, otros estudios en los que se comprueba resistencia a ganciclovir demuestran buena respuesta a la asociación de ambos fármacos 100.
Resistencia a ganciclovir. Problema emergente, en particular en trasplantados de páncreas-riñón y de pulmón y en pacientes con factor de riesgo de infección primaria (receptor seronegativo con donante seropositivo) que han recibido profilaxis con ganciclovir oral durante tiempo prolongado, en ocasiones con niveles subterapéuticos. La incidencia de cepas de CMV resistentes al ganciclovir no es conocida, aunque se han identificado hasta el 5% en trasplantados de pulmón 101.
La asociación de ganciclovir y foscarnet es sinérgica in vitro frente a CMV con cepas resistentes a ganciclovir 100,102. Clínicamente, en casos de resistencia, la asociación de ambos fármacos ha resultado eficaz en trasplantes de órgano sólido 100 (BII).
El mecanismo de resistencia a ganciclovir puede deberse a mutación en el gen UL97, UL54 o ambos. La mutación en UL54 puede condicionar resistencia a otros fármacos como cidofovir o foscarnet. En caso de resistencia a ganciclovir y foscarnet, se recomienda administrar cidofovir 87. Sin embargo, la aparición de alta resistencia al ganciclovir (ID50 ≥ 30 μM) conferida por alteraciones del gen de la polimerasa, se asocia a resistencia cruzada al cidofovir 103. En caso de resistencia a los tres fármacos debe plantearse otros tratamientos o estrategias de combinación 88,94.
Duración del tratamiento. La duración óptima del tratamiento antiviral no está bien establecida, lo que comporta un riesgo de recurrencias. La recomendación del tratamiento de inducción en los pacientes con trasplante de progenitores hematopoyéticos es de 21 a 28 días 21. Aunque no existe una correlación entre la evolución clínica y la respuesta antiviral mediante la monitorización de la antigenemia pp-65 o la PCR, sí que se han comprobado disminuciones significativas de carga viral durante el tratamiento con ganciclovir 104.
*Todos los autores de este documento pertenecen a RESITRA (Red de Estudio de Infección en el Trasplante).