La infección de prótesis articular (IPA) es una complicación con graves repercusiones cuyo principal agente responsable en la mayoría de los casos es Staphylococcus aureus. El propósito del presente estudio es evaluar si la descolonización de los pacientes portadores de S.aureus a los que se indica una prótesis articular consigue una disminución en la incidencia de IPA por S.aureus.
Material y métodosEstudio de intervención antes-después en el que se comparó la incidencia de IPA en pacientes bajo cirugía de prótesis articular de rodilla o cadera entre enero y diciembre de 2011 a los que se realizó estudio de detección de colonización nasal por S.aureus y erradicación si procedía, con un protocolo de mupirocina intranasal y ducha con clorhexidina, con respecto a una serie histórica de pacientes intervenidos entre enero y diciembre de 2010.
ResultadosEn el período de control se realizaron 393 artroplastias en 391 pacientes. En el período de intervención se implantaron 416 prótesis en 416 pacientes. Se realizó estudio de colonización a 382 pacientes (91,8%), de los que 102 fueron positivos (26,7%) y se trataron según el protocolo. Se produjeron 2 casos de IPA por S.aureus frente a 9 en el año control (0,5% vs 2,3%, odds ratio [OR]: 0,2, intervalo de confianza [IC] del 95%: 0,4 a 2,3, p=0,04).
ConclusiónEn nuestro estudio la aplicación de un protocolo de detección de colonización/ erradicación de S.aureus consiguió un descenso significativo de la incidencia de IPA por S.aureus respecto a un control histórico.
Prosthetic joint infection (PJI) is a complication with serious repercussions and its main cause is Staphylococcus aureus. The purpose of this study is to determine whether decolonization of S.aureus carriers helps to reduce the incidence of PJI by S.aureus.
Material and methodsAn S.aureus screening test was performed on nasal carriers in patients undergoing knee or hip arthroplasty between January and December 2011. Patients with a positive test were treated with intranasal mupirocin and chlorhexidine soap 5days. The incidence of PJI was compared with patients undergoing the same surgery between January and December 2010.
ResultsA total of 393 joint replacements were performed in 391 patients from the control group, with 416 joint replacements being performed in the intervention group. Colonization study was performed in 382 patients (91.8%), of which 102 were positive (26.7%) and treated. There was 2 PJI due S.aureus compared with 9 in the control group (0.5% vs 2.3%, odds ratio [OR]: 0.2, 95% confidence interval [CI]: 0.4 to 2.3, P=.04).
ConclusionsIn our study, the detection of colonization and eradication of S.aureus carriers achieved a significant decrease in PJI due to S.aureus compared to a historical group.
La infección de un dispositivo implantable es consecuencia directa del progreso médico. La mejora de las técnicas anestésicas y quirúrgicas ha generalizado multitud de procedimientos que cada vez se realizan a un mayor número de personas y de mayor edad. Las prótesis articulares han supuesto una importante mejora en la capacidad funcional de los pacientes con artropatía. En España se calcula que se implantan alrededor de 300.000 prótesis anuales1, y solo en Estados Unidos se estima que en 2030 se implantarán cerca de 4,5 millones de prótesis de cadera y rodilla, triplicando las actuales de cadera y multiplicando por 7-8 las de rodilla2. Las mejoras en las técnicas de antisepsia no han sido suficientes para compensar el hecho de que, a pesar de disminuir porcentualmente los casos de infección derivados de la misma, se haya incrementado el número absoluto de casos3, por lo que se precisan nuevas medidas para atenuar este efecto. La infección de prótesis articular (IPA) tiene efectos catastróficos sobre el paciente, pero también sobre el sistema sanitario, porque precisa de reingresos hospitalarios, largos cursos antibióticos, repetidas cirugías y en algunos casos la pérdida de la prótesis1. En la pasada década se ha producido un aumento del 63% de hospitalizaciones en Estados Unidos por esta causa4.
La IPA es en la mayoría de los casos una infección de herida quirúrgica, pues es más frecuente en los 12 primeros meses tras su implantación5. La infección de la herida quirúrgica es la tercera infección nosocomial más frecuente, y Staphylococcus aureus es su principal agente causal6 y también de la IPA, especialmente de la que se manifiesta en el período más precoz1,7. Se ha demostrado que la colonización nasal por S.aureus es el principal factor de riesgo para la infección de la herida quirúrgica en cirugía ortopédica8-10 y que la descolonización con mupirocina nasal y baños de clorhexidina disminuye las infecciones provocadas por este en la infección nosocomial en general y quirúrgica en particular11.
En el presente trabajo analizamos la incidencia de IPA por S.aureus después de iniciar un protocolo de detección de colonización nasal de S.aureus y erradicación de los mismos, con baños de clorhexidina y mupirocina intranasal.
Material y métodosRealizamos un estudio de intervención antes-después con los pacientes del Hospital Universitario Príncipe de Asturias de Alcalá de Henares (Madrid) a los que se implantó una prótesis articular de cadera o de rodilla, incluyendo totales y parciales, primarias y recambios, electivas y urgentes (por fractura de cadera) desde el 1 de enero al 31 de diciembre de 2011. Se estableció como comparador el grupo de pacientes que se sometieron a la misma intervención entre el 1 de enero y el 31 de diciembre de 2010.
Los pacientes siguieron revisiones en consulta de policlínica durante al menos 12meses.
Se usaron como criterios diagnósticos de IPA: recuento leucocitario intraarticular mayor de 1.700/ml en rodilla o 4.200/ml en cadera, líquido sinovial o periprotésico purulento, número de leucocitos en biopsia de sinovial superior a 5 por campo de gran aumento, presencia de fístula intraarticular o aislamiento en 2 o más muestras de un microorganismo (una sola si es S.aureus)1. Se incluyeron como casos aquellos que desarrollaron IPA en los 12 primeros meses tras la cirugía, con al menos un aislamiento microbiológico de S.aureus. Se excluyeron del análisis estadístico los pacientes que fallecieron antes de completar el período de seguimiento, salvo que fuera debido a una IPA.
Para determinar que ambos grupos eran comparables se registraron los datos que se han demostrado relacionados con la incidencia de IPA: edad12, presencia de diabetes mellitus (DM)13 o artropatía inflamatoria1, la comorbilidad medida según el índice de Charlson14, el riesgo anestésico mediante el índice ASA12,15, la duración de la cirugía15, el riesgo de infección mediante el índice NNIS16, el tipo de indicación de la cirugía si era electiva o no (por fractura de cadera)12, los casos de prótesis primaria o recambio15, el número de transfusiones17, los días de cateterización urinaria1 o la incidencia de infección urinaria postoperatoria16,17. Se registraron, en los casos que desarrollaron IPA, además, el agente causal.
Protocolo de intervenciónA los pacientes del grupo de intervención con indicación electiva de artroplastia se les realizó, tras ser incluidos en la lista de espera quirúrgica, un estudio de detección de colonización nasal de S.aureus mediante cultivo de exudado nasofaríngeo. Los pacientes dieron su consentimiento informado para la realización del test y el tratamiento si correspondía.
Las torundas nasales fueron inoculadas en el medio de cultivo selectivo agar manitol salado (Oxoid, S.A.), incubándose durante 48h. Las colonias con aspecto característico se mantuvieron a −40°C para posibles posteriores estudios. A las colonias con aspecto sospechoso se les realizo pruebas adicionales (DNASA; espectofotometría de masas) para su identificación definitiva. Las pruebas de sensibilidad a mupirocina se realizaron por el método de microdilución con los paneles comerciales «PM28» (Siemens), siguiendo las normas de interpretación del European Committee of Antimicrobial Susceptibility Testing (EUCAST)18. No se realizó antibiograma para comprobar la sensibilidad a meticilina.
Los pacientes con resultado positivo fueron tratados con un protocolo de mupirocina tópica intranasal 2 veces al día y ducha con clorhexidina jabonosa diaria, ambos durante 5días. Al finalizar el tratamiento se tomó una nueva muestra para comprobar la erradicación.
Los pacientes con indicación urgente de prótesis articular son, casi en la totalidad de los casos, pacientes con fractura subcapital de cadera que son ingresados por vía urgente y posteriormente se programan para la cirugía, generalmente a las 24-72h del ingreso, si no existe contraindicación. A estos pacientes se les tomaba la muestra el primer día del ingreso, y si el resultado era positivo se realizaba el mismo tratamiento anteriormente mencionado. Tras finalizar este, también se repetía el test para comprobar la erradicación.
Todos los pacientes, tanto del grupo de intervención como de control, siguieron el protocolo estándar de prevención de IPA recomendada por la Asociación Americana de Cirujanos Ortopédicos con profilaxis antibiótica preoperatoria con cefazolina o vancomicina en caso de alergia a betalactámicos19.
Análisis estadísticoLa descripción de las variables cuantitativas se realizó con la media y su intervalo de confianza (IC) del 95%. Las variables categóricas las describimos con el porcentaje y su IC95%. Las diferencias de medias las analizamos mediante la t de Student, y el análisis de las variables categóricas mediante el cálculo de odds ratio (OR). La significación estadística se estableció en p<0,05. Todos los cálculos se realizaron con el paquete estadístico SPSS 15.0 (Chicago, EE.UU.).
ResultadosEn el período de estudio se realizaron un total de 809 artroplastias en 807 pacientes con una edad media de 71,6años (IC95%: 70,3-72,9), de los que 503 fueron mujeres (61,2%). Se excluyeron del análisis 16 casos porque fallecieron antes de completar el período de estudio, por una causa diferente a IPA.
En el grupo control se incluyeron 393 cirugías de artroplastia en 391 pacientes. Fallecieron antes de completar el período de seguimiento 9 pacientes (2,3%). Del resto de casos (384) desarrollaron IPA 19, lo que supone una incidencia del 4,9%, de los cuales en 9 (47%) estaba implicado S.aureus.
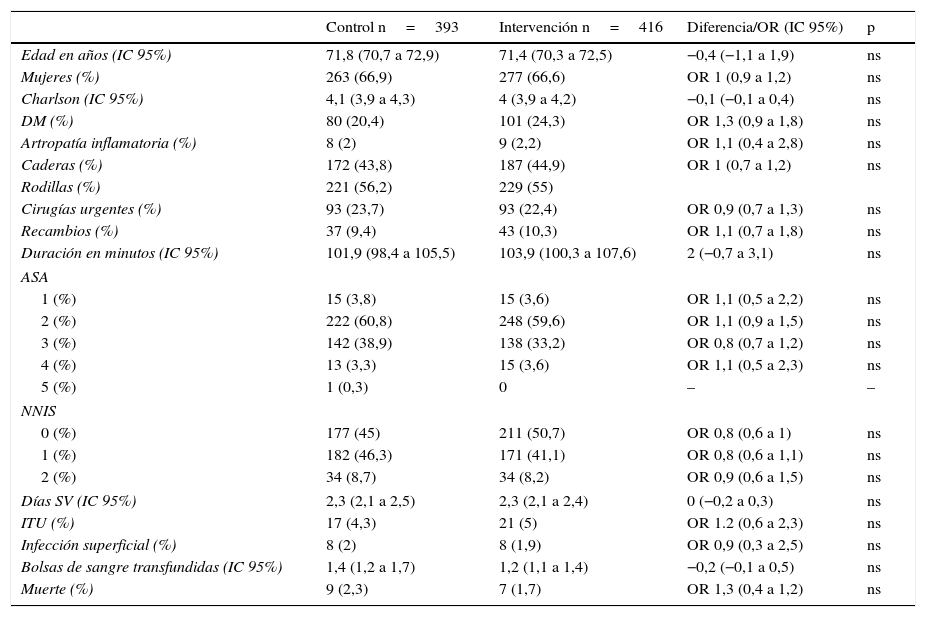
En el año grupo de intervención se realizaron 416 artroplastias en 416 pacientes. En la tabla 1 se describen las características de los pacientes comparados con el grupo control.
Datos comparativos de los pacientes del grupo control e intervención
| Control n=393 | Intervención n=416 | Diferencia/OR (IC 95%) | p | |
|---|---|---|---|---|
| Edad en años (IC 95%) | 71,8 (70,7 a 72,9) | 71,4 (70,3 a 72,5) | −0,4 (−1,1 a 1,9) | ns |
| Mujeres (%) | 263 (66,9) | 277 (66,6) | OR 1 (0,9 a 1,2) | ns |
| Charlson (IC 95%) | 4,1 (3,9 a 4,3) | 4 (3,9 a 4,2) | −0,1 (−0,1 a 0,4) | ns |
| DM (%) | 80 (20,4) | 101 (24,3) | OR 1,3 (0,9 a 1,8) | ns |
| Artropatía inflamatoria (%) | 8 (2) | 9 (2,2) | OR 1,1 (0,4 a 2,8) | ns |
| Caderas (%) | 172 (43,8) | 187 (44,9) | OR 1 (0,7 a 1,2) | ns |
| Rodillas (%) | 221 (56,2) | 229 (55) | ||
| Cirugías urgentes (%) | 93 (23,7) | 93 (22,4) | OR 0,9 (0,7 a 1,3) | ns |
| Recambios (%) | 37 (9,4) | 43 (10,3) | OR 1,1 (0,7 a 1,8) | ns |
| Duración en minutos (IC 95%) | 101,9 (98,4 a 105,5) | 103,9 (100,3 a 107,6) | 2 (−0,7 a 3,1) | ns |
| ASA | ||||
| 1 (%) | 15 (3,8) | 15 (3,6) | OR 1,1 (0,5 a 2,2) | ns |
| 2 (%) | 222 (60,8) | 248 (59,6) | OR 1,1 (0,9 a 1,5) | ns |
| 3 (%) | 142 (38,9) | 138 (33,2) | OR 0,8 (0,7 a 1,2) | ns |
| 4 (%) | 13 (3,3) | 15 (3,6) | OR 1,1 (0,5 a 2,3) | ns |
| 5 (%) | 1 (0,3) | 0 | – | – |
| NNIS | ||||
| 0 (%) | 177 (45) | 211 (50,7) | OR 0,8 (0,6 a 1) | ns |
| 1 (%) | 182 (46,3) | 171 (41,1) | OR 0,8 (0,6 a 1,1) | ns |
| 2 (%) | 34 (8,7) | 34 (8,2) | OR 0,9 (0,6 a 1,5) | ns |
| Días SV (IC 95%) | 2,3 (2,1 a 2,5) | 2,3 (2,1 a 2,4) | 0 (−0,2 a 0,3) | ns |
| ITU (%) | 17 (4,3) | 21 (5) | OR 1.2 (0,6 a 2,3) | ns |
| Infección superficial (%) | 8 (2) | 8 (1,9) | OR 0,9 (0,3 a 2,5) | ns |
| Bolsas de sangre transfundidas (IC 95%) | 1,4 (1,2 a 1,7) | 1,2 (1,1 a 1,4) | −0,2 (−0,1 a 0,5) | ns |
| Muerte (%) | 9 (2,3) | 7 (1,7) | OR 1,3 (0,4 a 1,2) | ns |
ASA: Asociación Americana de Anestesiología; DM: diabetes mellitus; IC: intervalo de confianza; ITU: infección del tracto urinario, NNIS: sistema nacional de vigilancia de infecciones hospitalarias de EE.UU.; ns: no significativo; OR: odds ratio; SV: sonda vesical.
Se realizó el test de detección de colonización nasal de S.aureus a 382 pacientes (91,8%). Al resto no se les hizo, bien porque no acudieron a la cita en el caso de cirugías electivas o, en el caso de las cirugías urgentes, porque se les intervino el mismo día que ingresaron y no hubo tiempo de realizar el test.
Tuvieron un resultado positivo 102 pacientes (26,7%). Recibieron tratamiento 100 pacientes (98%). En los otros 2 casos, un paciente falleció antes de conocer el resultado y otro fue dado de alta antes de disponer del mismo.
Los 100 pacientes restantes recibieron el tratamiento según el protocolo. No se produjeron efectos adversos significativos y el 100% de pacientes cumplió el tratamiento. No se consiguió la erradicación en 2casos, en los que se testó la sensibilidad a mupirocina. En uno de ellos la cepa mantenía la sensibilidad en las 2muestras. Se realizó otro ciclo de tratamiento con información más detallada de la forma de administración con erradicación definitiva. En el otro caso la primera muestra era sensible, mientras que la segunda fue resistente.
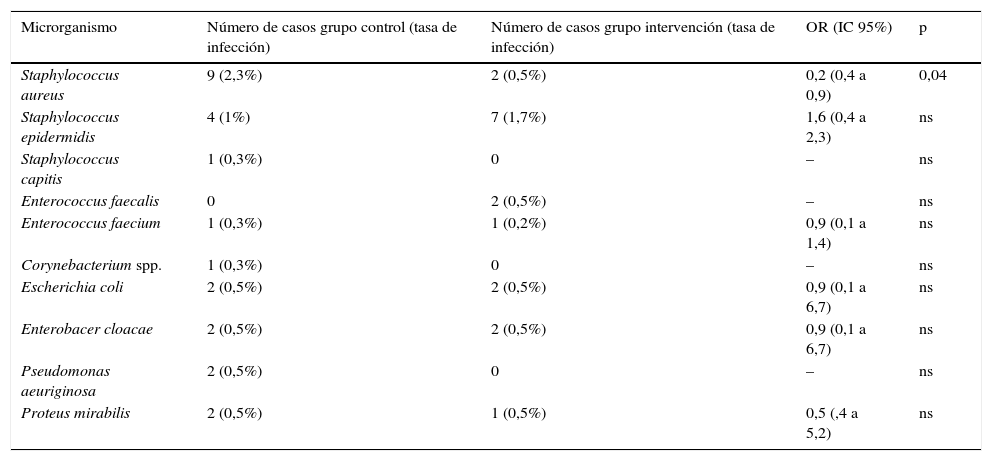
De los pacientes que completaron el período de seguimiento del grupo del año de intervención (409) se produjeron 12 casos de IPA, lo cual representa una incidencia del 2,9%, frente a la del 4,9% del grupo control (OR: 0,6; IC95%: 0,3-1,2; p=0,1). En 2 casos estaba implicado S.aureus, uno sensible a la meticilina (que había tenido test de colonización negativo) y otro resistente a la meticilina (este paciente había sufrido una IPA previa por el mismo agente y la nueva prótesis también se le infectó, a pesar de haber sido tratado con antibióticos y descolonizado eficazmente antes de la cirugía). En la tabla 2 se muestra la etiología de los casos comparada con la del grupo control.
Comparación de agentes causales de IPA entre el grupo control con respecto al grupo de intervención
| Microrganismo | Número de casos grupo control (tasa de infección) | Número de casos grupo intervención (tasa de infección) | OR (IC 95%) | p |
|---|---|---|---|---|
| Staphylococcus aureus | 9 (2,3%) | 2 (0,5%) | 0,2 (0,4 a 0,9) | 0,04 |
| Staphylococcus epidermidis | 4 (1%) | 7 (1,7%) | 1,6 (0,4 a 2,3) | ns |
| Staphylococcus capitis | 1 (0,3%) | 0 | – | ns |
| Enterococcus faecalis | 0 | 2 (0,5%) | – | ns |
| Enterococcus faecium | 1 (0,3%) | 1 (0,2%) | 0,9 (0,1 a 1,4) | ns |
| Corynebacterium spp. | 1 (0,3%) | 0 | – | ns |
| Escherichia coli | 2 (0,5%) | 2 (0,5%) | 0,9 (0,1 a 6,7) | ns |
| Enterobacer cloacae | 2 (0,5%) | 2 (0,5%) | 0,9 (0,1 a 6,7) | ns |
| Pseudomonas aeuriginosa | 2 (0,5%) | 0 | – | ns |
| Proteus mirabilis | 2 (0,5%) | 1 (0,5%) | 0,5 (,4 a 5,2) | ns |
IC: intervalo de confianza; IPA: infección de prótesis articular; ns: no significativo; OR: odds ratio; spp: especie.
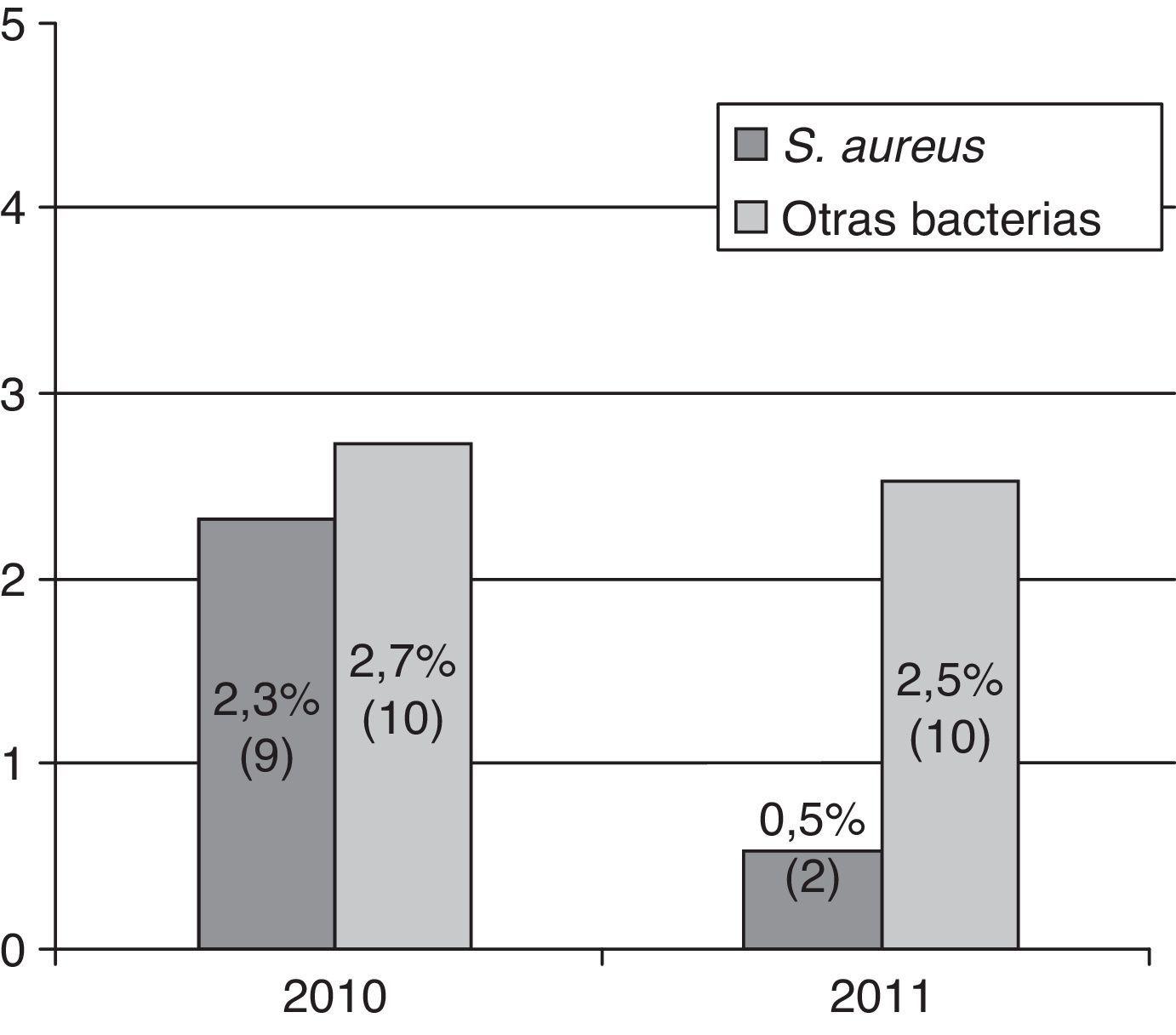
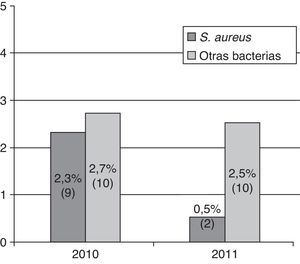
Mientras que la IPA por S.aureus descendió un 79% con respecto al grupo control, de manera estadísticamente significativa, la tasa de IPA por otras bacterias no presentó cambios estadísticamente significativos, ni cada una por separado, ni evaluada de forma global (OR: 0,9; IC95%: 0,4-2,3; p=0,9) (fig. 1).
El número de casos con aislamiento de S.aureus, con independencia del origen de la muestra, fue de 10 en el grupo control frente a 2 en el de intervención (2,6% vs 0,5%; OR: 0,2; IC95%: 0,04-0,8; p=0,03).
Entre los pacientes colonizados por S.aureus, y que recibieron tratamiento erradicador, la tasa de IPA no fue diferente de la los pacientes no colonizados (2% vs 2,9%; OR: 1,4; IC95%: 0,3-7; p=0,6).
DiscusiónEn nuestro estudio, la erradicación del estado de portador de S.aureus en pacientes con indicación de artroplastia condujo a una menor incidencia de IPA por el mismo, con respecto de un grupo histórico de similares características, con buena tolerabilidad, sin apreciarse un aumento significativo de infecciones por otros microrganismos diferentes. La tasa global de IPA también disminuyó, aunque no se alcanzó la significación estadística.
Existe una fuerte evidencia de que la colonización cutánea por S.aureus es un factor de riesgo muy importante para la infección de la herida quirúrgica por este8,9. También es un factor de riesgo para la infección estafilocócica en pacientes en diálisis crónica (tanto hemodiálisis20 como diálisis peritoneal)21 y fue donde primero se demostró que la erradicación del estado de portador disminuía esas infecciones22,23. Sin embargo, los primeros intentos de conseguir similares resultados para la infección de la herida quirúrgica con el uso de mupirocina intranasal fracasaron24. Es verdad que las fosas nasales son el principal reservorio de S.aureus, pero no el único10, por lo que si únicamente erradicamos dicho foco, el paciente probablemente continuará colonizado en otras localizaciones de su anatomía y persistirá en riesgo de infección.
Aunque algunos estudios se han centrado en la prevención de la infección por S.aureus resistente a meticilina, sin tampoco demostrar efectividad25, nosotros hemos incluido todos los pacientes colonizados por S.aureus, pues también la colonización por cepas sensibles a meticilina es factor de riesgo para la infección y, además, es más frecuente que la producida por cepas resistentes10,26. En ese sentido, un estudio reciente demuestra que la erradicación del estado de portador de S.aureus, sin distinguir entre cepas sensibles y resistentes a meticilina, en pacientes que ingresan en un hospital por cualquier causa, disminuye de forma estadísticamente significativa la tasa de infecciones por S.aureus, a expensas fundamentalmente de disminuir las infecciones de la herida quirúrgica11. Además, no parece haber diferencias en el pronóstico de las IPA producidas por S.aureus sensible a meticilina que por S.aureus resistente a meticilina27.
Por estos motivos, no se testó la sensibilidad a meticilina en los pacientes portadores, y es que, además, tampoco hay resistencia cruzada con mupirocina28, por lo que la detección de estas cepas no cambiaría el protocolo de descolonización.
No existen estudios específicos con respecto a la relación entre la IPA y el estado de portador de S.aureus, aunque en muchos de los estudios realizados sobre la incidencia de infección de herida quirúrgica se incluían pacientes con cirugías de artroplastia8. Se puede considerar que las formas agudas y retardadas son de adquisición nosocomial y se incluirían como infección de la herida quirúrgica. En la medida que estas se adquieren fundamentalmente en el momento perioperatorio5, solo en ellas debería existir relación de causalidad, aunque hasta la fecha este hecho no ha sido demostrado específicamente.
En nuestro estudio, la tasa de colonización de los pacientes fue del 26,7%, similar a las tasas comunicadas en estudios realizados en población general10,11. La tasa de erradicación del estado de portador nasal fue del 98%, superior a la notificada en otros estudios24,29.
Uno de los riesgos asociados al uso de antibióticos en profilaxis, cualquiera que sea su indicación, es seleccionar la flora bacteriana. En ese sentido, los pacientes colonizados por S.aureus que recibieron el tratamiento erradicador podrían tener mayor riesgo teórico de sufrir infecciones por otro microorganismo, como también ocurre en los pacientes en diálisis crónica30. Sin embargo, no hubo diferencias significativas en la tasa de infección por bacterias diferentes de S.aureus entre los pacientes que fueron descolonizados. En estudios similares en pacientes quirúrgicos tampoco se ha observado mayor incidencia de infecciones por otros microorganismos11. Es cierto que en el grupo de intervención Staphylococcus epidermidis desplaza a S.aureus como el agente causal más frecuente. Sin embargo, cuando se analiza la tasa de IPA por S.epidermidis esta no aumenta de manera estadísticamente significativa (1% vs 1,7%).
La limitación más importante de este estudio es que los pacientes no están aleatorizados y el grupo de control es una cohorte histórica, es decir, el estudio no es un ensayo clínico sino un estudio cuasiexperimental. Sin embargo, en el caso de este estudio las características de los pacientes tanto del grupo control como del de intervención son comparables, sobre todo en cuanto a los factores de riesgo conocidos de IPA.
Otra limitación derivada de no ser un ensayo clínico es que no hay enmascaramiento, lo que puede provocar un sesgo de observación en cuanto al recuento de casos de IPA. Y es que no existe un criterio específico definitivo definitorio de IPA sino un conjunto de criterios que carecen del 100% de sensibilidad y especificidad. Esto es particularmente importante porque la distinción entre infección superficial de herida quirúrgica e infección profunda en ocasiones puede ser difícil. En ese sentido, si buscamos un parámetro objetivo para evitar sesgos, como es el número total de aislamientos de S.aureus en las muestras microbiológicas que se recogieron en ambos grupos, por cualquier motivo, sin distinguir entre dehiscencia de sutura, toma rutinaria de cultivos si se producía una reintervención o infección de herida quirúrgica superficial o profunda (que a veces son difíciles de diferenciar), la diferencia se mantenía. En cualquier caso, a la luz de los resultados de los estudios ya publicados no parecería ético aleatorizar pacientes colonizados por S.aureus a no descolonizar.
En cuanto a los pacientes con cirugía electiva, existe el riesgo de la recolonización si la cirugía se demora excesivamente tras realizar el tratamiento. Sin embargo, ninguno de los pacientes que sufrió un retraso en la intervención desarrolló IPA. En cualquier caso, para evitar el problema de la recolonización, después de finalizar el período de estudio se ha modificado el protocolo. Al paciente colonizado se le entrega el tratamiento pero se le advierte que no lo aplique hasta que se le avise con la fecha de la cirugía (el aviso se hace con aproximadamente una semana de antelación para que pueda efectuarlo).
En cuanto a los pacientes con cirugía urgente, en algunos casos el resultado del test no estuvo disponible hasta después de la cirugía, por lo que se descolonizaron después de la misma. Ninguno de estos pacientes desarrolló IPA. Esto podría poner de manifiesto que el período postoperatorio también es importante en la patogenia de la IPA, aunque el bajo número de casos impide extraer conclusiones definitivas en este aspecto.
Siendo un estudio no controlado, pudieran existir factores no estudiados que influyeran en los resultados. ¿Se podría atribuir el descenso de los casos de IPA por S.aureus a otras medidas implementadas en esa fecha? Si las hubiere, estas deberían haber reducido tanto las IPA por S.aureus como por otros microorganismos, puesto que en el tiempo de la intervención no se realizó ninguna otra acción específica contra el primero (por ejemplo, la profilaxis antibiótica precirugía era igual). El número de casos de IPA por microorganismos diferentes a S.aureus se mantuvo exactamente igual en el grupo control que en el de intervención, por lo que no parecen existir otros factores para explicar este descenso.
El número absoluto de casos de IPA por S.aureus fue bajo en ambos grupos, y aunque se alcanza la significación estadística, esto también es una limitación del estudio. Tras la finalización de este, el protocolo se ha continuado en nuestro centro, manteniendo buenos resultados. En los próximos años, con mayor casuística, podremos ver si este efecto se confirma.
En conclusión, el estudio sugiere que la descolonización de los pacientes portadores de S.aureus podría ser una medida eficaz en disminuir la incidencia de IPA por el mismo. El tratamiento descolonizador con mupirocina intranasal y clorhexidina jabonosa es eficaz en conseguir la erradicación el estado de portador de S.aureus, con una baja tasa de fracasos, muy barato y no supone ningún riesgo para el paciente, ni en cuanto a efectos secundarios derivados del tratamiento ni en cuanto a posibilidad de sufrir infecciones por otros agentes infecciosos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.