Clostridium difficile ha puesto en alerta a los profesionales sanitarios en los últimos años por el incremento de su incidencia en Norteamérica y Europa. En brotes nosocomiales y en casos adquiridos en la comunidad, se ha identificado una cepa de C. difficile caracterizada como tipo toxinogénico III, ribotipo por PCR 027 (C. difficile 027), que tiene una patogenicidad mayor debido a la hiperproducción de exotoxinas y presenta un perfil de resistencia a antibióticos característico. En Europa, desde 2003, varios países han notificado casos de enfermedad asociada a C. difficile 027, lo que demuestra su rápida diseminación. En este artículo se revisan los últimos brotes asociados a C. difficile 027, que indican la necesidad de establecer un sistema de vigilancia homogéneo para la detección temprana y la toma de medidas de control que permitan disminuir la extensión de los brotes desde su inicio.
The incidence of Clostridium difficile infection in North America and Europe has increased in the last years, generating concern among health professionals. A new strain of C. difficile has been identified in recent nosocomial outbreaks and community-acquired infections. This new strain, characterized as toxigenic type III, PCR ribotype 027 (C. difficile 027), presents higher pathogenicity because of increased exotoxin production, and a characteristic antibiotic resistance profile. Since 2003, several European countries have notified cases of C. difficile 027-associated disease, a fact that demonstrates its rapid dissemination. In this article, we review the latest nosocomial outbreaks associated with this new strain, which illustrate the need for a standardized surveillance system for early detection and implementation of control measures aimed at reducing the spread of this microorganism.
Clostridium difficile es un microorganismo implicado con frecuencia en la aparición de colitis seudomembranosa en pacientes hospitalizados1–3, que ha puesto en alerta a la comunidad sanitaria debido al incremento de su detección en los últimos años. Este aumento del número de infecciones por C. difficile se atribuye, en gran medida, a la aparición de una nueva cepa hipervirulenta que se ha caracterizado como tipo toxinogénico III, ribotipo por PCR 027 (C. difficile 027). Esta cepa tiene una patogenicidad elevada, una capacidad de diseminación mayor y un perfil de resistencia a antibióticos característico, lo que le confiere un importante potencial epidémico en el ámbito hospitalario y en la comunidad4–6.
Desde el año 2001, se observa un aumento de la incidencia de casos de enfermedad por C. difficile 027 en Estados Unidos7–9, y en el año 2003 diferentes hospitales de Canadá experimentaron varios brotes nosocomiales de enfermedad asociada a este patógeno con una letalidad elevada10–13. En los últimos años, esta cepa se ha extendido por varios países europeos, y se han detectado brotes nosocomiales en el Reino Unido, los Países Bajos, Bélgica, Irlanda, Francia, Finlandia y Alemania14.
Desde que se detectó esta nueva cepa, las autoridades sanitarias europeas están en alerta debido a su mayor virulencia y capacidad de diseminación, como demuestra la rápida afectación de varios países europeos en pocos años. Se ha observado que el riesgo de transmisión hospitalaria está asociado al traslado de pacientes de un hospital a otro, de forma similar a lo ocurrido en brotes nosocomiales por Acinetobacter baumannii multirresistente15.
En España, hasta la fecha no se han notificado brotes nosocomiales o casos esporádicos causados por C. difficile 027. A nivel nacional, no hay un sistema de vigilancia establecido con carácter obligatorio para la notificación de los casos de enfermedad por C. difficile. La información sobre la infección por C. difficile se obtiene del Sistema de Información Microbiológica y de la declaración de brotes a la Red Nacional de Vigilancia Epidemiológica, además del Conjunto Mínimo Básico de Datos y de los artículos científicos publicados.
Para realizar esta revisión, se ha llevado a cabo una búsqueda bibliográfica en PubMed (1997–2007), en las páginas web de los principales organismos internacionales y sus publicaciones periódicas, así como en las páginas web de las instituciones de salud pública de diferentes países. Las palabras clave utilizadas fueron “Clostridium difficile”, “C. difficile-associated disease”, “enfermedad asociada a Clostridium difficile” y “PCR ribotype 027”.
Características microbiológicas del C. difficile 027C. difficile es un bacilo grampositivo, anaerobio estricto y formador de esporas. Se encuentra con frecuencia en el ambiente y como parte de la flora intestinal normal en un 3% de la población humana adulta16. También se puede encontrar en el tracto intestinal de otros mamíferos, ganado porcino y ganado equino, fundamentalmente, y también en aves17. C. difficile se ha aislado de alimentos derivados de animales domésticos, lo que indica la posibilidad de transmisión alimentaria18.
Las características clínicas de la infección se deben a la producción de toxinas extracelulares secretadas en el colon durante el crecimiento bacteriano. La mayoría de las cepas toxigénicas producen 2 toxinas: una enterotoxina A (TcdA) y una citotoxina B (TcdB), y una pequeña cantidad de cepas patógenas producen una TcdA truncada, no funcional, junto con TcdB normal (Tcd A- TcdB+). Los genes que codifican para la producción de estas toxinas se localizan en el locus genómico de patogenicidad (PaLoc), de 19kb, cuya expresión está regulada por un circuito en el que se encuentran implicados tcdC y tcdR19. También se ha identificado una tercera toxina, la toxina binaria de C. difficile, que puede estar presente en un 4% de los aislamientos de C. difficile y cuya función es independiente de los elementos regulatorios asociados a PaLoc20,21.
La cepa hipervirulenta que ha aparecido en los brotes notificados en Norteamérica y Europa se ha caracterizado como toxinotipo III, ribotipo por PCR 027, NAP1, REA B1 y resistente a algunas fluoroquinolonas (C. difficile 027)4. NAP (tipo de patrón de electroforesis en campos pulsados) y REA (análisis de restricción enzimática) son los métodos más utilizados en Norteamérica para la caracterización de cepas de C. difficile. Esta cepa es hiperproductora de toxinas debido a una delección en el gen regulador de la toxina tcdC, que ocasiona un incremento en la producción de toxinas A y B de 16 a 20 veces superior a las cepas sin la delección. Esta cepa libera toxinas fundamentalmente en la fase de crecimiento logarítmica, a diferencia de las cepas sin la mencionada delección que lo hacen en la fase estacionaria22,23.
Enfermedad asociada a C. difficileLa enfermedad asociada a C. difficile (EACD) incluye síntomas de diversa gravedad, que van desde la diarrea leve a la inflamación grave del intestino (colitis hemorrágica, seudomembranosa, necrotizante)24,25, con una mortalidad alta en los grupos de más riesgo, como inmunodeprimidos y mayores de 65 años26. La colitis fulminante ocurre en el 1–3% de los pacientes, con síntomas de toxicidad grave, fiebre, dolor y distensión abdominal27,28.
El reservorio de C. difficile en los hospitales está constituido por los pacientes infectados o colonizados, además de las superficies contaminadas por éstos29–31, ya que las esporas del C. difficile son muy resistentes en el medio ambiente y pueden sobrevivir en superficies durante meses32.
El principal vehículo de transmisión entre los pacientes son las manos del personal sanitario. Un estudio revela que el riesgo de colonización es directamente proporcional al tiempo de ingreso, siendo de un 1% en los pacientes con un tiempo de ingreso inferior a una semana, pero que alcanza hasta un 50% en pacientes que permanecen en el hospital más de 4 semanas33.
El período de incubación es muy variable. Se ha observado que entre la administración de antibióticos y la aparición de síntomas pueden transcurrir desde uno hasta 6 días o incluso semanas34,35.
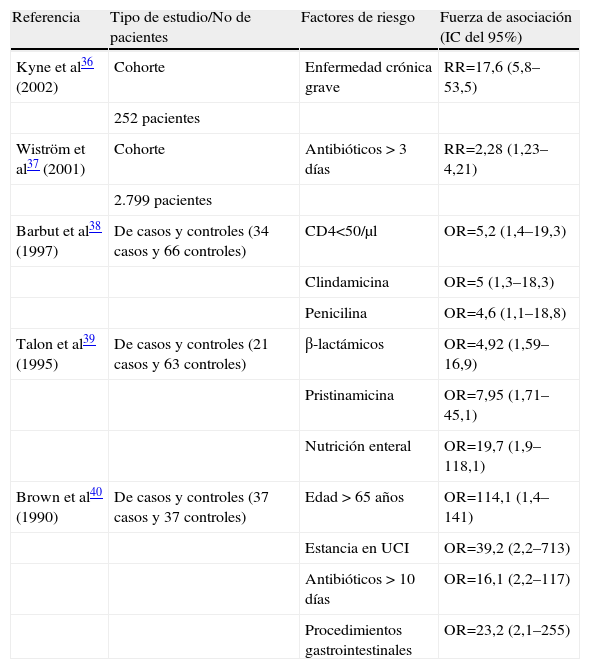
Entre los factores de riesgo asociados a esta enfermedad, el primero en frecuencia es la utilización de antibióticos de amplio espectro durante un ingreso hospitalario prolongado. Otros factores de riesgo son presentar una enfermedad crónica, ser mayor de 65 años o someterse a procedimientos gastrointestinales no quirúrgicos, como el sondaje nasogástrico. En la tabla 1 se incluyen algunos de los principales estudios que miden la asociación entre estos factores de riesgo y la EACD36–40. Sin embargo, en investigaciones recientes, se señala que se está produciendo un aumento de la EACD adquirida en la comunidad, por lo que se está revisando el papel de los antibióticos como factor predisponente. Este fenómeno se observó en un estudio en Filadelfia (Estados Unidos), en el que el 30% de los pacientes con EACD no tenía historia previa de tratamiento antibiótico41. En esta línea, otro estudio en Inglaterra revela que la incidencia de C. difficile en pacientes diagnosticados en atención primaria había aumentado de un caso por 100.000 habitantes en 1994 a 22 casos por 100.000 habitantes en 200442.
Estudios en los que se han analizado los factores de riesgo identificados para la enfermedad asociada a Clostridium difficile
| Referencia | Tipo de estudio/No de pacientes | Factores de riesgo | Fuerza de asociación (IC del 95%) |
| Kyne et al36 (2002) | Cohorte | Enfermedad crónica grave | RR=17,6 (5,8–53,5) |
| 252 pacientes | |||
| Wiström et al37 (2001) | Cohorte | Antibióticos > 3 días | RR=2,28 (1,23–4,21) |
| 2.799 pacientes | |||
| Barbut et al38 (1997) | De casos y controles (34 casos y 66 controles) | CD4<50/μl | OR=5,2 (1,4–19,3) |
| Clindamicina | OR=5 (1,3–18,3) | ||
| Penicilina | OR=4,6 (1,1–18,8) | ||
| Talon et al39 (1995) | De casos y controles (21 casos y 63 controles) | β-lactámicos | OR=4,92 (1,59–16,9) |
| Pristinamicina | OR=7,95 (1,71–45,1) | ||
| Nutrición enteral | OR=19,7 (1,9–118,1) | ||
| Brown et al40 (1990) | De casos y controles (37 casos y 37 controles) | Edad > 65 años | OR=114,1 (1,4–141) |
| Estancia en UCI | OR=39,2 (2,2–713) | ||
| Antibióticos > 10 días | OR=16,1 (2,2–117) | ||
| Procedimientos gastrointestinales | OR=23,2 (2,1–255) |
IC: intervalo de confianza; OR: odds ratio; RR: riesgo relativo; UCI: unidad de cuidados intensivos.
Hay discrepancias entre los métodos y las estrategias para el diagnóstico, por lo que una definición clara de caso de EACD es clave para establecer un sistema de vigilancia homogéneo que permita el seguimiento de esta enfermedad. Para abordar este tema, el Centro Europeo para la Prevención y el Control de Enfermedades (ECDC, por sus siglas en inglés) estableció en el año 2006 un Grupo de Trabajo para C. difficile en el ámbito europeo (European Study Group on Clostridium difficile), que propuso una definición de EACD basada en la experiencia de los últimos brotes de Canadá, Estados Unidos, el Reino Unido y los Países Bajos (tabla 2)4.
Definición de caso para enfermedad asociada a Clostridium difficile (EACD)
| Se considera caso de EACD a cualquier paciente que cumpla alguno de los criterios siguientes |
| Criterio 1 |
| Heces diarreicas o megacolon tóxico y |
| Una técnica de laboratorio positiva para toxina A o B de C. difficile en heces, o detección de C. difficile productor de toxina en cultivo de heces |
| Criterio 2 |
| Colitis seudomembranosa observada con endoscopia gastrointestinal baja |
| Criterio 3 |
| Muestra colónica con características histopatológicas de infección por C. difficile obtenida por endoscopia, colectomía o autopsia |
| Dos episodios de EACD en el mismo paciente se consideran distintos eventos si ocurren separados por más de 2 meses |
| No se considera caso de EACD |
| Paciente asintomático con cultivo de heces positivo a C. difficile |
| Paciente asintomático con una técnica positiva para toxina de C. difficile |
| Diarrea asociada a otras causas |
Tomada de ESCMID Study Group for Clostridium difficile (ESGCD), EU Member States and the European Centre for Disease Prevention and Control (ECDC)4.
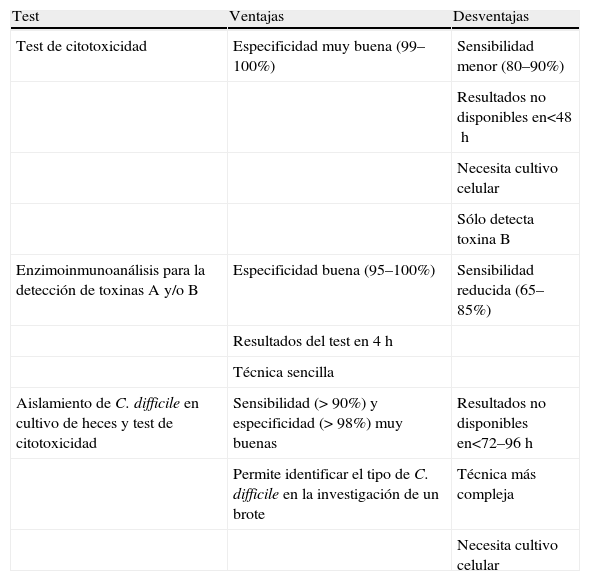
En el documento elaborado por este grupo de trabajo, se comenta la falta de una prueba ideal para el diagnóstico de laboratorio de la EACD, por lo que se recomienda utilizar alguna técnica que demuestre la presencia de toxinas (A y/o B) en heces. La prueba que presenta una especificidad mayor es la detección del efecto citopático de la toxina B en cultivos celulares (test de citotoxicidad)43–48. En la tabla 3 se comparan las ventajas y las desventajas de las principales pruebas diagnósticas24.
Ensayos y pruebas de laboratorio para el diagnóstico de enfermedad asociada a Clostridium difficile
| Test | Ventajas | Desventajas |
| Test de citotoxicidad | Especificidad muy buena (99–100%) | Sensibilidad menor (80–90%) |
| Resultados no disponibles en<48h | ||
| Necesita cultivo celular | ||
| Sólo detecta toxina B | ||
| Enzimoinmunoanálisis para la detección de toxinas A y/o B | Especificidad buena (95–100%) | Sensibilidad reducida (65–85%) |
| Resultados del test en 4h | ||
| Técnica sencilla | ||
| Aislamiento de C. difficile en cultivo de heces y test de citotoxicidad | Sensibilidad (> 90%) y especificidad (> 98%) muy buenas | Resultados no disponibles en<72–96h |
| Permite identificar el tipo de C. difficile en la investigación de un brote | Técnica más compleja | |
| Necesita cultivo celular |
Tomada de Pountanen y Simor24.
El incremento en la incidencia de EACD observada en Estados Unidos desde el 2001, y en Canadá desde el 2003, se ha relacionado con un aumento del número de aislamientos de la nueva cepa de C. difficile7–13,49,50.
C. difficile 027 se aisló por primera vez en 1988 en una mujer de 28 años con una colitis seudomembranosa grave9, pero hasta el año 2003 no se consideró la relevancia de este hallazgo, debido a su frecuencia baja, ya que esta cepa se aislaba en menos del 3% de los casos asociados a enfermedad grave51,52.
Inicio de la alerta: NorteaméricaDesde marzo de 2003, se observó un aumento de la notificación de brotes nosocomiales de EACD en diferentes hospitales de Canadá. En 2004, se registró un incremento de la incidencia de EACD en varias instituciones sanitarias de la región de Québec que afectó a más de 14.000 pacientes13,53. En este mismo año, la incidencia calculada de EACD en 12 hospitales de Québec fue de 22,5 casos por cada 1.000 ingresos hospitalarios, con una tasa de letalidad de 6,9%. Tanto la incidencia, como la mortalidad atribuible a la EACD aumentaban en los grupos de más edad. La mayoría de los pacientes habían recibido tratamiento con fluoroquinolonas y cefalosporinas, y se observó resistencia a fluoroquinolonas en el 82,2% de los casos54.
En Estados Unidos, los hospitales duplicaron los casos de EACD durante el período 1996–2003 (31 casos/100.000 habitantes en 1996, 61 casos/100.000 habitantes en 2003). Se identificó una nueva cepa de C. difficile tipo NAP1, REA grupo B1, productora de toxina binaria y con una delección en el gen tcdC, que produce grandes cantidades de toxina A y B6–8,55. Esta cepa se asoció a una mayor morbimortalidad declarada en varios brotes hospitalarios en 11 estados9,55,56. Además, se observó un aumento de la resistencia a fluoroquinolonas comparado con las cepas que anteriormente eran la causa de estos brotes (el 100 frente al 42%; p<0,001)7,56.
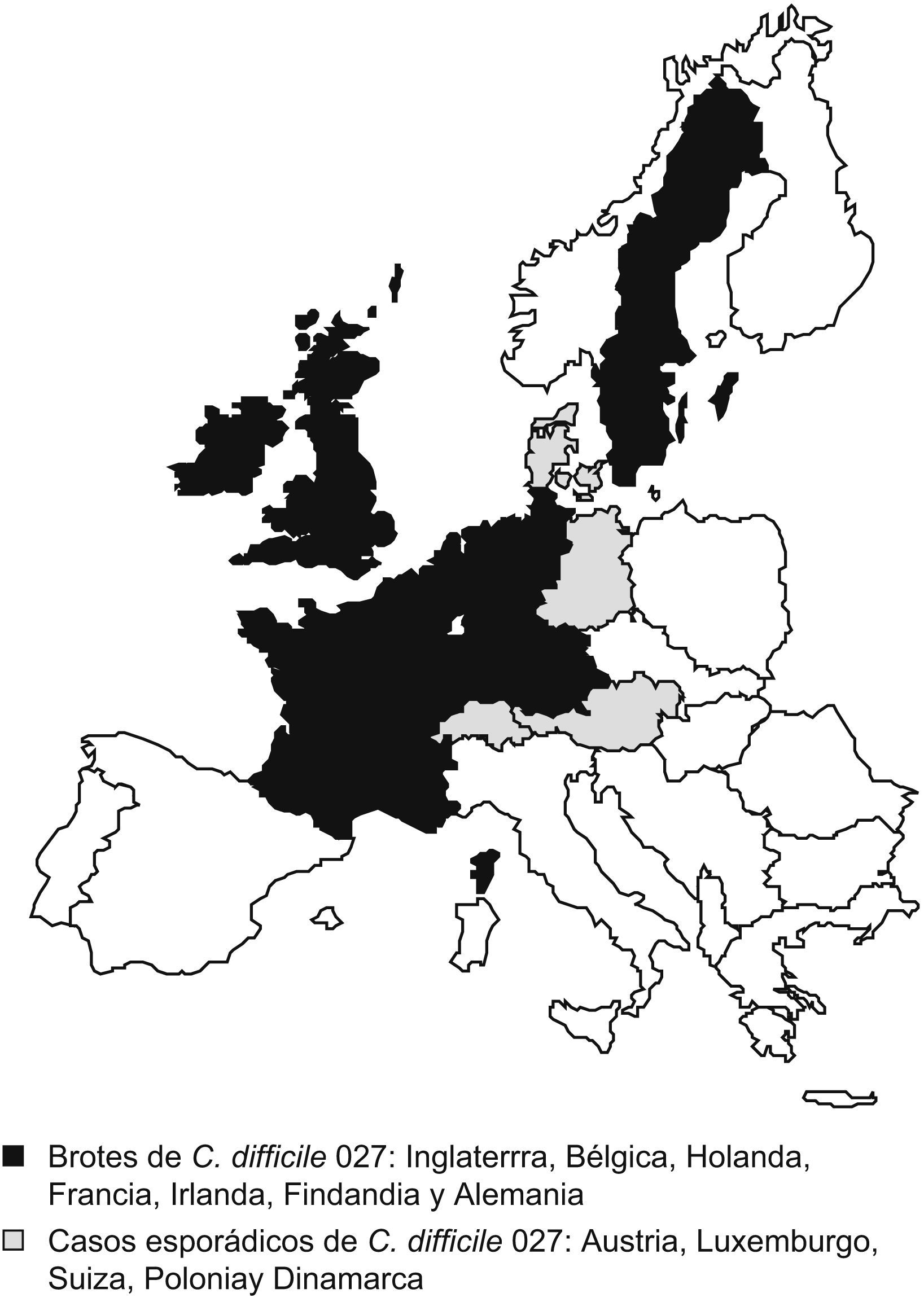
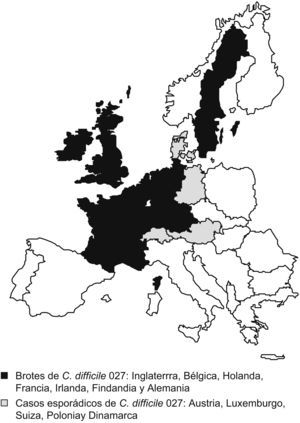
Extensión a EuropaDesde el año 2003, en Europa se han declarado brotes nosocomiales por la nueva cepa en el Reino Unido, los Países Bajos, Bélgica, Irlanda, Francia, Finlandia y Alemania, y casos esporádicos adquiridos en la comunidad en Austria, Luxemburgo, Suiza, Polonia y Dinamarca14 (fig. 1).
Países europeos con casos notificados de Clostridium difficile 027 a junio de 2007. Tomada de Kuijper et al14.
Entre octubre de 2003 y junio de 2004 se aisló C. difficile 027 en un brote nosocomial en Inglaterra que afectó a 174 pacientes, de los que 19 murieron (tasa de letalidad del 11%). Posteriormente, se han producido otros brotes nosocomiales por esta nueva cepa en distintos hospitales de Inglaterra y Gales. Hasta abril de 2006, el laboratorio de referencia de anaerobios en Cardiff había aislado C. difficile 027 en 450 muestras enviadas por 75 hospitales diferentes. Este hecho pone de manifiesto la diseminación rápida de la nueva cepa en un período relativamente corto57,58.
El siguiente país que declaró casos fue los Países Bajos. En un hospital de Harderwijk, la incidencia de EACD aumentó de 4/10.000 pacientes ingresados en 2004 a 83/10.000 en el período comprendido entre abril y julio de 2005, en el que se identificó C. difficile 027 en un 63,3% de los aislamientos59,60. Un segundo brote, relacionado con el primero, ocurrió cuando se trasladó a un paciente con EACD a otro hospital cercano. A finales de 2005, en el segundo hospital se había identificado a 85 pacientes con EACD, con una tasa de letalidad del 22%. Dos hospitales que no habían notificado brotes por C. difficile hasta ese momento enviaron muestras al laboratorio de referencia para su tipificación, y se aisló C. difficile 027 en 6 de 17 (35%) y 1 de 4 (25%) de las muestras enviadas59.
En septiembre de 2005, se produjo el primer aislamiento de C. difficile 027 en 4 pacientes ingresados en un hospital de Bélgica. Con el objetivo de realizar un seguimiento y comparar la incidencia de EACD en los hospitales belgas, se creó un sistema de vigilancia de ámbito nacional. En el período de julio a noviembre de 2006, 17 hospitales enviaron 45 aislamientos de C. difficile al laboratorio de referencia. El 40% eran cepa 027, procedentes de 10 hospitales61,62.
En marzo de 2006, en un hospital austríaco, ingresó una turista británica de 69 años con un cuadro gastrointestinal compatible con colitis seudomembranosa. Un diagnóstico retrospectivo por PCR confirmó la cepa C. difficile 02763. Éste es un ejemplo de cómo la nueva cepa puede extenderse entre países a partir de casos adquiridos en la comunidad.
En mayo de 2006, se notificó una agrupación de casos de EACD en un hospital del norte de Francia. El total de casos de EACD en este brote fue de 41; el 74% de los aislamientos fueron cepa 027. Se sospecha que este brote podría estar relacionado con el traslado de pacientes desde hospitales belgas, aunque no ha podido confirmarse des de un punto de vista microbiológico64. Posteriormente, se han notificado nuevos brotes no sólo en pacientes hospitalizados, sino también en personas que han recibido atención domiciliaria o que han acudido a unidades de rehabilitación64,65.
Irlanda notificó casos de enfermedad asociada a C. difficile 027 en abril de 2007. El primer caso se identificó de forma retrospectiva en un paciente trasladado desde un hospital de Inglaterra con diagnóstico de infarto cerebral en mayo de 2005. Al ingreso, el paciente presentaba diarrea y el análisis de las muestras de heces confirmó la cepa 027. Posteriormente, entre enero y abril de 2006, se identificaron 2 brotes nosocomiales no relacionados con este paciente en 2 hospitales de Dublín, en los que se identificó C. difficile 02766.
Durante 2007 se notificaron brotes nosocomiales en Finlandia y Alemania, y casos esporádicos en Luxemburgo, Suiza, Polonia y Dinamarca14.
Caso esporádico en JapónEl primer caso de la nueva cepa fuera de Norteamérica y Europa se declaró en Japón a principios de 2007 y se detectó de forma retrospectiva. Se trataba de una mujer de 30 años que en marzo de 2005 ingresó en un hospital de Japón con diagnóstico de colitis ulcerosa. A los 2 meses del ingreso desarrolló un episodio de diarrea y una colonoscopia demostró colitis seudomembranosa. El diagnóstico microbiológico confirmó C. difficile 027. En los brotes nosocomiales investigados hasta finales de 2006 no se volvió a aislar C. difficile 02767,68.
Control y prevención de la enfermedadLa revisión de los brotes de EACD alerta sobre el problema de la transmisión interhospitalaria asociada al traslado de pacientes de un hospital a otro. Los brotes nosocomiales se diseminan rápidamente, si no se diagnostican y tratan con prontitud.
Para el diagnóstico temprano de los casos, se recomienda hacer una prueba de laboratorio que demuestre la presencia de toxinas en heces en los casos de diarrea nosocomial69,70. Por otra parte, no se recomienda hacer prueba en heces de pacientes asintomáticos o después de que hayan comenzado con tratamiento antibiótico71.
Ante un caso de EACD es prioritario el tratamiento de la diarrea mediante la retirada de los antibióticos causantes, cuando esto sea posible, acompañado de una adecuada rehidratación y aportación de electrolitos. A pesar de no ser estrictamente necesario, dada la potencial gravedad, en la mayoría de los pacientes se utilizan antibióticos eficaces frente al C. difficile, de los cuales el metronidazol por vía oral (500 mg/6-8h durante 7-10 días) es el tratamiento de elección. La vancomicina oral (125mg/6h) se reserva como antibiótico de segunda línea para los casos de más gravedad72–76.
Las medidas de control recomendadas para evitar la diseminación de los casos de EACD incluyen:
- •
Aislamiento en habitación individual con baño propio, siempre que la situación en el hospital lo permita. Si no hubiera disponibilidad de habitaciones individuales, podría contemplarse el aislamiento de la cohorte de casos en una planta del hospital o parte de esta, con la asignación de un personal sanitario específico, para disminuir el riesgo de contaminación cruzada a otros pacientes77–80. El aislamiento se mantiene hasta 48h después de la resolución del cuadro entérico59.
- •
Lavado de manos meticuloso con agua y jabón de todo el personal sanitario, después de haber atendido a un caso con EACD o contactado con superficies potencialmente contaminadas por éste. Ante una sospecha de EACD, las soluciones alcohólicas no deben sustituir el lavado de manos81–83.
- •
Bata y guantes en personal sanitario que atiende a un paciente con diarrea y que está en contacto con superficies potencialmente contaminadas84.
- •
Limpieza terminal de superficies contaminadas con heces. Los baños y las cuñas deben limpiarse de forma minuciosa. La desinfección de las habitaciones de pacientes con EACD debe hacerse con un agente esporicida eficaz. La limpieza con una solución de hipoclorito a una concentración de al menos 1.000ppm se asocia a una reducción de la incidencia de EACD. Reservar material de limpieza para las habitaciones con casos de EACD85–87.
- •
Limitación de la utilización de políticas antibióticas agresivas. Lo ideal sería detener el tratamiento antibiótico en pacientes con EACD. Como en la mayoría de los casos, no podremos eliminar completamente el tratamiento antibiótico, debería reducirse la utilización de los antibióticos de amplio espectro (amoxicilina-ácido clavulánico y cefalosporinas) a favor de antibióticos de espectro menor (bencil penicilina, trimetroprim y amoxicilina)72–76.
Cuando se produce un brote nosocomial por C. difficile, se deberán extremar las medidas anteriores y aplicar medidas adicionales para controlarlo. Estas medidas deberían incluir:
- •
El equipo encargado del control de la infección nosocomial debe informar del incremento de casos de EACD al personal sanitario de los servicios afectados y a los profesionales de salud pública de la comunidad autónoma correspondiente.
- •
Hay que reforzar todas las medidas de higiene y revisar los protocolos de limpieza. Si es posible, designar un equipo de limpieza específico bien entrenado para la limpieza de las habitaciones de los pacientes con EACD78.
- •
Debe revisarse la política antibiótica en pacientes de riesgo, especialmente el uso de cefalosporinas, fluoroquinolonas y clindamicina88,89.
- •
Deben tomarse muestras de heces en los pacientes afectados para su caracterización microbiológica56,90,91.
- •
Cuando la transmisión continúa a pesar de asignar personal sanitario específico y aplicar las medidas de control comentadas, puede ser necesario cerrar la unidad y proceder a una limpieza intensa para eliminar los potenciales reservorios de C. difficile78.
La EACD ha experimentado un incremento de su incidencia y gravedad debido a la aparición de la cepa hipervirulenta C. difficile 027. Esta cepa se ha diseminado rápidamente en los últimos años y ha producido casos esporádicos y brotes nosocomiales en Norteamérica y Europa. Dada esta situación, es fundamental establecer un sistema de vigilancia oportuno para la detección temprana y la toma de medidas de control que permitan disminuir la extensión de estos brotes. Para conseguir la detección temprana de los casos, cada hospital debería revisar sus protocolos de vigilancia y medidas de control de la EACD y difundirlos entre los servicios que puedan verse afectados. En este sentido, cobra especial importancia la necesidad de aplicar una definición de caso consensuada como la propuesta por el grupo de trabajo del ECDC4.
Por otro lado, la presentación de la enfermedad como casos esporádicos en la comunidad en personas sin factores de riesgo debe tenerse en cuenta por los profesionales sanitarios con el fin de prevenir su extensión intrahospitalaria.
Los autores agradecen al Centro Nacional de Epidemiología (Instituto de Salud Carlos III) la información proporcionada sobre los datos de Clostridium difficile disponibles en la Red Nacional de Vigilancia Epidemiológica en España.