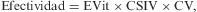Analizar la evolución de los casos declarados (notificación microbiológica) de enfermedad neumocócica invasora (ENI) en niños menores de 2 años de Cataluña (España) después de la comercialización de la vacuna neumocócica conjugada heptavalente.
Material y métodosLos casos de ENI en los niños menores de 2 años se han obtenido a partir de las declaraciones efectuadas al Sistema de Notificación Microbiológica de Cataluña durante los períodos 1997–1999 y 2002–2004 por los hospitales (n=23) que han participado de forma continuada e ininterrumpida en este sistema desde su puesta en marcha en 1995.
ResultadosLas tasas globales de casos declarados fueron de 49,2 por 100.000 personas-año durante el período 1997–1999 y de 40,4 por 100.000 personas-año en el período 2002–2004. La diferencia no fue estadísticamente significativa. Las tasas de neumonías bacteriémicas pasaron de 25,2 por 100.000 personas-año en 1997–1999 a 21,6 por 100.000 personas-año en 2002–2004, y las de meningitis de 6,0 a 4,3 por 100.000 personas-año, respectivamente, pero en ambos casos las diferencias no alcanzaron significación estadística (p>0,05).
ConclusionesDespués de la comercialización de la vacuna neumocócica conjugada heptavalente, se ha producido una cierta reducción, no estadísticamente significativa, en las tasas de notificaciones de la enfermedad neumocócica invasora en los niños menores de 2 años de Cataluña. En caso de haber alcanzado significación estadística, la reducción global habría sido del 17,90%, no muy lejana de la reducción teóricamente esperada (22%), a partir de la eficacia protectora de la vacuna (89%), el porcentaje de serotipos causantes de enfermedad invasora incluidos en la vacuna (70%) y las coberturas vacunales alcanzadas durante el período analizado (35%).
To analyze the changes occurring in declared cases (microbiological report) of invasive pneumococcal disease (IPD) in children <2 years old in Catalonia (Spain) after the 7-valent pneumococcal conjugate vaccine (PCV7) was licensed for use.
Material and methodsCases of IPD in children <2 years old were obtained from notifications to the Microbiological Reporting System of Catalonia (MRSC) in 1997–1999 and 2002–2004 by the hospitals (n=23) that have participated in the MRSC continuously and uninterruptedly since its inception in 1995.
ResultsOverall reported rates were 49.2 cases per 100,000 persons-year in 1997–1999 and 40.4 per 100,000 persons-year in 2002–2004; the difference was not statistically significant. The rate of bacteremic pneumonia fell from 25.2 per 100,000 persons-year in 1997–1999 to 21.6 per 100,000 persons-year in 2002–2004, and meningitis from 6.0 to 4.3 per 100,000 persons-year; again, differences were not statistically significant (P>0.05).
ConclusionsAfter PCV7 was licensed for use, a noticeable, but non-significant, reduction in reported IPD rates in children <2 years old occurred in Catalonia. If the results had been statistically significant, the overall reduction would have been 17.90%, not far below the theoretically expected reduction (22%), based on the protective efficacy of PCV7 (89%), the percentage of invasive disease-causing serotypes included in the vaccine (70%), and the vaccination coverage achieved during the study period (35%).
La magnitud del problema de la infección neumocócica en los niños menores de 2 años y la resistencia antibiótica creciente estimularon la obtención de vacunas conjugadas frente al neumococo. La primera comercializada fue la heptavalente (PNC7), en el año 2000 en Estados Unidos, después que un ensayo clínico controlado demostrara su eficacia protectora frente a la enfermedad neumocócica invasora (ENI) en los niños pequeños1. Un año más tarde llegó a España.
En Cataluña, antes de la introducción de la vacunación, la proporción de serotipos causantes de ENI incluidos en la vacuna PNC7 era del 70,54%2. En una encuesta realizada para investigar las coberturas vacunales se encontró una cobertura de alrededor del 35%3.
El objetivo del presente estudio ha sido analizar la evolución de los casos declarados de ENI en los niños menores de 2 años en Cataluña antes (período 1997–1999) y después (período 2002–2004) de la comercialización de la vacuna PNC7.
Material y métodosLa mayoría de los hospitales de Cataluña (36 hospitales que representan el 78,3% del total de camas de los hospitales públicos) informan de forma voluntaria al Departamento de Salud de los aislamientos de Streptococcus pneumoniae, en lugares normalmente estériles, a través del Sistema de Notificación Microbiológica de Cataluña (SNMC).
Las tasas del período 1997–1999 se han calculado a partir del censo de 1996 y las del período de 2002–2004, a partir de la población estimada en el año 2002. Para valorar la significación estadística de las diferencias entre proporciones, se ha utilizado la prueba de χ2, considerando una p<0,05 como estadísticamente significativa. La efectividad directa esperada de la vacunación se ha calculado con la fórmula siguiente:
donde EVit es la eficacia protectora de la vacuna en intención de tratar; CSIV, la cobertura de serotipos de neumococo causantes de ENI incluidos en la vacuna, y CV, la cobertura vacunal alcanzada.ResultadosDurante el período 1997–1999 se notificaron un total de 156 aislamientos de S. pneumoniae y 152 durante el período 2002–2004. Las tasas fueron de 49,2 y de 40,4 por 100.000 personas-año, sin que la diferencia fuera estadísticamente significativa. Descendieron las neumonías bacteriémicas (tasa de 25,2 por 100.000 personas-año durante el período 1997–1999 y de 21,6 en 2002–2004), las meningitis (6,0 frente a 4,3) y las bacteriemias sin foco (18,0 frente a 13,8), sin que las diferencias alcanzaran significación estadística (tabla 1).
Notificación según la forma clínica de enfermedad neumocóccica invasora en menores de 2 años en Cataluña antes (1997–1999) y después (2002–2004) de la comercialización de la vacuna neumocócica conjugada heptavalentea
| Forma clínica | Notificaciones de enfermedad neumocócica invasora | pd | |||
| 1997–1999b | 2002–2004c | ||||
| Cifras absolutas | Tasa por 100.000 personas-año | Cifras absolutas | Tasa por 100.000 personas-año | ||
| Neumonía neumocócica bacteriémica | 80 | 25,2 | 81 | 21,6 | 1,000 |
| Meningitis neumocócica | 19 | 6,0 | 16 | 4,3 | 0,736 |
| Bacteriemia sin foco | 57 | 18,0 | 52 | 13,8 | 0,702 |
| Otras formas invasoras | 0 | 0 | 3 | 0,8 | 0,250 |
| Todas las formas invasoras | 156 | 49,2 | 152 | 40,4 | 0,864 |
La efectividad directa (sin inmunidad de grupo) esperada para una eficacia protectora de la vacuna en intención de tratar del 89%, una cobertura de serotipos causantes de ENI incluidos en la vacuna del 70,54% y una cobertura vacunal estimada del 35% se ha estimado del 22%, no muy lejana de la observada (17,9%).
DiscusiónLa vacuna PNC7 no se ha incorporado a los calendarios de vacunaciones oficiales, pero sí al calendario propuesto por la Asociación Española de Pediatría4, y algunos pediatras la recomiendan.
Los beneficios de la vacunación masiva en Estados Unidos, tanto directos como indirectos, derivados de la inmunidad de grupo y los efectos negativos de la vacunación (reemplazo de los serotipos vacunales por serotipos no vacunales, tanto en los portadores, como en los pacientes) se han estudiado de forma amplia en los últimos años en este país5–7. En cambio, se conoce muy poco de los efectos de la vacuna aplicada con carácter individual, en el ámbito privado, con más cobertura en la población de más nivel socioeconómico. En esta situación, que sería la de Cataluña, el impacto de la inmunidad de grupo es previsible que sea mucho menor que cuando la vacunación se aplica de forma masiva.
Los resultados del presente estudio indican un cierto descenso en la tasa de casos notificados de ENI en menores de 2 años después de la introducción de la vacunación, tanto para el conjunto de la enfermedad invasora (tasa de 40,4 por 100.000 personas-año en el período 2002–2004 y de 49,2 en el período 1997–1999), como para las diferentes formas clínicas de la enfermedad, pero las diferencias no alcanzan significación estadística.
Si se tiene presente que la eficacia protectora de la vacuna (vacunación completa e incompleta) en el estudio del Kaiser Permanente fue del 89%1, y que la cobertura de serotipos causantes de ENI en los menores de 2 años de Cataluña era del 70,54% antes de la comercialización de la vacuna, difícilmente se podrían esperar resultados mejores con la cobertura vacunal estimada del 35%6. De acuerdo con estos datos, la efectividad esperada (efectividad directa) sería del 22%, no muy lejana de la observada (17,9%). En cuanto a la protección indirecta (inmunidad de grupo), es probable que haya sido baja, dados los valores de cobertura vacunal alcanzados, que además no han sido uniformes.
La principal fortaleza del presente estudio es la fuente de datos, el SNMC, que funciona con anterioridad a la comercialización de la vacuna, y proporciona información sólida y fiable obtenida de forma prospectiva, con una disminución del riesgo de producción de sesgos de información. La principal debilidad deriva de la no disponibilidad del serotipo causante de los casos de ENI notificados, que ha impedido analizar la evolución de los casos declarados según el serotipo.
Es posible que en nuestro estudio hayan ocurrido sesgos. El más probable es que, entre los 2 períodos analizados, se haya incrementado el número de cultivos realizados y, en consecuencia, de aislamientos de neumococo, debido a un aumento del interés por la enfermedad por parte de los pediatras desde la comercialización de la vacuna. En este caso, la reducción de los casos declarados podría haberse subestimado. También es posible que los criterios de declaración microbiológica durante el período estudiado no se hayan seguido de forma homogénea, ya que algunos hospitales no empezaron a declarar los aislamientos en empiemas y derrame pleural hasta el año 2004. Por el contrario, no pensamos que la infrarrepresentación de los hospitales privados entre los hospitales declarantes haya dado lugar a una subestimación relevante del impacto de la vacunación, ya que se ha mantenido constante en los 2 períodos y, además, la mayoría de los casos de ENI se ingresan en los hospitales públicos.
En dos estudios recientes realizados en España8,9, se ha analizado el impacto de la vacunación. En el estudio de Aristegui et al8 se ha encontrado una reducción estadísticamente significativa del 39,7% en los niños menores de 2 años y del 37% en el conjunto del grupo de edad de menores de 5 años después de la comercialización de la vacuna; y en el de Barricarte et al9 se ha hallado una reducción de la incidencia global de ENI del 12%, no estadísticamente significativa (p=0,689). La discordancia entre los resultados se explica probablemente por las diferentes poblaciones estudiadas y la diferente fuente de los datos (diagnóstico clínico en el primero y casos declarados por los laboratorios de microbiología en el segundo).
Benito-Fernández et al10 recopilaron de forma retrospectiva en un hospital público del País Vasco los casos de bacteriemia sin foco diagnosticados antes y después de la comercialización de la vacuna, y encontraron una reducción del 57,5% (p<0,05). Esta reducción se ha producido a pesar de haber aumentado el número de cultivos practicados (de 1.171 a 1.575). Aunque las diferencias han sido estadísticamente significativas, el bajo número de casos del estudio (19 en el período anterior y 11 en el posterior) limita la relevancia del resultado.
Los resultados de nuestro estudio indican que coberturas vacunales poblacionales bajas-intermedias no consiguen los beneficios directos e indirectos observados en Estados Unidos.
El Grupo de Trabajo del Sistema de Notificación Microbiológica de Cataluña está constituido por microbiólogos de: Hospital Clínic de Barcelona; Fundació Gestora Sanitària Hospital de la Santa Creu i Sant Pau, Barcelona; Ciutat Sanitària de la Vall d’Hebron, Barcelona; Hospital Casa Maternitat, Barcelona; Hospital Universitari Germans Trias i Pujol, Badalona; Hospital Comarcal de Sant Jaume, Calella, Barcelona; Hospital Sant Joan de Déu, Esplugues de Llobregat, Barcelona; Hospital General de Granollers; Consorci Hospital General de l′Hospitalet, L’Hospitalet de Llobregat, Barcelona; Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat, Barcelona; Hospital de Sant Joan de Déu, Martorell, Barcelona; Consorci Sanitari de Mataró, Barcelona; Hospital Mútua de Terrassa, Barcelona; Hospital Universitari Dr. Josep Trueta, Girona; Hospital Universitari Arnau de Vilanova, Lleida; Hospital Universitari Joan XXIII, Tarragona; Hospital Verge de la Cinta, Tortosa, Tarragona; Hospital d’Igualada FP, Barcelona; Hospital General de Vic, Barcelona; Hospital Residència Sant Camil, Sant Pere de Ribes, Barcelona; Hospital Sant Joan de Déu, Manresa, Barcelona; Corporació Sanitària Parc Taulí, Sabadell, Barcelona; Laboratori de Referència de Catalunya: Hospital del Mar, Barcelona; Hospital de l’Esperança, Barcelona; Hospital General de Catalunya, San Cugat del Vallès, Barcelona; Hospital de Terrassa, Barcelona; Hospital de Sant Bernabé, Berga, Barcelona; Hospital de Figueras, Girona; Hospital Universitari Sant Joan de Reus, Tarragona; Hospital de Sant Pau i Santa Tecla, Tarragona; Hospital Comarcal Móra d’Ebre, Tarragona; Centre Hospitalari de Manresa, Barcelona; Hospital Municipal de Badalona, Barcelona; Hospital Comarcal de l’Alt Penedès, Vilafranca del Penedés, Barcelona; Hospital Comarcal de Blanes, Barcelona; Hospital de Santa Maria, Lleida.