El tratamiento antirretroviral combinado de gran actividad (TARGA) redujo la morbimortalidad por la infección por el virus de la inmunodeficiencia humana (VIH), pero indujo efectos adversos como la dislipidemia, cuyo tratamiento se dificulta por interacciones farmacológicas. En las guías para su tratamiento se propuso usar pravastatina o atorvastatina para reducir el colesterol de las lipoproteínas de baja densidad (c-LDL), y gemfibrozil o fenofibrato para tratar la hipertrigliceridemia. Rosuvastatina, una estatina con escaso metabolismo hepático, podría ser una nueva alternativa.
MétodosEstudio retrospectivo para evaluar la efectividad y la toxicidad del uso de rosuvastatina (10mg/día) por 16 semanas en pacientes con dislipidemia, portadores del VIH con TARGA y riesgo cardiovascular de moderado a muy elevado. Los resultados se analizaron mediante las pruebas de Shapiro-Wilks, K-S Lilliefors y el test del signo; los porcentajes se compararon mediante la prueba de chi al cuadrado.
ResultadosSetenta y ocho pacientes recibieron rosuvastatina, 60 como único hipolipemiante. Tras 16 semanas, el descenso mediano del c-LDL y del colesterol no ligado a las lipoproteínas de alta densidad (c-no-HDL) fue significativo (−31,3 y −29,9%, respectivamente); el 65,8% de los pacientes lograron la meta para c-no-HDL. La reducción de la trigliceridemia también fue significativa (−34,1%); el 35% de los pacientes alcanzaron la meta terapéutica para trigliceridemia. Dos individuos suspendieron la droga por toxicidad muscular y uno por intolerancia digestiva. No hubo diferencia en la toxicidad y la eficacia de acuerdo a si los pacientes recibían concomitantemente inhibidores de proteasa, inhibidores de transcriptasa inversa no nucleosídicos o fibratos.
ConclusiónRosuvastatina fue efectiva y segura para tratar la dislipidemia de pacientes VIH+ con TARGA, logrando resultados similares a los descritos en población no infectada por VIH.
Highly active antiviral therapy (HAART) results in a sharp decrease in HIV-related morbidity and mortality, but also induces adverse effects such as dyslipidemia, which is difficult treat because of drug interactions. Guidelines recommend lipid-lowering therapy with pravastatin or atorvastatin to reduce LDL cholesterol in these patients, and gemfibrozil or fenofibrate for treating hypertriglyceridemia. The use of statins in the management of dyslipidemia is complicated by drug interactions with some of the components of HAART. Rosuvastatin, a statin with minimal cytochrome P-450-mediated metabolism, could be an alternative option for this population.
MethodsRetrospective study to evaluate the efficacy and safety of rosuvastatin (10 mg/day) for 16 weeks in HAART-treated HIV-infected patients with dyslipidemia, and moderate to high cardiovascular risk. Results were analyzed with the Shapiro-Wilks, K-S Lilliefors, and sign tests. Percentages were analyzed with the chi-square test.
ResultsSeventy-eight patients were started on rosuvastatin for dyslipidemia, 60 as single therapy. After 16 weeks of treatment, a significant median decrease was seen in both LDL-cholesterol and non-HDL cholesterol (31.3% reduction in LDL and 29.9% in non-HDL). The therapeutic goal for non-HDL was achieved in 65.8% of patients. The decrease in triglyceride levels was also significant (34.1%); 35% of subjects achieved the therapeutic goal. The drug was withdrawn in 2 patients because of myositis, and in 1 because of gastrointestinal intolerance. There were no differences in efficacy or toxicity between patients receiving protease inhibitors, non-nucleoside reverse transcriptase inhibitors, or fibrates.
ConclusionRosuvastatin was safe and effective for treating dyslipidemia in HAART-treated HIV-infected patients.
Resultswere similar to those observed in the HIV-uninfected population.
El tratamiento antirretroviral combinado de gran actividad (TARGA) permitió la reducción de la morbimortalidad debida a la infección por el virus de la inmunodeficiencia humana (VIH)1, pero se asoció a la aparición de efectos adversos que generaron comorbilidades, y fue de particular importancia la dislipidemia2,3.
El tratamiento de esta complicación metabólica se dificulta porque muchos hipolipemiantes y algunos componentes del TARGA comparten las vías metabólicas dependientes del citocromo P-450 generando complejas interacciones4. Las guías para la evaluación y tratamiento de la dislipidemia en adultos infectados con VIH que reciben TARGA proponen el uso de pravastatina o atorvastatina para reducir el c-LDL, y gemfibrozil o fenofibrato para el tratamiento de la hipertrigliceridemia5,6.
Rosuvastatina es un medicamento inhibidor de la enzima 3-hidroxi-3-metilglutaril coenzima-A reductasa. Su metabolismo en el sistema enzimático del citocromo P-450 es escaso y mediado especialmente por la isoenzima 2C9, lo que reduce su potencial de interacción con los antirretrovirales7. En algunos estudios desarrollados en poblaciones sin infección por VIH se demostró que tiene mayor potencia que otras estatinas8,9.
Su escaso metabolismo hepático, su potencia y el bajo potencial de interacciones farmacológicas con los antirretrovirales nos estimularon a indicarla a pacientes infectados con VIH tratados con TARGA con dislipidemia.
MétodosEstudio retrospectivo del uso de rosuvastatina durante 16 semanas para tratamiento de la dislipidemia en adultos infectados con VIH en tratamiento con TARGA.
Los datos fueron obtenidos mediante la revisión de las historias clínicas.
Se incluyeron a todos los pacientes adultos, infectados con VIH, en tratamiento con TARGA con riesgo cardiovascular de moderado a muy elevado de acuerdo con los criterios del National Cholesterol Education Program ATPIII10, que hubieran recibido rosuvastatina (10 mg/día) y que tuvieran al menos un control de laboratorio en las siguientes 16 semanas (± 2 semanas).
Al momento de constatarse la dislipidemia, todos los pacientes fueron aconsejados por su médico tratante acerca de llevar adelante un estilo de vida saludable y fueron derivados a la consulta con la licenciada en Nutrición, antes de indicársele tratamiento farmacológico. Asimismo, se discutió con ellos la posible vinculación del trastorno metabólico con algún componente del TARGA y se les sugirieron cambios en el esquema antirretroviral para lograr una reducción de la toxicidad. La decisión final en cuanto a modificar o no el esquema se tomó en acuerdo con el paciente.
Las muestras de sangre fueron recogidas de una vena periférica tras un ayuno de al menos 10 h.
Se definió hipercolesterolemia como al menos dos determinaciones de c-LDL o de colesterol no ligado a las lipoproteínas de alta densidad (c-no-HDL) superiores al valor definido como meta terapéutica para la categoría de riesgo a la cual perteneciera el paciente. Se definió hipertrigliceridemia como al menos dos determinaciones de trigliceridemia superiores a 200 mg/dl.
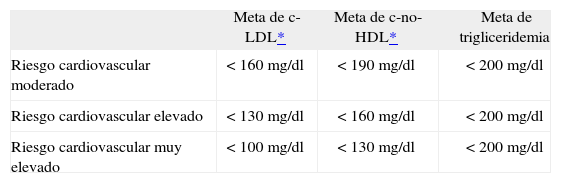
Metas terapéuticasLas metas terapéuticas para los pacientes con hipercolesterolemia fueron definidas de acuerdo a lo propuesto por el National Cholesterol Education Program ATPIII10. En cuanto a los pacientes con hipertrigliceridemia, dicha meta fue definida en una trigliceridemia < 200 mg/dl. Las metas terapéuticas se resumen en la tabla 1.
Metas terapéuticas del estudio
| Meta de c-LDL* | Meta de c-no-HDL* | Meta de trigliceridemia | |
| Riesgo cardiovascular moderado | < 160 mg/dl | < 190 mg/dl | < 200 mg/dl |
| Riesgo cardiovascular elevado | < 130 mg/dl | < 160 mg/dl | < 200 mg/dl |
| Riesgo cardiovascular muy elevado | < 100 mg/dl | < 130 mg/dl | < 200 mg/dl |
c-LDL: colesterol de las lipoproteínas de baja densidad; c-no-HDL: colesterol no ligado a las lipoproteínas de alta densidad.
En este análisis fueron incluidos todos los pacientes que recibieron rosuvastatina como única droga hipolipemiante. Se determinaron las medianas de c-LDL, c-HDL, c-no-HDL y trigliceridemia basales, y luego de 8 (± 2) y 16 (± 2) semanas. También se determinaron las medianas de los porcentajes de variación respecto a los valores basales de iguales parámetros y tras 8 (± 2) y 16 (± 2) semanas de tratamiento con rosuvastatina. A iguales plazos se determinaron los porcentajes de pacientes que alcanzaron las metas terapéuticas.
El c-LDL fue calculado utilizando la fórmula de Friedewald en aquellos pacientes con una trigliceridemia igual o inferior a 200 mg/dl11. En los individuos con una trigliceridemia superior a 200 mg/dl, la aplicación de dicha fórmula habría infravalorado el c-LDL12, por lo que no fue aplicada. Debido a ello, también evaluamos el c-no-HDL, una determinación con demostrada relación a patología aterosclerótica13,14, el cual se obtiene restando el c-HDL al colesterol total.
ToxicidadEn este análisis se incluyó la totalidad de los pacientes que recibieron rosuvastatina, ya sea sola o combinada con fibratos. Se definió toxicidad hepática como el aumento en las transaminasas glutámicooxalacética (TGO) o glutámico-pirúvica (TGP) plasmáticas superior a 5 veces el máximo valor normal en quienes tenían hepatograma basal normal (grados 3 y 4 de la tabla de HIV Prevention Trials Network15), o más de 3,5 veces el máximo valor normal para aquéllos con hepatograma basal anormal16. Se definió toxicidad digestiva como el desarrollo de síntomas gastrointestinales que hubieran motivado la suspensión de la estatina. Se definió toxicidad muscular como el aumento de más de 10 veces el máximo valor normal de creatinfosfocinasa (CPK) plasmática (grados 3 y 4 de la tabla de HIV Prevention Trials Network11) y/o a la aparición de mialgias o debilidad muscular que motivaran la suspensión del fármaco.
Análisis estadísticoSe utilizaron las pruebas de Shapiro-Wilks y K-S Lilliefors para establecer la distribución de las variables continuas y, dada la distribución anormal que demostraron, se usó el test del signo para analizarlas. Para comparar porcentajes se usó la prueba de chi al cuadrado.
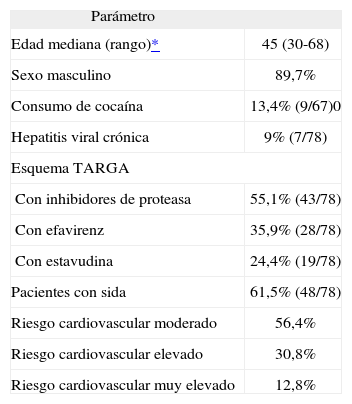
ResultadosSe identificaron 78 pacientes infectados con VIH con TARGA, con riesgo cardiovascular de moderado a muy elevado, que recibieron rosuvastatina. Un total de 60 la recibieron como único fármaco hipolipemiante y 18 la recibieron combinada con fibratos. Las características demográficas de la población estudiada se resumen en la tabla 2.
Características basales de la población estudiada (n = 78)
| Parámetro | |
| Edad mediana (rango)* | 45 (30-68) |
| Sexo masculino | 89,7% |
| Consumo de cocaína | 13,4% (9/67)0 |
| Hepatitis viral crónica | 9% (7/78) |
| Esquema TARGA | |
| Con inhibidores de proteasa | 55,1% (43/78) |
| Con efavirenz | 35,9% (28/78) |
| Con estavudina | 24,4% (19/78) |
| Pacientes con sida | 61,5% (48/78) |
| Riesgo cardiovascular moderado | 56,4% |
| Riesgo cardiovascular elevado | 30,8% |
| Riesgo cardiovascular muy elevado | 12,8% |
TARGA: terapia antirretroviral de gran actividad.
Hubo 44 que recibieron rosuvastatina tras el fracaso de otros tratamientos; 62 la recibieron para tratamiento de hipercolesterolemia e hipertrigliceridemia y 16 la recibieron para tratamiento de hipercolesterolemia aislada.
EfectividadEvaluamos la efectividad en 60 pacientes.
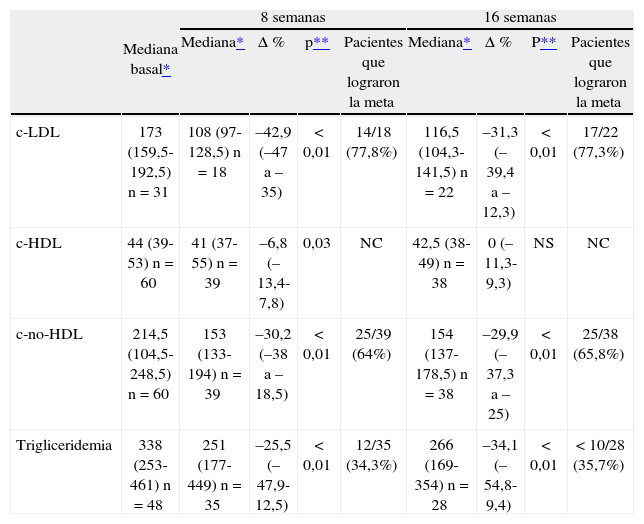
Al final del estudio se observó un significativo descenso del c-LDL y del c-no-HDL. Más del 60% de los pacientes evaluados alcanzaron la meta terapéutica para esta última determinación.
También se evidenció un significativo descenso de la trigliceridemia. Cerca de un tercio de los pacientes evaluados logró la meta terapéutica.
Si bien a las 8 semanas se había observado un descenso estadísticamente significativo del c-HDL, dicho resultado no se mantuvo al final del estudio.
El porcentaje de pacientes con c-HDL inferior a 40 mg/dl fue del 30% durante todo el período. Un total de 6 individuos con c-HDL basal por debajo de 40 mg/dl superaron ese valor al final del estudio, mientras que en 6 pacientes con c-HDL basal igual o superior a 40 mg/dl se constató un descenso a menos de 40 mg/dl a las 16 semanas.
Los resultados de la acción de rosuvastatina sobre c-LDL, c-HDL, c-no-HDL y trigliceridemia se resumen en la tabla 3.
Acción de rosuvastatina sobre c-LDL, c-HDL, c-no-HDL y trigliceridemia
| Mediana basal* | 8 semanas | 16 semanas | |||||||
| Mediana* | Δ % | p** | Pacientes que lograron la meta | Mediana* | Δ % | P** | Pacientes que lograron la meta | ||
| c-LDL | 173 (159,5-192,5) n = 31 | 108 (97-128,5) n = 18 | –42,9 (–47 a –35) | < 0,01 | 14/18 (77,8%) | 116,5 (104,3-141,5) n = 22 | –31,3 (–39,4 a –12,3) | < 0,01 | 17/22 (77,3%) |
| c-HDL | 44 (39-53) n = 60 | 41 (37-55) n = 39 | –6,8 (–13,4-7,8) | 0,03 | NC | 42,5 (38-49) n = 38 | 0 (–11,3-9,3) | NS | NC |
| c-no-HDL | 214,5 (104,5-248,5) n = 60 | 153 (133-194) n = 39 | –30,2 (–38 a –18,5) | < 0,01 | 25/39 (64%) | 154 (137-178,5) n = 38 | –29,9 (–37,3 a –25) | < 0,01 | 25/38 (65,8%) |
| Trigliceridemia | 338 (253-461) n = 48 | 251 (177-449) n = 35 | –25,5 (–47,9-12,5) | < 0,01 | 12/35 (34,3%) | 266 (169-354) n = 28 | –34,1 (–54,8-9,4) | < 0,01 | < 10/28 (35,7%) |
Δ%: porcentaje mediano de variación respecto al valor basal; NC: no corresponde.
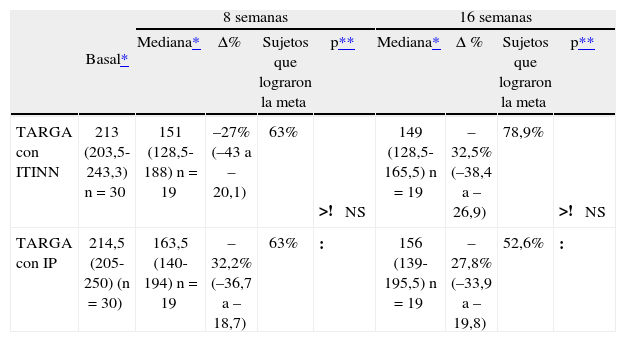
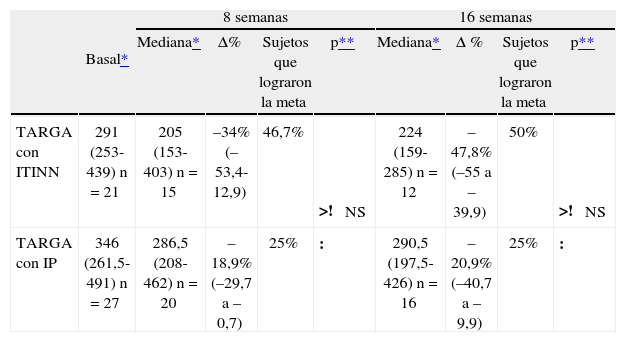
Los resultados de acuerdo a si los pacientes recibían TARGA con inhibidores de la transcriptasa inversa no nucleosídicos (ITINN) o con inhibidores de la proteasa (IP) fueron similares y se resumen en las tablas 4 y 5.
Acción de rosuvastatina sobre c-no-HDL de acuerdo con el uso de TARGA con IP o ITINN
| Basal* | 8 semanas | 16 semanas | |||||||
| Mediana* | Δ% | Sujetos que lograron la meta | p** | Mediana* | Δ % | Sujetos que lograron la meta | p** | ||
| TARGA con ITINN | 213 (203,5-243,3) n = 30 | 151 (128,5-188) n = 19 | –27% (–43 a –20,1) | 63% | >! NS | 149 (128,5-165,5) n = 19 | –32,5% (–38,4 a –26,9) | 78,9% | >! NS |
| TARGA con IP | 214,5 (205-250) (n = 30) | 163,5 (140-194) n = 19 | –32,2% (–36,7 a –18,7) | 63% | : | 156 (139-195,5) n = 19 | –27,8% (–33,9 a –19,8) | 52,6% | : |
Δ%: porcentaje mediano de variación respecto al valor basal; IP: inhibidores de la proteasa; ITINN: inhibidores de la transcriptasa inversa no nucleosídicos; NS: no significativo; TARGA: tratamiento antirretroviral de gran actividad.
Acción de rosuvastatina sobre la trigliceridemia de acuerdo con el uso de TARGA con IP o ITINN
| Basal* | 8 semanas | 16 semanas | |||||||
| Mediana* | Δ% | Sujetos que lograron la meta | p** | Mediana* | Δ % | Sujetos que lograron la meta | p** | ||
| TARGA con ITINN | 291 (253-439) n = 21 | 205 (153-403) n = 15 | –34% (–53,4-12,9) | 46,7% | >! NS | 224 (159-285) n = 12 | –47,8% (–55 a –39,9) | 50% | >! NS |
| TARGA con IP | 346 (261,5-491) n = 27 | 286,5 (208-462) n = 20 | –18,9% (–29,7 a –0,7) | 25% | : | 290,5 (197,5-426) n = 16 | –20,9% (–40,7 a –9,9) | 25% | : |
Δ%: porcentaje mediano de variación respecto al valor basal; IP: inhibidores de la proteasa; ITINN: inhibidores de la transcriptasa inversa no nucleosídicos; NS: no significativo; TARGA: tratamiento antirretroviral de gran actividad.
La seguridad fue evaluada en los 78 pacientes.
Un total de 3 pacientes (5,7%) suspendieron la toma del fármaco por toxicidad (1 por intolerancia digestiva y 2 por mialgias, uno de los cuales presentó un incremento de la CPK plasmática de 19.000 UI/l). De ellos, 2 tomaban sólo rosuvastatina (2/60 = 3,3%), mientras que uno la tomaba combinada con fibratos (1/18; el 5,6%). No hubo diferencias entre estos porcentajes.
De los 2 que suspendieron la toma del fármaco por toxicidad muscular, uno tomaba IP y el otro (el que presentó el aumento de la CPK) tomaba efavirenz.
Sólo un paciente presentó un aumento asintomático de TGO y TGP que se normalizaron sin discontinuar el medicamento. Dicho paciente tomaba IP, no tomaba fibratos y no tenía hepatitis crónica, pero su hepatograma basal era ligeramente anormal.
DiscusiónEn esta pequeña experiencia, rosuvastatina fue segura y efectiva para el tratamiento de la dislipidemia en sujetos infectados con VIH con TARGA. Tras 16 semanas de tratamiento, los resultados logrados sobre c-LDL, c-no-HDL y trigliceridemia fueron similares a los observados con el uso de rosuvastatina y otras estatinas en poblaciones no infectadas con VIH17,18. A diferencia de dichas experiencias9,18, no observamos cambios significativos en las concentraciones de c-HDL.
El tratamiento de la dislipidemia en los pacientes infectados con VIH que reciben TARGA se ve dificultado por las interacciones farmacológicas entre algunos antirretrovirales y las estatinas en el sistema enzimático del citocromo P-45019, puesto que los IP inhiben y los ITINN inducen su metabolismo. De ese modo, la coadministración de IP y estatinas podría incrementar la toxicidad de estas últimas, mientras que la coadministración con ITINN podría reducir su actividad hipolipemiante20,21. Tal situación podría influir sobre los efectos terapéuticos y tóxicos de las estatinas. Esto es particularmente notorio para la interacción entre IP y simvastatina, lo que hace que dicha combinación esté contraindicada20. En quienes reciben IP se pueden utilizar atorvastatina y pravastatina, estatinas con escaso metabolismo hepático5,6, aunque los resultados obtenidos con su uso en pacientes infectados con VIH no son uniformemente satisfactorios22,23.
Si bien rosuvastatina demostró ser más efectiva e igualmente segura que otras estatinas en pacientes no infectados con VIH8,9,24, no hay estudios comparativos en individuos infectados.
Recientemente se publicó un ensayo abierto sobre 16 pacientes infectados con VIH que recibían IP y presentaban hipercolesterolemia en el cual rosuvastatina fue segura y efectiva25.
Una experiencia llevada a cabo en pacientes portadores de VIH, tratados con lopinavir/ritonavir y rosuvastatina mostró que ésta no influía sobre las concentraciones plasmáticas del IP, pero que éste inducía un ligero aumento de la concentración plasmática de la estatina por encima del esperado en individuos que no tomen IP, lo que evidencia que, aunque leve, existe interacción entre los fármacos26.
En cuanto a la seguridad, el porcentaje de pacientes que suspendió el fármaco por efectos adversos fue similar al observado en otros estudios24. Tampoco fue significativamente diferente el porcentaje de pacientes que suspendió la estatina en función de si consumían fibratos concomitantemente.
Nuestro estudio presenta varias limitaciones. En primer lugar, el pequeño número de pacientes incluido impide obtener conclusiones que se puedan extrapolar a otras poblaciones. Esto es especialmente notorio al analizar el porcentaje de pacientes que alcanzó las metas terapéuticas según el tipo de TARGA que recibían (con IP o con ITINN). Si bien el porcentaje de pacientes tomando ITINN que logró las metas terapéuticas para trigliceridemia fue el doble que el de sujetos bajo IP (el 50 y el 25%, respectivamente), su análisis no mostró diferencias estadísticamente significativas debido al escaso número de pacientes que pudo ser evaluado (12 con ITINN y 16 con IP).
En segundo término, el carácter retrospectivo impidió evaluar adecuadamente la adherencia e intervenir de forma activa sobre la misma.
En este punto, nos llamó la atención la baja aceptación de los pacientes que concurrían a la interconsulta con la licenciada en Nutrición: sólo el 28% la consultaron, y la mayoría lo hizo sólo una vez. Los motivos referidos por los pacientes fueron problemas personales (falta de tiempo y dificultades laborales) y temor a que la dieta les indujera una excesiva pérdida de peso. Si bien el tratamiento dietario aislado ya había demostrado escaso efecto sobre los lípidos plasmáticos de sujetos infectados con VIH tratados con TARGA con IP27, su cumplimiento en combinación con rosuvastatina podría haber aumentado la eficacia de la intervención.
Por otra parte, muchos pacientes rechazaron la propuesta de cambiar algún fármaco del TARGA por otro con menor potencial de toxicidad metabólica, prefiriendo tomar estatinas antes que cambiar un tratamiento adecuado desde el punto de vista virológico e inmunológico.
Por último, la baja prevalencia de hepatitis viral crónica (tabla 2) impidió obtener datos sobre la seguridad de rosuvastatina en pacientes VIH+ coinfectados por virus de hepatitis B o C.
Nuestra pequeña experiencia mostró que rosuvastatina fue segura y efectiva en pacientes infectados con VIH con dislipidemia en tratamiento con TARGA. Debido a su potencia y buena tolerabilidad, rosuvastatina podría ser una buena alternativa para tratar la dislipidemia en esta población. Sin embargo, se necesitan más estudios, prospectivos, comparativos y con mayor número de pacientes para ratificar estos hallazgos preliminares.