Tipranavir (Aptivus®, Boehringer Ingelheim) es un inhibidor no peptídico de la proteasa usado en el tratamiento de la infección por el virus de la inmunodeficiencia humana (VIH), no aprobado en pediatría1, que ha mostrado actividad in vitro contra cepas del VIH-1 resistentes a otros inhibidores de la proteasa (IP) de segunda generación. Comparado con otros IP, tipranavir ha demostrado una mayor eficacia en el descenso de la carga viral y el aumento de CD4 en adultos, especialmente si se administra conjutamente con enfuvirtida subcutáneo, tal y como indican los estudios RESIST (Randomised Evaluation of Strategic Intervention in multidrug reSistant patients with Tipranavir)2,3. La dosis establecida en pacientes adultos es 500mg de tipranavir potenciado con 200mg de ritonavir dos veces al día vía oral, aunque se desconoce la dosis para la edad pediátrica. La monitorización terapéutica de fármacos (MTF) pretende conseguir tanto la optimización del efecto terapéutico como la prevención de concentraciones plasmáticas tóxicas o infraterapéuticas.
El caso que se presenta muestra la utilidad de la MTF en un paciente de 12 años, afecto de sida con síndrome de caquexia en relación con el VIH, tratado con tipranavir, con el fin de optimizar la dosis de un fármaco en el que no se ha establecido el perfil farmacocinético (y por lo tanto las dosis adecuadas) en niños.
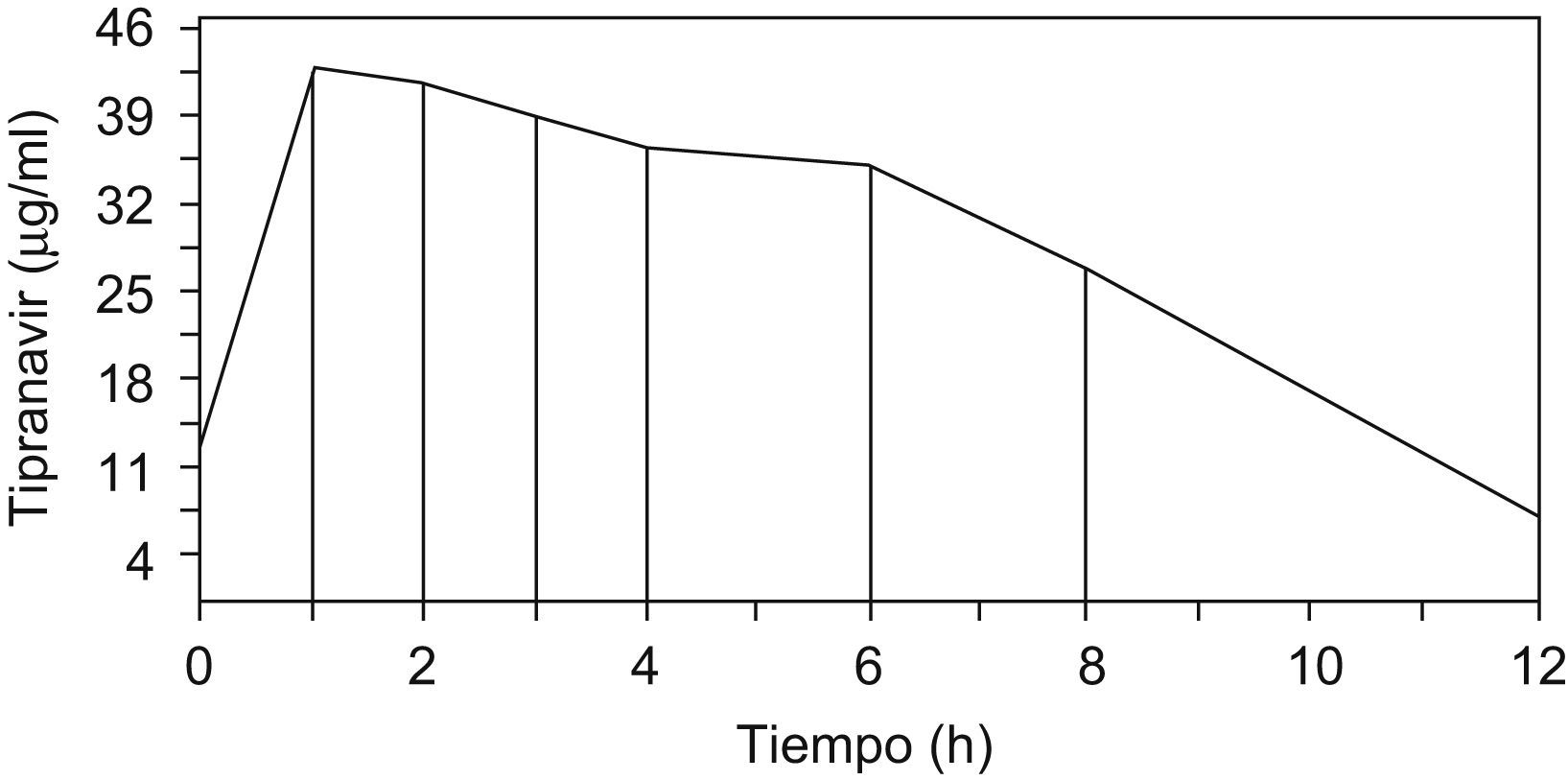
Varón de 12 años de edad, con infección por el VIH en estadio C3 (sida; CDC 1994), con antecedente de múltiples infecciones oportunistas y síndrome de emaciación en relación con el VIH, con un peso de 18kg (–6 desviaciones estándar). Ha recibido múltiples regímenes antirretrovirales durante su evolución. El estudio genotípico de resistencias realizado 2 meses antes del inicio del tratamiento con tipranavir mostró resistencia a todos los antirretrovirales disponibles en ese momento, con 7 mutaciones al gen de la proteasa (L10I, L33V, M46I, L63P, A71V, V82F, L90M), ninguna de las cuales se halla en el score de mutaciones para tipranavir. Presentaba una carga viral de 29.000 copias/μl y CD4 totales de 14/μl (1%) y se inició tratamiento con didanosina, abacavir, tipranavir potenciado con bajas dosis de ritonavir por vía oral y enfuvirtida subcutáneo. El uso de tipranavir se realizó bajo modalidad de uso compasivo, previo consentimiento del paciente y su tutor legal. Tal y como refiere un reciente estudio pediátrico de farmacocinética de tipranavir4, su dosis se calculó en función de la superficie corporal (0,84m2): 250mg/12h administrados a las 9.00 y las 21.00. La dosis de ritonavir fue de 100mg/24h y se administraba a las 21.00. Tras 15 días con este nuevo régimen, se realizó MTF de tipranavir y ritonavir. Se obtuvo un total de 8 muestras: la primera a las 9.00 (antes de la administración de la primera dosis), y las 7 restantes, en un intervalo de 12h; la última muestra se tomó a las 21.00 (antes de la administración de la última dosis). Se obtuvo una curva de valores para tipranavir (fig. 1) con las concentraciones valle diurna (12,34μg/ml) y nocturna (7,18μg/ml), así como el área bajo la curva (AUC0−12h=350,4μg/h/ml) del intervalo de tiempo estudiado. Las concentraciones plasmáticas de ritonavir fueron bajas, como era de suponer; 0,08μg/ml por la mañana y concentraciones indetectables a las 4h de la toma. A pesar de que las concentraciones de tipranavir obtenidas fueron inferiores a los valores de referencia de adultos sanos, fueron suficientes para alcanzar una concentración inhibitoria del 90% (CI90), por lo que se decidió mantener la misma dosis administrada en el momento del estudio. Se debe tener en cuenta que la concentración plasmática de tipranavir se ve alterada (aumento del 32% de la Cmáx y disminución del 34% de la concentración a las 12h) en caso de coadministrarse con didanosina5, por lo que no puede descartarse esta interacción que, junto con la diferente farmacocinética en niños y la diarrea crónica, podría justificar los bajos valores de tipranavir en nuestro paciente. De todos modos, la administración separada por un mínimo de 2h minimizaría dicha interacción en este caso.
Con este régimen y a estas dosis se consiguió una mejoría clínica (aumento de 3kg de peso) e inmunológica (115 CD4/μl [4%]) a los 6 meses de su inicio. Se consiguió un descenso de la carga viral mayor a 1log, aunque no se alcanzó la indetectabilidad. No aparecieron efectos secundarios significativos. Es necesario señalar la combinación de enfuvirtida y tipranavir que, en pacientes adultos, ha demostrado mayor eficacia que en caso de utilizar tipranavir de forma aislada2,3.
La falta de una dosis establecida para un determinado fármaco es un hecho relativamente común en pediatría. Además, frecuentemente las dosis utilizadas en niños son fruto de extrapolaciones de datos de adultos ya que son escasos los estudios de farmacocinética y farmacodinamia en esta población, acercamiento que ha demostrado ser poco adecuado y peligroso en algunos casos6. La MTF permite controlar y ajustar la dosificación de fármacos mediante las repetidas determinaciones de las concentraciones plasmáticas para conseguir tanto la optimización del efecto terapéutico del fármaco como la prevención de cifras plasmáticas tóxicas o infraterapéuticas, a la vez que monitorizar el efecto de otros fármacos coadministrados con potencial riesgo de interacción con el fármaco estudiado7. La MTF es aplicable a los IP y a los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN).
Así, la MTF adquiere una gran importancia en el manejo de la infección por el VIH en pediatría, hasta el punto que ciertos grupos la consideran básica para optimizar el tratamiento en este grupo de edad8. De todos modos, nos encontramos ante el problema de la ausencia de valores de referencia para la mayoría de los antirretrovirales en niños.
Nuestro paciente presenta unas concentraciones inferiores a los valores de referencia de adultos sanos a dosis de 500/200mg/12h TPV/RTV (23,16μg/ml)9 y pacientes con VIH positivo (28,35–39,45μg/ml)10, pero suficientes para alcanzar una concentración eficaz del 50 y el 90% (EC50 y EC90) (0,042 y 0,108μg/ml, respectivamente) y una CI90 para cepas de virus salvaje (0,096μg/ml) y cepas de virus resistentes (0,372μg/ml) y, por su elevada unión a proteínas plasmáticas, una CI90 ajustada a proteínas (1,2μg/ml)1. Por ese motivo se decidió mantener la misma dosis administrada en el momento del estudio, tanto de tipranavir como de ritonavir, con buena respuesta clínica e inmunológica.
Como conclusión, se pretende remarcar que la MTF es un procedimiento útil en el manejo de la infección por el VIH en pediatría, ya que puede ayudar a adecuar las dosis farmacológicas, y así minimizar tanto la toxicidad como el fracaso terapéutico. De todos modos, son necesarios más estudios en este grupo de edad que permitan establecer valores de referencia para la edad pediátrica en la monitorización terapéutica de tipranavir.