El albendazol es un derivado del benzimidazol con actividad antihelmíntica y constituye el tratamiento de elección del quiste hidatídico causado por Echinococcus granulosus (E. granulosus) (enfermedad hidatídica o equinococosis) cuando la cirugía no es factible o como tratamiento coadyuvante de la misma1. De entre sus efectos adversos destaca su capacidad para producir depresión de la médula ósea. Aunque la incidencia es reducida, la potencial repercusión clínica de esta reacción obliga a monitorizar el recuento de células sanguíneas en los pacientes en tratamiento con este fármaco.
A continuación se presenta el caso de un paciente que desarrolló aplasia medular al recibir tratamiento con albendazol.
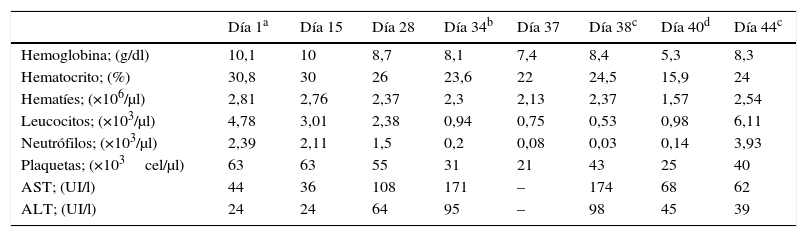
Se trata de un paciente varón de 57 años que ingresa en nuestro centro con diagnóstico de quiste hidatídico peritoneal (visualizado en un TAC, E. granulosus: anticuerpos IgG positivo [título 1/640], Western-blot A5P). El paciente presentó insuficiencia renal postrenal por compresión del quiste hidatídico. Como antecedentes médicos de interés destaca coinfección por VIH, VHB y VHC, con signos de hepatopatía crónica con una anemia macrocítica y trombocitopenia crónica (rango de valores durante los 2 años previos: plaquetas: 60.000-129.000cel/μl, hemoglobina: 10,6-14,7g/dl, hematocrito: 31,6-43,6) (Child-Pugh: C, MELD: 21). Cuatro años antes fue sometido a una quistoperiquistectomía total de un quiste hidatídico hepático dependiente de los segmentos II y III. Se inicia tratamiento con albendazol (400mg/12h vía oral) de forma previa a la intervención quirúrgica y se observa una disminución progresiva de los valores hematológicos. Se orienta el cuadro como posible toxicidad por albendazol y se suspende el tratamiento con el mismo (día 34). A pesar de la interrupción del tratamiento con el antiprotozoario se observa una disminución continuada del recuento de las 3 líneas celulares hasta llegar a los valores nadir indicados en la tabla 1 (días 37-40). Mediante soporte transfusional y administración de factores estimulantes de colonias de granulocitos, los parámetros hematológicos de las 3 series celulares volvieron a los valores basales 10 días después (día 44). El paciente presentó alopecia y elevación moderada de transaminasas, efectos adversos también asociados al tratamiento con albendazol2.
Evolución de los parámetros hematológicos
| Día 1a | Día 15 | Día 28 | Día 34b | Día 37 | Día 38c | Día 40d | Día 44c | |
|---|---|---|---|---|---|---|---|---|
| Hemoglobina; (g/dl) | 10,1 | 10 | 8,7 | 8,1 | 7,4 | 8,4 | 5,3 | 8,3 |
| Hematocrito; (%) | 30,8 | 30 | 26 | 23,6 | 22 | 24,5 | 15,9 | 24 |
| Hematíes; (×106/μl) | 2,81 | 2,76 | 2,37 | 2,3 | 2,13 | 2,37 | 1,57 | 2,54 |
| Leucocitos; (×103/μl) | 4,78 | 3,01 | 2,38 | 0,94 | 0,75 | 0,53 | 0,98 | 6,11 |
| Neutrófilos; (×103/μl) | 2,39 | 2,11 | 1,5 | 0,2 | 0,08 | 0,03 | 0,14 | 3,93 |
| Plaquetas; (×103cel/μl) | 63 | 63 | 55 | 31 | 21 | 43 | 25 | 40 |
| AST; (UI/l) | 44 | 36 | 108 | 171 | – | 174 | 68 | 62 |
| ALT; (UI/l) | 24 | 24 | 64 | 95 | – | 98 | 45 | 39 |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa.
La incidencia de toxicidad hematológica por albendazol en humanos es reducida. Hasta el momento se han reportado 2 casos de bicitopenias3,4, uno de trombocitopenia5 y 3 casos de pancitopenia6–8. Nuestro paciente es el cuarto caso de pancitopenia descrito en la literatura.
El mecanismo de toxicidad es desconocido pero podría estar relacionado con una conversión del albendazol a su metabolito activo sulfóxido y sulfona, por lo que niveles elevados de albendazol podrían incrementar los efectos toxicológicos en las funciones celulares dependientes de microtúbulos con toxicidad asociada a la médula ósea8,9.
Nuestro paciente presentó los valores hematológicos más bajos al mes de haber iniciado el tratamiento con albendazol, a diferencia de los 3 casos descritos en la literatura, en los que los pacientes presentaron anemia aplásica a los 15, 16 y 22 días después de iniciar tratamiento con albendazol, respectivamente.
Asimismo, el paciente de este caso presentó coinfección por VIH, VHB y VHC como antecedentes de interés. Se ha descrito que los pacientes con enfermedad hepática se asocian a un riesgo superior de depresión de la médula ósea por albendazol2. De forma paralela, en uno de los casos descritos en la literatura, el paciente presentó cirrosis hepática y en otro hipertensión portal como antecedentes de base.
A pesar de que no se ha identificado, el hecho de presentar unos valores bajos de plaquetas y hemoglobina al inicio del tratamiento podría haber contribuido al desarrollo de la toxicidad hematológica por albendazol.
Como en el caso de Rovira et al.7, se ha evaluado la causalidad de la reacción adversa hematológica al albendazol mediante el algoritmo de Naranjo et al.10, obteniendo una puntuación de 5. De acuerdo a este valor, la relación entre el albendazol y la aplasia medular se clasificaría como probable, descartando la implicación de otros fármacos e interacciones farmacológicas en la toxicidad hematológica.
Los valores hematológicos del paciente de este caso se recuperaron después de 10 días de retirar el albendazol, de forma similar a 2 casos descritos en la literatura, en los que la recuperación hematológica se produjo a los 7 y 12 días de retirar el fármaco.
Aunque poco frecuente, la repercusión clínica de esta reacción adversa obliga a una monitorización exhaustiva de los parámetros hematológicos durante el tratamiento, principalmente en caso de pacientes de edad avanzada y con afectación hepática de base, dado que son más susceptibles a la depresión de médula ósea.
Conflicto de interesesLos autores declaran la no existencia de conflicto de intereses.