El tratamiento antirretroviral, si bien no puede erradicar la infección por el VIH, mantiene suprimida la replicación viral, incrementa el número de linfocitos CD4+, disminuye la morbimortalidad (tanto la relacionada con el sida como con otras comorbilidades que se asocian a ella), mejora la calidad de vida y previene la transmisión sexual del VIH. En este artículo se revisan sus objetivos, el estado actual acerca de cuándo y con qué combinaciones debe iniciarse, cuál es el mejor modo de hacerlo en presencia de enfermedades oportunistas definitorias de sida y qué parámetros clínicos debe incluir tanto el estudio previo a la instauración del mismo como su seguimiento ulterior. Asimismo, se comentan los principios básicos de la modificación del tratamiento antirretroviral motivada por fracaso virológico y por simplificación terapéutica, así como los aspectos particulares del mismo en determinadas situaciones especiales como hepatopatías crónicas y embarazo.
Antiretroviral therapy suppresses viral replication, increases CD4+ cell-count, decreases AIDS- related mortality and morbidity and comorbidities, improves the quality of life of HIV-infected patients, and prevents sexual transmission of HIV. However, this treatment is unable to eradicate HIV infection. The aims of antiretroviral therapy are reviewed in this article, updating information on when to initiate treatment, which combinations of drugs should be used, what is the best antiretroviral treatment in the presence of AIDS-defining opportunistic diseases, and what clinical parameters should be included in the pre-treatment study and in the patient follow-up. Changes in antiretroviral therapy induced by virological failure or therapy simplification, and how to deal with specific situations such as chronic liver disease or pregnancy are also discussed.
En el año 1987, sólo seis años después de la aparición de los primeros casos de sida, se aprobó el uso clínico de zidovudina (ZDV) para el tratamiento de la infección por el VIH. A este primer fármaco antirretroviral (FARV) le siguieron otros inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) que primero en monoterapia y más tarde en combinaciones dobles fueron utilizados a lo largo del siguiente decenio. No obstante, ambas estrategias terapéuticas fracasaron debido al rápido desarrollo de mutaciones de resistencia frente a estos FARV y no fue hasta el año 1996 cuando con la adición de un inhibidor de la proteasa (IP) a una pareja de ITIAN, se logró suprimir de forma eficaz y duradera la replicación del VIH. Por ello, a esta combinación de FARV y poco después a la formada por dos ITIAN y un inhibidor de la transcriptasa inversa no-análogo de nucleósidos (ITINN) se les denominó “tratamiento antirretroviral de gran eficacia” (TARGA), al que en adelante llamaremos simplemente tratamiento antirretroviral (TAR). Con posterioridad, numerosos estudios y la práctica clínica acumulada han confirmado que el TAR, si se utiliza adecuadamente, puede mantener suprimida la replicación viral de forma indefinida, impidiendo que se desarrollen mutaciones de resistencia frente a los FARV. Este beneficio virológico se asocia con una mayor o menor repoblación de linfocitos T CD4+ y con una importante reducción de la morbi-mortalidad relacionada con la infección por el VIH1,2. A este respecto, la supervivencia acumulada lograda por el TAR es muy superior a la de muchas otras terapias actuales de gran relevancia médica y social3, habiéndose comparado su impacto sobre la mortalidad al de los antibióticos. Gracias al TAR, una elevada proporción de pacientes infectados por el VIH tienen una calidad de vida y una funcionalidad socio-familiar y laboral prácticamente normales. En el plano epidemiológico, el TAR es un instrumento eficaz para prevenir la transmisión sexual del VIH4. Y, además de todo ello, el gasto sanitario relacionado con él es netamente costo-efectivo5.
Sin embargo, el TAR es incapaz de erradicar la infección por el VIH porque éste permanece latente en diversos reservorios celulares en los que elude tanto la respuesta inmunitaria como la acción de los FARV. Esta circunstancia tiene una gran trascendencia clínica, pues implica la necesidad de mantenerlo de por vida, lo cual entraña un elevado riesgo de incumplimiento terapéutico y, por ende, de resistencia farmacológica.
Hasta el presente se han aprobado 25 FARV pertenecientes a seis familias diferentes (tabla 1), tres de los cuales han sido retirados por toxicidad o inconveniencia, así como cinco presentaciones farmacéuticas con combinaciones a dosis fijas de dos o tres FARV (tabla 2). Con todos ellos pueden conformarse múltiples regímenes de TAR, tanto de la primera como de ulteriores líneas terapéuticas.
Fármacos antirretrovirales cuyo uso clínico está actualmente aprobado en España
| ITIAN* | ITINN& | IP# | II | IF | A. CCR5 |
| ZidovudinaDidanosinaEstavudinaLamivudinaAbacavirTenofovirEmtricitabina | NevirapinaEfavirenzEtravirina | SaquinavirRitonavirIndinavirNelfinavirLopinavir/ritonavirAtazanavirFosamprenavirTipranavirDarunavir | Raltegravir | Enfuvirtida | Maraviroc |
*La comercialización de zalcitabina fue suspendida a finales del 2006; &: el uso clínico de delavirdina nunca ha sido aprobado en Europa; #: amprenavir fue sustituido por su profármaco fosamprenavir.
ACCR5: antagonistas del correceptor celular R5; IF: inhibidores de la fusión; IP: inhibidores de la proteasa; ITIAN: inhibidores de la transcriptasa inversa análogos de nucleósidos/nucleótidos. ITINN: inhibidores de la transcriptasa inversa no-análogos de nucleósidos. II: inhibidores de la integrasa.
Presentaciones farmacéuticas con combinaciones a dosis fijas de dos o tres fármacos antirretrovirales cuyo uso clínico está actualmente aprobado en España
| Combinaciones de ITIAN | Combinaciones de ITIAN e ITINN |
| Zidovudina y lamivudinaAbacavir y lamivudinaTenofovir y emtricitabinaZidovudina, lamivudina y abacavir | Efavirenz, emtricitabina y tenofovir |
Puesto que con los FARV actuales es imposible erradicar la infección por el VIH, el objetivo inmediato del TAR es reducir y mantener la carga viral plasmática (CVP) por debajo de 50 copias/mL de ARN-VIH, dintel de detección más utilizado en la práctica clínica y por debajo del cual no suelen seleccionarse mutaciones de resistencia. Pero éste es solo un paso imprescindible para lograr otros objetivos a más largo plazo, que, en orden consecutivo, son: restaurar y/o preservar la función inmunitaria, reducir la morbilidad y mortalidad relacionadas con la inmunodeficiencia celular y la activación inmunitaria crónica presentes en la infección por el VIH (objetivo principal), y mejorar la calidad de vida6,7. Además, otro objetivo al que cada vez se le concede una mayor importancia es prevenir la transmisión del VIH6,7
Cuándo iniciar el tratamiento antirretroviralEn la infección por VIH aguda o recienteEn relación a estas etapas de la infección, aún no se dispone de resultados de ensayos clínicos comparativos y aleatorizados de un tamaño muestral adecuado. Los estudios de cohortes que han evaluado la eficacia del TAR en pacientes con infección por el VIH aguda (diagnosticada antes de la seroconversión) o reciente (de duración inferior a seis meses) no han mostrado beneficios clínicos ni inmunológicos fehacientes en relación a los pacientes no tratados. Todo lo más, algunos de ellos han constatado un descenso del set point de la CVP o determinadas mejoras inmunológicas de escasa relevancia. Por ello y aunque algunas directrices sobre TAR dejan la decisión de tratar a criterio del clínico7, la recomendación más extendida en la actualidad es no iniciarlo durante las etapas de infección aguda o reciente, a menos que éstas cursen con enfermedades definitorias de sida6,8, afectación grave de sistemas u órganos (SNC, corazón, hígado, etc)6,8,9, persistencia de los síntomas6,8 o caída de la cifra de linfocitos CD4+ por debajo de 350 o 200 linfocitos CD4+/μL6,8. Asimismo, algunas de ellas consideran iniciarlo si existe un alto riesgo de transmisión sexual del VIH6, acerca de lo cual dado que dicho riesgo suele ser mucho mayor en la infección aguda debido a la intensa replicación viral que ocurre en ella, algunos expertos preconizan tratar a todos los pacientes que se hallen en esta fase.
En la infección por el VIH crónicaDesde que se dispone de combinaciones de TAR potentes, las recomendaciones acerca de cuándo iniciar el TAR en los pacientes con infección crónica han sido modificadas en diversas ocasiones. En el período 1998-2000, debido a la convicción de que el TAR podía curar la infección por el VIH, se recomendó iniciarlo en todos los pacientes que tuviesen un recuento de linfocitos CD4+ inferior a 500 células/μL, e incluso en los que, con cifras mayores que ésta presentasen una CVP superior a 10.000 copias/mL. Entre los años 2001 y 2006, tras constatarse la incapacidad del TAR para erradicar aquélla, su gran potencial de toxicidad a corto y largo plazo y el frecuente desarrollo de resistencia farmacológica si la adherencia al mismo no es la adecuada, se impusieron unos criterios mucho más restrictivos, que limitaron la indicación del TAR a los pacientes con enfermedades oportunistas o con cifras de linfocitos CD4+ inferiores a 200 células/μL. Posteriormente, debido a los resultados de diversos estudios de cohortes2,10–15 y de un ensayo clínico aleatorizado16, según los cuales el riesgo de progresión clínica a sida o muerte es significativamente mayor en los pacientes que comienzan el TAR con cifras de linfocitos CD4+ inferiores a 350 células/μL que en los que lo hacen por encima de dicho límite, esta recomendación se extendió a todos los pacientes con menos de 350 linfocitos CD4+/μL, criterio que en la mayoría de las guías de TAR para adultos de los países desarrollados ha permanecido vigente hasta fechas recientes. Actualmente, sin embargo, la mayoría de éstas recomiendan iniciar el TAR en todas las personas infectadas por el VIH que tengan menos de 500 linfocitos CD4+/μL (tabla 3). Ello se basa en los resultados de algunos estudios de cohortes que han mostrado que el riesgo de progresión a sida o muerte es mayor entre los individuos que inician el TAR con cifras de linfocitos CD4+ comprendidas entre 201-350 células/μL que entre los que lo comienzan con 350-500 células/μL13–15, así como en un análisis post hoc de la subpoblación de pacientes con más de 350 linfocitos CD4+/μL del ensayo clínico SMART, en la cual los individuos en los que se pospuso el inicio del TAR hasta que sus cifras de linfocitos CD4+ cayesen por debajo de 250 células/μL tuvieron un mayor riesgo de enfermedades oportunistas y muerte por acontecimientos clínicos no definitorios de sida que los que comenzaron el TAR con más de 350 células/μL17. Pero, además, se fundamenta en que la proporción de pacientes cuya repoblación de linfocitos CD4+ alcanza cifras normales es significativamente mayor entre los que inician el TAR con más de 350 células/μL que entre los que lo hacen por debajo de dicho umbral18–20 y en que los regímenes de TAR utilizados actualmente son menos tóxicos y menos susceptibles de desarrollar resistencia farmacológica que los que se usaban hasta hace poco tiempo.
Criterios de las guías de práctica clínica respecto al inicio del tratamiento antirretroviral en la infección crónica por el VIH
| GESIDA/PNS6: |
| • En pacientes con infección sintomática (eventos B o C de la clasificación de los CDC): recomendar TAR (A*). |
| • En pacientes asintomáticos con < 350 linfocitos CD4+/μL: recomendar TAR (A*). |
| • En pacientes asintomáticos con 350-500 linfocitos CD4+/μL: recomendar TAR salvo determinadas situaciones (cifra estable de linfocitos CD4+, CVP baja, predisposición escasa del paciente) (B**). |
| • En pacientes asintomáticos con > 500 linfocitos CD4+/μL: diferir el TAR en general, pero considerarlo si coexiste alguna de las siguientes condiciones: |
| ○ Cirrosis hepática, hepatitis crónica por VHC o hepatitis B que requiera tratamiento. |
| ○ CVP ≥ 100.000 copias/mL (≥ 5 log10) de ARN/VIH. |
| ○ Porcentaje de linfocitos CD4+ ≤ 14%. |
| ○ Edad > 55 años. |
| ○ Nefropatía asociada a la infección por el VIH. |
| ○ Riesgo cardiovascular elevado. |
| ○ Parejas serodiscordantes con alto riesgo de transmisión. |
| DHHS7: |
| • En pacientes con una enfermedad definitoria de sida: recomendar TAR (AI@). |
| • En pacientes asintomáticos con < 500 linfocitos CD4+/μL: recomendar TAR (con fuerza AI @si < 350 CD4+/μL y con fuerza A/B-II& si 351-500 CD4+/μL). |
| • En pacientes asintomáticos con > 500 linfocitos CD4+/μL: 50% de los miembros del panel recomiendan iniciar el TAR (B$) y 50% lo consideran opcional (B/C-III#). |
| • Con independencia del recuento de linfocitos CD4+, debe recomendarse TAR si existe alguna de las siguientes condiciones: |
| ○ Embarazo (AI@). |
| ○ Nefropatía asociada a la infección por el VIH (AII^). |
| ○ Coinfección por el VHB, en caso de existir indicación de tratarla (AIII^^). |
| EACS8: |
| • En pacientes con enfermedades B o C de la clasificación de CDC: recomendar TAR. |
| • En pacientes asintomáticos con < 350 linfocitos CD4+/μL: recomendar TAR (si < 200 linfocitos CD4+/μL sin dilación). |
| • En pacientes asintomáticos con 350-500 linfocitos CD4+/μL: considerar TAR, especialmente si hay: |
| ○ Caída rápida de linfocitos CD4+ (50-100/año). |
| ○ CVP ≥ 100.000 copias/mL (≥ 5 log10) de ARN/VIH. |
| ○ Riesgo cardiovascular elevado. |
| ○ Neoplasias no-definitorias de sida. |
| y recomendarlo si existe alguna de las siguientes condiciones: |
| ○ Coinfección por VHB o VHC. |
| ○ Nefropatía asociada a la infección por el VIH. |
| ○ Cualquier otra afectación orgánica específica. |
| • En pacientes asintomáticos con > 500 linfocitos CD4+/μL: diferir el TAR en general, pero ofrecerlo si existe alguna de las condiciones anteriormente enumeradas. |
| IAS-USA9: |
| • Se recomienda iniciar el TAR con grado de firmeza AIa@ en pacientes con: |
| ○ Enfermedades B o C de la clasificación de los CDC. |
| ○ ≤ 350 linfocitos CD4+/μL |
| ○ Mujeres embarazadas |
| • Se recomienda iniciar el TAR con grado de firmeza AIIa en pacientes con: |
| ○ Recuento de linfocitos CD4+ entre 350 y 500 células/μL |
| ○ CVP > 100.000 copias/mL de ARN-VIH. |
| ○ Caída rápida de linfocitos CD4+ (≥ 100 células/año). |
| ○ Coinfección activa por el VHC. |
| • Se recomienda iniciar el TAR con grado de firmeza BIIa en pacientes con: |
| ○ Hepatitis B activa |
| ○ Riesgo cardiovascular elevado. |
| ○ Nefropatía asociada al VIH. |
| ○ Elevado riesgo de transmisión del VIH. |
| • Se recomienda iniciar el TAR con grado de firmeza CIII en pacientes asintomáticos con > 500 linfocitos CD4/μL. |
CDC: Centers for Disease Control; DHHS: Department of Human Health Services de EE.UU.; EACS: European AIDS Clinical Society; GESIDA-PNS: Grupo de Estudio del SIDA de la Sociedad Española de Enfermedades Infecciosas y Plan Nacional sobre el SIDA; IAS-USA: International AIDS Society.
Grados de recomendación:
GESIDA-PNS: A: estudios aleatorizados; B: estudios de cohortes; C: opinión de expertos.
DHHS y IAS-USA: A: recomendación fuerte; B: recomendación moderada; C: recomendación opcional; I: uno o más ensayos clínicos aleatorizados; II: uno o más ensayos no aleatorizados o estudios de cohortes bien diseñados y con resultados a largo plazo; III: opinión de expertos.
Pero, no obstante, las guías que aún no recomiendan tratar abiertamente a todos los individuos VIH-positivos asintomáticos con menos de 500 linfocitos CD4+/μL8, sí consideran hacerlo en los que tienen cifras de dichas células comprendidas entre 350 y 500/μL y, además, presentan determinadas circunstancias o comorbilidades (tabla 3), pues diversos estudios de cohortes21–23 y subanálisis del ensayo SMART24–28 indican que el riesgo de presentar neoplasias y enfermedades cardiovasculares, renales y hepáticas no definitorias de sida es significativamente inferior en los individuos que tienen más de 350 linfocitos CD4+/μL. Con todo, dada la elevada frecuencia con que los individuos infectados por el VIH presentan tales circunstancias o comorbilidades (tabla 3), el número de los que deberían iniciar el TAR aplicando esta recomendación más restrictiva no difiere mucho del de quienes habrían de hacerlo en función de la otra más reciente de tratar a todos los que tengan menos de 500 linfocitos CD4+/μL.
Aunque también existen evidencias de que la mortalidad de los individuos VIH-positivos con más de 500 linfocitos CD4+/μL es mayor que la de las personas no infectadas por el VIH10,13,21 y de que sólo si inician el TAR por encima de dicho dintel se puede equiparar su mortalidad a la de la población general29, los resultados discordantes de los principales estudios de cohortes en esta subpoblación concreta de pacientes14,15,30, determinan que todas las guías de práctica clínica sean más conservadoras a la hora de recomendar el TAR a las personas que se hallan en tal situación inmunológica (tabla 3)6–9.
En presencia de infecciones oportunistas definitorias de sidaLa infección por el VIH se diagnostica muy tarde en un elevado porcentaje de pacientes, muy a menudo junto a infecciones oportunistas (IO) o tumores de categoría C de la clasificación de los CDC. Recientemente, varios estudios han constatado que en estas circunstancias es mejor iniciar el TAR de forma precoz, junto a las terapias específicas de dichas IO, que posponerlo hasta después de haber tratado éstas. A este respecto, el ensayo clínico ACTG A5164, en el cual no se incluyeron pacientes con tuberculosis (TB), ha revelado que la tasa de progresión a sida o muerte en los que iniciaron el TAR de forma precoz (durante las dos primeras semanas de terapia de las IO) fue un 49% menor que la de los que lo iniciaron de forma diferida y que, además, la repoblación de linfocitos CD4+ fue más rápida en aquéllos31. Asimismo, un ensayo clínico exclusivo de pacientes con TB (SAPIT) ha mostrado que la mortalidad de los que iniciaron el TAR de forma temprana fue menos de la mitad de la de los que no lo hicieron hasta haber finalizado la terapia de la TB (5,4 vs 12,1 muertes por 100 pacientes-año)32, lo cual ha corroborado el estudio CAMELIA (8,3% vs 13,8% de mortalidad en los que iniciaron el TAR antes de dos semanas y los que lo hicieron tras ocho semanas de tratamiento antituberculoso, respectivamente), el cual se ha efectuado en pacientes con TB aun más profundamente inmunodeprimidos33. Por ello, en los pacientes con IO, las guías recomiendan iniciar el TAR tan pronto como sea posible, durante el tratamiento de las mismas6–9,34,35. No obstante, en determinadas IO en las que existe un riesgo muy elevado de síndrome inflamatorio de reconstitución inmune (SIRI) o de que éste afecte al SNC, está justificado tratarlas durante un corto periodo de tiempo antes de iniciar el TAR7. Con respecto a éstas, en otros dos ensayos clínicos, la administración precoz del TAR no redujo la mortalidad de la meningitis tuberculosa36 ni de la de la meningitis criptocócica37.
Qué parámetros deben evaluarse antes de iniciar el tratamiento antirretroviralEn la tabla 4 se muestran los parámetros clínicos y biológicos que conviene conocer antes de iniciar el TAR. Con respecto a estos últimos, el número de linfocitos CD4+ es esencial, pues es el mejor marcador del riesgo de progresión clínica de la infección por el VIH1 y el dato más importante para valorar si hay que iniciar el TAR (tabla 3)6–9. Asimismo, debe determinarse la CVP, pues con cierta frecuencia constituye un factor decisivo para iniciar el TAR (tabla 3)6–9 y siempre es un buen complemento de la cifra de linfocitos CD4+1. La prueba genotípica de resistencia tiene como finalidad saber si el paciente ha sido infectado por virus que han desarrollado mutaciones de resistencia frente a uno o más FARV (resistencia primaria o transmitida) para, en tal caso, evitar la inclusión de éstos en el régimen inicial de TAR. La recomendación unánime de esta prueba6–9 se basa en que la prevalencia de resistencia primaria del VIH se mueve en torno al 10% y en que es coste-efectiva. La determinación del tropismo del VIH por los correceptores celulares (CC) antes de iniciar el TAR sólo se exige si uno de los FARV elegidos es un antagonista del CCR56–9, lo cual hasta ahora no se recomienda como práctica habitual6–9.
Parámetros clínicos y analíticos que debe incluir el estudio previo al inicio del tratamiento antirretroviral6–9
| Exploración física: |
| • Debe ser lo más completa posible, incluyendo: altura, peso, presión arterial y perímetro abdominal. |
| Pruebas de laboratorio: |
| • Recuento y porcentaje de linfocitos CD4+,*. |
| • Carga viral plasmática. |
| • Parámetros bioquímicos plasmáticos: |
| ○ Creatinina, sodio, potasio calcio y fosfato. |
| ○ ALT, AST, GGT, bilirrubina total, fosfatasa alcalina, LDH. |
| ○ Glucemia basal, colesterol (total, LDL y HDL) y triglicéridos. |
| • Orina: proteinuria y glucosuria (mediante tira reactiva) y sedimento. |
| • Hemograma: |
| ○ Hemoglobina/hematocrito. |
| ○ Fórmula y recuento de leucocitos. |
| ○ Plaquetas. |
| • Marcadores serológicos de VHB y VHC, si no se han realizado previamente. |
| • Prueba genotípica de resistencia (si no se ha efectuado antes o ha transcurrido un periodo prolongado de tiempo desde que se efectuó en la visita inicial). |
| • HLA-B*5701 (si no se había determinado previamente y se considera incluir abacavir en el TARV de inicio). |
| • Prueba de embarazo en mujeres en edad fértil en las que se considera utilizar efavirenz. |
| Estimaciones indirectas: |
| • Filtrado glomerular (mediante la ecuación MDRD o la de Cockroft-Gault). |
| • Riesgo cardiovascular (mediante la ecuación de Framinghan, SCORE, u otras). |
MDRD: Modification of Diet in Renal Disease. *En determinadas circunstancias como son el uso de fármacos mielosupresores, la esplenectomía o la coexistencia de una infección aguda, el porcentaje de linfocitos CD4+ puede ser más adecuado que la cifra absoluta de los mismos6.
Si no se conoce el estado actual acerca del virus de la hepatitis B (VHB), antes de prescribir el TAR es preciso saber si existe o no coinfección por él, pues en caso afirmativo aquél debe incluir TDF y emtricitabina (FTC) o lamivudina (3TC)6–8, que son también fármacos muy eficaces contra el VHB y constituyen la terapia de elección para la hepatitis B en los pacientes infectados por el VIH. De modo similar, dada la potencial teratogenicidad de efavirenz (EFV), antes de iniciar un régimen de TAR que incluya este ITINN conviene asegurarse de que las mujeres en edad fértil no estén embarazadas6,7. Además, puesto que el no ser portador del alelo HLA-B*5701 tiene un valor predictivo negativo del 100% para la reacción de hipersensibilidad a abacavir (ABC)38, la determinación del mismo es muy útil para descartar una eventual aparición de esta complicación. Por ello, y porque el uso de ABC está proscrito en los portadores del HLA-B*5701, esta prueba, también coste-efectiva, es preceptiva antes de prescribir un régimen que contenga este ITIAN6–9. Por otro lado, ya que la nefrotoxicidad por tenofovir (TDF) resulta mucho más frecuente en pacientes con enfermedad renal previa y que es factible prevenirla detectando la existencia oculta de ésta y evitando el uso de TDF, antes de iniciar el TAR, debe efectuarse también una estimación del filtrado glomerular renal por medio de las fórmulas MDRD (Modification of Diet in Renal Disease) o de Cockroft-Gault e investigar la presencia de proteinuria y glucosuria mediante una tira reactiva en la orina6–9,39. Asimismo, es deseable calcular el riesgo cardiovascular (RCV), pues, como se describe en el apartado siguiente, algunos estudios de cohortes han relacionado el uso de ciertos FARV con un mayor riesgo de infarto agudo de miocardio (IAM), especialmente en los pacientes con un RCV más elevado. Y, además de todos estos parámetros (tabla 4), es esencial conocer la disposición del paciente a comenzar el TAR para actuar en consecuencia y ayudarle, mediante una información detallada y un examen conjunto de los “pros” y “contras” de éste, a superar el miedo al TAR y otras potenciales barreras para su realización8.
Con qué fármacos antirretrovirales debe iniciarse el TARSe recomienda que los regímenes de primera línea de TAR estén formados por dos ITIAN y un “tercer fármaco”, el cual puede ser un ITINN, un IP potenciado con dosis bajas de ritonavir (IP/r) o un inhibidor de la integrasa6–9. Otros posibles regímenes, como el de tres ITIAN formado por ZDV, 3TC y ABC40, o incluso de 4 ITIAN41, tienen una menor eficacia virológica y son más tóxicos, mientras que otros, como los que incluyen dos ITIAN y maraviroc (MVC, un antagonista del CCR5) no cuentan aun con el suficiente apoyo científico para ser recomendados como elección preferente en el TAR de inicio. Actualmente se están evaluando determinados regímenes “libres de ITIAN”, como los integrados por un IP/r y RAL o MVC, pero los datos disponibles de los mismos aun son limitados.
Elección de la pareja de ITIANTDF más FTC6–9 y ABC más 3TC, si bien ésta de forma no unánime y con ciertas reservas6,7, son las parejas de ITIAN preferentemente recomendadas para el TAR de inicio. Ello se debe a la mayor eficacia y seguridad (particularmente en lo que a lipoatrofia y a trastornos metabólicos se refiere) de ambas parejas respecto a la formada por 3TC o FTC y ZDV, o a contar con el apoyo de muchas más evidencias científicas y un menor potencial de toxicidad que la constituida por 3TC o FTC y didanosina (ddI), que son consideradas como alternativas6–9. Otras combinaciones de ITIAN no deben usarse en primera línea de TAR por su elevada toxicidad (como las que incluyen estavudina [d4T]) o por no haber sido evaluadas en pacientes sin TAR previo. Las formulaciones a dosis fijas de TDF/FTC y ABC/3TC son preferidas a la administración de sus componentes por separado6–9,42.
La predilección de algunas guías de práctica clínica por TDF/FTC7,9 y las reservas de otras para usar ABC/3TC en determinadas circunstancias6,8 se basa en datos acerca de una menor eficacia de ABC/3TC en pacientes con CVP superior a 100.000 copias/mL y de una asociación entre su uso y un mayor riesgo de IAM. Respecto a la primera cuestión, el ensayo clínico ACTG 5202 constató que los pacientes con más de 100.000 copias de ARN/VIH que recibían ABC/3TC tardaron un tiempo significativamente menor hasta el primer fracaso virológico y experimentaron más fallos que los tratados con TDF/FTC43. De forma similar, el ensayo clínico ASSERT observó una proporción significativamente mayor de pacientes en fracaso virológico entre los tratados con ABC/3TC que entre los que recibieron TDF/FTC44. Sin embargo, el estudio HEAT, un ensayo clínico aleatorizado y doble-ciego, no registró diferencias significativas entre ambas parejas de ITIAN en lo que respecta a la proporción de pacientes con CVP menor de 50 copias/mL, tanto en los estratos inferiores como en los superiores a 100.000 copias/mL de ARN-VIH45, y lo mismo ocurrió en el reanálisis conjunto de diversos ensayos clínicos en los que uno de los brazos de aleatorización incluía ABC/3TC46. En cuanto al segundo asunto, un estudio de la cohorte D:A:D reveló una asociación entre el uso reciente o acumulado de ABC y el riesgo de IAM, la cual fue más estrecha en los pacientes con un riesgo cardiovascular elevado47. Resultados similares se observaron en los pacientes del brazo de tratamiento continuo del estudio SMART48 y en la cohorte francesa ANRS-CO449. Por el contrario, ni un metanálisis de 52 ensayos clínicos que incluyó 9.052 pacientes tratados con ABC50, ni un estudio de la cohorte HOPS51, entre otros, han observado dicha asociación. En vista de estos datos contradictorios, ningún organismo oficial ha desaconsejado hasta ahora el uso de ABC en la primera línea de TAR y algunas guías solo advierten que ABC/3TC debe utilizarse con precaución en pacientes con una CVP mayor de 100.000 copias/mL o un riesgo cardiovascular elevado6,8.
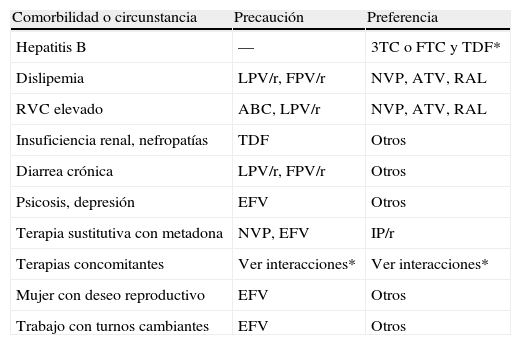
Elección del tercer fármacoTradicionalmente el tercer componente del régimen inicial de TAR ha sido un ITINN o un IP (IP/r en los últimos años) a los que en fechas más recientes se ha unido RAL, un inhibidor de la integrasa6–9. En ausencia de resistencia primaria, los FARV de estas tres familias son muy eficaces, por lo que la elección entre ellos debe ser individualizada. Ésta se basa habitualmente en otros factores (tabla 5), como la coexistencia de ciertas enfermedades, la posibilidad de interacciones relevantes con otros fármacos, las características demográficas del paciente y las preferencias de éste derivadas de su estilo de vida, sus condiciones sociolaborales u otras circunstancias, sin olvidar el embarazo o el deseo gestacional en las mujeres. Las formulaciones a dosis fijas y los regímenes de una sola administración diaria son preferibles porque facilitan el cumplimiento terapéutico6–9,42. A igualdad de condiciones, el precio de los FARV es un factor a tener en cuenta.
Comorbilidades y circunstancias que pueden influir en la elección de los componentes del régimen de primera línea del tratamiento antirretroviral
| Comorbilidad o circunstancia | Precaución | Preferencia |
| Hepatitis B | — | 3TC o FTC y TDF* |
| Dislipemia | LPV/r, FPV/r | NVP, ATV, RAL |
| RVC elevado | ABC, LPV/r | NVP, ATV, RAL |
| Insuficiencia renal, nefropatías | TDF | Otros |
| Diarrea crónica | LPV/r, FPV/r | Otros |
| Psicosis, depresión | EFV | Otros |
| Terapia sustitutiva con metadona | NVP, EFV | IP/r |
| Terapias concomitantes | Ver interacciones* | Ver interacciones* |
| Mujer con deseo reproductivo | EFV | Otros |
| Trabajo con turnos cambiantes | EFV | Otros |
ABC: abacavir; ATV: atazanavir; EFV: efavirenz; FPV/r: fosamprenavir/ritonavir; FTC: emtricitabina; LPV/r: lopinavir/ritonavir; MVC: maraviroc; NVP: nevirapina; RAL: raltegravir; RCV: riesgo cardiovascular; TDF: tenofovir; 3TC: lamivudina.
*http://www.interaccioneshiv.com/
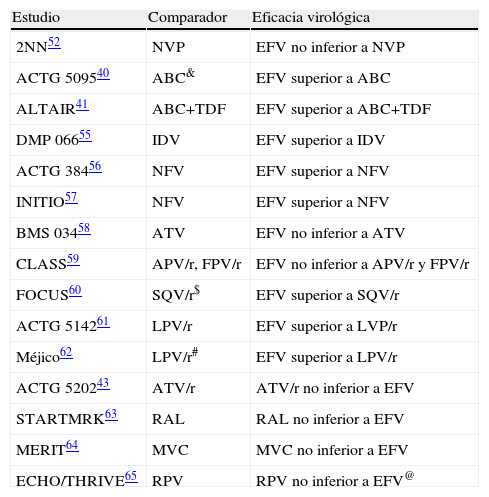
El estudio 2NN52 reveló que nevirapina (NVP) no era inferior a EFV, pero que provocaba toxicidad hepática con mayor frecuencia que éste. Más tarde se constató que la hepatotoxicidad de NVP es más frecuente en los pacientes sin TAR previo con recuentos de linfocitos CD4+ superiores a 250 células/μL (mujeres) o 400 células/μL (varones), lo que contraindica su uso en tales circunstancias. Ello, unido a que NVP solo ha sido comparada con dos IP/r (lopinavir/ritonavir [LPV/r]53 y atazanavir/ritonavir [ATV/r]54) y a que solo en contados ensayos clínicos ha sido combinada con una de las parejas de ITIAN preferentes en la actualidad53,54, ha motivado que diversas guías la consideren una alternativa a EFV6,9. No obstante, su excelente perfil lipídico la convierte en una opción útil para los pacientes con dislipemia o riesgo cardiovascular importante y que tengan cifras de linfocitos CD4+ por debajo de los límites anteriormente referidos. EFV, por el contrario, ha sido comparado con múltiples FARV de diversas familias, ninguno de los cuales ha resultado más eficaz que él (tabla 6)40,41,52,55–65. Sin embargo, debido a su potencial teratogenicidad, debe evitarse durante el primer trimestre de la gestación. Aun no se han publicado datos sobre la eficacia de etravirina (ETR) ni rilpivirina (RPV o TMC278)65 en pacientes sin TAR previo, por lo que no se recomiendan en la primera línea de TAR.
Ensayos clínicos aleatorizados que han comparado la eficacia de efavirenz frente a otros fármacos antirretrovirales de diferentes familias
| Estudio | Comparador | Eficacia virológica |
| 2NN52 | NVP | EFV no inferior a NVP |
| ACTG 509540 | ABC& | EFV superior a ABC |
| ALTAIR41 | ABC+TDF | EFV superior a ABC+TDF |
| DMP 06655 | IDV | EFV superior a IDV |
| ACTG 38456 | NFV | EFV superior a NFV |
| INITIO57 | NFV | EFV superior a NFV |
| BMS 03458 | ATV | EFV no inferior a ATV |
| CLASS59 | APV/r, FPV/r | EFV no inferior a APV/r y FPV/r |
| FOCUS60 | SQV/r$ | EFV superior a SQV/r |
| ACTG 514261 | LPV/r | EFV superior a LVP/r |
| Méjico62 | LPV/r# | EFV superior a LPV/r |
| ACTG 520243 | ATV/r | ATV/r no inferior a EFV |
| STARTMRK63 | RAL | RAL no inferior a EFV |
| MERIT64 | MVC | MVC no inferior a EFV |
| ECHO/THRIVE65 | RPV | RPV no inferior a EFV@ |
ABC: abacavir; APV/r: amprenavir/ritonavir; ATV: atazanavir; ATV/r: atazanavir/ritonavir; EFV: efavirenz. FPV/r: fosamprenavir/ritonavir; IDV: indinavir; LPV/r: lopinavir/ritonavir; MVC: maraviroc; NFV: nefinavir; NVP: nevirapina; RAL: raltegravir; RPV: rilpivirina; SQV/r: saquinavir/ritonavir.
&: en combinación con zidovudina y lamivudina, formando parte de una triple co-formulación a dosis fijas (trizivir®). #: en pacientes con < 200 linfocitos CD4+/μL. $: a dosis de 1.600/100mg en una sola toma diaria. @: en pacientes con < 100.000 copias/mL de ARN-VIH.
Diversos ensayos clínicos aleatorizados han demostrado que en pacientes sin TAR previo la eficacia virológica a 48 semanas de cuatro IP/r (fosamprenavir/ritonavir [FPV/r], saquinavir/ritonavir [SQV/r], ATV/r y darunavir/ritonavir [DRV/r]) es no-inferior a la de LPV/r66–69, el cual, junto a EFV, ha sido durante muchos años el tercer fármaco preferente para el TAR de inicio. Dos análisis recientes han mostrado la superioridad virológica a las 96 semanas de ATV/r70 y DRV/r71 respecto a LPV/r. En relación al primero de ellos, dicha superioridad tuvo su origen en una menor tasa de interrupciones debidas a efectos adversos70, mientras que en el caso de DRV/r fue motivada exclusivamente por una mayor proporción de fracasos virológicos (sobre todo en pacientes con CVP muy elevadas, cifras muy exiguas de linfocitos CD4+ o cumplimiento terapéutico inadecuado)71.
Basándose en estos datos, las guías norteamericanas solo consideran a ATV/r y a DRV/r como IP/r preferentes para la primera línea de TAR, exceptuando a las mujeres embarazadas7,9, mientras que para las de GESIDA/PNS y las de la EACS son preferentes la mayoría de los anteriormente referidos 6,8. En general la elección del IP/r más adecuado para cada paciente depende más de factores tales como el impacto sobre el metabolismo lipídico, la tolerabilidad gastrointestinal, las interacciones farmacológicas específicas, el número de comprimidos diarios, la viabilidad de una sola administración al día, etc., que de posibles diferencias de eficacia virológica entre ellos. En este sentido ATV/r y DRV/r tienen un mejor perfil lipídico, una mejor tolerabilidad gastrointestinal y un menor número de comprimidos72.
Regímenes basados en un inhibidor de la integrasaDesde 2009 las guías de práctica clínica incluyen también a RAL entre los “terceros fármacos” preferentes para conformar el TAR de inicio. Ello se basa en la no inferioridad de la eficacia virológica de RAL respecto a la de EFV, incluso en pacientes con una replicación vírica muy activa o una profunda inmunodeficiencia celular63. No obstante, su precio, más alto que el de otros FARV preferentes, constituye una desventaja para su uso en este contexto.
Seguimiento y control del TARLos parámetros a evaluar en las visitas de seguimiento del TAR son los mismos que los del estudio previo al mismo (tabla 4), exceptuando: los marcadores serológicos de VHB y VHC, la prueba genotípica de resistencia (a menos que el paciente esté en fallo virológico) y la prueba de gestación. Respecto al riesgo cardiovascular, se aconseja calcularlo anualmente.
Carga viral plasmática del VIHEs el parámetro fundamental en el seguimiento de los pacientes que realizan TAR pues constituye el marcador más fehaciente de la respuesta al mismo. El objetivo inmediato del TAR es alcanzar una cifra de CVP inferior a 50 copias/mL con la que se ha comprobado que no se seleccionan mutaciones de resistencia y con la que la respuesta virológica es mucho más duradera que en los pacientes que mantienen cifras de ARN-VIH entre 50 y 500 copias/mL. La CVP desciende rápidamente (1-2 log10) al inicio del TAR y la cifra nadir se correlaciona con la duración de la respuesta73. No obstante, los individuos con CVP muy elevadas pueden tardar hasta 24 semanas en conseguir niveles inferiores a 50 copias/mL. Es conveniente medir la CVP a las cuatro semanas de haber iniciado del TAR para comprobar la respuesta virológica y como medida indirecta de adherencia. Posteriormente se determinará cada 3-6 meses6. Si la CVP se efectúa tras un proceso viral intercurrente o una vacunación, puede haber rebrotes transitorios de la misma. Si se van a tomar decisiones terapéuticas en función de un resultado de la CVP, éste debe ser confirmado con una segunda determinación.
Linfocitos CD4Otro de los objetivos del TAR es la restauración inmunológica y la forma más práctica de valorar ésta es medir el incremento del número de linfocitos CD4+, que ocurre desde las primeras semanas de tratamiento y que suele ser lento, pero constante en el tiempo. Sin embargo, no hay datos que definan cuál es una respuesta inmunológica adecuada. Se admite, según estudios de cinética celular, que durante el primer año debería existir un aumento mínimo de 50-100 linfocitos CD4+/μL, pero no es raro observar una discordancia entre las respuestas virológica e inmunológica: pacientes que mantienen una cifra de células CD4+ estable o que disminuye a pesar de tener una CVP indetectable74. En los individuos asintomáticos debe medirse la cifra de linfocitos CD4+ cada 3-6 meses6 y ante un hallazgo que oriente a tomar una decisión terapéutica debe repetirse en 3-4 semanas.
Detección de resistencias del VIH a fármacos antirretroviralesLas variantes víricas resistentes pueden detectarse mediante técnicas genotípicas o fenotípicas75. Las genotípicas detectan cambios específicos en los genomas de las enzimas diana de los FARV (transcriptasa inversa, proteasa, integrasa, envuelta viral), mientras que las fenotípicas determinan la respuesta de la población viral mayoritaria a concentraciones crecientes de los distintos FARV. Ambas comparten limitaciones como la dificultad de detección cuando la población mutada es inferior al 20% de la población viral total o la CVP es inferior a 1.000 copias/mL, aunque varias técnicas han conseguido superarlas. Las pruebas de resistencia deben realizarse durante la realización activa del TAR, ya que la población viral resistente es sustituida por otra sensible a las pocas semanas de retirar los FARV. Los resultados de estas pruebas deben interpretarse teniendo en cuentas los estudios previos de resistencia, la historia terapéutica y la adherencia del paciente. En la práctica asistencial se considera indicada la realización de técnicas genotípicas de detección de resistencias para guiar los cambios de TAR motivados por fracaso virológico.
Determinación del tropismo viralSe recomienda efectuar siempre una prueba de tropismo antes de iniciar el tratamiento con un antagonista del CCR56. Existe una técnica fenotípica ultrasensible (Trophile®), que detecta hasta un 0,3% de poblaciones X4 o duales/mixtas, y técnicas genotípicas consistentes en la secuenciación de la región V3 de la proteína gp120. La primera tiene los inconvenientes de su elevado coste y de necesitar más de 1.000 copias/mL de ARN-VIH para su realización, mientras que las genotípicas, aún no comercializadas pero al alcance de bastantes laboratorios, tienen la ventaja de ser más rápidas y económicas.
Adherencia terapéuticaSe entiende por adherencia al TAR la capacidad del paciente para implicarse correctamente en la elección, inicio y cumplimiento del mismo a fin de conseguir una adecuada supresión de la replicación viral. El control virológico depende de múltiples factores, pero la adherencia incorrecta es la principal causa de fracaso terapéutico, relacionándose con una mala respuesta virológica, una peor reconstitución inmune y un mayor riesgo de mortalidad76. Por tanto, es muy importante que los pacientes sean conscientes de su enfermedad, entiendan claramente el objetivo del TAR, participen en la decisión de iniciarlo, se sientan capaces de cumplir dicho tratamiento y comprendan la enorme importancia que tiene una toma continuada y correcta de la medicación.
Durante la realización del TAR es fundamental evaluar periódicamente la adherencia, que siempre debe ser tenida en cuenta en las decisiones terapéuticas. Dado que no existe un método fiable de evaluación de la adherencia, se recomienda utilizar varios de ellos, tales como entrevistas, cuestionarios estructurados (algunos de los cuales están validados en España77), recuento de medicación, etc.
Modificación del TAR por fracaso del tratamientoDefinición de fracaso terapéuticoEl fracaso del TAR puede definirse de tres formas: 1) Fracaso virológico: imposibilidad para alcanzar o mantener la máxima supresión virológica; 2) Fracaso inmunológico: disminución progresiva del recuento de linfocitos CD4+; y 3) Fracaso clínico: progresión de la enfermedad. El fracaso virológico ocurre cuando un régimen de TAR no consigue reducir la CVP hasta niveles indetectables (respuesta virológica incompleta) o cuando ésta se eleva de nuevo después de haber alcanzado una supresión inicial. La reducción de la CVP por debajo del límite de detección ocurre habitualmente entre la semanas 24 y 36 de tratamiento, aunque esto puede variar dependiendo de la CVP inicial y de la potencia del régimen utilizado. Por ello, la mayoría de las guías de TAR definen aquél como una medición repetida de la CVP por encima de 400 copias/mL después de 24 semanas de tratamiento o por encima de 50 copias/mL después de 48 semanas de de tratamiento6. En la práctica clínica, los fracasos inmunológico y clínico son menos importantes que el fracaso virológico, aunque resultan muy relevantes en aquellos pacientes en que no es posible alcanzar la supresión completa.
Estrategias iniciales contra el fracaso del tratamientoCuando existe un fracaso del TAR, la prioridad principal es determinar la causa del mismo, pues el enfoque terapéutico dependerá totalmente de ésta. Los motivos más comunes de fracaso virológico son:
- a)
Mal cumplimiento terapéutico
Debe preguntarse a los pacientes acerca de su adhesión al TAR de forma abierta y sin emitir juicios. Es más probable que sean honestos en lo relativo a su cumplimiento si entienden la relación entre adherencia, fracaso terapéutico, resistencia farmacológica y elección de un nuevo régimen de TAR.
- b)
Toxicidad farmacológica
Los efectos secundarios y la toxicidad de los FARV pueden conducir al incumplimiento terapéutico y al fracaso del TAR si no se solucionan rápidamente. Una vez se haya identificado al agente causante del problema, si no hay ninguna razón para sospechar la existencia de resistencia farmacológica, puede utilizarse un FARV diferente de similar o mayor potencia pero con un perfil distinto de efectos adversos.
- c)
Factores farmacocinéticos
Los pacientes con buen cumplimiento terapéutico pueden fracasar al TAR debido a la existencia de niveles plasmáticos inadecuados de los FARV. El médico debe preguntar al paciente acerca de la pauta cronológica de la toma de cada dosis, la administración de las mismas con o sin comida y la utilización de otros tratamientos concomitantes, incluyendo medicamentos sin receta médica y terapias naturales, todos los cuales pueden interactuar con los FARV. Los vómitos y la diarrea pueden disminuir la absorción de éstos.
- d)
Resistencia a los fármacos antirretrovirales
Es importante considerar si el fracaso puede ser causado por resistencia viral a uno o más de los componentes del régimen de TAR, debido a un virus mutante preexistente o adquirido, por lo que si el número de copias/mL de ARN-VIH es suficiente para realizarlo, debe efectuarse un análisis de la resistencia.
El objetivo virológico inicial del TAR es la supresión completa de la replicación del VIH. Existen firmes evidencias acerca de que la consecución de este objetivo disminuye sustancialmente el riesgo de progresión clínica, aumenta el número de células CD4+ y reduce el riesgo de resistencia farmacológica. Suprimir la CVP por debajo de 50 copias/mL es mucho más difícil en los pacientes previamente tratados con resistencia a varios tipos de FARV, pero éste debe seguir siendo el principal objetivo terapéutico en ellos, especialmente tras la incorporación al arsenal terapéutico de nuevos FARV pertenecientes a nuevas familias con nuevos mecanismos de acción. Solamente si es imposible alcanzar este objetivo en un paciente concreto, deberían considerarse otras alternativas.
Antes de seleccionar un nuevo régimen, el médico debe revisar el historial de TAR y las causas de fracaso terapéutico, realizar una prueba de resistencia y considerar ésta en el contexto de TAR anteriores y de los resultados de otras pruebas de resistencia previas.
Efecto de las mutaciones preexistentes sobre la actividad de los nuevos fármacosNormalmente son escasos los datos relativos a la relevancia de las mutaciones que confieren resistencia a los nuevos FARV, y especialmente a aquéllos todavía en proceso de investigación. Sin embargo, es importante reconocer que los nuevos FARV presentan generalmente una actividad antiviral disminuida cuando frente a otros de su misma clase se han desarrollado mutaciones que disminuyen la susceptibilidad viral, incluso si se presume que el nuevo fármaco es aun activo. Por ejemplo, el análisis fenotípico indica frecuentemente que ABC y TDF serán activos en pacientes que han recibido previamente otros ITIAN, pero la respuesta virológica en ellos está a menudo atenuada en relación a la de quienes jamás han tomado dichos fármacos y empiezan un régimen que contiene ABC y TDF. Los pacientes con un elevado nivel de resistencia a ITIAN que comienzan a tomar un régimen que contiene uno de estos agentes a menudo tienen una respuesta mínima o inexistente.
Los datos de los estudios con tipranavir (TPV) y DRV indican que la respuesta a estos agentes depende en gran medida del número y tipo de mutaciones a IP que un paciente tiene cuando comienza a administrárseles. Para entender mejor qué mutaciones afectan la respuesta a TPV y DRV se ha desarrollado una puntuación o score para cada uno de dichos IP78,79, y lo mismo ha ocurrido con el ITINN de segunda generación ETR80.
Utilización de fármacos activos para construir un nuevo régimenLas directrices de TAR recomiendan la utilización del historial terapéutico del paciente y los resultados de sus pruebas de resistencia pasadas y actuales para diseñar un nuevo régimen con múltiples FARV activos (preferiblemente tres o más)6–9. Los factores asociados a una mejor respuesta virológica al TAR de rescate en pacientes con múltiples fracasos virológicos previos fueron determinados por primera vez en los estudios TORO 1 y 2, sendos ensayos clínicos de fase III con enfuvirtida (ENF o T20) que evaluaron este inhibidor de la fusión en combinación con un tratamiento de base optimizado (TBO)81. El TBO más ENF obtuvo una tasa de repuesta virológica dos veces mayor que el TBO solo82 y en los análisis adicionales para determinar qué pacientes tuvieron mejores resultados con ENF, el mayor efecto beneficioso se observó en los que presentaban: 1) Un mayor recuento basal de células CD4+ (más de 100 células/μL); 2) Menores cifras de CVP basal (menos de 100.000 copias/mL); 3) Menor número de regímenes previos de TAR (menos de 11 FARV en el historial terapéutico), y 4) Presencia de al menos dos FARV activos en el nuevo régimen. Los pacientes con estos cuatro factores predictivos positivos tuvieron una probabilidad del 80% de lograr una CVP indetectable con ENF frente a una del 55% con TBO solo82. La importancia de incluir varios FARV activos en un régimen de rescate ha sido demostrada también en diversos ensayos clínicos en fase III con TPV/r (RESIST 1 y 2)83, DRV/r (POWER 1 y 2)84, RAL (BENCHMRK 1 y 2)85, MVC (MOTIVATE 1 y 2)86,87 y ETR88.
Así pues, un objetivo poco realista hasta hace poco tiempo como era el de lograr una CVP inferior a 50 copias/mL en pacientes con múltiples fracasos virológicos previos parece ahora definitivamente al alcance de la mayoría de los pacientes gracias a la aparición de nuevos FARV de nuevas familias con nuevos mecanismos de acción.
Cuándo comenzar un nuevo régimen supresorEl momento ideal para empezar un nuevo régimen es cuando éste tiene una posibilidad razonable de suprimir completamente la replicación del VIH. Cuando se dispone de nuevos FARV, especialmente si no se cuenta con varios de ellos de forma simultánea, es posible utilizarlos demasiado pronto o demasiado tarde. Demasiado pronto significa utilizar un nuevo FARV potente cuando el paciente puede que no necesite un cambio de tratamiento. En particular, en una persona inmunológicamente estable con un recuento de linfocitos CD4+ relativamente alto puede ser más prudente esperar hasta que se disponga de varios FARV para maximizar las posibilidades de éxito. Se considera que se ha cambiado a un nuevo régimen demasiado tarde cuando los ITIAN o IP disponibles han sido utilizados en serie hasta haber desarrollado éstos una amplia resistencia cruzada, tras lo cual no quedan suficientes FARV para formar un nuevo régimen de TAR.
Modificación del TAR por simplificaciónLa simplificación del TAR consiste en cambiar un régimen terapéutico que ha conseguido la supresión de la replicación viral por otro más sencillo que sigue manteniendo dicha supresión6. Sus objetivos son: mejorar la calidad de vida, facilitar la adherencia y prevenir o revertir determinados efectos adversos. Pero, además, con la simplificación se puede aprovechar la comodidad de las coformulaciones de FARV a dosis fijas, eliminar las restricciones alimentarias y reducir o eliminar las interacciones farmacológicas6.
Se puede simplificar el TAR reduciendo el número de FARV, de comprimidos o de tomas. En lo que concierne al primer punto, la estrategia más en boga es la simplificación de un régimen triple de un IP/r más dos ITIAN a monoterapia con IP/r. Sendos ensayos clínicos aleatorizados han demostrado la no inferioridad en cuanto a eficacia virológica de la monoterapia con LPV/r y DRV/r, en pacientes sin historia de fracaso previo a dichos fármacos y con una CVP inferior a 50 copias/mL durante al menos los seis meses previos al cambio a monoterapia89,90. Otra estrategia de este mismo grupo consiste en suprimir la potenciación con RTV a un régimen compuesto por ATV/r y dos ITIAN, con el fin de evitar los efectos lipídicos o gastrointestinales asociados a RTV. Respecto a la reducción del número de comprimidos y/o de dosis, la estrategia más estudiada ha sido la sustitución de un IP/r por ATV o un FARV de otra familia, habitualmente NVP, EFV o RAL. Por último, existen múltiples posibilidades de simplificar a regímenes de una sola administración diaria, lo cual ha constituido una práctica habitual durante los últimos años. Todas estas estrategias y las evidencias científicas que las soportan, se analizan con detalle en el documento de consenso de GESIDA y el Plan Nacional sobre el Sida acerca del TAR en adultos6.
Tratamiento antirretroviral en situaciones especialesHepatopatías crónicasEn pacientes coinfectados por el VHC o el VHB se debe adelantar el inicio del TAR por encima de 350 CD4+/μL, individualizando la decisión en función de variables virológicas e histopatológicas así como de la motivación del paciente6. Las hepatopatías crónicas pueden alterar el metabolismo y la biodisponibilidad de los FARV, dando lugar a un incremento de toxicidad o a una alteración de la actividad antiviral6. La hepatitis crónica sin insuficiencia hepatocelular es una situación muy frecuente y la experiencia acumulada sugiere que en ella se pueden usar los FARV a las dosis habituales y que la eficacia de éstos no está comprometida. Sin embargo en la insuficiencia hepatocelular se reduce el metabolismo de fármacos por la vía del citocromo P450 y la glucuronoconjugación. En general se considera que el TAR no debe iniciarse simultáneamente con la terapia de la hepatitis crónica C91,92 y que cuando se traten a la vez la infección por el VIH y ésta debe realizarse un seguimiento estrecho del paciente para detectar reacciones adversas..No debe asociarse ribavirina con ddI y debe evitarse el uso simultáneo de ribavirina y ZDV91,92. En todo paciente coinfectado por el VIH y el VHC ha de procurarse que las dosis de ribavirina se ajusten al peso del paciente. Esta recomendación debe extremarse en caso de tratamiento concomitante con ABC, pero no se considera necesario modificar la estrategia de monitorización del VIH durante el tratamiento simultáneo de la infección por VHC91,92.
Embarazo y profilaxis de la transmisión materno-fetalCon el fin primordial de prevenir la transmisión vertical del VIH, se recomienda la realización de TAR en toda mujer embarazada, independientemente de cuál sea su estado clínico, inmunológico o virológico6–9,93,94. El objetivo primario del TAR en la gestación es como en cualquier paciente infectado por el VIH suprimir la replicación viral, pero, puesto que el riesgo de transmisión del VIH es mucho mayor durante el parto, es de capital importancia que la mujer llegue a éste con CVP indetectable. Si este objetivo no se logra está indicada la realización de cesárea motivo por el que debe conocerse la CVP antes del parto.
Hay que realizar siempre una prueba genotípica de resistencia antes de iniciar el TAR si la mujer no ha sido tratada previamente o si realizando aquél presenta una CVP detectable. El régimen de TAR debe incluir tres FARV activos6–9,93,94. En base a los resultados de un ensayo clínico con ZDV en monoterapia95 se recomienda que, a menos que exista resistencia o antecedentes de toxicidad, uno de ellos sea ZDV, que debe administrarse a la gestante durante el embarazo y el parto (en perfusión intravenosa) así como al recién nacido durante el primer mes de vida6–9. Debido a cambios de su farmacocinética durante la gestación, en especial en el tercer trimestre, los IP/r no alcanzan a menudo sus concentraciones plasmáticas óptimas8, aunque no se conoce la relevancia clínica de este hecho ni existen recomendaciones al respecto. El régimen de elección es LPV/r más ZDV y 3TC6–9,93,94. Se desaconseja el uso de monoterapia con NVP o la administración de una dosis única de este ITINN durante el parto, pues induce con frecuencia el desarrollo de resistencia6. Está contraindicada la combinación de d4T y ddI, por riesgo de acidosis láctica, el inicio del TAR con NVP en mujeres no tratadas previamente y con más de 250 linfocitos CD4+/μL, por mayor riesgo de hepatotoxicidad, y el uso de EFV durante el primer trimestre de gestación6–9.
Otras situaciones especialesMuchos de los FARV se excretan principalmente por vía renal y algunos son nefrotóxicos. Por ello, en presencia de insuficiencia renal (IR), la exposición a dichos FARV puede aumentar de forma importante y con ello la posibilidad de que induzcan toxicidad. Como es norma general, cuando existe IR la dosificación de los fármacos debe ajustarse en función del aclaramiento de creatinina y monitorizarse las manifestaciones de toxicidad propias de la acumulación de cada uno ellos39,96. Los ajustes de dosis necesarios según el grado de afección renal pueden consultarse en las dos artículos anteriormente citados39,96.
El tratamiento de las comorbilidades que se asocian a la infección por el VIH y de los efectos adversos del TAR puede originar interacciones entre éste y los fármacos utilizados para tratar dichas complicaciones. Los efectos de los FARV sobre el metabolismo de tales fármacos o viceversa pueden consultarse en programas informáticos destinados al efecto97 o en revisiones específicas sobre el tema98.
Conflicto de interesesEl Dr. Fernando Lozano ha efectuado labores de consultoría para Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithkline, Janssen, Merck-Sharp & Dome, Pfizer, Roche Pharmaceuticals y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithkline, Jansen, Merck-Sharp & Dome, Pfizer, Roche Pharmaceuticals y ViiV Healthcare.
El Dr. Pere Domingo ha efectuado labores de consultoría para Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare.
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formacion.