Introducción
El tratamiento antirretroviral (TARV) con las nuevas terapias ha conseguido una importante disminución de la mortalidad y la morbilidad en los pacientes infectados por el virus de la inmunodeficiencia humana (VIH). En estos últimos años han surgido importantes limitaciones como los efectos adversos, las dificultades del cumplimiento y el desarrollo de resistencias. A pesar de disponer de nuevos fármacos más cómodos, potentes y con diferentes o mejores perfiles de tolerancia que permiten una secuenciación de éstos, las opciones siguen siendo limitadas, por lo que deben preservarse opciones futuras de tratamiento. Por otra parte, se ha constatado que con los fármacos actuales no es posible la erradicación del virus1, lo cual, junto a las limitaciones de aplicación en la clínica de otras estrategias como las interrupciones estructuradas de tratamiento2 plantean que el TARV hoy día sea para toda la vida. En este contexto, el que un paciente inicie antes o después el TARV, representa variar el tiempo de exposición a los fármacos y, por lo tanto, obviar al menos parcialmente estos inconvenientes. Esto debe contrapesarse con el riesgo de progresión a sida o muerte que pueda conllevar iniciar el TARV más tardíamente. Desde la anteriores recomendaciones de GESIDA/PNS3 se han publicado diversos estudios observacionales de cohortes que pueden ayudar a la toma de decisiones en este sentido. Aunque no se han producido cambios sustanciales en lo referido a la disponibilidad de nuevos fármacos, existen algunas aportaciones que deben ser incluidas. Cuándo y con qué fármacos empezar la terapia depende de numerosos factores que obligan a individualizar el TARV en cada paciente. A continuación, se analizan aquellos datos clínicos de mayor relevancia desde la publicación de la anterior guía, ya que otros aspectos más específicos se tratan en otros apartados.
Infección aguda por el VIH-1
El TARV en la infección aguda por el VIH-1 es un tema de debate como lo demuestra el hecho de que existan recomendaciones contrapuestas en las diferentes guías3,4.
Sabemos que el TARV en la infección aguda proporciona beneficios claros, tanto sobre la recuperación inmunitaria como sobre el control de la infección por el VIH con disminución, pero no eliminación, del ADN proviral5-7. Sin embargo, no se conocen datos sobre la evolución clínica a largo plazo, porque el TARV en la infección aguda conlleva el riesgo de sobretratamiento en pacientes que conseguirían de manera espontánea un punto de equilibrio de la carga viral y una cifra de CD4 aceptables. Debe tenerse en cuenta que aunque el TARV es bien tolerado en general, puede ocasionar algunos efectos adversos como la lipodistrofia en un porcentaje similar al de los pacientes con infección establecida o crónica8.
Para tratar de mejorar el control de la infección y minimizar estos inconvenientes se han explorado diversas estrategias terapéuticas. La combinación de TARV con interferón alfa (IFN-α) es bien tolerada y consigue el control de la replicación viral en plasma y en ganglios linfáticos9, Girard et al10 observaron que 5 de 9 pacientes en los que se interrumpió el TARV tras 12 meses, mantuvieron a los 18 meses sin terapia una carga viral reducida, por lo que la interrupción definitiva del TARV podría ser una estrategia a considerar en algunos casos. Las interrupciones estructuradas de tratamiento en la infección aguda tratan de restaurar la capacidad del individuo de controlar la replicación del VIH mediante el desarrollo de respuesta inmunitaria específica. Los datos actuales se basan en ensayos con macacos en los que se demostró mejor respuesta en aquellos que siguieron interrupciones estructuradas de tratamiento que los que recibieron TARV y en un número reducido de casos clínicos11-13. En un estudio español que incluyó 12 pacientes que lograron carga viral indetectable tras 4 ciclos de 2 meses sin tratamiento y dos con tratamiento, solo o combinado con interleucina 2 (IL-2), se observó que 7 de los 12 pacientes alcanzaron carga viral indetectable en plasma y ganglio linfático y una respuesta linfoproliferativa específica adecuada. No encontraron resistencias genotípicas14. En todos estos estudios los pacientes estudiados son escasos y los períodos de seguimiento son cortos. Sin embargo, estos datos son prometedores e inciden en la necesidad de seguir explorando nuevas estrategias terapéuticas, aunque sean poco concluyentes en relación a su aplicación clínica actual.
Por lo tanto, no existen nuevos datos que induzcan a cambiar la anterior recomendación de GESIDA/PNS3. No se dispone de evidencias científicas concluyentes como para recomendar TARV a todos los pacientes con infección aguda por el VIH-1. Se puede considerar individualmente, si un paciente expresa su deseo de iniciar el TARV tras habérsele explicado las ventajas e inconvenientes, o presenta síntomas graves asociados con la infección aguda.
Infección establecida por el virus de la inmunodeficiencia humana
El TARV presenta ventajas e inconvenientes. Entre las primeras se encuentran la mejoría de la mortalidad y la morbilidad, consecuencia de la recuperación del número y funciones de los linfocitos T, así como una mejora de la respuesta proliferativa frente a antígenos, lo cual ha permitido suprimir las profilaxis secundarias frente a determinadas infecciones oportunistas, aunque la inmunidad específica frente al VIH no se recupera en todos los casos (tabla 1). Entre los inconvenientes están la toxicidad a medio-largo plazo, los problemas de cumplimiento, la aparición de resistencias, las interacciones con otros fármacos, el impacto sobre la calidad de vida, así como la potencial limitación de futuras opciones terapéuticas (tabla 2).
Aunque existen datos de que la recuperación inmunitaria es mejor y más completa cuando se interviene en fases iniciales que cuando se efectúa tardíamente15,16, no se conoce el beneficio a largo plazo ni el "precio" que deba pagarse por ello con los fármacos actuales. Salvo para los pacientes sintomáticos o asintomáticos con cifras de CD4 inferiores a 200 cél./μl, no existen datos que indiquen cuál es el momento óptimo para iniciar el TARV, ya que se carece de estudios prospectivos que comparen las administraciones precoz y tardía con los regímenes antirretrovirales combinados actuales. Hoy día se sabe que con los fármacos disponibles no es posible erradicar el VIH-1 y que las interrupciones estructuradas de tratamiento en la infección crónica tienen aún limitaciones en su aplicación clínica1,2. Por todo ello, el TARV debe considerarse una terapia de por vida. En este contexto, el inicio precoz o tardío del TARV modifica de modo importante el tiempo de exposición a los fármacos y evitar, al menos transitoriamente, algunos de los inconvenientes del tratamiento. Esto hay que sopesarlo con el riesgo de progresión a sida o muerte en ausencia de tratamiento y que ya quedó establecido hace algunos años en función de los valores basales de CD4 y de la carga viral17.
Desde la anteriores recomendaciones del Plan de Sida/ GESIDA3 se han publicado los resultados de estudios observacionales de cohortes que pueden ayudar a la toma de decisiones en este sentido18-24.
Estos trabajos podrían agruparse en dos apartados:
1. Estudios de cohortes de pacientes con y sin tratamiento18,19.
2. Estudios observacionales de cohortes de la respuesta al tratamiento según la situación basal al inicio del tratamiento20-24.
En la cohorte del hospital John Hopkins18 se observó que los pacientes con cifras de CD4 inferiores a 200 cél./μl que recibieron tratamiento presentaron una menor progresión a sida y muerte que los que permanecieron sin tratamiento. Sin embargo, iniciar o no el TARV no produjo diferencia en la progresión clínica o mortalidad en los pacientes con CD4 entre 200-350 cél./μl o con más de 350 cél./μl basales. La carga viral basal no supuso diferencia en el riesgo de presentar enfermedad definitoria de sida o muerte en ninguno de los estratos de CD4 y la variable más fuertemente asociada con progresión de la enfermedad fue una cifra de CD4 inferior a 200 cél./μl. En contraposición con estos datos, en la cohorte suiza19 se encuentra diferencia en eventos B y C y mortalidad en el grupo de pacientes con CD4 de más de 200 cél./μl que no siguieron tratamiento. Estas complicaciones aparecieron de manera significativa antes de que la cifra de CD4 descendiera por debajo de 200 cél./μl. Este trabajo sugiere que existe morbimortalidad en el rango de CD4 entre 200-350 cél./μl y que el riesgo de retrasar el tratamiento por debajo de 350 cél./μl no debe menospreciarse. En este mismo estudio19 se encontró una alta incidencia de efectos adversos entre los que iniciaron el TARV.
En los estudios de cohortes que analizan la respuesta al TARV según la situación basal al inicio del mismo, deben diferenciarse los datos clínicos20-22 de los virológicos e inmunológicos23,24.
Los resultados clínicos son similares, aunque con algunas diferencias20-22. En la cohorte de Canadá, en el análisis univariable, se encontró una relación entre progresión a sida y muerte en los pacientes con carga viral basal superior a 100.000 copias/ml, cifra de CD4 inferior a 200 cél./μl y existencia previa de infecciones oportunistas. En el análisis multivariante únicamente la cifra de CD4 se relacionó con la mortalidad20. Estos datos se confirman en otros dos estudios de cohortes21,22, y solamente en la cohorte de Alabama, se observa un aumento de la mortalidad en aquellos pacientes con una carga viral basal superior a 50.000 copias/ml22. En ninguno de estos estudios encuentran diferencias en la evolución en función de edad, sexo o raza.
En lo relativo a datos de respuesta inmunológica o virológica23,24, se observó que el incremento de CD4 tras TARV es igual en todos los grupos con independencia del valor basal de CD4. En relación a la respuesta virológica, los pacientes con cifras de CD4 inferiores a 200 cél./μl presentaron un mayor riesgo de fracaso virológico respecto a los que empezaron con más de 350 cél./μl, pero no hubo diferencias de fracaso virológico en los pacientes con cifras entre 200-350 cél./μl y los de más de 350 cél./μl. La carga viral basal no aumentó el riesgo de fracaso virológico en ninguno de los estratos de CD4, aunque los pacientes con carga viral superior a 100.000 copias/ml tuvieron una supresión más lenta de la viremia plasmática24. Por otra parte, confirma el incremento de mortalidad o evolución a sida de los que empezaron con cifras de CD4 de menos de 200 cél./μl, pero no encuentra diferencias clínicas entre los que empezaron entre 200-350 cél./μl y más de 350 cél./μl24. Las limitaciones de estos estudios son el tiempo corto de seguimiento, en particular entre los pacientes con linfocitos CD4 entre 200-350 cél./μl. Estos resultados discrepan parcialmente con ciertos estudios observacionales previos25,26 y con los estudios de marcadores de progresión de la cohorte del MACS17. Aspectos a favor son el gran número de pacientes y lo reproducible de los resultados.
Los estudios mencionados expresan cuándo es demasiado tarde, no cuál es el momento idóneo para iniciar el TARV. Podría concluirse que:
1. El inicio del tratamiento debe poner más énfasis en la cifra de CD4 que en la carga viral. La depleción de CD4 es más rápida con valores más altos de carga viral y debería controlarse más estrechamente a los pacientes con cargas virales elevadas.
2. Se confirma el límite inferior de la cifra de CD4 de menos de 200 cél./μl a partir del cual la respuesta al tratamiento es peor. Esto recuerda la importancia del diagnóstico precoz de la infección, sobre todo en nuestro medio, en que aún existe una proporción considerable de diagnósticos tardíos28.
3. A corto y medio plazo, los pacientes con cifras de CD4 superiores a 350 cél./μl no parecen tener mayor riesgo por no iniciar el TARV incluso con cargas virales superiores a 100.000 copias/ml.
4. A corto y medio plazo no hay diferencias significativas en lo relativo a progresión clínica ni respuesta virológica o inmunológica si se empieza tratamiento con cifras de CD4 entre 200-350 cél./μl o con más de 350 cél./μl. No obstante, los pacientes con CD4 entre 200-350 cél./μl pueden tener un mayor riesgo a corto-medio plazo de progresión clínica o muerte.
Por otra parte, hay que considerar que la respuesta al tratamiento es compleja y sobre ella pueden influir factores diversos como sistema de antígenos de histocompatibilidad (HLA), genotipo viral, etc. Por ello, son necesarios nuevos datos que permiten establecer factores pronósticos más individualizados29-31.
A la hora de tomar decisiones sobre el inicio del TARV, además de los datos referidos al riesgo de progresión de la enfermedad, deben valorarse los beneficios e inconvenientes del TARV (v. tablas 1 y 2), y la disposición del paciente. Las recomendaciones que se exponen a continuación deben tomarse como orientaciones y no como guías absolutas.
Recomendaciones
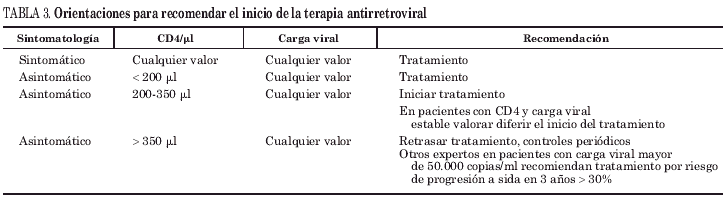
Las recomendaciones actuales se resumen en la tabla 3 y pueden concretarse en:
1. Mantener la recomendación de TARV en pacientes sintomáticos con independencia de la cifra de CD4 y carga viral, así como para los pacientes asintomáticos con cifras de CD4 inferiores a 200 cél./μl, sea cual sea la carga viral.
2. Los pacientes con CD4 entre 200-350 cél./μl deberían iniciar el TARV. Ciertos pacientes con CD4 estables en torno a 350 cél./μl y con viremia controlada podrían posponer el inicio del TARV siempre que siguieran controles estrechos.
3. Los pacientes con CD4 de más de 350 cél./μl podrían posponer el TARV con independencia de la viremia plasmática. Se debería controlar más estrechamente a aquellos con cargas virales elevadas e instaurar tratamiento según la evolución de la pendiente de descenso de los CD4. Una aproximación más agresiva indicaría tratamiento a todos los pacientes con cifras de CD4 superiores a 350 cél./μl y con carga viral plasmática superior a 55.000 copias/ml dado el riesgo de progresión a sida del 30% en 3 años17.
Con qué fármacos iniciar el tratamiento antirretroviral
No ha habido avances sustanciales en lo que se refiere a medicamentos desde las anteriores recomendaciones de GESIDA/PNS del año 20003 que modifiquen de manera significativa el TARV, aunque sí algunos datos que deben considerarse.
Para escoger un TARV inicial no sólo debe valorarse la potencia intrínseca de los fármacos, sino también el número de comprimidos, requerimientos alimentarios, efectos adversos a corto y largo plazo, interacciones farmacológicas y precio. Se deben valorar nuevos factores de comorbilidad, sobre todo la coinfección con virus de hepatitis B y C, que pueden representar un factor de riesgo añadido para una mayor incidencia de hepatotoxicidad grave con algunos fármacos32,33. En pacientes sintomáticos o muy inmunodeprimidos con CD4 menores de 50 μl las combinaciones de 2 inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) más un inhibidor de la proteasa (IP) son las que presentan una eficacia mejor documentada. En pacientes con menor inmunosupresión (CD4 > 50 μl) se ha demostrado que la eficacia de efavirenz (EFV) es similar o superior a la de los regímenes con IP, por lo que sería indistinto comenzar con 2 ITIAN + IP o con 2 ITIAN + EFV34,35. Los regímenes de 2 ITIAN con nevirapina (NVP) y la combinación de 3 ITIAN han demostrado ser eficaces, pero se dispone de escasos datos de eficacia de NVP en pacientes con carga viral superior a 100.000 copias/ml, y la eficacia para las combinaciones con 3 ITIAN (abacavir [ABC]) parece de menor duración en pacientes con carga viral superior a 100.000 copias /ml que la de las pautas con IP36-38.
Las nuevas combinaciones de ritonavir (RTV) con otros IP permiten mejorar la farmacocinética y la potencia de acción contra determinadas cepas virales con sensibilidad disminuida39-42, aunque existan pocos datos de la eficacia clínica en pacientes sin TARV previo43-46.
Deben considerarse las nuevas formulaciones de fármacos previamente disponibles (didonasina [ddI] con cubierta entérica, estavudina [d4T] de liberación retardada), las nuevas pautas simplificadas (NVP o lamivudina [3TC]) o las formulaciones de combinaciones de fármacos (zidovudina [AZT] + 3TC, AZT + 3TC + ABC) que ofrecen mayor comodidad y similar garantía de eficacia y seguridad47-50.
Inhibidores de la transcriptasa inversa análogos de nucleósidos
Las pautas de 2 ITIAN combinadas con otro fármaco constituyen la base del TARV. No se recomienda la asociación AZT + d4T por antagonismo y se aconseja evitar aquellas que puedan suponer una potenciación de su toxicidad (zalcitabina [ddC] + ddI, ddI o d4T + hidroxiurea [HU])51. Las pautas que combinan AZT + ddI, AZT + 3TC, d4T + ddI y d4T + 3TC son de eficacia similar y bien documentada52,53. Varios estudios comparan la eficacia de ITIAN en pautas simplificadas. Las pautas que incluyen las nuevas formulaciones de ddI-CE y d4T administrada 1 vez al día son de eficacia similar a las pautas previas de 2 veces al día47,48. La formulación de AZT + 3TC + ABC en un solo comprimido es similar a AZT + 3TC + ABC en formulaciones independientes49,50. Recientemente se ha aprobado por la Agencia Europea del Medicamento la presentación de 3TC (300 mg) para su administración en una dosis diaria, aunque los datos sobre su equivalencia clínica en pacientes con infección por VIH son escasos49.
La combinación de AZT + 3TC + ABC es equivalente a AZT + 3TC + indinavir (IDV) en alcanzar carga viral menor de 40 copias/ml a las 48 semanas; sin embargo, la eficacia virológica es de menor duración para ABC en el subgrupo de pacientes con carga viral mayor de 100.000 copias/ml36.
El tenofovir (TNF) y la emtricitabina (FTC) son dos fármacos de próxima comercialización en España que comparten la comodidad de la posología, aunque existen muy pocos datos en pacientes sin TARV previo54,55.
Inhibidores de la transcriptasa inversa no nucleósidos
Los inhibidores de la transcriptasa inversa no nucleósidos (ITINN) disponibles en España son NVP y EFV. La NVP ha demostrado un efecto virológico sostenido en pacientes sin TARV previo56. Estudios que comparan NVP con regímenes estándar con IP son el Atlantic37 (IDV) y el Combine38 (nelfinavir [NFV]). En ambos estudios existe un número relativamente bajo de pacientes con cargas virales elevadas lo cual impide conocer la eficacia real de este fármaco comparado con IP en pacientes con cargas virales superiores a 100.000 copias/ml. No obstante, en el estudio Combine no se observaron diferencias entre NVP y NFV en un subgrupo de 47 pacientes con viremia mayor de 100.000 copias/ml tratados con NVP38. Raffi et al57 analizaron los datos de diversos estudios con NVP en pacientes sin TARV previo y encontraron que 82 de 99 pacientes con carga viral mayor de 100.000 copias/ml alcanzaron carga viral indetectable a los 6 meses. El EFV con los resultados a las 144 semanas de tratamiento ha demostrado una respuesta virológica superior al tratamiento con IDV y que la actividad se mantiene para pacientes con carga viral superior a 100.000 copias/ml35.
No existen estudios clínicos que hayan comparado los ITINN entre sí, aunque los resultados de estudios de cohortes sugieren que EFV es superior a NVP tanto en la respuesta virológica como en el tiempo hasta fracaso virológico, sobre todo en pacientes con carga viral mayor de 150.000 copias/ml58,59. La NVP puede prescribirse en una sola toma diaria60. Los efectos adversos de ambos fármacos son diferentes, característicamente neurológicos para EFV61 mientras que con NVP son fundamentalmente hepatotóxicos32,33.
Inhibidores de la proteasa
En España están comercializados seis fármacos de esta clase: IDV, NFV, RTV (líquido y gelatina blanda), saquinavir (SQV) (gelatina dura y blanda), amprenavir (APV) y lopinavir (LPV)/RTV. A pesar de la falta de estudios comparativos en pacientes sin TARV previo, probablemente la eficacia sea similar en todos ellos. Aunque no existen motivos para excluir a ninguno de ellos de la terapia inicial salvo a SQV-HGC en uso no combinado debido a su baja biodisponibilidad, debe considerarse cuáles de ellos presentan la mejor tolerancia, comodidad, requerimientos alimentarios o interacciones farmacológicas. El RTV, cuando se usa como único IP, presenta dificultades de tolerancia e interacciones farmacológicas marcadas. El SQV-SGC y el APV presentan como inconvenientes el elevado número de comprimidos necesarios cuando se usan como IP único. Las pautas con NFV en dosis de 1.250 mg/12 h son tan eficaces como la administración de 750 mg/8 h, aunque sin embargo no se recomiendan las pautas de 2 dosis al día de IDV62,63.
Combinaciones de dos inhibidores de la proteasa
En los últimos 2 años se ha generalizado el uso combinado de RTV con otro IP para aumentar sus concentraciones plasmáticas, facilitando el control virológico incluso frente a cepas de virus con resistencia moderada. Asimismo, esta combinación permite regímenes más cómodos y mejor tolerados.
Las dosis de RTV utilizadas tienen diferente importancia según el IP de la combinación. Así, con SQV-HGC y con APV, la dosis de 100 mg de RTV cada 12 h es igual a la de 400 mg 2 veces al día, por lo que son preferibles 100 mg de RTV cada 12 h en combinación con 800 mg 2 veces al día de SQV y 600 mg cada 12 h para APV39,40. La combinación RTV/SQV-SGC no parece aportar ventajas adicionales en relación con SQV-HGC43.
Aunque existen estudios farmacológicos que apoyan el uso de RTV junto con otros IP, hay pocos datos clínicos en pacientes naive salvo para RTV/LPV, RTV-SQV y RTV/IDV44-46. Por otra parte, todavía no se conocen los efectos adversos a largo plazo de este uso combinado de los IP.
Otras terapias
Existen pocos datos hasta la fecha de terapias cuádruples en pacientes sin TARV previo que incluyen fármacos de las tres familias disponibles, así como de los tratamientos combinados de antorretrovirales e inmunomoduladores64-66.