Introducción
La supervivencia prolongada conseguida con la introducción del tratamiento antirretroviral de gran actividad (TARGA) ha permitido que en los enfermos infectados por el virus de la inmunodeficiencia humana (VIH) se pongan de manifiesto trastornos médicos distintos a las enfermedades oportunistas que inicialmente afectaban a este colectivo. Hasta fechas recientes las infecciones oportunistas representaban más del 90% de la morbimortalidad de este colectivo; actualmente, la comorbilidad y los efectos secundarios del tratamiento antirretroviral (TARV) son los que requieren mayor atención. Estos problemas, infecciosos o de otra naturaleza, se presentan de manera simultánea y su evolución puede verse modificada por la infección VIH o su tratamiento.
El objetivo de los autores es definir cuál debe ser el TARV en el enfermo VIH+ con una enfermedad grave concurrente (aunque dada la interacción medicamentosa del TARV en algunas ocasiones se hable también del tratamiento de la enfermedad concurrente). Nuestro interés es describir los fármacos y las dosis aconsejados para el tratamiento del VIH en un enfermo con otra enfermedad con el fin de que pueda servir de consulta fácil al facultativo que trata enfermos VIH+ o a cualquier profesional que requiera estos datos. Por razones de espacio no se van a comentar todas las entidades cuyo tratamiento interaccione con el TARV (tabla 1), ya que existen excelentes revisiones sobre estos temas a las que se remite al lector. Conviene afirmar además que no se encuentran estudios de series que respondan a numerosos de los interrogantes que se nos plantearon y algunas afirmaciones expresadas se basan en opiniones de expertos, al igual que en algunas guías terapéuticas. Por este motivo, deben revisarse estas recomendaciones cuando se disponga de más datos.
Enfermedades oportunistas relacionadas con la inmunodeficiencia
Tuberculosis
La tuberculosis es una infección muy prevalente en nuestro medio y el evento oportunista tipo C más frecuente en los enfermos VIH+ (el 40% de los casos de sida comunicados)1.
Las rifamicinas (rifampicina [RFM] o rifabutina [RFB]) son fármacos de primera línea en el tratamiento de la enfermedad tuberculosa y en algunos esquemas terapéuticos de la infección tuberculosa latente. Se metabolizan por el sistema enzimático del citocromo P-450, induciendo la síntesis de algunas de sus isoenzimas. Tanto los inhibidores de la proteasa (IP) como los inhibidores de la transcriptasa inversa no nucleósidos (ITINN) se metabolizan igualmente por esta vía, produciendo cierto efecto inductor o represor de algunas isoenzimas, por lo que las interacciones medicamentosas son frecuentes modificando las concentraciones del fármaco.
El inicio simultáneo de ambos tratamientos puede condicionar, además de las interacciones farmacocinéticas, un mayor riesgo de efectos adversos y requerirá la toma de un gran número de comprimidos, lo cual facilitará la falta de adherencia al tratamiento. Por este motivo, se ha sugerido posponer el TARV en el enfermo con tuberculosis2, pero la duración de esta demora no se ha definido. Teniendo en cuenta el riesgo de progresión de la infección por VIH y las tendencias a retrasar el TARV deberían considerarse los siguientes escenarios:
1. Enfermo con bajo riesgo de progresión (CD4 > 350 cél./μl) en el que debe tratarse la tuberculosis y una vez finalizado el tratamiento considerar el TARV.
2. Paciente con riesgo intermedio (CD4 entre 200 y 350 cél./μl), se debe demorar el TARV al menos 2 meses (mientras se administran 3 o 4 fármacos antituberculosos).
3. En el enfermo con riesgo elevado (CD4 < 200 cél./μl), en el que ambos tratamientos se iniciarán simultáneamente (pero se aconseja comprobar inicialmente tolerancia al tratamiento antituberculoso y retrasar 2-3 semanas el TARV).
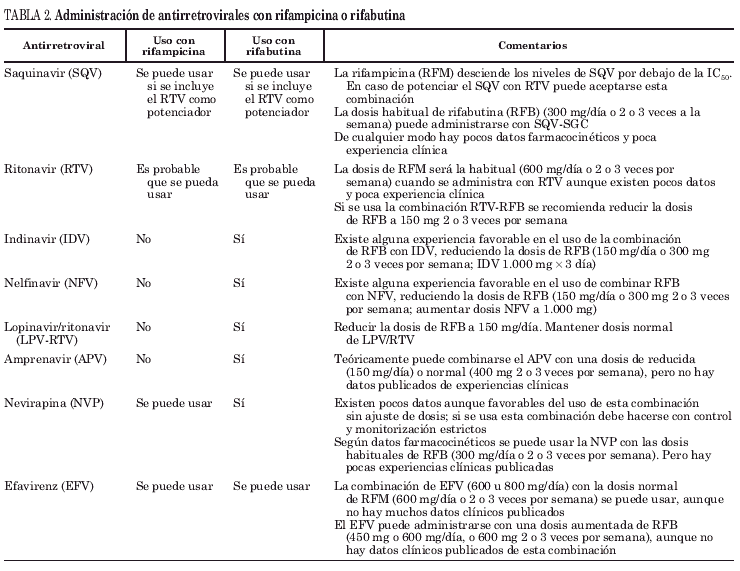
Teniendo en cuenta las interacciones del tratamiento antituberculoso con el TARV (tabla 2), la prioridad de las opciones terapéuticas sería:
1. Dos inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) +1 ITINN. El efavirenz (EFV) es el ITINN con mayor experiencia en el uso combinado con RFM. La RFM reduce el 25-30% el área bajo la curva del EFV sin modificar éste los valores de RFM; la dosis de EFV podría elevarse en una proporción similar (se aconseja administrar 800 mg/día), aunque algunos autores no lo consideran necesario. La nevirapina (NVP) es el otro ITINN disponible en España. La RFM reduce el área bajo la curva de NVP hasta el 58%, por lo que hay autores que contraindican su uso. Sin embargo, dado que los niveles valle de NVP con RFM son muy superiores a la IC90 de la cepa silvestre de VIH, no procedería aumentar la dosis de fármaco; sin embargo, hay poca experiencia clínica que apoye esta actitud3,4 y existe el riesgo añadido de hepatotoxicidad de la combinación NVP + RFM: ambos fármacos son hepatotóxicos, pero no se ha descrito efecto sinérgico al administrarlos de forma simultánea.
Si al ITINN se le asocia RFB, la dosis de RFB debe aumentarse a 450-600 mg/día sin modificar las dosificaciones de los antirretrovirales.
2. Combinación de 3 ITIAN. Se puede usar este esquema terapéutico si la carga viral no es muy alta (< 100.000 copias/ml) o el paciente no está severamente inmunodeprimido (CD4 > 100 cél./μl)5. No hay datos de tratamiento simultáneo de ambas infecciones usando esta combinación como TARGA, pero desde el punto de vista teórico parece un tratamiento cómodo y suficiente y puede facilitar el cumplimiento.
3. IP +2 ITIAN. La administración simultánea de IP con RFM está contraindicada por el descenso de la Cmin del IP. Tan sólo el nivel valle del ritonavir (RTV) queda por encima de la IC90 y la RFM no reduce el área bajo la curva de RTV a niveles que contraindique su uso, pero la intolerancia digestiva puede dificultar este tratamiento, por lo que deberían plantearse otras posibilidades terapéuticas6.
En caso de que la única posibilidad terapéutica fuera un IP, debe considerarse el uso de RFB por sus menores interacciones. La dosis de RFB debe reducirse a 150 mg/día o 300 mg/2 o 3 veces a la semana, mientras la dosificación del IP es variable (tabla 2). Habría que aumentar en un tercio la dosis si se utiliza nelfinavir (NFV) o indinavir (IDV) o no modificarla en caso de RTV, saquinavir (SQV), amprenavir (APV) o lopinavir (LPV). En cualquier caso se debe insistir en el correcto cumplimiento de ambos tratamientos y llevar un estricto seguimiento de los pacientes ya que la falta de adherencia al TARV convertirá en inadecuadas la dosis del tratamiento antituberculoso con riesgo de aparición de resistencias.
En opinión de los autores y por la experiencia acumulada, con el fin de facilitar la adherencia al tratamiento y reducir las interacciones, las opciones aconsejadas son 2 ITIAN + 1 ITINN o 3 ITIAN. Además, debe facilitarse el tratamiento observado directamente en colectivos con pobre adhesión al tratamiento.
Neoplasias
Las neoplasias con mayor prevalencia en el enfermo VIH+ son el linfoma no hodgkiniano, el sarcoma de Kaposi, la enfermedad de Hodgkin y los carcinomas de cérvix o canal anal. Se relacionan con la inmunodepresión y la acción patogénica de otros virus. Se están describiendo otras neoplasias (pulmón, tumores germinales, etc.) en relación con la mayor supervivencia o factores específicos de riesgo.
Al diseñar una pauta de TARV en un enfermo en tratamiento quimioterápico debe tenerse en cuenta que la toxicidad propia de algunos antirretrovirales (leucopenia con zidovudina [AZT], neuropatía con didanosina [ddI], zalcitabina [ddC] o estavudina [d4T], nefropatía con IDV y hepatotoxicidad con NVP) puede aumentar si existe una toxicidad similar de los citostáticos que se estén empleando. Además la vía metabólica de determinados antirretrovirales (IP e ITINN) es el sistema del citocromo P-450 y al inhibir/inducir algunas isoenzimas alterar el área bajo la curva de citostáticos que se metabolizan por esa vía (antraciclinas, alcaloides de la vinca, ciclofosfamida, etopósido) causando efectos adversos graves7. Puesto que el primer ciclo de quimioterapia se asocia a las complicaciones más serias se debe iniciar el TARV tras el segundo ciclo, como recomienda GESIDA8.
El tratamiento citostático del sarcoma de Kaposi se efectúa con una antraciclina liposómica si las lesiones no desaparecen con TARGA9. Si se administra simultáneamente con el TARV, se vigilará de cerca la aparición de efectos adversos potenciados por las interacciones10. Durante el tratamiento de otras neoplasias (pulmón, tumores germinales, etc.) se seguirán los mismos principios a la hora de instaurar el TARV.
La quimioterapia y radioterapia pueden producir graves leucopenias y linfocitopenias CD411. Por ello, la respuesta al TARV se efectuará por la carga viral VIH. La cifra de CD4 (obtenida en el período de menor mielodepresión) se utilizará para evaluar el riesgo de infecciones oportunistas (que puede estar aumentado por otras medicaciones como corticoides, etc.) e instaurar los tratamientos profilácticos que hubiere lugar.
Comorbilidad secundaria a infecciones o procesos concurrentes
Consumo de drogas o tratamiento sustitutivo
La drogadicción activa constituye una contraindicación para el uso de TARV por tratarse de una de las causas más frecuentes de falta de cumplimiento y fracaso del tratamiento. Mientras se corrige la adicción, debe primar la profilaxis de las enfermedades oportunistas12.
Sin embargo, no hay ningún inconveniente en aconsejar e indicar el TARV si el paciente lleva tratamiento sustitutivo con metadona. También en este caso se tendrá en cuenta el efecto inductor (o represor) de algunos IP o ITINN sobre el citocromo P-450. El área bajo la curva de la metadona puede variar (disminuir o aumentar) al iniciarse el TARV, por lo que puede requerirse ajuste de dosis (en general aumento por síntomas de abstinencia). Semanalmente debe controlarse la adhesión y aparición de efectos adversos o síndrome de abstinencia. El ajuste de la dosis de metadona, alrededor del 20%, se efectuará entre los días 8 y 12 sin modificar el TARV12.
Hepatopatías
Las enfermedades hepáticas constituyen las comorbilidades más importantes de la población VIH+, tanto por su elevada prevalencia como por las consecuencias respecto a la calidad de vida y supervivencia. La causa más frecuente de hepatopatía en nuestro medio es la coinfección por el virus de la hepatitis C (VHC), que puede alcanzar hasta el 85% según el mecanismo de contagio13. Otros virus hepatotropos (hepatitis B, citomegalovirus) y el consumo de alcohol (que llega al 70%)14 pueden causarla en menor proporción. Además, la medicación antirretroviral puede producir o agravar una hepatopatía preexistente.
No hay datos que orienten hacia un TARV específico en función de la gravedad de la afectación hepática. Se ha comentado que los fármacos antirretrovirales pueden ser hepatotóxicos. Los ITIAN son los menos tóxicos (aunque la esteatosis hepática relacionada con la lactacidemia o la acidosis láctica es específica de esta familia de fármacos). Sin embargo, tanto los IP como los ITINN pueden producir elevaciones graves de las enzimas hepáticas. El RTV es el IP más hepatotóxico cuando se administra en dosis plenas como único IP6,15; aunque su toxicidad es menor si se administra en minidosis como potenciador farmacocinético. En cuanto a los ITINN, prácticamente desde su introducción en la práctica clínica se sabe que la hepatitis era un efecto adverso frecuente de la NVP y se recomendaron controles frecuentes de las enzimas hepáticas al inicio del tratamiento, posteriormente cuestionados16. Se ha encontrado hepatotoxicidad grave en el 15,6% de los enfermos tratados con NVP y el 8% de los tratados con EFV. Esta toxicidad incide más en los enfermos con hepatitis crónica por VHC o VHB17. La descripción de evoluciones aceleradas de hepatitis/cirrosis y el consiguiente aumento de mortalidad parecen reclamar matizaciones del TARV en los enfermos con hepatopatía crónica18-20. Aunque un dato optimista descrito por algunos autores es el efecto protector de los IP en la hepatitis crónica: a pesar de aumentar las transaminasas al inicio del TARV, las cifras disminuyen a valores inferiores a los basales, y pueden reducir la fibrosis y evolución a cirrosis21. Con el fin de controlar la reacción inicial, debe monitorizarse la función hepática en los primeros meses del TARV en enfermos con hepatopatía.
Desde el punto de vista de la individualización del TARV en los enfermos con hepatopatía, los escenarios posibles y su recomendación específica serían los que se analizan a continuación.
Hepatopatía crónica sin signos de insuficiencia hepatocelular
Esta es la condición más frecuente y la individualización del tratamiento se justifica por el riesgo de toxicidad añadida de los antirretrovirales. Las recomendaciones serían:
1. Asociación de 3 ITIAN. Dado que son los menos hepatotóxicos puede recomendarse una asociación de 3 ITIAN si la carga viral, CD4 y tratamiento previo no lo contraindican (recuérdese que no hay suficiente experiencia en enfermos gravemente inmunodeprimidos o con carga viral elevada y que además la historia previa de tratamientos subóptimos condiciona un fracaso precoz de las pautas de simplificación con ITIAN); sin embargo, debe vigilarse la aparición de síntomas de hiperlactacidemia en función de los ITIAN utilizados.
2. Si se va a administrar un IP como fármaco potente, deben valorarse NFV, IDV o amprenavir (APV). Se evitará el RTV salvo que se use como potenciador farmacocinético.
3. Si se opta por un ITINN, el fármaco que se va a considerar sería el EFV por su menor hepatotoxicidad15,17. En caso de intolerancia al EFV, recuérdese que la mayoría de los enfermos toleran la NVP sin ninguna reacción hepática.
Hepatopatía crónica con signos de insuficiencia hepatocelular
En pacientes VIH+ coinfectados por VHC o VHB es difícil evaluar la presencia de insuficiencia hepatocelular. Cuando el paciente tiene una cirrosis demostrada es posible sospechar un cierto grado de insuficiencia hepatocelular. El metabolismo de los fármacos que utilizan el sistema enzimático del citocromo P-450 está reducido en la cirrosis o insuficiencia hepática grave, pero no hay datos sobre los que fundamentar recomendaciones terapéuticas.
De los ITIAN sólo la AZT tiene un elevado metabolismo hepático, se acumula en caso de insuficiencia hepática y debe reducirse su dosis para controlar la posible toxicidad relacionada22-24; de los ITINN, el EFV puede administrarse en dosis plenas25, mientras que de los IP puede administrarse SQV, NFV o APV ajustando la dosis y administrándolos 2 veces al día. Sin embargo, no hay datos sobre cuánto se debe "ajustar la dosis" en función de la insuficiencia hepática (Child-Pugh)26-28. En caso de descompensación hidrópica, encefalopatía u otra manifestación de insuficiencia hepática grave que aparezca durante un tratamiento, deben retirarse todos los fármacos hepatotóxicos y también el TARV mientras se recupera la insuficiencia y considerar no reintroducir el TARV o aconsejar un tratamiento con 3 ITIAN. Se debe vigilar el riesgo de hiperlactacidemia con cuadros más o menos graves dada la menor capacidad del hígado para metabolizar el ácido láctico.
Hepatitis aguda
Los pacientes VIH+ pueden presentar cuadros de hepatitis aguda tóxicos o por infección viral aguda. Cuando esto ocurre en un paciente en TARV lo habitual es suspenderlo (aunque no sea el causante de la hepatitis) y volver a reintroducirlo una vez superado el evento. En general, la mayoría de los pacientes podrán interrumpir el tratamiento y reintroducirlo sin problemas, evitando así por un lado una toxicidad que podría dificultar la resolución del cuadro agudo y, por otro, una exposición inadecuada a los fármacos que condicionara la aparición de resistencias. No obstante, este criterio no está basado en estudios clínicos y en cada caso deben sopesarse los riesgos de la interrupción del TARV. La experiencia del clínico responsable será en definitiva el criterio fundamental para actuar en este escenario.
Hepatitis crónica por VHB
En esta situación la individualización del TARV se debe, por una parte, al riesgo de hepatotoxicidad y, por otra, a que existen fármacos con actividad anti-VIH y anti-VHB como el interferón (IFN), la lamivudina (3TC) y tenofovir (TFV)29,30.
Puesto que actualmente el tratamiento de la hepatitis B se efectúa en régimen de monoterapia, parece adecuado recomendar la inclusión del 3TC en el TARV de los pacientes con hepatitis crónica por VHB en dosis anti-VIH. Si aparecen resistencias del VIH al 3TC, debe mantenerse si es efectivo para el VHB (en estas circunstancias puede reducirse la dosis de 3TC a 100 mg/día).
Si no se considerara conveniente tratar la hepatitis por VHB se debe reservar el 3TC, si las alternativas terapéuticas para el VIH lo permiten, para una situación más ventajosa de tratamiento de la hepatitis B (tratamiento combinado futuro o pretrasplante con el fin de evitar la infección por VHB del injerto).
Hepatitis crónica por VHC con criterios de tratamiento anti-VHC
La individualización del TARV en este caso no viene determinada por la existencia de fármacos con actividad antiviral combinada (aunque el pegINF ha demostrado cierta reducción de viremia VIH), ni por la toxicidad de los antirretrovirales en pacientes con hepatitis crónica C, sino porque la combinación de TARV y anti-VHC puede provocar interacciones farmacocinéticas y/o farmacodinámicas con riesgo potencial de incrementar la toxicidad o disminuir la actividad antiviral.
El IFN-a produce mielotoxicidad (neutropenia, trombopenia) y neurotoxicidad entre otros efectos adversos. Entre los TARV habrá que tener una vigilancia especial cuando se asocie con AZT (mielotoxicidad) o con EFV (toxicidad del sistema nervioso central), ya que los estudios de farmacovigilancia sobre estas asociaciones hasta el momento son insuficientes. La ribavirina es un análogo de nucleósido (guanosina) y puede producir anemia hemolítica como efecto adverso fundamental. Por lo tanto, su empleo con fármacos mielotóxicos (AZT) debe realizarse con una estrecha monitorización de la cifra de hemoglobina. La ribavirina disminuye in vitro la fosforilación de la AZT y d4T, pero el significado clínico de estas interacciones se desconoce; no se ha descrito disminución de la actividad anti-VIH (de AZT o d4T) por la interacción, pero el número de pacientes estudiados hasta la fecha es escaso. Posiblemente la ribavirina potencie la toxicidad de los ITIAN: se han descrito pancreatitis y casos de acidosis láctica sintomática en pacientes tratados simultáneamente con ddI31. No se conoce la prevalencia de este efecto, por lo que se recomienda prudencia cuando se asocian.
Comorbilidad secundaria al tratamiento antirretroviral
Alteraciones metabólicas y cambios en la distribución de la grasa
El TARGA ha puesto en evidencia a medio plazo ciertos cambios en el aspecto del cuerpo (lipodistrofia) y determinadas alteraciones metabólicas (hipertrigliceridemia, hipercolesterolemia, resistencia a insulina) cuyos mecanismos patogénicos exactos no se conocen, pero su causa está relacionada con el tratamiento y parece ser multifactorial. La sospecha inicial de que pudieran deberse o estar potenciados por los IP va cobrando fuerza32-34, al tiempo que se describen otras alteraciones, como reducción del ADN mitocondrial, causadas por los ITIAN, que pudiera ser el mecanismo común subyacente.
La importancia de estas alteraciones metabólicas radica en que constituyen un factor de riesgo vascular que en algunas series se empieza a vislumbrar35 y, además, producen cambios estigmatizantes en el aspecto corporal. No existe un tratamiento definido para estas alteraciones. Una actitud terapéutica consistiría en modificar alguno de los fármacos que puedan causarlas. En este sentido se ha estudiado el cambio del IP bien por un ITINN o ITIAN (abacavir [ABC]), ya que parecen estar asociados en menor grado a las alteraciones metabólico-corporales. Se ha cuestionado el papel que pueden tener los análogos de la timidina (principalmente d4T) en la patogenia de la lipoatrofia.
El tratamiento de estas alteraciones se basa en medidas dietéticas, ejercicio físico y modificaciones del tratamiento medicamentoso (tabla 3). Dado que pensamos que estas alteraciones están relacionadas con el TARV la primera actitud del facultativo es modificar el/los fármaco/s responsables. Cualquier cambio de esquema terapéutico requiere fármacos cuya eficacia terapéutica (virológica o inmunológica) sea suficiente para mantener inhibida la replicación viral. Partiendo de estas premisas, numerosos autores han evaluado la reversibilidad de las alteraciones metabólicas al cambiar el IP por ITINN o ITIAN. La mayoría de los estudios son observacionales y la falta de homogeneidad impide agrupar las series; además, en la evaluación de los cambios morfológicos se han empleado medidas subjetivas (opinión del enfermo o médico).
Hiperlipidemia (hipertrigliceridemia e hipercolesterolemia)
En el enfermo con alteraciones lipídicas, el cambio del IP por NVP ha demostrado resultados variables: desde no modificar los valores iniciales a una reducción de triglicéridos (no de colesterol) o inducir un perfil lipídico antiaterogénico en los tratados con NVP36-38. Los resultados del cambio del IP por EFV son igualmente variables: ausencia de cambios, descenso de triglicéridos o aumento de colesterol total o lipoproteína de alta densidad (HDL)39-41. Sin embargo, cuando se cambia el IP por ABC parece haber mejoras, evidenciándose a las 4 semanas una reducción significativa de valores de colesterol total y triglicéridos y cierta tendencia a aumentar el colesterol de las HDL42.
No hay datos concluyentes para aconsejar unas características determinadas del TARV en los enfermos con hipertrigliceridemia o hipercolesterolemia, pero sí apuntar que el cambio del IP por uno de los fármacos anteriormente citados puede mejorar la alteración lipídica. Además, si junto al ejercicio físico y una dieta pobre en grasas e hidratos de carbono, se decide asociar un tratamiento hipolipemiante primario, cabe recordar que la mayoría de las estatinas se metabolizan por el sistema del citocromo P-450, por lo que deben modificarse algunas dosis de antirretrovirales. Los fibratos (p. ej., gemfibrocilo) y la pravastatina no se metabolizan por vía hepática.
Resistencia a la insulina
Los IP son los fármacos que desencadenan la resistencia a la insulina en algunos estudios22 y se ha demostrado una cierta reversibilidad al cambiar el IP por NVP, EFV o ABC43,44.
Redistribución de la grasa
Las alteraciones del aspecto corporal (lipoacumulación o lipoatrofia) son muy prevalentes en los enfermos en TARGA32,33. Prácticamente en casi todos los estudios anteriormente mencionados se ha evaluado el efecto del cambio del fármaco en la redistribución de la grasa y los resultados se han basado en observaciones subjetivas (opinión del médico o paciente). Pues bien, la reversibilidad observada en la redistribución de la grasa es muy pobre en lo que respecta a la lipohipertrofia y nula en la recuperación de la lipoatrofia36,39,45,46.
Patogénicamente, los IP parecen ser la causa desencadenante o aceleradora de las alteraciones metabólicas o los cambios del aspecto corporal, pero no está claro qué función desempeñan los ITIAN en su patogénesis. Los ITIAN forman parte de todos los tratamientos antirretrovirales y los resultados de algún estudio observacional han mostrado cierta correlación entre las alteraciones del aspecto del cuerpo y el tratamiento con d4T, lo que se explica por su toxicidad mitocondrial de este análogo de timidina47. Sin embargo, en los resultados de dos series, una prospectiva y la otra retrospectiva, intentando correlacionar la aparición de lipodistrofia con algún fármaco concreto, sólo se llegó a demostrar cierta relación con el uso de IP y no con los ITIAN que componían el TARGA48,49.
Aunque no hay datos definitivos respecto a qué medidas deben tomarse cuando se manifiesten alteraciones metabólicas o lipoatrofia-lipoacumulación en enfermos en TARV, procedería modificar los esquemas terapéuticos a combinaciones que no incluyeran IP o que contuvieran un ITIAN con menor toxicidad mitocondrial.
Acidosis láctica
La lactacidemia es otra alteración metabólica que se presenta en los enfermos en TARV. Inicialmente descrita como formas graves de acidosis láctica con esteatosis hepática, recientemente se han descrito formas leves o crónicas que cursan con fatigabilidad, náuseas, dolor abdominal, pérdida de peso, neuropatía, pancreatitis y una menor afectación hepática. Aunque no todos los estudios son concluyentes, estas alteraciones se han descrito en enfermos que llevaban tratamiento con ITIAN, mayoritariamente con d4T50-52 y es más intensa según el número de ITIAN del tratamiento53. Incluso algunas alteraciones metabólicas como hipertrigliceridemia o lipoatrofia se presentan con un componente bioquímico de lactacidemia crónica, posiblemente relacionados con la alteración mitocondrial inducida por los ITIAN.
En el caso de lactacidemia sintomática procede modificar el TARV a fármacos con poca toxicidad mitocondrial (AZT, 3TC, ABC, TNF) o instaurar tratamientos con IP y ITINN.
Otras comorbilidades
Insuficiencia renal
Las alteraciones renales (desde formas mínimas y asintomáticas hasta formas graves que pueden llegar a requerir hemodiálisis) no son raras en los enfermos VIH+ y es de esperar que la mayor supervivencia y las comorbilidades de riesgo (diabetes, etc.) aumente su prevalencia en el futuro.
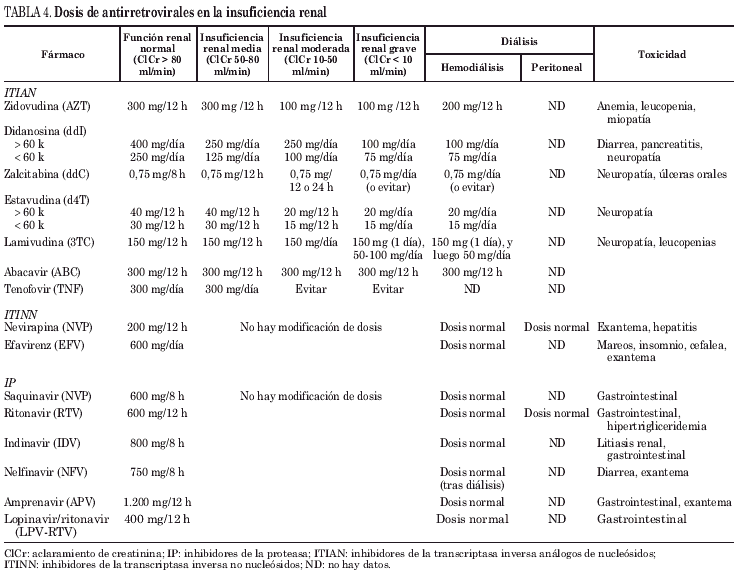
Algunos fármacos antirretrovirales o sus metabolitos se eliminan por el riñón. En caso de insuficiencia renal la exposición a éste aumentará y con ello sus efectos adversos. En estos casos, al igual que con otros medicamentos, se ajustarán las dosis según el aclaramiento de creatinina. Es importante vigilar los síntomas relacionados con la toxicidad característica de cada fármaco cuando estemos ante un paciente con insuficiencia renal54,55. Se analizan a continuación las características de cada fármaco en el contexto de la familia a la que pertenece (tabla 4).
Inhibidores de la transcriptasa inversa análogos de nucleósidos
La forma activa de estos fármacos es la molécula trifosfatada que se encuentra en el espacio intracelular. Las concentraciones elevadas en plasma del fármaco o sus metabolitos serán los causantes de la toxicidad. Las dosis de cada fármaco, según función renal, se muestran en la tabla 3.
Zidovudina
El 15-20% de la AZT se excreta por el riñón sin modificar y el 60-70% en forma de un metabolito inactivo glucuronizado en el hígado. Se han descrito cuadros de acidosis láctica o rabdomiólisis en enfermos en tratamiento con AZT. La semivida prolongada puede poner en evidencia toxicidad en medula ósea (anemia, leucopenia) o miopatía. La hemodiálisis no tiene efecto sobre la AZT.
Didanosina
Dado que una proporción muy elevada (50%) de la ddI se elimina por el riñón, los descensos no demasiado marcados (< 60 ml/min) del aclaramiento de creatinina pueden condicionar acumulaciones importantes y riesgo de pancreatitis, neuropatía, hepatitis o despigmentación retiniana. La hemodiálisis no influye en sus niveles, pero se aconseja administrar la dosis diaria tras la hemodiálisis.
Zalcitabina
El riesgo de acumulación de la ddC en caso de insuficiencia renal es muy elevado, ya que hasta el 75% de éste se elimina por el riñón sin modificación. El alargamiento de la semivida hasta más de 4 veces produce un riesgo grave de neuropatía, estomatitis o exantema.
Estavudina
También en el caso de la d4T se requiere ajuste de dosis en la afectación renal, ya que el 40% de la dosis se elimina por el riñón sin modificar. Los valores plasmáticos elevados en plasma pueden aumentar la toxicidad por neuropatía y posiblemente la toxicidad mitocondrial.
Lamivudina
La eliminación renal de este fármaco llega al 71% de la dosis administrada, por lo que su semivida aumenta hasta 4 veces en caso de insuficiencia renal. Es un fármaco con pocos efectos adversos, pero estos niveles pueden asociarse a pancreatitis, neuropatía o trastornos digestivos. La hemodiálisis puede eliminar parte del fármaco, por lo que debe administrarse tras la diálisis.
Abacavir
Se elimina por el riñón hasta el 20% sin modificar, pero la mayor parte de ésta se elimina como un metabolito formado en el hígado, por lo que no requiere ajuste de dosis.
Tenofovir
Aunque se trata de un inhibidor de la transcriptasa inversa análogo de nucleótido (ITIANT), puesto que actúa como un terminador de cadena, puede ser considerado en este apartado. La experiencia clínica con este fármaco en situaciones especiales es escasa, pero dada la nefrotoxicidad del adefovir (ADV), se debe recomendar mucha precaución (o contraindicar su uso) si el aclaramiento de creatinina es inferior a 60 ml/min. La administración simultánea con otros fármacos nefrotóxicos (aciclovir, valaciclovir, ganciclovir o cidofovir) puede aumentar la exposición al fármaco al interferir la eliminación renal. No existen datos respecto a hemodiálisis.
Inhibidores de la transcriptasa inversa no nucleósidos
El metabolismo de los ITINN se produce en el hígado, por lo que en caso de insuficiencia renal no se requieren ajustes de dosis (v. tabla 3).
Inhibidores de la proteasa
Los IP se metabolizan en el hígado por el sistema del citocromo P-450 por lo que en caso de alteración de la función renal no se requieren modificaciones de la dosis. Aunque los datos de la bibliografía son abundantes, algunas de las indicaciones de la tabla 3 son extrapolaciones a partir de algunos casos concretos publicados.
Proceso agudo intercurrente
Uno de los pilares del TARV, mantener el tratamiento con la máxima adherencia, incluso durante los procesos intercurrentes, se está modificando últimamente. En los estudios de interrupciones estructuradas del tratamiento o de tratamiento por pulsos semanales se ha comprobado que la interrupción terapéutica por un tiempo no prolongado no empeora la evolución de la infección por VIH.
En este sentido, ante la eventualidad de un cuadro intercurrente agudo (infeccioso o quirúrgico) no hay inconveniente en abandonar el TARV hasta que el cuadro tienda a controlarse. El único riesgo de progresión de la infección por VIH se produce cuando la situación de CD4 es muy comprometida (< 200 cél./μl o < 50 cél./μl) y la interrupción supera los 3 meses.
La idea de que el TARV no es una urgencia está detrás de esta actitud que lo que persigue es el establecimiento de períodos de descanso alternando con otros en los que el TARV se siga con el máximo cumplimiento para conseguir carga viral por debajo del umbral de detección.