Introducción
Las infecciones no complicadas del tracto urinario inferior son las que cursan con síntomas miccionales, habitualmente sin fiebre, y que se dan en pacientes sin anomalías funcionales o anatómicas del aparato urinario, instrumentación reciente de la vía urinaria o infección urinaria en las semanas previas. Debido a la alta probabilidad de que el hombre con infección urinaria tenga una alteración anatómica o funcional subyacente, se incluye en el grupo de las infecciones complicadas, por lo que no se tratará en este artículo.
La forma clínica habitual de la infección del tracto urinario inferior es la cistitis aguda. Ésta es un motivo muy frecuente de consulta en atención primaria, especialmente en el caso de las mujeres. En Estados Unidos la incidencia de cistitis aguda es de 7 millones de episodios al año y cada episodio conlleva una pérdida de 1,2 días de asistencia al trabajo 1. Se calcula que más de la mitad de las mujeres tendrá una infección del tracto urinario inferior (ITUI) durante su vida 2.
La importancia de esta infección no radica sólo en su elevada prevalencia, sino también en que afecta a la calidad de vida de los pacientes y ésta se ve influenciada por la eficacia y seguridad del tratamiento administrado 3.
Diagnóstico
El diagnóstico de la infección del tracto urinario inferior se basa en la clínica. El inicio brusco de disuria, frecuencia miccional, urgencia miccional y dolor suprapúbico en ausencia de fiebre y de dolor lumbar es muy sugestivo de cistitis aguda. En ocasiones aparece hematuria franca. Debe realizarse diagnóstico diferencial con la uretritis y vulvovaginitis producidas por microorganismos de transmisión sexual, porque el tratamiento es diferente. La uretritis no suele cursar con dolor suprapúbico ni con hematuria, el cuadro es de instauración insidiosa y hay antecedentes que hacen sospechar una enfermedad de transmisión sexual. En ocasiones cursa con descarga uretral. En casos con irritación vaginal o flujo vaginal aumentado debe sospecharse una vulvovaginitis. La probabilidad de que una mujer tenga una cistitis cuando presenta disuria, frecuencia miccional o hematuria, es del 50% en el medio ambulatorio 4. Sin embargo, cuando hay síntomas de vaginitis, como irritación vaginal o leucorrea, la probabilidad de cistitis se reduce a un 20%. La combinación de síntomas específicos de cistitis aumenta la probabilidad a un 90%, y si la mujer ha tenido cistitis previas la probabilidad de que tenga un nuevo episodio en caso de presentar síntomas es del 84-92% 5,6. En la tabla 1 se muestra el diagnóstico diferencial del síndrome uretral agudo.
Hay una serie de pruebas complementarias que pueden mejorar el proceso diagnóstico de la infección urinaria y que aseguran una evaluación adecuada del paciente.
1. Examen del sedimento de orina. La presencia de piuria, definida como la detección de más de 10 leucocitos por mm3 de orina no centrifugada o de más de 5 leucocitos por campo en orina centrifugada y examinada con microscopio de 40 aumentos, tiene una sensibilidad superior al 95%, aunque su especificidad es baja (71%). La piuria en presencia de síntomas urinarios es un indicador muy sensible de infección urinaria 7.
2. Tiras reactivas para la detección de nitritos y leucocitos en orina. Es una prueba muy útil en atención primaria por su accesibilidad y rapidez diagnóstica. Cuando las tiras reactivas son positivas para los nitritos y leucocitos, la sensibilidad es del 75% y la especificidad del 82% para el diagnóstico de infección urinaria 8. En población general, si uno o ambos resultados son negativos, tiene suficiente valor predictivo para descartar la infección 9.
3. Urocultivo. En pacientes que presentan síndrome miccional, el hallazgo de más de 1.000 unidades formadoras de colonias por mililitro (103 UFC/ml) en el urocultivo se considera significativo 10. En la infección no complicada del tracto urinario inferior en la mujer no se recomienda realizar un urocultivo porque no resulta coste-efectivo frente al tratamiento antibiótico empírico basado en la clínica y antecedentes de la paciente y en los datos regionales o locales de sensibilidad antimicrobiana 11,12.
4. Estudio radiourológico. La práctica de un estudio morfológico o funcional de las vías urinarias (ecografía, pielografía intravenosa) está indicada en todos los varones, en las mujeres con infección urinaria recidivante o con sospecha de enfermedad urológica concomitante (dolor cólico, dificultad en la micción, hematuria, incontinencia, infección por Proteus spp.) y en los niños menores de 5 años.
Tratamiento
Como en la mayoría de las enfermedades infecciosas, el tratamiento antibiótico empírico inicial de la infección urinaria es importante, especialmente en la cistitis no complicada de la mujer, donde como se ha comentado en capítulos anteriores no es necesario efectuar un urocultivo y antibiograma, excepto si no se trata de una recidiva o una falta de respuesta al tratamiento antibiótico previo. La elección del antibiótico dependerá de varios factores, como los antecedentes personales, incluyendo la historia de alergias u otras reacciones adversas a los antimicrobianos, la situación clínica del paciente, las conclusiones de estudios comparativos de antibióticos en el tipo de paciente que hay que tratar, del coste del tratamiento y del patrón local o regional de resistencia de los uropatógenos. En los últimos años se ha producido un aumento de las tasas de resistencia de los patógenos productores de infecciones urinarias frente a los antimicrobianos que se utilizan habitualmente, no sólo en el medio hospitalario, sino también en la comunidad 13,14. Este hecho ha causado cambios en las recomendaciones terapéuticas de las infecciones urinarias en muchos países, incluido España 15.
A continuación se exponen las opciones terapéuticas más importantes para el tratamiento empírico de la infección no complicada del tracto urinario inferior.
Cotrimoxazol
El cotrimoxazol ha sido uno de los antibióticos más utilizados hasta hace pocos años, con resultados excelentes en cuanto a eficacia clínica y tasas de recurrencias 16. Sin embargo, en muchos países, los patógenos habituales han alcanzado tasas de resistencia a cotrimoxazol superiores al 20%, por lo que este antibiótico ha dejado de ser útil en el tratamiento empírico de las infecciones urinarias 13,14. De hecho, el tratamiento con cotrimoxazol de cistitis producidas por microorganismos resistentes a este antimicrobiano obtiene tasas de curación menores del 60% 17. Las últimas guías terapéuticas norteamericanas recomiendan evitar la utilización empírica de cotrimoxazol en la infección urinaria cuando la prevalencia local de resistencia de Escherichia coli sea del 10-20% 18. En España, las guías terapéuticas actuales excluyen al cotrimoxazol como tratamiento empírico de las infecciones urinarias porque las tasas de resistencia de los patógenos comunitarios a cotrimoxazol en nuestro país exceden el 30% 15,19-21.
Fluoroquinolonas
Son activas frente a la mayoría de los uropatógenos, con excepción del enterococo, si bien actualmente hay un aumento de resistencias con implicaciones en la práctica clínica. Las fluoroquinolonas tienen una excelente biodisponibilidad que permite su utilización por vía oral, ya que alcanzan rápidamente concentraciones muy superiores a la concentración mínima inhibitoria (CMI) de los gérmenes sensibles, especialmente en orina. Los estudios comparativos de quinolonas con cotrimoxazol en la infección urinaria no complicada demuestran similares tasas de erradicación, de recurrencias y de efectos secundarios 22,23. Además, las quinolonas han mostrado ser superiores a los betalactámicos en eficacia 24-26. En cuanto a la duración del tratamiento, varios estudios han demostrado que para la cistitis no complicada el tratamiento con fluoroquinolonas durante 3 días equivale a 7 días, con menos efectos secundarios 12,27. Sin embargo, la monodosis de fluoroquinolonas presentaba menores tasas de erradicación que su administración durante 3 días 28. Los niveles de resistencia a las quinolonas de primera generación (ácido pipemídico, ácido nalidíxico) actualmente son demasiado elevados (> 30%) como para utilizarlas de forma empírica en las infecciones urinarias. En series recientes de nuestro país se ha observado que la resistencia de E. coli a las fluoroquinolonas ha aumentado de forma importante 14,19. Aunque en algunos estudios las tasas de resistencias a ciprofloxacino en mujeres con cistitis no complicada aún son inferiores al 10% 29, por lo que aún podrían emplearse de forma empírica en dichos casos, en otras series las resistencias de E. coli a ciprofloxacino fueron del 14,7% y del 13,7%, respectivamente 14,19. Se ha demostrado que el aumento de la utilización de las fluoroquinolonas se correlaciona con un aumento en las resistencias a estos antibióticos 30, por lo que varios autores desaconsejan su utilización como primera elección en las infecciones urinarias no complicadas 31,32. Además, la publicación reciente, en Estados Unidos, del aislamiento en la flora rectal de E. coli resistente a las fluoroquinolonas tras el tratamiento de cistitis no complicada 33 es un motivo de preocupación, y más en nuestro medio, en el que hay un uso importante de estos fármacos, tanto en humanos como en animales, contribuyendo a seleccionar con mayor facilidad cepas resistentes 34,35. En este mismo trabajo ni fosfomicina, ni nitrofurantoina seleccionaron cepas resistentes a estos agentes en la flora rectal 33.
Cefalosporinas orales
Las cefalosporinas de primera generación presentan tasas de resistencias elevadas en algunas áreas geográficas, por lo que ya no se recomiendan para el tratamiento empírico.
Las cefalosporinas orales de segunda y tercera generación (cefuroxima, cefixima, ceftibuteno, cefpodoxima) son activas frente a la mayoría de los gramnegativos implicados en las infecciones urinarias, con excepción de Pseudomonas spp. y gramnegativos productores de betalactamasas de espectro extendido (BLEE). Mantienen tasas de resistencia muy bajas frente a E. coli, por lo que en la actualidad son una alternativa válida para el tratamiento de la infección urinaria de vías bajas. En estudios comparativos de tratamiento oral de las infecciones urinarias no complicadas, que comparaban cefixima con cotrimoxazol o amoxicilina, se observaron las mismas tasas de curación bacteriológica con los 3 antibióticos (75-95%) 36. Lo mismo ocurría al comparar cefpodoxima proxetil con cefaclor o amoxicilina 37.
Sin embargo, las tasas de recurrencia son mayores con las cefalosporinas que con cotrimoxazol 38. Este hecho se debe, en parte, a que los betalactámicos son menos capaces de erradicar las enterobacterias de la flora colónica y vaginal, probablemente debido a que adquieren concentraciones menores en esos lugares 38. También se ha sugerido que se debe al efecto anaerobicida de las cefalosporinas, con el consiguiente desequilibrio de la flora bacteriana fecal y vaginal 39.
Otro problema añadido a esta opción terapéutica es la creciente incidencia de infecciones urinarias de la comunidad producidas por uropatógenos productores de BLEE, que les confieren resistencia a cefalosporinas de segunda y tercera generación 41-42. En el primer estudio multicéntrico sobre la prevalencia de BLEE en hospitales españoles se comprobó la presencia de bacilos gramnegativos productores de BLEE en el 90% de los hospitales que participaron, con un número importante de aislamientos procedentes de la comunidad, la mayoría de ellas correspondientes a infecciones urinarias 41,43. Se han descrito algunos factores de riesgo asociados a las infecciones comunitarias por enterobacterias productoras de BLEE: la hospitalización previa, el tratamiento antibiótico en los meses previos (incluyendo cefalosporinas de tercera y de segunda generación, penicilina y quinolonas), la infección urinaria recurrente, la edad avanzada, la diabetes y el sexo masculino 41,44. En un reciente estudio de base poblacional, las mujeres presentaban un mayor riesgo de infección por enterobacterias productoras de BLEE 45.
Los porcentajes de E. coli uropatógeno resistente a cefalosporinas de tercera generación que se aíslan en series recientes de nuestro país son inferiores al 6% 19,20, por lo que de momento no representan un problema teórico a la hora de decidir la pauta antibiótica empírica en la infección urinaria baja no complicada. Sin embargo, la tendencia creciente de este problema es un motivo de preocupación y obliga a mantener una actitud vigilante. Si se tiene en cuenta el elevado coste de este grupo de antibióticos y el riesgo en el incremento de BLEE que puede ocasionar la utilización de cefalosporinas de tercera generación en una enfermedad tan frecuente como la infección urinaria, creemos que tampoco son el tratamiento empírico de primera elección.
Asociaciones de betalactámicos con inhibidores de las betalactamasas
Actualmente, las tasas de resistencia de E. coli a amoxicilina y ampicilina son superiores al 40%. No obstante, su asociación con inhibidores de las betalactamasas (ácido clavulánico, sulbactam) ha logrado que la resistencia sea inferior al 5-10%, por lo que se consideran una opción válida para el tratamiento de las infecciones urinarias en general. Sin embargo, recientemente se ha publicado que la eficacia del tratamiento con amoxicilina-ácido clavulánico durante 3 días en la cistitis aguda no complicada es menor que ciprofloxacino durante 3 días 26. Este resultado coincide con estudios previos realizados con otros betalactámicos que demuestran que las tasas de erradicación son inferiores que con cotrimoxazol o quinolonas 38,46. Por ello, en las guías americanas de cistitis no se recomienda la utilización empírica de betalactámicos como pauta de primera elección 18.
Por otra parte, las recurrencias con amoxicilina parecen superiores que con cotrimoxazol o quinolonas. Este hecho parece relacionado con la menor capacidad de los betalactámicos de erradicar las enterobacterias de la flora vaginal en comparación con las quinolonas 26. Amoxicilina-ácido clavulánico además altera la flora fecal y vaginal más que otros antimicrobianos, lo que facilita la colonización por Candida sp. 47,48.
Fosfomicina-trometamol
Bloquea la síntesis de precursores del peptidoglicano de la pared bacteriana. Es activa especialmente frente a bacterias grampositivas, como los estafilococos, y también frente a gramnegativas, incluyendo E. coli. La sal cálcica de fosfomicina oral tiene una absorción reducida (30-40%). La sal de trometamol le confiere una mayor estabilidad a pH gástrico, de forma que su absorción por vía oral es mayor (50-60%) que la de la sal cálcica. Se excreta por vía renal en forma activa y consigue concentraciones urinarias elevadas. Con una única dosis de 3 g de la sal de trometamol se consiguen valores urinarios adecuados durante 48-72 h. La sal de trometamol está aprobada para el tratamiento de la cistitis no complicada en monodosis y se han obtenido buenos resultados comparativos con una dosis única de 3 g 49-52. En algunos estudios, los efectos secundarios fueron algo más frecuentes y las tasas de erradicación ligeramente inferiores a las observadas con tratamientos de 5-7 días de quinolonas, pero similares a 7 días con nitrofurantoína 53-55.
Las tasas de recurrencia con fosfomicina-trometamol son similares a las observadas a las de los comparadores, entre ellos quinolonas y trimetroprim 53-56 y el riesgo de vaginitis por alteración de la flora vaginal es bajo (< 2%) 57. Si tenemos en cuenta estos datos, y sabiendo que en nuestro medio las tasas de resistencia a fosfomicina de los uropatógenos habituales son inferiores al 4% 19, este antimicrobiano se considera de elección para el tratamiento de la cistitis aguda no complicada en nuestro medio 15. Además, dado el actual aumento de resistencias de E. coli a cotrimoxazol y a quinolonas, recientemente se ha propuesto la utilización de fosfomicina-trometamol como primera elección en la infección urinaria baja para poder reducir la utilización empírica de esos antibióticos y evitar el consiguiente desarrollo de resistencias a estos fármacos potencialmente útiles en otras indicaciones. De hecho, recientemente se ha observado que la resistencia a las quinolonas era un factor de riesgo independiente que incrementaba la mortalidad en infecciones por E. coli y Klebsiella spp., y este incremento se atribuía, en parte, al retraso en la instauración de un tratamiento empírico adecuado.
Debe recordarse que este fármaco pertenece a la categoría B de la FDA y por lo tanto puede utilizarse en el tratamiento de la infección urinaria de la embarazada, como se comentará en otro capítulo.
Nitrofurantoína
Su mecanismo de acción parece relacionado con la actividad enzimática de las bacterias, pero aún no está definido. Es activa frente a E. coli y enterococos; sin embargo, Proteus y Klebsiella tienen menor susceptibilidad, y Pseudomonas es resistente. Su absorción por vía oral es buena y mejora con la ingesta de alimentos. Adquiere concentraciones elevadas en orina. Los efectos secundarios son frecuentes, sobre todo de tipo digestivo. También puede producir cuadros graves, como la neumonitis intersticial.
En nuestro medio, un 30-40% de Klebsiella y todos los Proteus son resistentes a nitrofurantoína, mientras que E. coli mantiene tasas de resistencia inferiores al 10%, por lo que se puede considerar una opción empírica para la cistitis no complicada 19,21. También se ha recomendado como fármaco "ahorrador" de quinolonas en la cistitis aguda 32. Su eficacia en cistitis aguda parece menor que la del cotrimoxazol 38 y faltan estudios de eficacia comparativos con otros antimicrobianos. Las tasas de erradicación con tratamientos de 3 días con nitrofurantoína son menores que con 7 días, por lo que actualmente se recomiendan 7 días de tratamiento en la cistitis no complicada. Esto, unido a la necesidad de administrarla 4 veces al día y a su potencial toxicidad hacen que en la actualidad la nitrofurantoína se utilice menos que otros antimicrobianos en la infección no complicada del tracto urinario inferior.
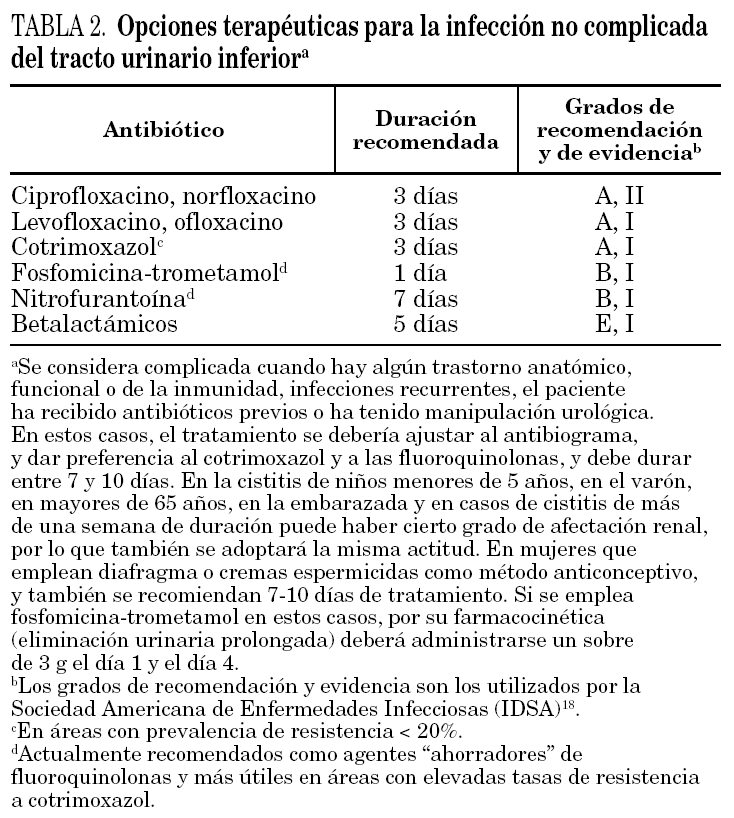
En la tabla 2 se resumen las opciones terapéuticas actuales para la infección no complicada del tracto urinario inferior según la Sociedad Americana de Enfermedades Infecciosas (IDSA). En nuestro medio debemos matizar la aplicación de estas guías. En este sentido, cotrimoxazol, un fármaco con evidencia AI, que aún puede utilizarse en algunas áreas de Estados Unidos, no puede emplearse de forma empírica en nuestro medio, ya que si tenemos en cuenta que el porcentaje de resistencias es del 30%, y que aproximadamente la mitad de los pacientes infectados con cepas cotrimoxazol resistente fracasa 58, nos daría una tasa real de fracasos en el tratamiento empírico del orden del 15%, y no se consideraría evidencia AI. Por el mismo motivo, la eficacia real del tratamiento empírico con fluoroquinolonas, en algunas áreas de nuestro país, no sería la misma que en lugares donde las tasas de resistencia sean muy bajas. Ya se ha comentado que nitrofurantoína y fosfomicina-trometamol se consideran fármacos "ahorradores" de quinolonas en este contexto clínico. Aunque en estudios controlados la eficacia clínica de ambos es similar, en la práctica diaria es más fácil asegurarse un adecuado cumplimiento con una sola dosis de fosfomicina-trometamol que con nitrofurantoína, cuya administración deberá ser de 7 días en varias tomas diarias.
Duración del tratamiento antibiótico y dosificación de los antimicrobianos en la infección no complicada del tracto urinario inferior
La duración del tratamiento de la cistitis ha experimentado importantes modificaciones en los últimos años 15,18,59. Esto es importante, ya que una duración superior a la necesaria comporta un aumento de los costes y efectos secundarios, entre ellos de candidiasis vaginal, una complicación no inusual tras el tratamiento de la cistitis. Inicialmente, la pauta más habitual consistía en la administración de un antibiótico activo durante 7 días, posteriormente se intentó tratar a los pacientes con una sola dosis de antibióticos con cotrimoxazol, betalactámicos o quinolonas, pauta que se abandonó dados los elevados índices de fracasos terapéuticos.
Aunque ya se ha ido exponiendo a lo largo del artículo al hablar de cada grupo de antimicrobianos, a continuación se expone de forma resumida la duración del tratamiento de la infección no complicada del tracto urinario inferior. Los estudios de revisión 15,60 muestran que: a) las pautas de 3 días con fluoroquinolonas o cotrimoxazol tienen una eficacia similar a la pauta convencional de 7 días; b) la eficacia de 3 días con betalactámicos es inferior a 3 días de cotrimoxazol o fluoroquinolonas; c) la eficacia con 5 días de betalactámicos es superior a 3 días de los mismos fármacos; d) la eficacia de 3 días de nitrofurantoína es inferior a su administración durante 7 días, y e) la eficacia de una monodosis de betalactámicos, cotrimoxazol o fluroquinolonas es inferior a la utilización de 3 días de los mismos fármacos. En la actualidad, en el tratamiento de la cistitis no complicada, sólo se acepta la dosis única con la administración de fosfomicina-trometamol.
En determinadas circunstancias, que se especifican en la tabla 2, como por ejemplo en infección recurrente en el último mes, o si la clínica es de más de una semana de evolución ("sospecha de pielonefritis subclínica"), se aconseja prolongar el tratamiento durante 7-10 días.
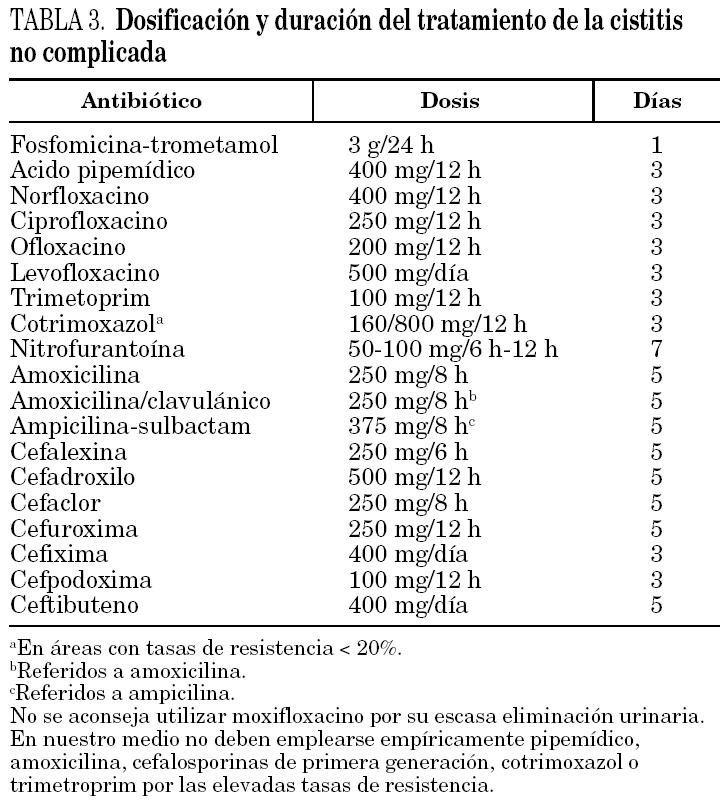
En la tabla 3 se muestra la dosificación y la duración del tratamiento recomendadas para la cistitis aguda no complicada. Como puede observarse, la dosificación de la mayoría de los antimicrobianos es más baja que en la pielonefritis y en otras indicaciones no urológicas. En este sentido, si se administra ciprofloxacino, se aconseja utilizar 250 mg/12 h; dosis de 100 mg/12 h también consiguen elevadas tasas de curación tanto clínica como bacteriológica en áreas de baja resistencia a las quinolonas. En áreas con tasas de resistencias elevadas, algunos autores sugieren utilizar empíricamente 500 mg/12 h.
La dosificación adecuada de los antimicrobianos reducirá no sólo los costes, sino también la frecuencia de efectos secundarios.
Correspondencia: Dr. J.P. Horcajada.
Unidad de Enfermedades Infecciosas.
Servicio de Medicina Interna. Hospital
Universitario Marqués de Valdecilla.
Valdecilla, s/n. 39008 Santander. España.
Correo electrónico: jhorcajada@yahoo.es