Introducción
Las infecciones urinarias recurrentes (IUR), definidas generalmente en la bibliografía como 3 episodios de IU en los últimos 12 meses o 2 episodios en los últimos 6 meses, constituyen un problema clínico común especialmente en mujeres jóvenes sexualmente activas, en embarazadas, en mujeres posmenopáusicas y en pacientes con patología urológica subyacente 1-49. No sólo suponen un malestar importante en las mujeres que las padecen, sino que tienen una gran repercusión económica por los costes sanitarios que representa la asistencia sanitaria ambulatoria, las pruebas de diagnóstico y las prescripciones.
La clasificación de las IUR en recidivas y reinfecciones es fundamental para determinar la actitud diagnóstico-terapéutica de las mismas.
Las recidivas representan el 20% de las recurrencias, se presentan generalmente en las primeras 2 semanas tras la aparente curación de la infección urinaria (IU) y son debidas a la persistencia de la cepa original en el foco de la infección 34,49.
Las recidivas pueden ser debidas al acantonamiento del microorganismo en un lugar inaccesible al antibiótico (pacientes con patología urológica subyacente litiasis renal o prostatitis crónica), o ser causadas por un tratamiento antibiótico inadecuado o demasiado corto (situación observada en ancianos o pacientes con síndrome cistítico de más de 7 días de evolución que han sido tratados durante 3 días); en realidad se trata de pielonefritis poco sintomáticas 34. Esta complicación también debe descartarse en pacientes afectados de una pielonefritis tratada adecuadamente según antibiograma durante 2 semanas y que recidivan debido a la existencia de una pielonefritis focal o bien un absceso renal subyacente, demostrados por ecografía o tomografía computarizada.
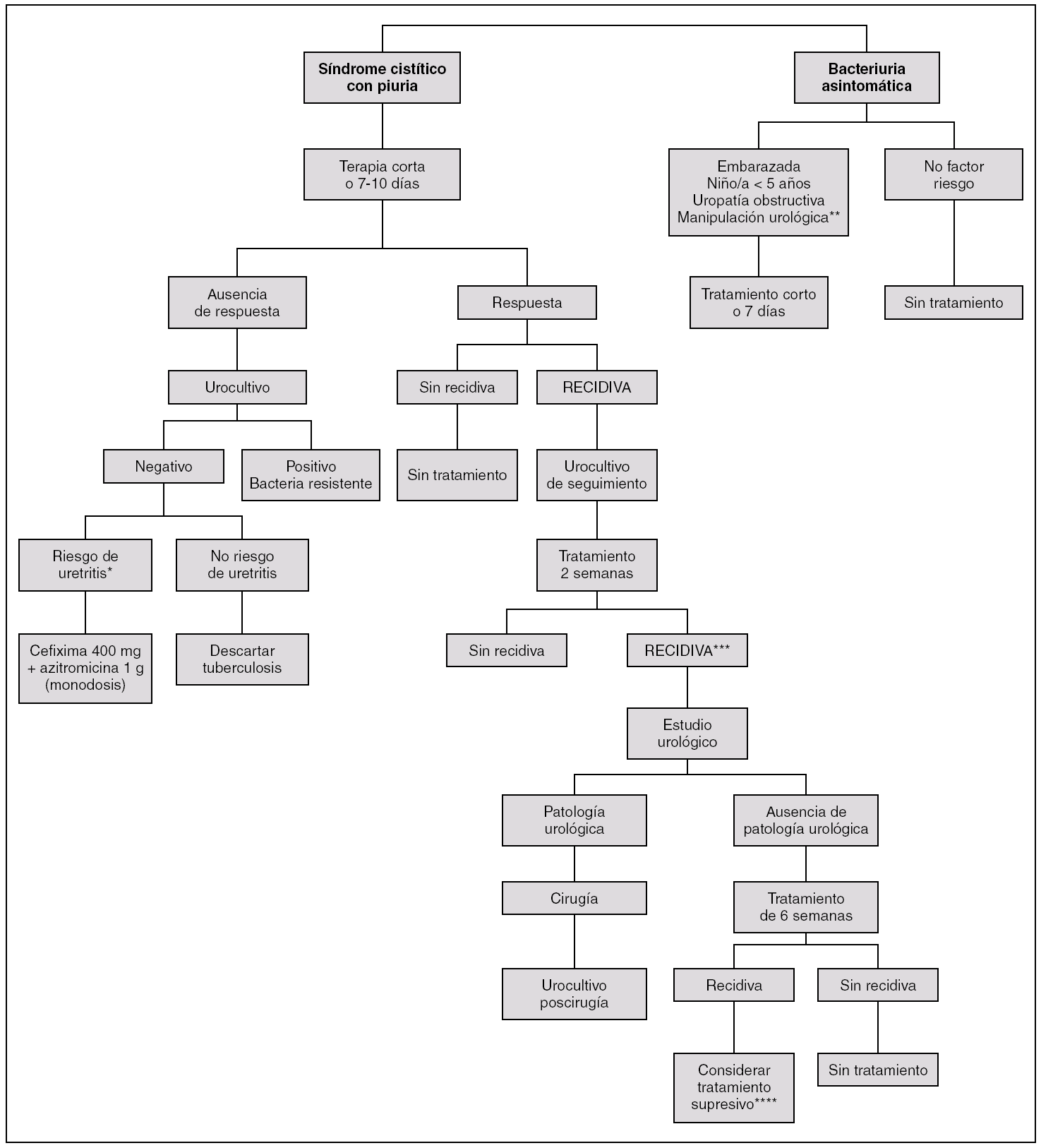
Algunos pacientes presentan recidivas sin causa aparente, es decir, después de haber realizado un tratamiento antibiótico correcto durante un tiempo adecuado y a pesar de tener un estudio urológico normal. En esta situación se aconseja administrar tratamiento antibiótico según antibiograma durante 4-6 semanas (fig. 1) 34. Es posible que algunos de estos pacientes en los que se aconsejaba un tratamiento prolongado, basado en un estudio del año 1966 (período anterior a la tomografía computarizada), estuvieran afectados de una pielonefritis focal, situación que en la actualidad se trata durante 3 semanas.
Figura 1. Algoritmo diagnóstico-terapéutico del síndrome cistítico, bacteriuria asintomática y de las recidivas. *Promiscuidad sexual, enfermedades de transmisión sexual en pareja, cambio reciente de pareja. **Terapia corta para iniciar antes de la manipulación; no es imprescindible el urocultivo periódico de seguimiento; en niños hay que descartar la existencia de reflujo vesicouretral. ***En el varón joven o de mediana edad hay que descartar la prostatitis crónica. ****En adultos sin embarazo, uropatía obstructiva o síntomas urinarios no se aconseja profilaxis.
Si la infección recidiva con un tratamiento antibiótico de 6 semanas y es un niño/a de menos de 5 años, una embarazada o una paciente con anomalía urológica no corregible con riesgo de lesión renal o con IU sintomáticas de repetición, se aconseja profilaxis durante 6-12 meses con dosis bajas de antibióticos, tales como: 1/2 comprimido de cotrimoxazol al día (es decir, 40 mg de trimetoprim/200 mg de sulfametoxazol), 100 mg de trimetoprim, dosis bajas de quinolonas (p. ej., ofloxacino, 200 mg/día; ciprofloxacino, 250 mg/día), cefalexina (250 mg/día) o bien 50 mg de nitrofurantoína (si es posible hay que evitarla por el riesgo de efectos adversos, que, aunque raramente graves, pueden llegar a producir toxicidad pulmonar).
La profilaxis se administra por la noche y se inicia una vez tratada la última IU con el antibiótico, dosis y tiempo adecuados.
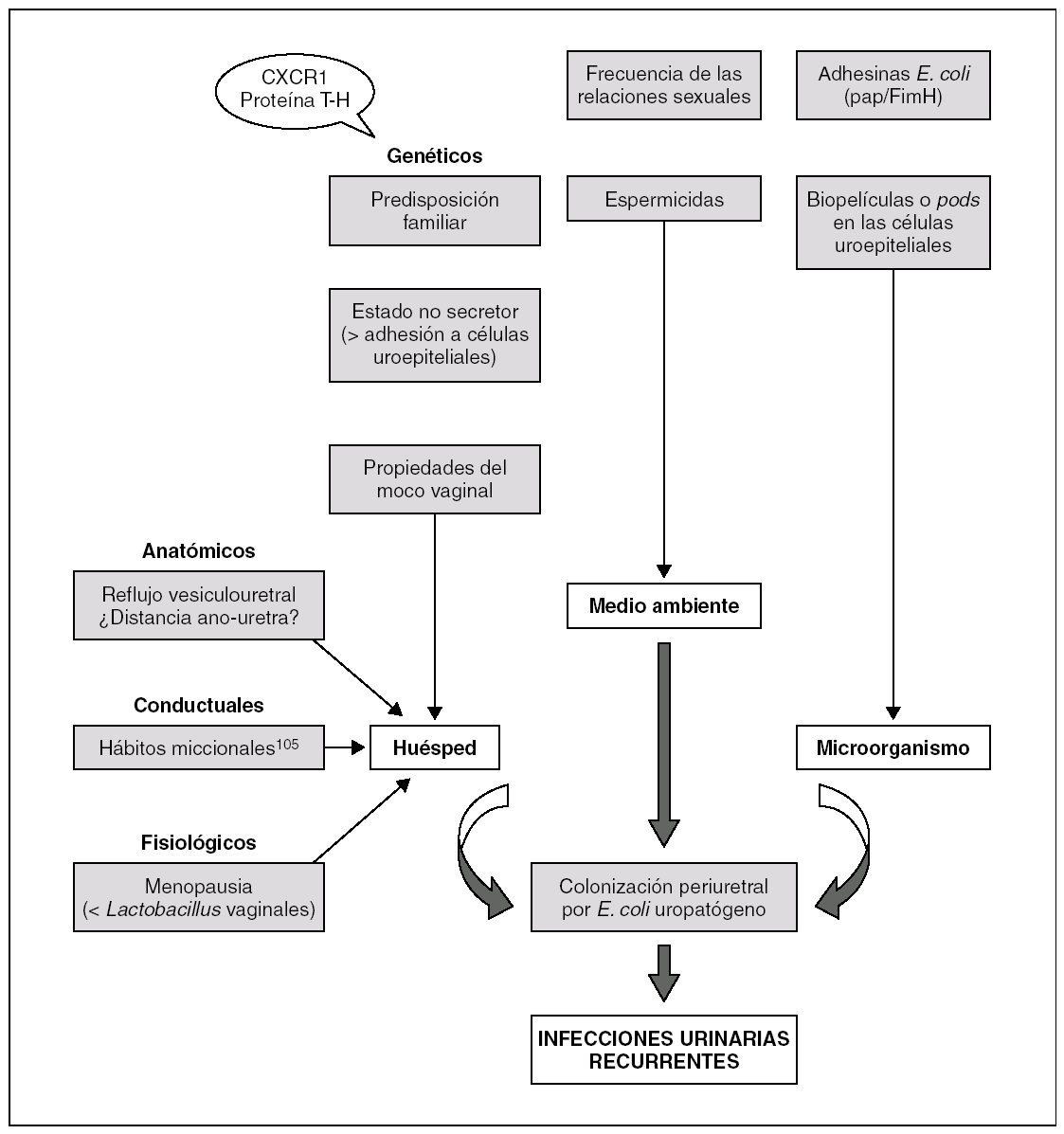
Las reinfecciones representan el 80% de las IUR y son nuevas IU causadas por cepas diferentes 37. Sin embargo, estudios recientes en mujeres jóvenes sexualmente activas han demostrado que pueden estar causadas por la misma cepa, cuyo reservorio sería el tracto digestivo 45, o bien las propias células uroepiteliales donde crearían biopelículas o pods, como se comenta en el capítulo de la patogenia 51. Las reinfecciones suelen producirse más tardíamente que las recidivas (en general, más de 2 semanas tras la IU inicial). También se considera como reinfección cuando entre las 2 IUR se documenta un urocultivo estéril. En la figura 2 se muestran los principales factores involucrados en las IUR.
Figura 2. Fisiopatología de las infecciones urinarias recurrentes. T-H: Tamm-Horsfall.
Las reinfecciones se observan fundamentalmente en mujeres jóvenes sexualmente activas, mujeres posmenopáusicas y pacientes con patología urológica subyacente. La patología urológica asociada con mayor frecuencia a reinfecciones urinarias es la presencia de incontinencia urinaria, cistocele y/o residuo posmiccional.
Infecciones urinarias recurrentes en mujeres premenopáusicas
Aproximadamente el 25% de las mujeres jóvenes sexualmente activas presentan reinfecciones tras un episodio inicial de cistitis 45-49,52. En los últimos años se han estudiado exhaustivamente en este colectivo de pacientes los principales factores predisponentes de las IUR y las terapias para su prevención.
Patogenia
La mayoría de las IUR en mujeres jóvenes no tienen relación con una patología urológica anatómica o funcional subyacente, y las IUR son debidas a una compleja interrelación entre la cepa infectante y las células epiteliales 45,48 (fig. 2).
Factores de riesgo
Los factores predisponentes de IUR dependientes de la bacteria (adhesinas, fimbrias tipo I, fimbrias P) se tratan extensamente en el capítulo sobre la patogenia.
Es conocido desde hace años que las mujeres con IUR tienen una mayor colonización vaginal y periuretral con uropatógenos que las pacientes sin IUR 29,30,36,53,54. En las IUR se han involucrado factores genéticos, biológicos y conductuales 16,36,45-50.
En un estudio multivariado, el principal factor predisponente fue el número de relaciones sexuales. En mujeres con relaciones diarias el riesgo de IUR era 9 veces superior 14,16,32. En nuestra experiencia, en las pacientes con más de 3 IUR al año la frecuencia sexual oscila entre 3 y 7 veces por semana. En otro estudio reciente, en el que se analizaron 229 casos y 253 controles, los resultados del análisis multivariado mostraron como factores de riesgo el haber mantenido una relación sexual durante el último mes, el uso de espermicidas durante 12 meses (que disminuirían la concentración vaginal de Lactobacillus) y el cambio de pareja sexual durante el año anterior 32. Otros factores de riesgo fueron la edad en la que se había padecido el primer episodio de IU (< 15 años) y antecedentes de IUR en la madre 16,32,55,56. También la administración reciente de antibióticos, que alterarían la flora vaginal y facilitarían la colonización vaginal por uropatógenos 57, así como la utilización de condones impregnados con espermicidas, se han asociado con un mayor riesgo de IUR 58,59.
Las pacientes con IUR son más susceptibles a la colonización vaginal por uropatógenos, lo cual está condicionado en parte por factores genéticos 19,30,31. Se ha demostrado que las células uroepiteliales de las pacientes no secretoras para el grupo ABO tienen una mayor susceptibilidad para la adherencia por uropatógenos, debido a que expresan dos glucoesfingolípidos en la membrana celular con mayor avidez para los receptores de los Escherichia coli uropatógenos 21, y un riesgo superior a presentar IUR 33,60. Las mujeres con IUR tienen una probabilidad 4 veces superior de ser no secretoras. Por otro lado, la expresión del fenotipo P1 se ha asociado con pielonefritis recurrente 61,62.
Se ha sugerido que alteraciones en el CXCR1, el receptor para la interleucina 8, podrían predisponer a las infecciones del tracto urinario al haberse demostrado que en el ratón la ausencia del mismo predispone a IU bacteriémicas y que en algunos niños con pielonefritis recurrente un defecto en el mismo justificaría las recurrencias 63.
Otros factores, como el déficit de inmunoglobulina A secretora o la concentración urinaria de proteína de Tamm-Horsfall, no parecen predisponer a la IUR 64,65. Sin embargo, en el curso de una cistitis puede perderse la acción protectora (antiadherente) de la proteína de Tamm-Horsfall, lo cual podría explicar parcialmente el hecho de que en algunas mujeres los episodios de IUR se presentan en acumulaciones (episodios repetidos de cistitis recurrente seguidos de intervalos libres).
Estos factores genéticos explicarían la predisposición familiar en esta enfermedad. La predisposición genética vendría apoyada por el hecho de que las niñas con IU durante la infancia tienen más riesgo de presentar bacteriuria e IU sintomática en la edad adulta, incluso en ausencia de anomalía urológica subyacente 66,67.
Aunque habitualmente se aconseja que las pacientes con IUR orinen a menudo y que realicen una micción poscoital para prevenir las recurrencias, en nuestra experiencia prácticamente todas las pacientes con más de 3 IUR anuales realizan micciones frecuentes y poscoitales y, a pesar de ello, siguen presentando IU. En un estudio reciente no se ha demostrado que exista relación entre las IUR y la práctica de micción pre y/o poscoital, el número diario de micciones, los hábitos de limpieza corporal tras la defecación, la utilización de duchas vaginales, bañera, el empleo de medias tipo pantys o ropas ceñidas tipo leotardos, ni tampoco con el índice de masa corporal 32.
Los factores anatómicos quizá pueden desempeñar un papel en algunas mujeres con IUR. En un único estudio sobre 213 mujeres (100 con historia de IU recurrente y 113 controles) se observó que las pacientes con IUR tenían una distancia inferior entre la uretra y el ano. Sin embargo, no se hallaron diferencias en el tamaño de la uretra, la presencia de residuo posmiccional ni los patrones de flujo urinario 15.
Estrategias terapéuticas de las IU recurrentes en las mujeres premenopáusicas
Las mujeres jóvenes sexualmente activas que padecen IUR excepcionalmente tienen anomalías del tracto genitourinario. Por dicho motivo, si no existe una historia sugestiva (antecedentes de cólico nefrítico, hematuria persistente tras la curación de la cistitis, sospecha de vejiga neurógena), no se aconseja realizar exploraciones radiourológicas en las cistitis, y sólo tras 2 episodios de pielonefritis 68,69.
A pesar de no existir evidencia de su eficacia 32,70, y de fracasar en nuestra experiencia en muchas pacientes, por su simplicidad se aconseja la adquisición del hábito de orinar con frecuencia y realizar una micción poscoital 68. Si la paciente utiliza cremas espermicidas, sobre todo conjuntamente con la aplicación de un diafragma, se le aconsejará un cambio de método anticonceptivo 17.
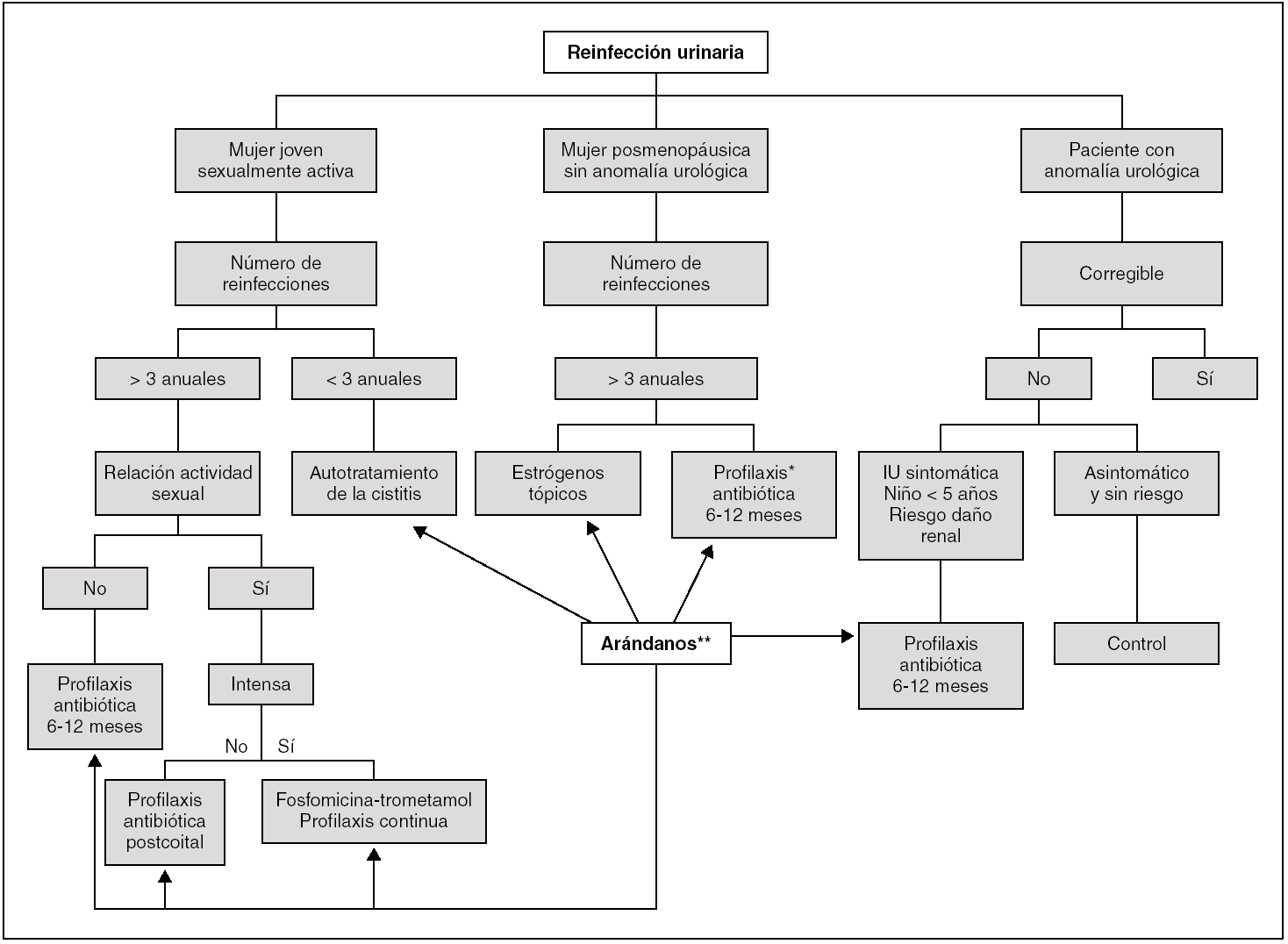
Si persisten las IU de repetición después de aplicar las medidas anteriores, se considerará alguna de las 3 siguientes estrategias terapéuticas 17,45-47: profilaxis antibiótica continua, profilaxis antibiótica poscoital y autotratamiento de las cistitis. La elección de una u otra pauta dependerá del número de IUR y del malestar que experimente la paciente en los episodios de cistitis, de su relación con la actividad sexual y de las preferencias de la mujer (en especial en pacientes reacias a tomar tratamiento antibiótico). En la figura 3 se muestra un algoritmo de actuación de las IUR por reinfección.
Figura 3. Algoritmo diagnóstico-terapéutico de las infecciones urinarias recurrentes por reinfección. IU: infección urinaria. *Profilaxis antibiótica a dosis bajas: cotrimoxazol 1/2 comprimido/día (40/200 mg); quinolonas (ciprofloxacino, 100 mg/día; ofloxacino, 200 mg/día; norfloxacino, 200 mg/día); nitrofurantoína (50-100 mg/día), cefalexina (250 mg/día); fosfomicina-trometamol (3 g cada 7-10 días). **Arándanos: alternativa a los antibióticos, estrógenos en pacientes reacios a tomarlos o si fracasa la profilaxis anterior.
En general, si las IUR son poco frecuentes (menos de 3 al año), cada episodio de cistitis se tratará aisladamente (autotratamiento). Si las IU recurren más de 3 veces al año se aconsejará profilaxis antibiótica con dosis bajas de antibióticos. Si las IUR se relacionan con la actividad sexual, se aconsejará profilaxis poscoital 10,17,45,47.
Antes de iniciar un tratamiento profiláctico debe haberse erradicado de la última IU (urocultivo negativo practicado a la 1-2 semanas tras finalizar el tratamiento). La elección del antibiótico profiláctico se efectuará basándose en la historia previa de alergias y en los patrones de sensibilidad de las IU previas.
Profilaxis antibiótica continua
La profilaxis continua, realizada característicamente mediante la administración de una dosis nocturna de antibióticos, suele indicarse en pacientes con IUR frecuentes que no tengan clara relación con la actividad sexual. En nuestra experiencia, dado que a menudo la actividad sexual suele ser intensa, también la utilizamos en estos casos.
Numerosos estudios aleatorizados y comparativos con placebo han demostrado que la profilaxis continua con dosis bajas de antibióticos reduce un 85-95% las IUR (desde 2-3 episodios por paciente y año a 0,1-0,2 episodios por paciente y año) 4,17,45-47. Se ha sugerido que su acción profiláctica se produce mediante 3 mecanismos: disminuyendo la concentración de Enterobacteriaceae uropatógenas del reservorio fecal, como se ha observado tras la administración de fluorquinolonas o cotrimoxazol 71,72; esterilizando la orina intermitentemente, como se ha sugerido con la utilización de nitrofurantoína 71,73, o bien porque las concentraciones subinhibitorias del antimicrobiano inhibirían la adhesión bacteriana a las células de la mucosa vesical 71,74, efecto también demostrado recientemente con la fosfomicina 75.
Los antibióticos más utilizados en la profilaxis de las IUR han sido el cotrimoxazol (40 mg de trimetoprim/ 200 mg de sulfametoxazol/día) y dosis bajas de quinolonas (p. ej., ofloxacino, 200 mg/día; ciprofloxacino, 250 mg/día, o norfloxacino, 200 mg/día) 1,2,35,43,73. También puede emplearse trimetoprim, a dosis de 100 mg/día; cefalexina, a dosis de 250 mg/día; otras cefalosporinas de primera generación (cefadroxilo, cefradina), o bien 50-100 mg de nitrofurantoína, que debe utilizarse con cautela, por el riesgo de aparición de efectos adversos 34. Sin embargo, en un metaanálisis que incluyó a 219 mujeres con IUR, la nitrofurantoína, en una dosis diaria nocturna de 50 mg, se consideró como una alternativa apropiada y con un buen perfil de tolerabilidad en esta indicación 2.
En un estudio reciente, aleatorizado y comparativo con placebo (144 pacientes), en mujeres con IUR, la administración de fosfomicina-trometamol a dosis de 3 g cada 10 días (158 pacientes) mostró una reducción en las IUR desde 2,97 a 0,14 episodios/paciente y año (p < 0,001); además, la fosfomicina-trometamol fue más eficaz que el placebo para evitar IUR a los 6 meses de haber suspendido la profilaxis antibiótica 76.
Las tasas de efectos adversos observadas con los diferentes antibióticos oscilan entre el 7 y el 40% para las pautas que contienen trimetroprim, el 7 y el 21% para las fluorquinolonas, el 0 y el 40% para la nitrofurantoína 46, y sólo 1 de 302 casos en el estudio con fosfomicina-trometamol 77.
En una revisión reciente publicada en la Cochrane 77 en la que se abordaban 6 estudios comparativos entre 2 antibióticos y que incluían un total de 517 pacientes no se detectaron diferencias entre un antibiótico y otro 1,78-82. Como no disponemos de ningún estudio comparativo entre los distintos antibióticos que tenga suficiente potencia estadística, no podemos recomendar un régimen profiláctico determinado. Sin embargo, la comodidad y la buena aceptación por parte de las pacientes de la utilización de fosfomicina-trometamol, administrada cada 10 días, tanto en el estudio referido anteriormente, como en el trabajo multicéntrico en el que hemos participado (pendiente de análisis de resultados), sugieren que ésta será una opción atractiva en el futuro.
La mayoría de los autores aconsejan la administración de la profilaxis antibiótica por la noche durante un mínimo de 6 meses, basándose en que las IUR suelen producirse en acumulaciones (episodios repetitivos de IUR a intervalos cortos seguidos de períodos prolongados libres de IU) 37. Si las IU recurren una vez cesada la profilaxis, situación que sucede en el 60% de las pacientes 71,73, se aconseja una terapia prolongada durante 1-2 años o, incluso, durante un período más prolongado 13,73. La administración de bajas dosis de cotrimoxazol u otros agentes durante períodos de incluso 5 años ha demostrado ser efectiva y bien tolerada 45,83. La emergencia de bacterias resistentes al régimen antibiótico profiláctico administrado es un hecho infrecuente, aunque puede ser problemático. La monitorización de la flora rectal o vaginal para detectar la presencia de microorganismos resistentes no predice el desarrollo de recurrencias 71.
Profilaxis antibiótica poscoital
La profilaxis poscoital es una estrategia terapéutica útil en las pacientes en que las infecciones urinarias se relacionan con la actividad sexual. Generalmente suele comportar la utilización de menos dosis de antibióticos.
En un estudio controlado con placebo, la administración poscoital de cotrimoxazol (40 mg de trimetoprim/200 mg de sulfametoxazol) redujo las infecciones del 3,6 al 0,3 por paciente y año 39. Otros estudios, no controlados, han demostrado que la administración poscoital de fluorquinolonas 26,45,84,85 (cinoxacino, 250 mg; ciprofloxacino, 125 mg; norfloxacino, 200 g; ofloxacino, 100 mg), cefalexina a dosis de 250 mg 86 o nitrofurantoína a dosis de 50-100 mg 45 reduce las tasas de reinfección en porcentajes similares. La eficacia de la profilaxis poscoital es similar a la de la profilaxis continua. En mujeres con una actividad sexual intensa probablemente sea más cómoda la profilaxis continua, en especial la administración de fosfomicina-trometamol cada 10 días.
Autotratamiento de la cistitis
En las mujeres con pocas IU anuales (< 3 al año) y en las pacientes que prefieren reducir la toma de antibióticos puede utilizarse el autotratamiento. Tres estudios han demostrado que, en pacientes con un nivel intelectual suficiente, el autodiagnóstico de la cistitis se estableció correctamente en aproximadamente el 90% de los casos 31,43,87. Las tasas de curación clínica y microbiológica, utilizando cotrimoxazol o quinolonas (ofloxacino, levofloxacino), fueron superiores al 90%. Sólo el 6% de las mujeres precisó posteriormente realizar una pauta de profilaxis antibiótica continua 87. En nuestra experiencia, la utilización de fosfomicina-trometamol también ha resultado eficaz.
Aunque con esta estrategia terapéutica las pacientes tienen más IU sintomáticas que las pacientes que utilizan profilaxis antibiótica continua o poscoital, la autoadministración de antimicrobianos eficaces frente a la cistitis reduce rápidamente los síntomas. Esta estrategia debe aplicarse sólo en mujeres con IUR documentadas previamente, en pacientes motivadas, con una buena relación médico-paciente y con un nivel intelectual suficiente para poder establecer el diagnóstico de cistitis y comprender las instrucciones médicas. Si los síntomas no se resuelven en 48 h, la paciente debe contactar con un facultativo. Esta estrategia no es aconsejable en pacientes con riesgo elevado de padecer enfermedades de transmisión sexual, ya que puede retrasar el diagnóstico y el tratamiento de las mismas.
En la mujer con cistitis no complicada de origen extrahospitalario no es necesario realizar un urocultivo, excepto en caso de recidiva. Se inicia tratamiento antibiótico empírico según los estudios de sensibilidad de los microorganismos prevalentes en el área geográfica. En nuestro medio, dados los elevados niveles de resistencia a la amoxicilina (alrededor del 50%), al cotrimoxazol (aproximadamente el 40%), al ácido pipemídico (superior al 30%) y a las cefalosporinas de primera generación, no se aconseja su empleo como tratamiento empírico. En el tratamiento de la cistitis existen varias opciones terapéuticas:
Betalactámico con inhibidor de las betalactamasas: amoxicilina-ácido clavulánico, ampicilina-sulbactam (mayores tasas de recidiva que con cotrimoxazol o quinolonas 68).
Cefalosporinas de segunda-tercera generación. Alternativa válida, aunque el precio es elevado.
Fluorquinolonas. En nuestro medio, las tasas de resistencias de E. coli (y otras enterobacteriáceas) son del 20-25%; sin embargo, en la cistitis no complicada las tasas y los fracasos clínicos son inferiores (5-10%), probablemente debido a la elevada concentración del fármaco en la orina, por lo que aún pueden utilizarse como tratamiento empírico.
Fosfomicina-trometamol: constituye una de las pautas de elección en nuestro medio, tanto por su comodidad de administración (con una monodosis de 3 g se consiguen valores urinarios por encima de la concentración mínima inhibitoria [CMI] durante 48-72 h), como por las bajas tasas de resistencia (inferiores al 5%) y precio 25,90.
Con respecto a la duración de la terapia de la cistitis, los estudios de revisión muestran diferentes grados de erradicación bacteriológica:
Las pautas de 3 días con fluorquinolonas o cotrimoxazol tienen una eficacia similar a la pauta convencional de 7 días.
En un metaanálisis, la eficacia de 3 días con betalactámicos fue inferior a 3 días de cotrimoxazol o quinolonas (82% frente al 95 y al 93%, respectivamente) 88,89.
En el mismo metaanálisis, la eficacia de las pautas de 5 días con betalactámicos fue superior a las pautas de 3 días con los mismos fármacos (88% frente al 82%) 88,89.
La monodosis fue inferior a la terapia de 3 días con el empleo de betalactámicos (66% frente al 82%), cotrimoxazol (89% frente al 95%), fluorquinolonas (81% frente al 93%) o con aminoglucósidos. La eficacia de 3 días de nitrofurantoína es inferior a la de 7 días 68,89.
En niñas/os menores de 5 años, en embarazadas, en diabéticas, en la insuficiencia renal, en inmunodepresión, en caso de IU previa en el último mes, en clínica de más de una semana de evolución (mayor riesgo de pielonefritis), en la utilización de diafragmas o cremas espermicidas, en IU por Proteus spp., en anomalía anatómica o funcional de la vía urinaria y en pacientes > 65 años, se aconseja prolongar el tratamiento durante 7-10 días, dado el elevado porcentaje de recidivas que se presentan con las pautas más cortas. En estas situaciones se aconseja realizar un urocultivo de control postratamiento (1-2 semanas después).
En la mujer con cistitis no complicada de origen extrahospitalario no es necesario realizar un urocultivo de control, a no ser que la IU sea una recidiva precoz (primer mes).
En cuanto a la alteración de la flora fecal, hay que destacar que de entre las alternativas descritas anteriormente, la nitrofurantoína, el cotrimoxazol, las fluorquinolonas y la fosfomicina producen escasas modificaciones de la flora fecal normal. Por el contrario, los tratamientos que incluyen a betalactámicos se relacionan con una incidencia superior de efectos adversos, porque alteran drásticamente la flora vaginal y fecal 40.
Infección urinaria recurrente en la mujer posmenopáusica
Las IUR son relativamente frecuentes en las mujeres posmenopáusicas; entre el 15-20% de las mujeres mayores de 60 años presentarán una recurrencia 47, y este porcentaje es superior en pacientes institucionalizadas 91.
Patogenia
En un estudio controlado se observó que los factores anatómicos o funcionales que afectaban el vaciado de la vejiga urinaria eran los que más se asociaban a IUR 28. En este trabajo, los factores asociados a IUR fueron la incontinencia urinaria (41% frente al 9%; odds ratio [OR] = 5,79), presencia de cistocele (19% frente al 0%), presencia de residuo posmiccional (28% frente al 2%), historia previa de IU antes de la menopausia (OR = 4,85%), estado no secretor para el grupo sanguíneo ABO (OR = 2,9) y cirugía ginecológica previa 28.
En ancianos, la residencia en instituciones geriátricas, el sondaje urinario y la exposición a antimicrobianos son otros factores relacionados con IU recurrentes 38.
En posmenopáusicas no se había estudiado el papel de los hábitos sexuales, ni si los factores de virulencia de los uropatógenos tenían relación con las IUR. En un estudio reciente, que incluyó a 899 pacientes sanas > 55 años con IU y a 911 controles, se observó que las pacientes con IU eran con mayor frecuencia sexualmente activas (OR = 1,42), diabéticas (OR = 2,78), tenían antecedentes de IU (OR = 4,2) o incontinencia (OR = 1,36). El tratamiento hormonal sustitutivo por vía oral no redujo el riesgo de IU 92.
En mujeres posmenopáusicas con IUR no relacionadas con patología urológica, se ha sugerido que las IU estarían relacionadas con valores bajos de estrógenos vaginales, lo que condicionaría un descenso en la concentración vaginal de glucógeno y secundariamente de Lactobacillus spp. y que produciría un aumento del pH vaginal, lo cual favorecería la colonización vaginal por Enterobacteriaceae 38,47.
Estrategias terapéuticas en pacientes menopáusicas con IU recurrentes
En pacientes menopáusicas con IUR secundarias a una patología urológica (incontinencia urinaria, cistocele, residuo urinario, etc.), los esfuerzos terapéuticos deben dirigirse a corregirla. Si ésta no puede corregirse y las IUR son sintomáticas, estará indicada la profilaxis con dosis bajas de antibióticos durante 6-12 meses, administrados preferentemente por la noche, como se ha comentado anteriormente (figura 3).
La administración de estrógenos por vía oral no reduce el número de IU ni previene las IUR 47,93-95. Sin embargo, en un estudio aleatorizado, doble ciego y comparativo con placebo, la aplicación intravaginal de cremas de estrógenos redujo la incidencia de infecciones recurrentes de 5,9 infecciones por paciente y año a 0,5 infecciones por paciente y año. Además, se demostró que la aplicación tópica de estrógenos aumentaba la concentración de Lactobacillus en la vagina y disminuía el pH vaginal y la colonización vaginal por E. coli 27,28,45,96.
En otro estudio aleatorizado, abierto y paralelo, se demostró que, transcurridos 36 meses, la aplicación de un dispositivo vaginal de liberación de estrógenos disminuía significativamente la posibilidad de padecer un episodio de IUR 6, aunque la eficacia fue inferior a la observada con la crema vaginal de estrógenos 27.
El papel protector de la aplicación de los estrógenos tópicos probablemente sea multifactorial. En un estudio reciente realizado en mujeres jóvenes con IUR y tratamiento prolongado con contraceptivos orales, la aplicación de estriol vaginal se asoció a cambios en el flujo sanguíneo vesical y también redujo la incidencia de IUR 97.
En un estudio reciente, la efectividad de un pesario vaginal con estrógenos fue menos eficaz que la administración diaria de 100 mg de nitrofurantoína 98. Quedan pendientes estudios que comparen los antibióticos con la utilización de cremas vaginales.
Por lo tanto, en las mujeres posmenopáusicas sin patología urológica de base que presentan IUR con una frecuencia superior a 3 al año puede realizarse profilaxis antimicrobiana continua durante 6-12 meses o bien aplicar cremas vaginales de estrógenos. En las pacientes con menos de 3 episodios anuales aconsejamos realizar autotratamiento de cada episodio de cistitis 99 (fig. 3).
Infección urinaria recurrente en la embarazada
Las IU y la recurrencia de las mismas son frecuentes en las mujeres embarazadas. La prevalencia de bacteriuria asintomática (BA) en la embarazada es del 2-11%, y es superior en pacientes multíparas, mujeres con nivel socioeconómico bajo, infección urinaria previa, anomalías anatómicas o funcionales del tracto urinario y/o edad avanzada 99,100.
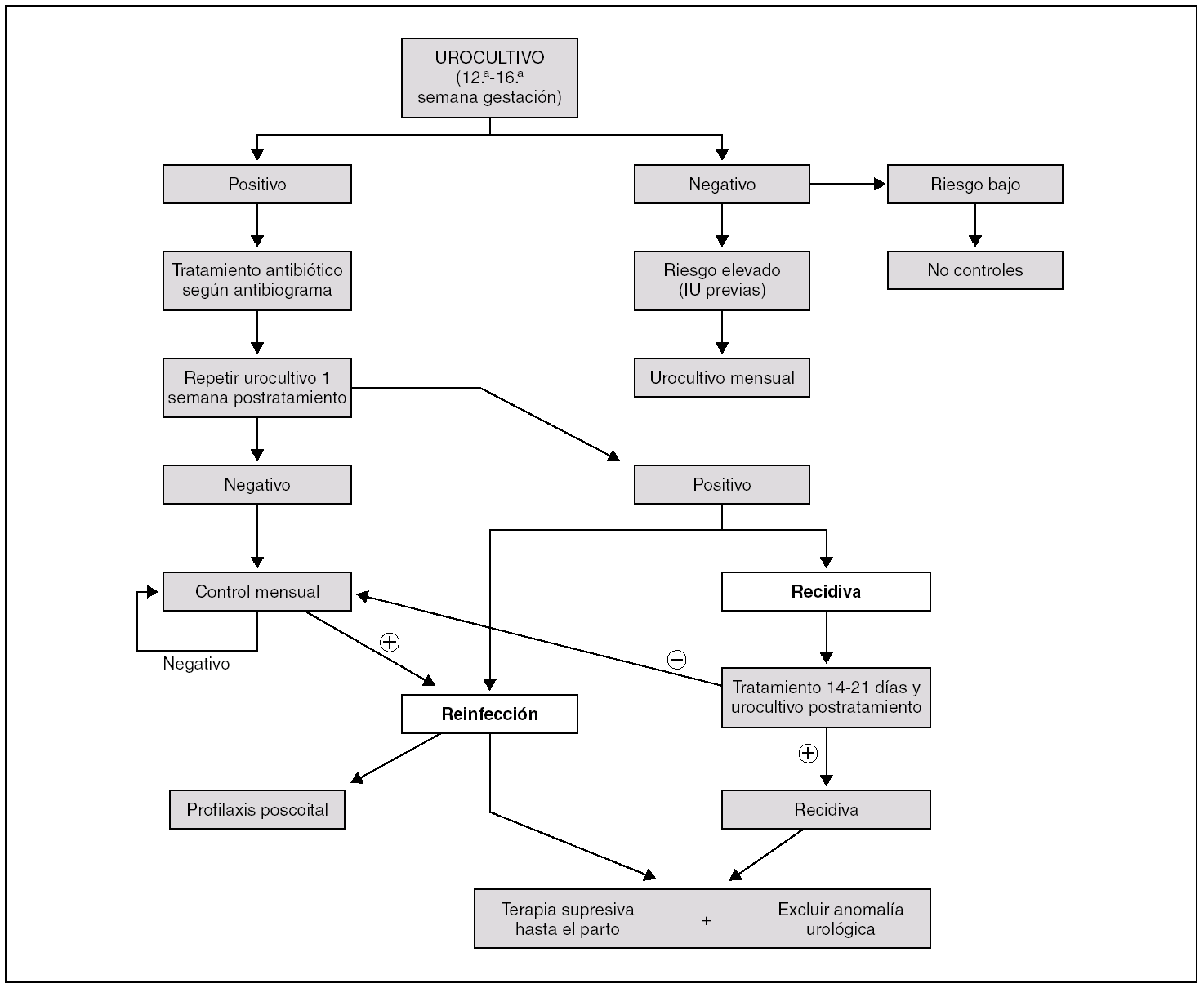
En ausencia de tratamiento antibiótico, un tercio de las embarazadas con BA desarrollan una pielonefritis. En un metaanálisis, la BA comportó el doble de riesgo de parto prematuro y aumentó en un 50% el riesgo de recién nacido de bajo peso. Por otro lado, la erradicación de la bacteriuria reduce en el 80-90% la incidencia de infección urinaria sintomática y disminuye el riesgo de parto prematuro y de recién nacido de bajo peso 101. Por dicho motivo, en la actualidad, para detectar la presencia de una BA se recomienda realizar a todas las embarazadas un urocultivo entre la 12.ª y la 16.ª semanas de gestación. En la figura 4 se recogen las recomendaciones para su detección sistemática y un algoritmo terapéutico de las recurrencias.
Figura 4. Algoritmo diagnóstico-terapéutico de la bacteriuria en la embarazada. IU: infección urinaria; recidiva: recurrencia de la infección urinaria por el mismo microorganismo; reinfección: recurrencia por distinto microorganismo (ambos pueden ser el mismo E. coli).
La elección del antibiótico se efectuará en función del resultado del antibiograma y de la categoría de riesgo del fármaco para el feto. Se incluyen en la categoría B, y por tanto pueden utilizarse sin riesgo, las penicilinas, los inhibidores de las betalactamasas como amoxicilina-ácido clavulánico, las cefalosporinas, la nitrofurantoína y la fosfomicina. El trimetroprim (categoría C), al ser un antagonista del ácido fólico, debe evitarse en el primer trimestre. Las sulfamidas (entre ellas el sulfametoxazol, componente del cotrimoxazol), que también pertenecen a la categoría C, deben evitarse en el tercer trimestre por el riesgo de ictericia, anemia hemolítica y querníctero en el recién nacido. Existe poca experiencia con el empleo de fluorquinolonas (categoría C) por el riesgo de afectación osteoarticular (cartílago de crecimiento) 24.
La duración de la terapia de la BA en la mujer embarazada es motivo de controversia. Inicialmente, por la elevada tasa de recidivas, se aconsejó tratamiento hasta el parto. En la actualidad la mayoría de autores, entre los que nos incluimos, se inclina por pautas más cortas, seguidas de urocultivos de control 24. Aproximadamente en el 70-80% de los casos la BA se erradica con una pauta de 7 a 10 días. Los resultados con pautas más cortas (3-4 días) o con una monodosis de 3 g de fosfomicina-trometamol son similares 102-104.
Independientemente de la terapia utilizada, la BA recurre en el 20-30% de los casos. Por dicho motivo se aconseja realizar un urocultivo de control a la semana de finalizado el tratamiento (fig. 4). Si el urocultivo es negativo, se efectuarán urocultivos mensuales hasta el parto. Si es positivo y se aísla el mismo microorganismo (recidiva), se aconsejan 14-21 días de tratamiento (probable pielonefritis silente) con un antibiótico que alcance concentraciones suficientes en el parénquima renal y que no sea tóxico para la embarazada ni para el feto. Si la IU recidiva tras un tratamiento prolongado debe excluirse la existencia de una anomalía urológica (litiasis, absceso renal, etc.) mediante ecografía. Si no se identifica una causa evidente de la recidiva, se aconseja realizar profilaxis antibiótica hasta el parto (fig. 4).
En las embarazadas con frecuentes IUR por reinfección se aconseja realizar profilaxis antibiótica hasta el parto con cefalexina, nitrofurantoína o cotrimoxazol (evitar en el último trimestre). La profilaxis poscoital con los mismos antibióticos tiene la misma eficacia si las recurrencias se relacionan con la actividad sexual 71.
Otras estrategias preventivas
Arándanos
Los arándanos son un remedio casero utilizado por la medicina alternativa para la prevención de las IUR 35. Inicialmente se había sugerido que los arándanos, que tenían un contenido ácido superior a la de otras frutas, incluyendo un precursor bacteriostático del ácido hipúrico, ejercían su acción acidificando la orina. Posteriormente se comprobó que la capacidad acidificante era insuficiente 107.
Se ha demostrado que los arándanos inhiben la adherencia de los uropatógenos a las células uroepiteliales 113,106,107. Las sustancias implicadas en este efecto antiadherente son la fructosa, que interfiere con la adhesión de las fimbrias-I de E. coli, y las proantocianidinas, taninos de naturaleza polifenólica que inhiben la adherencia de las fimbrias P de E. coli 41,106-108. Además, al incubar en medio agar suplementado con zumo de arándanos, las proantocianidinas disminuyen la producción de fimbrias de E. coli in vitro 109. Por otro lado, los arándanos tienen actividad antibacteriana contra un amplio grupo de microorganismos uropatógenos 107,110. A diferencia de otras frutas, el contenido en proantocianidinas A es más elevado en los arándanos que en otras frutas 107.
Experiencia clínica
En un estudio aleatorizado realizado en ancianas institucionalizadas y en el que existían diferencias significativas basales en el número de IU entre ambos brazos, la administración de zumo de arándanos redujo la incidencia de BA respecto al placebo 111.
Posteriormente, en otro trabajo aleatorizado doble ciego, pero que incluía pocas pacientes, la administración de 400 mg de arándanos en forma sólida redujo la incidencia de infecciones urinarias recurrentes 42.
En un estudio aleatorizado, abierto, realizado en 150 mujeres finlandesas con IU previas, la administración de 50 ml de concentrado de zumo de arándanos (7,5 g) redujo la incidencia de recidivas del 39 al 16%, mientras que la administración de 100 ml de un preparado que contenía Lactobacillus fue ineficaz 112.
En otro estudio aleatorizado con placebo, doble ciego, realizado en 150 mujeres sexualmente activas con IUR, de edades comprendidas entre 21 y 72 años, la incidencia al año de IU sintomática fue inferior en el grupo tratado con arándanos (32% frente al 20%; p < 0,05) 113; en este estudio, la administración de arándanos fue coste-efectiva, y la eficacia de las cápsulas fue similar a la del jugo de arándanos.
Si bien en la revisión inicial publicada en la Cochrane Library 18 no existía suficiente evidencia para recomendar los arándanos en la prevención de las IUR, en la reciente actualización realizada por los mismos autores 114, y que incluía 2 estudios recientes ya mencionados 112,113, se concluyó que los arándanos reducían significativamente la incidencia de IU a los 12 meses de seguimiento (riesgo relativo = 0,619) respecto al placebo. Queda por definir la cantidad y concentración de arándanos, y el tiempo necesario para ejercer dicho efecto protector 114.
Sin embargo, los arándanos no parecen prevenir las IUR relacionadas con sondajes urinarios intermitentes 114-116.
Acidificación de la orina
Durante años se había sugerido que la acidificación de la orina podría ser una medida eficaz en la prevención de las IUR. Se ha demostrado que con el empleo de ácido ascórbico, en dosis de aproximadamente 2 g, no se consigue la acidificación de la orina, por lo que no es eficaz en la prevención de las IU recurrentes 99.
Existe controversia en cuanto a la eficacia de la metenamina, profármaco del formol, en el tratamiento y en la prevención de las IU. En un estudio aleatorizado, doble ciego, cruzado, con un seguimiento de 2 años, el hipurato de metenamina se mostró efectivo como preventivo de la recurrencia de la cistitis 3. Sin embargo, este antiséptico urinario, no disponible en España desde hace pocos años, debería reservarse para cuando fracasen otras alternativas, principalmente en la prevención y el tratamiento de las IUR en pacientes con vejiga neurógena.
Lactobacillus
La administración de Lactobacillus por vía oral no es efectiva en la prevención de las IUR 107,112,117. La utilización de Lactobacillus en aplicación vaginal es una estrategia profiláctica atrayente 107. Se ha sugerido que los Lactobacillus competirían con los uropatógenos vaginales a través de diversos mecanismos 107,118: creando un pH ácido, lo cual dificulta el crecimiento de las enterobacteriáceas; produciendo peróxido de hidrógeno y bacteriocinas, que destruirían a los uropatógenos; bloqueando la adhesión y fijación bacterianas, directamente o a través de un mecanismo competitivo, o bien mediante la producción de otros factores que inhibieran el crecimiento bacteriano.
Algunos estudios, aunque sólo incluían un grupo reducido de pacientes, sugieren que la aplicación vaginal de Lactobacillus puede ser eficaz en la prevención de las IUR 119-122. La selección de la cepa adecuada, en especial su capacidad de producir peróxido de hidrógeno y su capacidad para inhibir la adhesión de E. coli a las células vaginales, son fundamentales para determinar su eficacia en la prevención de las IUR 107.
Se requieren más estudios, a ser posible con preparados comercializados que demuestren la eficacia e inocuidad de estos probióticos en la prevención de las IUR, especialmente tras la reciente publicación de dos casos de sepsis por Lactobacillus spp. asociados con la administración de estos productos 123.
Instilación intravesical de cepas avirulentas
También se ha empleado, como método preventivo, la administración de cepas de E. coli avirulentas creadas mediante ingeniería genética 12. En 2 estudios realizados en lesionados medulares en los que habían fallado las medidas profilácticas convencionales, la instilación intravesical de cepas avirulentas de E. coli redujo 50 veces la incidencia de IU 5,124. Si se confirman estos hallazgos, esta terapia, denominada de interferencia bacteriana, podría ser una opción terapéutica en pacientes seleccionados con IUR.
Sustancias inhibidoras de la adherencia
Otra estrategia preventiva sería la utilización de sustancias análogas de los receptores uroepiteliales, tales como determinados oligosacáridos que, al inhibir por un mecanismo competitivo la fijación de las bacterias, redujeran el número de IUR 44. Estas sustancias, todavía en fase experimental y cuyo principal problema es la hidrólisis de las mismas por glucosilasas bacterianas o humanas, tendrían la ventaja de no inducir la aparición de cepas resistentes a los antibióticos 107.
Vacunas
La administración oral, transdérmica o intravaginal de vacunas que emplean combinaciones de cepas uropatógenas, inactivadas mediante calor, tiene una eficacia transitoria (algunas semanas) en la prevención de las IUR 45,125. Aunque existe amplia experiencia con la vacuna Uro-Vaxon, compuesta de fracciones inmunoestimulantes de 18 serotipos de E. coli, y un reciente metaanálisis ha demostrado su eficacia, los estudios realizados no permiten extraer conclusiones de su eficacia a largo plazo 126.
En un estudio reciente, utilizando un extracto de E. coli (OM-89) administrado diariamente por vía oral durante 3 meses, seguido de 3 meses sin tratamiento y 3 recuerdos los primeros 10 días del 7.º, 8.º y 9.º meses, demostró una reducción en la tasa de IUR a los 12 meses 127.
Un avance prometedor es el desarrollo de una vacuna basada en la utilización de proteínas con capacidad adhesiva de las fimbrias tipo 1 (FimH) 20. En un modelo murino de cistitis, la inmunización de los animales con la vacuna FimH redujo un 99% la colonización de la mucosa urinaria por uropatógenos. Además, se ha demostrado que el suero de los animales vacunados inhibía también la fijación de E. coli uropatógenos a las células uroepitelialles 107.
En monos, la vacuna con FimH induce la formación de anticuerpos y protege al 75% de los animales del desarrollo de piuria y bacteriuria al instilar E. coli uropatógenos intravesicales 128. En la actualidad se están desarrollando estudios en humanos.
Correspondencia:
Dr. C. Pigrau-Serrallach.
Aribau 162, 2.º L. 08036 Barcelona. España.
Correo electrónico: cpigrau@vhebron.net