A pesar del gran avance que ha supuesto el tratamiento antirretroviral de gran actividad para el pronóstico de la infección por el virus de la inmunodeficiencia humana (VIH), las infecciones oportunistas (IO) continúan siendo causa de morbilidad y mortalidad en estos pacientes. Ocurre en muchos casos por la presencia de inmunodepresión grave, ante la falta de adherencia al tratamiento antirretroviral, el fracaso del mismo en ocasiones o el desconocimiento previo de la existencia de la infección por el VIH en pacientes que comienzan con una IO.
El presente artículo actualiza las recomendaciones de tratamiento del episodio agudo de diferentes infecciones en pacientes infectados por el VIH: infecciones parasitarias, fúngicas, víricas, micobacterianas y bacterianas. Se ha añadido en esta edición un apartado sobre infecciones parasitarias importadas –además de micosis endémicas en el apartado de infecciones fúngicas–, teniendo en cuenta el aumento de población inmigrante en nuestro país. Finalmente, se ha actualizado el capítulo sobre el síndrome de reconstitución inmune, relevante por su repercusión clínica y diagnóstica en pacientes que inician tratamiento antirretroviral en situación de inmunodepresión grave (versión en inglés en: http://www.gesida.seimc.org).
Despite the huge advance that highly active antiretroviral therapy has represented for the prognosis of infection by human immunodeficiency virus (HIV), opportunistic infections continue to be a cause of morbidity and mortality in HIV-infected patients. This is often the case because of severe immunodepression, poor adherence to antiretroviral therapy, failure of therapy, or the fact that patients are unaware of their HIV-positive status and debut with an opportunistic infection.
This article updates the guidelines on treatment of acute episodes of various opportunistic infections in HIV-infected patients, including infections due to parasites, fungi, viruses, mycobacteria, and bacteria. This edition has a new chapter on imported parasite infections as well as additional information on endemic mycoses in the chapter on fungal infections, taking into account the growing number of immigrants in our setting. Lastly, the chapter on the immune reconstitution syndrome has also been updated, providing relevant data on a phenomenon that has clinical and diagnostic repercussions in patients who start antiretroviral therapy while they are severely immunodepressed (English version available at http://www.gesida.seimc.org).
Las infecciones oportunistas (IO) han sido la principal causa de morbilidad y mortalidad de los pacientes infectados por el virus de la inmunodeficiencia humana (VIH) desde el inicio de la epidemia de sida1.
La instauración de pautas eficaces de profilaxis primaria y secundaria frente a las principales IO supuso el primer gran avance terapéutico para los enfermos infectados por el VIH, permitiendo un significativo descenso de mortalidad ya antes de la era del tratamiento antirretroviral de gran actividad (TARGA)2. Con la introducción del TAR-GA se asistió a un notable cambio en la evolución de la infección por VIH, con una drástica reducción de la mortalidad y de la incidencia de enfermedades oportunistas3. Sin embargo, continuamos observando casos de IO en varias situaciones: pacientes que no se sabían infectados por el VIH y que comienzan con una IO, enfermos que no reciben TARGA por mala tolerancia, fracaso del TARGA por falta de adherencia u otras4,5. Por ello, el tratamiento de las IO sigue siendo un tema de actualidad en el tratamiento de pacientes infectados por el VIH.
En este artículo se actualizan las recomendaciones para el tratamiento del episodio agudo de IO, así como la actitud que tomar ante un cuadro de reconstitución inmune. Con relación a la edición anterior6, se han añadido apartados sobre infecciones bacterianas y enfermedades importadas. Teniendo en cuenta los cambios demográficos y el aumento notable de pacientes inmigrantes infectados por el VIH en los últimos años4,5, creemos que este último es de gran utilidad. Para la clasificación de la fuerza y la calidad de las recomendaciones hemos aplicado el sistema utilizado por la Sociedad Americana de Enfermedades Infecciosas (IDSA) y el Departamento de Salud y Servicios Sociales de EE.UU. (DHHS) (tabla 1).
Sistema para la clasificación de las recomendaciones de guías de práctica clínica utilizado por la Sociedad Americana de Enfermedades Infecciosas (IDSA) y el Servicio de Salud Pública de Estados Unidos de América (USPHS)
Fuerza de la recomendación
|
El tratamiento de mantenimiento o profilaxis secundaria de las IO se trata en un artículo separado, por lo que no nos referiremos al mismo y remitimos a los lectores a dicha publicación7.
El presente artículo es una versión resumida del documento completo al que se puede acceder a través de la web de GESIDA (www.gesida.seimc.org). Por ello, en la mayoría de casos, las dosis de los tratamientos recomendados aparecen únicamente en las tablas.
Infecciones causadas por parásitos (tabla 2)Las infecciones parasitarias, especialmente las causadas por diferentes protozoos -Pneumocystis jiroveci (incluido en este apartado aunque desde hace un tiempo se le clasifica como hongo), Toxoplasma gondii, Leishmania donovani, Cryptosporidium parvum, Isospora belli, Microsporidia-, han sido muy frecuentes en pacientes infectados por el VIH en fases de inmunosupresión, antes de la introducción del TARGA y continúan observándose en la actualidad en un número no despreciable de casos.
Tratamiento de infecciones por parásitos en pacientes infectados por el virus de la inmunodeficiencia humana
| Microorganismo/enfermedad | Tratamiento | |
| Primera elección | Alternativas | |
| Pneumocystis jiroveci | ||
| Neumonía. Raramente en otras localizaciones o formas diseminadas | Formas graves:Cotrimoxazol, 15-20 mg/kg/día de trimetoprima y 75-100 mg/kg/día de sulfametoxazol i.v. o v.o., 21 días (repartido en 3-4 tomas)Añadir:Prednisona, 40 mg/12 h v.o. o i.v., si PO2 < 70 mmHgFormas leves-moderadas:Cotrimoxazol en las mismas dosis v.o. | Pentamidina (isotianato) 3-4 mg/kg/día i.v., 21 díasClindamicina, 600 mg v.o. o i.v./6-8 h, + primaquina 30 mg/día v.o.Dapsona 100 mg/día + trimetoprima 15-20 mg/kg/díaAtovacuona 750 mg/12 h v.o. |
| Toxoplasma gondii | ||
| Lesiones focales en el SNC coriorretinitis. Raramente en otras localizaciones (pulmonar, peritoneal, etc.) | Sulfadiazina, 4-6 g/día (en 4 tomas), + pirimetamina, 50 mg/día, + ácido folínico, 10 mg/día, 6-8 semanas | Clindamicina, 600 mg/6 h i.v. o v.o., + pirimetamina, 50 mg/día, + ácido folínico, 10 mg/día, 6-8 semanasAzitromicina 900-1200 mg/día o claritromicina 1 g/12 h o + pirimetamina, 50 mg/día (ácido folínico)Atovacuona, 1.500 mg/12 h + pirimetamina, 50 mg/día (ácido folínico) o + sulfadiazina 1-1,5 g/6 hCotrimoxazol (5 mg/kg trimetoprima + 25 mg/kg sulfametoxazol)/12 h v.o. o i.v. |
| Leishmania donovani | ||
| Kala-azar. En ocasiones, localizaciones raras (piel, estómago, etc.) | Anfotericina liposomal 4 mg/kg días 1-5, 10, 17, 24, 31, 38 (dosis total 20-60 mg/kg)Anfotericina complejo lipídico 3 mg/kg/día 5-10 días | Antimonio pentavalente, 20 mg/kg/día i.m., 4 semanasAnfotericina B, 0,5 mg/kg (dosis total, 1-1,5 g)Miltefosina 100 mg/día v.o., 4 semanas (uso compasivo) |
| Cryptosporidium spp. | ||
| Enteritis, menos frecuente en otras localizaciones (vía biliar o pulmonar) | TARGA | Nitazoxanide 500-1.000 mg/12 h v.o. |
| Isospora belli | ||
| Enteritis, excepcionalmente, localización extraintestinal (ganglios retroperitoneales) | Cotrimoxazol, 160 mg de trimetoprima/ 800 mg de sulfametoxazol, 3-4 veces/día v.o. 10 días | Pirimetamina 50 mg/día + ácido folínico Ciprofloxacino 500 mg/12 h, 7 días |
| Microsporidia (Enterocytozoon bieneusi, Encephalitozoon cuniculi, otros) | ||
| Enteritis. Raramente, queratoconjuntivitis, hepatitis y formas diseminadas | TARGAEnfermedad gastrointestinal por E. bieneusiFumagilina 20 mg/8 h v.o.Enfermedad diseminada (no ocular) e intestinal por especies diferentes de E. bieneusiAlbendazol 400 mg/12 h v.o.Infecciones oculares: ver texto | |
| Giardia lamblia, Entamoeba coli, Endolimax nana y Blastocystis hominis | ||
| Enteritis, enterocolitis | Metronidazol, 250 mg/8 h, v.o. o i.v., 5-7 días | Albendazol 400 mg/día, 5 días |
i.m.: intramuscular; i.v.: intravenoso; SNC: sistema nervioso central; TARGA: tratamiento antirretroviral de gran actividad; v.o.: vía oral.
Es causante fundamentalmente de neumonía, si bien en casos raros (tradicionalmente descritos en pacientes en profilaxis con pentamidina inhalada) pueden desarrollarse formas diseminadas con afectación multiorgánica.
En casos de neumonía grave (pO2 < 70 mmHg o gradiente alvéolo-arterial > 35 mmHg) el tratamiento de elección es el cotrimoxazol (COT) por vía intravenosa (i.v.), durante 21 días (AI)8. Está indicado, además, el tratamiento adyuvante con corticoides para mejorar la función respiratoria, reducir el riesgo de intubación y disminuir la mortalidad9 (AI). De entrada, no se recomienda añadir ácido folínico para prevenir la mielotoxicidad del COT, porque no está clara su eficacia, y existe alguna evidencia de que puede favorecer el fracaso del tratamiento10 (DII). Sin embargo, podría probarse en pacientes que empeoren su hemograma durante el mismo (CIII). Se han descrito mutaciones de resistencia al cotrimoxazol, pero su relevancia clínica no está clara11.
En pacientes que no toleran COT (30-40% en algunas series) se puede tratar con pentamidina i.v. (AI). Aunque algunos estudios previos mostraban una eficacia similar de COT y pentamidina, en un trabajo más reciente se observó menor fallo terapéutico, mejoría más rápida de la oxigenación y menor frecuencia de recaídas en los pacientes que recibían COT8. Además, si bien COT causa efectos adversos con cierta frecuencia, éstos suelen ser menos graves que los causados por pentamidina i.v.8. En casos de alergia no grave al COT se puede intentar una pauta de desensibilización. Otra alternativa es clindamicina i.v. + primaquina vía oral (v.o.) (BI). Trimetrexato ya no se comercializa. En la neumonía por P. jiroveci leve-moderada existen varias opciones terapéuticas orales para pacientes que no toleran el COT v.o.12 –nuevamente el fármaco de primera elección (AI)–: a) dapsona-trimetoprima (BI)13 (eficacia similar y menos toxicidad pero pauta incómoda por número de comprimidos), y b) clindamicina-primaquina (BI)10,14, atovacuona (BI)15 (menos efectivo que COT pero mejor tolerado). Pentamidina inhalada no se recomienda por menor eficacia y mayor frecuencia de recaídas (DI). A los pacientes que presentan fracaso al tratamiento inicial (falta de respuesta a los 5-7 días de tratamiento), estando en tratamiento oral, debería cambiarse a un tratamiento i.v. y descartar infecciones respiratorias concomitantes.
Toxoplasma gondiiT. gondii causa infección del sistema nervioso central (SNC) y con menos frecuencia afectación ocular e infección diseminada.
La encefalitis toxoplásmica (ET) es la infección del SNC más frecuente en pacientes infectados por el VIH. Ante un paciente en riesgo de ET -CD4 < 100 células/μl y serología positiva frente a T. gondii- que presenta clínica neurológica y lesiones focales compatibles en la tomografía computarizada (TC) o en la resonancia magnética (RM) craneales, se recomienda iniciar tratamiento empírico antitoxoplasma. La biopsia cerebral se reserva para aquellos casos que no responden al tratamiento después de 7-14 días o inicialmente en los que se sospecha otra etiología, fundamentalmente linfoma cerebral: serología negativa frente a T. gondii, profilaxis primaria correcta y lesión única en la RM.
El tratamiento de elección de la ET es la asociación de sulfadiacina y pirimetamina durante 6-8 semanas16,17 (AI). Se debe añadir ácido folínico para evitar la toxicidad hematológica de la pirimetamina y beber abundante agua para evitar la cristalización tubular de la sulfadiacina.
En casos seleccionados de rápida respuesta al tratamiento y desaparición de las imágenes en las pruebas radiológicas se podría acortar el tratamiento de la fase aguda a 3 o 4 semanas, pasando a tratamiento de mantenimiento (BIII).
En pacientes con hipertensión intracraneal grave y riesgo de enclavamiento cerebral se deben administrar corticoides (dexametasona 16 mg de entrada, seguidos de 4 mg/6 h) (BIII). En caso de crisis comicial, se añadirán fármacos anticomiciales (AIII), teniendo en cuenta las interacciones de casi todos ellos -salvo ácido valproico o levetiracetamcon los inhibidores de proteasa (IP) y los inhibidores de la transcriptasa inversa no nucleósidos (INNTI).
Para pacientes que no toleran la sulfadiazina, por reacciones de hipersensibilidad u otros efectos adversos, la alternativa es la asociación de clindamicina y pirimetamina (también añadiendo ácido folínico) (AI)16,17. La eficacia de esta pauta es similar aunque en la fase de mantenimiento se ha mostrado inferior a sulfadiazina-pirimetamina17. Atovacuona sola o asociada a pirimetamina o sulfadiazina es otra posibilidad (BII)18. La eficacia parece correlacionarse bien con los niveles en plasma y presenta sinergia con pirimetamina. Otras alternativas para pacientes que no toleran la clindamicina, aunque sin que exista una gran experiencia al respecto, son los macrólidos claritromicina o azitromicina asociados si es posible a pirimetamina (BIII)18,19. Existen algunas experiencias con cotrimoxazol i.v. -el fármaco de elección para la profilaxis primaria de esta infección oportunista-20, y puede ser especialmente útil en pacientes que no puedan recibir tratamiento oral o en sonda nasogástrica, así como para los casos raros de aparición simultánea de una neumonía por P. jiroveci y una encefalitis por T. gondii (CII).
La toxoplasmosis extracerebral -poco frecuentese trata con los mismos regímenes que la ET, aunque la respuesta puede no ser tan favorable.
Protozoos causantes de infección intestinal: Cryptosporidium parvum, Isospora belli, Microsporidia, Giardia lamblia y otrosA pesar de que la clínica de las infecciones causadas por algunos de estos patógenos suele ser muy similar -diarrea crónica, con adelgazamiento progresivoel tratamiento y la evolución son diferentes.
La respuesta de I. belli es en general buena e incluso espectacular, y es el COT el antibiótico de elección (AI)21. Se han propuesto como alternativas pirimetamina (BII), y ciprofloxacino (CI). Existe alguna experiencia favorable con diclazuril 300 mg/12 h, albendazol más ornidazol y nitazoxanida.
Microsporidia implica múltiples organismos (Enterocytozoon bieneusi, Encephalitozoon hellem, Septata intestinalis, Nosema, etc.) y diferentes cuadro clínicos y localizaciones22. E. bieneusi parece responder a fumagilina oral (BII)23, mientras que albendazol sería efectivo frente a diversas especies de microsporidia diferentes de Enterocytozoon y es el tratamiento recomendado para microsporidiosis intestinal y diseminada causadas por microorganismos que no sean E. bieneusi (AII)24. La infecciones oculares por microsporidia pueden tratarse con fumagilina tópica (BII), asociada a albendazol oral para eliminar formas extraoculares (BIII). El TARGA con reconstitución inmune se asocia a una resolución de síntomas de microsporidiasis intestinal, por lo que debe ofrecerse TARGA como parte del tratamiento inicial de esta complicación (AII)25.
Lo mismo sucede en el caso de Cryptosporidium, en que la respuesta al tratamiento "específico" ha sido siempre desalentadora. El tratamiento antirretroviral puede asociarse a una completa resolución de síntomas de esta enfermedad y debe darse como parte del manejo inicial (AII)25.
Si bien se han comunicado en ocasiones mejorías con paromomicina (1 g/12 h)26 sola o asociada a azitromicina (600 mg/día), los resultados de diversos estudios son contradictorios o no concluyentes y en la actualidad no se recomienda el uso de paromomicina para esta enfermedad (CII)27.
Nitazoxanida tiene actividad in vitro frente a C. parvum y en dosis de 500-1.000 mg/12 h durante 14 días mostró una tasa de curación (aclaramiento de microorganismos de las heces y reducción de diarrea) mayor que un grupo control en pacientes con CD4 por encima de 50/μ1, pero no en los más inmunodeprimidos27,28.
Finalmente, G. lamblia, Entamoeba coli, Endolimax nana y Blastocystis hominis también pueden causar cuadros diarreicos en pacientes infectados por el VIH, aunque su presencia en heces no siempre implica un papel patógeno. Suelen responder al tratamiento con metronidazol, aunque las recidivas son frecuentes. Albendazol sería la alternativa, y otras opciones son también furazolidona, tinidazol y quinacrina.
Leishmania donovaniLa leishmaniasis visceral es una enfermedad oportunista que aparece con cierta frecuencia en áreas endémicas y sus manifestaciones clínicas son similares a las de los pacientes VIH-negativos, si bien algunos enfermos pueden desarrollar localizaciones atípicas (lengua, tubo digestivo, etc.).
Durante tiempo los antimoniales (glucantime) se han considerado el tratamiento de elección. Anfotericina B se mostró igualmente eficaz en un estudio español29, pero su administración es mucho más incómoda. En EE.UU., la anfotericina B liposomal es el único agente aprobado por la Food and Drug Administration (FDA) para el tratamiento de la leishmaniasis visceral30. La respuesta al tratamiento inicial, ya sea con anfotericinas o antimoniales, es favorable en el 60-90% de casos, si bien las recaídas son frecuentes y pueden dar lugar a fracasos terapéuticos por aparición de resistencias. Glucantime se ha mostrado peor tolerado que anfotericina complejo lipídico31. Si se administra glucantime parece importante en pacientes infectados por el VIH utilizar dosis de 20 mg/kg/día durante 4 semanas, ya que los tratamientos de 3 semanas parecen menos efectivos. Las dosis de las diferentes anfotericinas se detallan en la tabla 2.
La eficacia similar y la mejor tolerabilidad de las anfotericinas liposomales frente a los antimoniales hace decantar la balanza hacia aquéllas como primera opción (AII), pero hay que tener en cuenta su elevado coste y que los datos con estos fármacos no son aún muy abundantes.
Las alternativas de tratamiento para pacientes con leishmaniasis visceral que no responden a los de primera elección son la miltefosina (100 mg/día 4 semanas) y la paromomicina (BIII). La miltefosina se ha utilizado en diferentes países con curaciones de hasta el 95% en pacientes sin infección por el VIH, con una eficacia similar al glucantime. En pacientes infectados por el VIH la eficacia es menor, con mayor tasa de fallo terapéutico y de recaídas32 pero con menos efectos secundarios que el glucantime y la anfotericina B. Puede presentar toxicidad gastrointestinal y se desaconseja en embarazadas por el riesgo de teratogenicidad. Paromomicina intramuscular se ha mostrado no inferior a anfotericina B en un estudio aleatorizado realizado en la India en pacientes no infectados por el VIH33. No existe experiencia publicada con este fármaco en pacientes infectados por el VIH.
Otros fármacos ensayados para el tratamiento de la leishmaniasis visceral son el alopurinol (20 mg/m2 en 3 dosis) o los imidazoles, como el ketoconazol (400-600 mg/día) o el itraconazol (400 mg/día) (CIII). La pentamidina i.v. tiene actividad pero se desaconseja por su toxicidad (DII).
Infecciones causadas por hongos (tabla 3)Candida spp.La candidiasis de las mucosas orofaríngea y esofágica ha sido la IO más frecuente en pacientes con infección por el VIH. La candidiasis vulvovaginal resulta un problema a veces importante en algunas pacientes, aunque todavía no se ha llegado a demostrar que exista una asociación inequívoca entre esta enfermedad y la infección por el VIH. La candidiasis esofágica es una infección diagnóstica de sida. Los síntomas son disfagia y odinofagia, pero puede cursar de manera asintomática.
Tratamiento de infecciones fúngicas en pacientes infectados por el virus de la inmunodeficiencia humana
| Enfermedad | Tratamiento | |
| Primera elección | Alternativas | |
| Candidiasis oral | Fluconazol 100 mg/día x 7-14 días | Itraconazol solución oral 100 mg/día x 7-14 díasClotrimazol, pastillas 10 mg 4-5 veces/día x 7-14 díasNistatina, suspensión 5 ml 4 veces/día x 7-14 díasKetoconazol 200 mg/día x 7-14 díasItraconazol cápsulas 100 mg/día x 7-14 días |
| Candidiasis esofágica | Fluconazol 100 mg/día x 10-14 días | Itraconazol solución 200 mg/día x 10-14 díasItraconazol cápsulas 200 mg/día x 14-21 díasKetoconazol 400 mg/día x 14-21 días |
| Candidiasis vulvovaginal | Azoles tópicos (clotrimazol, butoconazol, miconazol, ticonazol, terconazol) durante 3-7 díasNistatina tableta de 100.000 unidades/día durante 14 díasItraconazol oral 200 mg BID durante 1 día o 200 mg QD durante 3 díasFluconazol 150 mg al día en dosis única | |
| Candidiasis refractaria a azoles | Caspofungina 50 mg i.v. QD | Anfotericina B liposomal 3-5 mg/kg/día Anfotericina B desoxicolato 0,5-1 mg/kg/día Posaconazol 400 mg v.o. BID |
| Meningitis criptocóccica | ||
| Terapia de inducción | Anfotericina B desoxicolato 0,7 mg/kg/día ± fluorocitosina 25 mg/kg/6 h x 2 semanasAnfotericina B liposomal 4 mg/kg/día ± fluorocitosina 25 mg/kg/6 h x 2 semanas | Fluconazol 400-800 mg/día + fluorocitosina 25 mg/kg/6 h x 2 semanas |
| Terapia de consolidación | Fluconazol 400 mg/día 8 semanas | Itraconazol 200 mg/12 h 8 semanas |
| Aspergilosis | Voriconazol 6 mg/kg BID v.o./i.v. x 1 día, tras ello 4 mg/kg BID, i.v. o 200 mg BID, v.o. | Anfotericina B desoxicolato 1-1,5 mg/kg/día i.v.Anfotericina B liposomal 5 mg/kg/día i.v.Itraconazol 200 mg i.v. BID x 4 días, tras ello 200 mg i.v. QD o 600 mg/día v.o., tras ello 200 mg v.o. BID (monitorizando concentraciones de itraconazol)Caspofungina 70 mg i.v. 1 día, seguido de 50 mg i.v. QD |
| Micosis endémicas Histoplasmosis | ||
| Enfermedad grave | Fase aguda (3-10 días)Anfotericina B desoxicolato 0,7 mg/kg/día x 2 semanasAnfotericina liposomal 4 mg/kg/día x 2 semanasFase de continuación (12 semanas)Itraconazol 200 mg v.o. BID | Itraconazol 400 mg i.v. QDFluconazol 800 mg v.o. QD |
| Enfermedad menos grave | Itraconazol 200 mg v.o. TID x 3 días y después 200 mg v.o. BID durante 12 semanas | Fluconazol 800 mg v.o. QD (sólo enfermedad leve) |
| Meningitis | Anfotericina B desoxicolato 0,7 mg/kg/día o anfotericina B liposomal 4 mg/kg/día x 12-16 semanas | |
| Coccidioidomicosis | ||
| Infección no meníngea grave (diseminada o pulmonar difusa) | Anfotericina B desoxicolato 0,7 mg/kg/día hasta la mejoría | Anfotericina B + fluconazol |
| Infección no meníngea menos grave | Fluconazol 400-800 mg v.o. QDItraconazol 200 mg v.o. QD | |
| Infección meníngea | Fluconazol 400-800 mg v.o. QD | Anfotericina B intratecal |
| Peniciliosis | Fase aguda (3-10 días)Anfotericina B desoxicolato 0,6 mg/kg/día x 2 semanasFase de continuación (10 semanas)Itraconazol solución 400 mg v.o. BID | |
BID: 2 veces al día; i.v.: intravenoso; QD: una vez al día; TID: tres veces al día; v.o.: vía oral.
El fluconazol es el antifúngico de elección para el tratamiento de la candidiasis mucosa en pacientes infectados por el VIH. Suelen recomendarse de 7 a 14 días de tratamiento para la candidiasis oral y de 14 a 21 días para la esofágica34,35 (AI), aunque en un estudio se comprobó que prolongar el tratamiento de la esofagitis por encima de los 10 días no mejora la respuesta clínica. La mejoría clínica es el criterio que nos indica que el tratamiento antifúngico ha tenido éxito, ya que los cultivos pueden seguir siendo positivos en presencia de mejoría clínica en un 50-80% de los casos.
Los antifúngicos tópicos como la nistatina y el clotrimazol pueden funcionar en las formas leves, pero cuando la candidiasis es extensa, existe afectación esofágica o inmunodepresión avanzada, resultan mucho menos eficaces que los antifúngicos sistémicos36 (tabla 3). El itraconazol en suspensión tiene una eficacia similar a la del fluconazol para el tratamiento de la candidiasis oral o esofágica pero se tolera peor37. El ketoconazol y el itraconazol son menos eficaces que el fluconazol debido a su errática biodisponibilidad pues requieren que el pH estomacal sea suficientemente ácido para absorberse.
Desde el punto de vista clínico, suele considerarse resistente a fluconazol la candidiasis que no responde tras 7 días de tratamiento con 100 mg del antifúngico38. La principal causa de fracaso terapéutico en la candidiasis mucosa asociada al sida es la resistencia a los antifúngicos aunque, en algunas ocasiones, como se mencionó antes, el fracaso puede deberse a una concentración insuficiente del fármaco en el lugar de la infección por absorción insuficiente o por interacción farmacológica. La esofagitis por Candida spp. resistente a fluconazol puede tratarse con caspofungina39, anfotericina B o posaconazol40 (AII). En algunos pacientes con candidiasis oral resistente a fluconazol pueden lograrse mejorías transitorias con dosis más altas de fluconazol, con itraconazol en suspensión o con anfotericina B oral.
Cryptococcus neoformansLa criptococosis es una infección causada por C. neoformans, un hongo levaduriforme encapsulado que penetra en el organismo generalmente por vía respiratoria y que manifiesta una llamativa tendencia a invadir el sistema nervioso central41. La criptococosis ocurre en enfermos con cifras de linfocitos CD4 menores de 100/μl. Se caracteriza clínicamente por fiebre, malestar general y cefalea. En ocasiones pueden verse infiltrados pulmonares y lesiones cutáneas. Es importante señalar que pocos pacientes tienen síndrome meníngeo claro. La presencia de clínica encefalítica -letargia, cambios de conducta, pérdida de memoriasuele deberse a hipertensión intracraneal y resulta un dato de mal pronóstico41. Unos pocos enfermos sufren pérdida de visión por hipertensión intracraneal o por invasión fúngica del nervio óptico42. Al practicar punción lumbar es importante medir la presión de salida del líquido cefalorraquídeo (LCR) por si fuera necesario tomar medidas para reducirla (v. más adelante).
El tratamiento inicial consta de una fase de inducción de 2 semanas con anfotericina B desoxicolato o anfotericina liposomal, seguida de una fase de consolidación de 8 semanas con fluconazol (AI). La adición de fluorocitosina en la fase de inducción puede esterilizar el LCR más rápidamente y se asocia a una menor tasa de recaídas, pero no mejora el pronóstico del episodio agudo. La mortalidad con este tratamiento es inferior al 10%43,44. Las alternativas, con las que existe menos experiencia, son fluconazol en dosis altas (800 mg)45, solo o asociado a fluorocitosina46. Voriconazol y posaconazol son activos in vitro y pueden tener un papel en esta enfermedad, mientras que casponfungina y otras equinocandinas no tienen actividad frente a C. neoformans.
La hipertensión intracraneal puede causar deterioro clínico y es la principal causa de muerte precoz a pesar de una adecuada respuesta al tratamiento antifúngico47. Por dicho motivo, se debe medir siempre la presión de salida del LCR. Si ésta es superior a 25 cm de agua y el paciente tiene cefalea o sintomatología encefalítica o si es mayor de 35 cm, se recomiendan punciones lumbares evacuadoras a diario con extracción de 20 a 30 ml de LCR. Si el paciente no tolera el procedimiento o éste resulta ineficaz, se deber recurrir a la colocación de un drenaje externo o una derivación del LCR43,48 (AII).
Aspergillus spp.La infección avanzada por VIH se asocia a defectos en la función de macrófagos y neutrófilos frente a conidias e hifas de Aspergillus spp.49. En las principales series retrospectivas de aspergilosis e infección por el VIH los principales factores predisponentes fueron neutropenia, linfocitos T CD4+ menores de 50/μl, uso de corticoides y neumonía por P. jiroveci50,51.
El pulmón es la puerta de entrada más frecuente y el órgano diana en esta micosis. La evolución clínica depende en gran medida de la existencia o no de neutropenia. En presencia de este defecto, la evolución es más rápida dado que existe menos impedimento para el desarrollo de hifas, las cuales, por su tendencia a la invasión vascular, producen infartos y diseminación a órganos distantes52. En los pacientes con sida, la aspergilosis puede manifestarse de forma diversa: a) nódulos y/o cavidades -sobre todo en lóbulos superioresque tienen una evolución subaguda o crónica y que pueden dar lugar a hemoptisis; b) infiltrados segmentarios o difusos de evolución aguda (especialmente en pacientes con neutropenia); c) traqueobronquitis con inflamación, ulceración y, en ocasiones, formación de seudomembranas que producen obstrucción al flujo aéreo, y d) aspergiloma por colonización de cavidades tuberculosas o neumatoceles por P. jiroveci50,51. Estos pacientes también pueden sufrir aspergilosis de cualquier órgano en presencia o no de patología pulmonar. Los órganos más frecuentemente afectados son los senos paranasales, el cerebro y el riñón.
El tratamiento de elección de la aspergilosis invasiva en pacientes no infectados por el VIH es voriconazol53,54 (AI). En pacientes con infección por el VIH hay que tener en cuenta las interacciones con ITINN y con IP. También puede tratarse con anfotericina B desoxicolato, anfotericina liposomal itraconazol54,55, y se han publicado datos recientes con posaconazol (tabla 3). La caspofungina está indicada en pacientes con fracaso o intolerancia al tratamiento estándar o para mejorarlo54 (BII). Algunas series de casos muestran que el tratamiento combinado con caspofungina y anfotericina B liposomal o un azol activo frente a Aspergillus spp. podría resultar mejor que el tratamiento con voriconazol como único fármaco54 (CII), aunque se necesitan ensayos clínicos aleatorizados para confirmarlo. Es importante corregir el defecto inmunológico subyacente con TARGA y -en neutropénicoscon factor estimulante de colonias de granulocitos (AII). En la era anterior al TARGA muy pocos pacientes se curaban y la mayoría fallecía en los meses siguientes al diagnóstico.
Micosis endémicasAlgunas micosis resultan frecuentes en pacientes infectados por el VIH que residen o que han viajado a lugares en donde estas micosis son endémicas. En general, estas micosis suelen ocurrir en pacientes con infección por VIH y cifras de linfocitos CD4+ inferiores a 200/μl;, dando lugar a infecciones diseminadas. Desde el punto de vista patogénico, corresponde a infecciones por reactivación de una infección latente o bien por infección de novo. Dos de ellas -histoplasmosis y coccidioidomicosisestán incluidas en la lista de enfermedades definitorias de sida. Las principales zonas endémicas de histoplasmosis se localizan en América del Norte (sobre todo Indiana, Kansas y Tennessee), América Central y América del Sur y también en las islas caribeñas de Cuba y Puerto Rico. En África existe una variante de la enfermedad producida por Histoplasma capsulatum variedad duboisii cuyo curso clínico es más indolente y tiene una mayor tendencia a afectar a la piel y al hueso. La coccidioidomicosis está producida por el Coccidioides immitis que tiene su hábitat en regiones semidesérticas del sudoeste de EE.UU, norte de México y determinadas zonas de América Central y del Sur. La peniciliosis está causada por Penicillium marneffei, hongo con dimorfismo térmico que tiene su hábitat en algunos países del sudeste asiático. También se han descrito casos de blastomicosis y paracoccidioidomicosis complicando la infección por VIH. El tratamiento de estas micosis se refleja en la tabla 356.
Infecciones causadas por virus (tabla 4)Virus del herpes simple (VHS)Las formas clínicas más frecuentes son el herpes genital, generalmente producido por VHS tipo 2, y el orolabial, habitualmente debido al VHS tipo 1. En ambos casos, pero sobre todo en el herpes genital, son frecuentes las recurrencias57. En los pacientes con infección por el VIH, el herpes genital se ha asociado con lesiones más graves y más prolongadas que en la población normal57 y con un aumento del riesgo de adquisición y transmisión sexual del VIH58.
Tratamiento de infecciones oportunistas producidas por virus en pacientes infectados por el virus de la inmunodeficiencia humana
| Tratamiento de elección | Tratamientos alternativos | |
| Infecciones producidas por virus herpes simple | Herpes orolabial o genital no graveAciclovir 400 mg v.o. cada 8 h o aciclovir 200 mg v.o. 5 veces al día o famciclovir 500 mg v.o. cada 12 h o valaciclovir 1 g v.o. cada 12 h; durante 7-10 días | En herpes refractario/VHS resistente a aciclovir, foscarnet 40 mg/kg i.v. cada 8 h o foscarnet 60 mg/kg i.v. cada 12 h o cidofovir 5 mg/kg i.v. semanal o tratamiento tópico con foscarnet al 1%, cidofovir al 3% o trifluridina (fórmulas magistrales) |
| Herpes orolabial o genital graveTratamiento inicial con aciclovir 5 mg/kg i.v. cada 8 h Continuar con aciclovir 400 mg v.o. cada 8 h o famciclovir 500 mg v.o. cada 12 h o valaciclovir 1 g v.o. cada 12 h, hasta que las lesiones hayan curado | ||
| Herpes genital recurrenteTerapia supresora crónica con aciclovir 400-800 mg v.o. cada 8-12 h, o valaciclovir 500-1.000 mg v.o. cada 12-24 h, o famciclovir 250 mg v.o. cada 12 h | ||
| Encefalitis herpéticaAciclovir 10 mg/kg i.v. cada 8 h durante 14-21 días | ||
| Infecciones producidas por virus varicela-zóster | Herpes zóster localizadoFamciclovir 500 mg v.o. cada 8 h, o valaciclovir 1 g v.o. cada 8 h, o aciclovir 800 mg v.o. cada 6 h durante 7-10 días. No se recomienda tratamiento con corticoides | Aciclovir 10 mg/kg i.v. cada 8 h o foscarnet 40 mg/kg i.v. cada 8 h o foscarnet 60 mg/kg i.v. cada 12 h. En herpes zóster refractario/ VVZ resistente a aciclovir, foscarnet 40 mg/kg i.v. cada 8 h o foscarnet 60 mg/kg i.v. cada 12 h |
| VaricelaAciclovir 10 mg/kg i.v. cada 8 h durante 7-10 días (si no existe afectación visceral puede completarse el tratamiento por vía oral con valaciclovir 1 g v.o. cada 8 h, o famciclovir 500 mg v.o. cada 8 h o aciclovir 800 mg v.o. cada 6 h) | ||
| Herpes zóster diseminado o con afectación visceral o necrosis retiniana periféricaAciclovir 10 mg/kg i.v. cada 8 h hasta la resolución de las lesiones cutáneas y viscerales | Foscarnet 40 mg/kg i.v. cada 8 h o 60 mg/kg i.v. cada 12 h | |
| Necrosis retiniana externa rápidamente progresivaAciclovir 10 mg/kg i.v. cada 8 h en combinación con foscarnet 60 mg/kg i.v. cada 8 h | Ganciclovir 5 mg/kg i.v. cada 12 h en combinación con foscarnet 60 mg/kg i.v. cada 8 h | |
| Infecciones producidas por citomegalovirus | Tratamiento de inducciónRetinitis con riesgo de cegueraImplante intraocular de ganciclovir en combinación con valganciclovir 900 mg v.o. cada 24 h, o ganciclovir 5 mg/kg i.v. cada 12 h durante 14-21 días | Foscarnet 60 mg/kg i.v. cada 8 h o 90 mg/kg i.v. cada 12 h durante 14-21 díasCidofovir 5 mg/kg i.v. cada semana durante 2 semanasGanciclovir más foscarnet |
| Retinitis periféricaValganciclovir 900 mg v.o. cada 12 h durante 14-21 días o ganciclovir 5 mg/kg i.v. cada 12 h durante 14-21 días | ||
| Esofagitis o colitisGanciclovir 5 mg/kg i.v. cada 12 h o foscarnet 60 mg/kg cada 8 h o foscarnet 90 mg/kg cada 12 h i.v. durante 3-4 semanas o hasta resolución de los síntomas | Valganciclovir oral si los síntomas no son suficientemente graves como para impedir su absorciónGanciclovir más foscarnet | |
| NeumonitisGanciclovir 5 mg/kg i.v. cada 12 h o foscarnet 60 mg/kg cada 8 h o foscarnet 90 mg/kg cada 12 h i.v. durante 3-4 semanas o hasta resolución de los síntomas | Ganciclovir más foscarnet | |
| Enfermedad neurológicaGanciclovir i.v. en combinación con foscarnet hasta mejoría de los síntomas |
i.v.: intravenoso; VHS: virus herpes simple; v.o.: vía oral; VVZ: virus varicela-zóster.
El tratamiento antivírico con análogos de nucleósidos (aciclovir, valaciclovir y famciclovir) es eficaz, seguro y bien tolerado59,60 y, en el caso del herpes genital, podría reducir el riesgo de transmisión del VIH-161. Las pautas terapéuticas recomendadas se detallan en la tabla 4. En el documento completo disponible en la web de GESIDA se puede consultar una tabla de toxicidades del tratamiento de infecciones víricas.
Herpes orolabial o genitalEl tratamiento antivírico del herpes orolabial o genital disminuye los síntomas locales, acelera la curación de las lesiones, disminuye la excreción de virus, previene la aparición de nuevas lesiones y disminuye el riesgo de progresión o diseminación de las lesiones ya existentes. Las pautas más habituales de tratamiento se basan en aciclovir, famciclovir o valaciclovir v.o. durante 7-10 días59,60 (AII). Famciclovir y valaciclovir tienen una dosificación más cómoda que aciclovir, pero son más caros. En casos graves puede ser preferible emplear aciclovir intravenoso (AIII).
Herpes mucocutáneo recurrenteLas recurrencias son más frecuentes en el herpes genital y se tratan de forma idéntica a los episodios iniciales, aunque a menudo se prolonga el tratamiento hasta 2 semanas (BIII). El tratamiento es más eficaz si se inicia precozmente, en el período prodrómico o en el primer día tras la aparición de las lesiones. En personas con herpes genital recurrente, la terapia supresora prolongada con aciclovir oral, valaciclovir o famciclovir reduce la frecuencia de recurrencias en un 70-80%61–67, por lo que debe ofrecerse a todos los pacientes VIH+ con herpes genital recurrente (AI)68,69.
EncefalitisEl tratamiento de la encefalitis herpética es similar al empleado en los pacientes inmunocompetentes. Se recomienda aciclovir i.v., 10 mg/kg cada 8 h durante 14-21 días (AII). Tiene que iniciarse de forma empírica lo antes posible cuando se sospeche el diagnóstico.
Enfermedad gastrointestinalLa esofagitis y la proctitis herpética responden al aciclovir sistémico. Es habitual iniciar el tratamiento por vía i.v. y continuar v.o. Si los episodios son recurrentes, puede ser necesario un tratamiento supresor.
Infecciones por VHS resistente al aciclovirHa de considerarse la posibilidad de resistencia a los antivíricos cuando las lesiones no mejoran después de 7-10 días de un tratamiento administrado correctamente. Cuando se sospeche resistencia, tiene que tomarse una muestra de la lesión para cultivo y, si se aísla el virus, hay que realizar un estudio de sensibilidad a los antivíricos70. El tratamiento recomendado es foscarnet i.v. (AII)71. Sin embargo, hasta el 60% de los pacientes con aislados resistentes a nucleósidos tratados con foscarnet pueden desarrollar también resistencia a este fármaco72. El cidofovir y la trifluridina también pueden resultar útiles en el tratamiento de cepas resistentes a aciclovir (CIII)73.
Virus de la varicela-zóster (VVZ)La incidencia de infecciones por VVZ es mucho mayor en los pacientes con infección por el VIH que en la población general. Pueden ocurrir con cualquier recuento de linfocitos CD4 y, como en la población general, suelen presentarse en la mayoría de los casos como un herpes zóster. En pacientes con inmunodepresión avanzada, la presentación clínica puede ser diferente y/o el curso clínico alterado. Uno de los síndromes clínicos mejor caracterizados en pacientes con infección por el VIH es la necrosis retiniana.
Herpes zóster localizadoLas pautas más habituales de tratamiento consisten en aciclovir, famciclovir o valaciclovir por vía oral durante 7-10 días (AII)74 (tabla 4). El tratamiento va dirigido a prevenir la diseminación de la infección (sobre todo en pacientes inmunodeprimidos y mayores de 50 años), acortar la duración de los síntomas y reducir el riesgo de neuralgia postherpética. No existen datos del beneficio del uso de corticoides en pacientes con infección por el VIH y, en general, no se recomienda su empleo en estos pacientes (DIII). La mayor eficacia de los fármacos antivíricos se consigue cuando se administran en las primeras 72 h tras la aparición de las lesiones cutáneas. En los enfermos con infección por el VIH pueden continuar apareciendo lesiones durante más de 1 semana y la afectación de la rama oftálmica del trigémino reviste especial gravedad. Por ello, en estos casos está justificado el tratamiento antivírico incluso después de las citadas 72 h (BIII).
Varicela, herpes zóster diseminado o con afectación visceralEn la varicela, en el herpes zóster diseminado o cuando existe afectación visceral es preferible iniciar el tratamiento con aciclovir i.v. (AIII)71. Puede ser razonable continuar con tratamiento por v.o. con aciclovir, valaciclovir o famciclovir, una vez que el paciente ha mejorado. La necrosis retiniana aguda periférica suele responder también al tratamiento con aciclovir i.v. en dosis altas, que puede continuarse con valaciclovir v.o. (BIII)75,76. Puede ser necesario realizar fotocoagulación de la retina con láser para prevenir el desprendimiento. La necrosis retiniana externa rápidamente progresiva puede afectar a ambos ojos y se produce desprendimiento de retina hasta en el 70% de pacientes. En la actualidad, se recomiendan pautas que combinan aciclovir o ganciclovir i.v. con foscarnet (BIII)77. En algunos casos puede considerarse también tratamiento intravítreo78.
Infecciones por VVZ resistente a aciclovirLa resistencia del VVZ a los análogos de nucleósido es excepcional, aunque debe considerarse cuando las lesiones no mejoran después de 10 días de un tratamiento administrado correctamente o adoptan un aspecto verrugoso. Como en el caso del VHS, puede responder a foscarnet i.v. (AII)71.
Citomegalovirus (CMV)La incidencia de enfermedad por CMV en los pacientes infectados por el VIH ha disminuido drásticamente desde la introducción del TARGA79. Los síndromes clínicos más frecuentes son retinitis, colitis, esofagitis, neumonitis y la afectación del SNC (demencia, ventriculoencefalitis o polirradiculoneuritis ascendente).
RetinitisLa retinitis es el proceso más frecuente y su importancia deriva del elevado riesgo de pérdida de visión que supone. Los casos de retinitis con riesgo inminente de ceguera (lesiones cerca del nervio óptico o de la mácula) requieren un tratamiento urgente para intentar preservar la visión. En la era pre-TARGA, la pauta terapéutica más empleada para la retinitis por CMV fue la administración i.v. de ganciclovir80, foscarnet81 o cidofovir82, durante un período de inducción de 2 o 3 semanas. Con estos tratamientos se lograban respuestas iniciales favorables en más del 75% de los pacientes y se continuaba con terapia de mantenimiento con estos mismos fármacos también por vía i.v. o con ganciclovir por vía oral (AI)83.
Las pautas que incluyen implantes intraoculares de ganciclovir reducen sustancialmente la progresión de la retinitis en comparación con el ganciclovir i.v.84,85. Las pautas que combinan implantes intraoculares de ganciclovir con ganciclovir oral ofrecen una protección comparable al ganciclovir intravenoso frente al desarrollo de enfermedad extraocular84. El principal inconveniente del ganciclovir oral es su escasa biodisponibilidad (6-9%), que obliga a administrar dosis muy altas varias veces al día. El desarrollo en los últimos años de valganciclovir, un profármaco del ganciclovir que es rápidamente hidrolizado a ganciclovir, ha facilitado el tratamiento de la enfermedad por CMV. Con una dosis de 900 mg se logran concentraciones plasmáticas similares a las obtenidas con 5 mg/kg de ganciclovir i.v.
Por lo tanto, la combinación del implante intraocular de ganciclovir y valganciclovir oral debería ser considerado el tratamiento de elección, especialmente en pacientes con lesiones en la retina que entrañan un riesgo elevado de pérdida de visión a corto plazo (AI). En casos menos graves o cuando no existen recursos para poder efectuar el implante, se recomienda la administración de un ciclo de inducción con ganciclovir i.v. seguido de tratamiento de mantenimiento con valganciclovir oral (AII). Valganciclovir puede ser una opción aceptable como tratamiento de inducción en pacientes con retinitis periférica86 (AII). Foscarnet y cidofovir son fármacos de segunda elección en pacientes que no responden o presentan acontecimientos adversos con ganciclovir o valganciclovir (AI). Otras opciones consisten en la combinación de ganciclovir y foscarnet o las inyecciones intravítreas de fomivirsen.
Enfermedad extraocularLa experiencia en estos casos es más limitada que en la retinitis. Las recomendaciones se basan en general en estudios no controlados realizados en la era pre-TARGA en los que se utilizaron pautas con ganciclovir o foscarnet por vía i.v. (BII). En casos de encefalitis se recomienda tratamiento combinado de ganciclovir con foscarnet (BIII). El papel del tratamiento de mantenimiento en pacientes con CMV extraocular no está bien establecido.
Infecciones por citomegalovirus resistente a ganciclovirLas tasas de resistencia a ganciclovir han disminuido sustancialmente en los últimos años87. Estos casos pueden responder a foscarnet o cidofovir (BII)88.
Leucoencefalopatía multifocal progresiva (LMP)En la actualidad no existe ningún tratamiento eficaz. A pesar de datos iniciales sugiriendo un papel de cidofovir, su eficacia no fue confirmada en un ensayo clínico controlado (DI)89. El tratamiento con inhibidores de los receptores de serotonina (la entrada del virus en los oligodendrocitos) como mirtazapina o ciproheptadina es limitado y no ha demostrado eficacia.
Con la introducción del TARGA en 1996 se ha producido una disminución importante en la incidencia de LMP y, en general, se ha observado un efecto beneficioso de la terapia antirretroviral en la historia natural de la enfermedad, rápidamente progresiva y fatal en la era pre-TARGA. Se ha descrito un aumento significativo de la supervivencia, con mejoría del déficit neurológico y de las anomalías detectadas en los estudios de neuroimagen y aclaramiento del virus JC del LCR90–92bis. Sin embargo, algunos pacientes no mejoran con el TARGA y en otros puede producirse un empeoramiento de la LMP atribuido a reconstitución inmunológica93. No existe ningún tratamiento que haya demostrado ser eficaz en esta situación. En algunos de estos casos se ha descrito mejoría de los síntomas y de las lesiones observadas en las técnicas de imagen con un tratamiento adyuvante con esteroides, en ocasiones asociado a interrupción temporal del TARGA94.
Infecciones causadas por micobacterias (tablas 5 y 6)Mycobacterium tuberculosisLa tuberculosis y la infección por VIH son dos de las principales causas de mortalidad en los países en desarrollo. Actúan de una forma peligrosamente sinérgica desde la patogenia a la presentación clínica, el tratamiento y la prevención, con graves consecuencias clínicas, sociales y económicas95.
Tratamiento de la tuberculosis en pacientes infectados por el virus de la inmunodeficiencia humana
| Fases del tratamiento | Fármacosa | Dosis de pauta diaria | Dosis de pauta intermitenteb | Comentarios |
| Fase inicial (2 meses) | Isoniacida (H) +Rifampicina (R)c +Pirazinamida (Z) ±Etambutol (E)d | 5 mg/kg (máx. 300 mg)10 mg/kg (máx. 600 mg)25 mg/kg (máx. 2 g)25 mg/kg | Tres veces por semana: 10 mg/kg (máx. 900 mg)Tres veces por semana, 10 mg/kg (máx. 600 mg)Tres veces por semana, 35 mg/kg (máx. 3 g)Tres veces por semana, 30 mg/kg | Además de la contraindicación del tratamiento intermitente en pacientes con < 100 CD4/μl, los datos disponibles de eficacia con regímenes intermitentes son más escasos que en pacientes no infectados por el VIH, por lo que es preferible la administración diaria también en pacientes con > 100 CD4. En cualquier caso, si se utilizara, debiera ser directamente observada |
| Fase de continuación: 7 mesese | Isoniazida + | 5 mg/kg (máx. 300 mg) | Si es tres veces por semana, como lo señalado anteriormenteSi es dos veces por semana, 15 mg/kg (máx. 900 mg) | |
| Rifampicina | 10 mg/kg (máx. 600 mg) | Misma dosis que la indicada en fase inicial, tanto si es dos como tres veces por semana |
TAR: tratamiento antirretroviral; VIH: virus de la inmunodeficiencia humana.
Son recomendables pautas fijas: para cuando se use la combinación I + R + Z, las posibilidades son: Rifater® (por comprimido, H: 50 mg; R: 120 mg; Z: 300 mg) o Rimcure® (por comprimido, H: 75 mg; R: 150 mg; Z: 400 mg). Además, debe ir suplementado por una dosis de vitamina B6 de 25-50 mg, que puede administrarse como dosis semanal única de 300 mg
El tratamiento intermitente está contraindicado en pacientes con < 100 CD4 por menor eficacia. La experiencia con pautas intermitentes es también menor en pacientes con infección por VIH, por lo que se recomienda, incluso para pacientes con > 100 CD4 terapia diaria, si es posible.
Si por interacciones no es posible utilizar rifampicina, ésta puede ser sustituida por rifabutina en las dosis indicadas en la tabla de interacciones. Sin embargo, dado que los niveles adecuados de rifabutina son absolutamente dependientes de la toma adecuada del TAR, el tratamiento debería ser supervisado.
En pacientes procedentes de zonas con resistencia a H > 4% (como ocurre en la mayoría de pacientes inmigrantes de nuestro país) el tratamiento deberá constar de 4 fármacos (H + R + Z + E) hasta conocer el antibiograma. La presentación comercial adecuada es Rimstar® (por comprimido: H: 75 mg; R: 150 mg; Z: 400 mg; E: 275 mg).
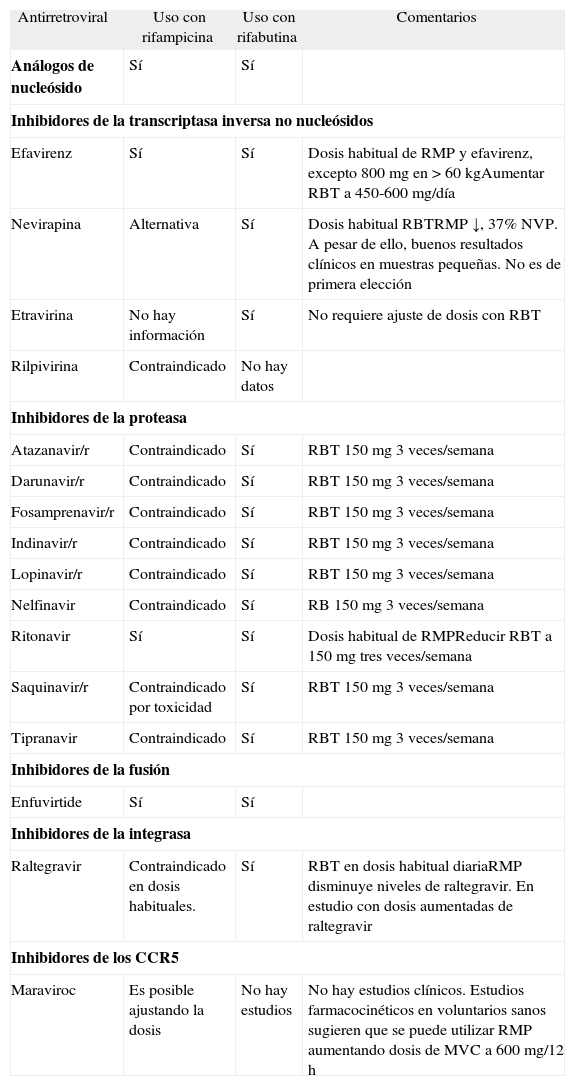
Interacciones entre rifamicinas y fármacos antirretrovirales
| Antirretroviral | Uso con rifampicina | Uso con rifabutina | Comentarios |
| Análogos de nucleósido | Sí | Sí | |
| Inhibidores de la transcriptasa inversa no nucleósidos | |||
| Efavirenz | Sí | Sí | Dosis habitual de RMP y efavirenz, excepto 800 mg en > 60 kgAumentar RBT a 450-600 mg/día |
| Nevirapina | Alternativa | Sí | Dosis habitual RBTRMP ↓, 37% NVP. A pesar de ello, buenos resultados clínicos en muestras pequeñas. No es de primera elección |
| Etravirina | No hay información | Sí | No requiere ajuste de dosis con RBT |
| Rilpivirina | Contraindicado | No hay datos | |
| Inhibidores de la proteasa | |||
| Atazanavir/r | Contraindicado | Sí | RBT 150 mg 3 veces/semana |
| Darunavir/r | Contraindicado | Sí | RBT 150 mg 3 veces/semana |
| Fosamprenavir/r | Contraindicado | Sí | RBT 150 mg 3 veces/semana |
| Indinavir/r | Contraindicado | Sí | RBT 150 mg 3 veces/semana |
| Lopinavir/r | Contraindicado | Sí | RBT 150 mg 3 veces/semana |
| Nelfinavir | Contraindicado | Sí | RB 150 mg 3 veces/semana |
| Ritonavir | Sí | Sí | Dosis habitual de RMPReducir RBT a 150 mg tres veces/semana |
| Saquinavir/r | Contraindicado por toxicidad | Sí | RBT 150 mg 3 veces/semana |
| Tipranavir | Contraindicado | Sí | RBT 150 mg 3 veces/semana |
| Inhibidores de la fusión | |||
| Enfuvirtide | Sí | Sí | |
| Inhibidores de la integrasa | |||
| Raltegravir | Contraindicado en dosis habituales. | Sí | RBT en dosis habitual diariaRMP disminuye niveles de raltegravir. En estudio con dosis aumentadas de raltegravir |
| Inhibidores de los CCR5 | |||
| Maraviroc | Es posible ajustando la dosis | No hay estudios | No hay estudios clínicos. Estudios farmacocinéticos en voluntarios sanos sugieren que se puede utilizar RMP aumentando dosis de MVC a 600 mg/12 h |
IP: inhibidores de la proteasa; MVC: maraviroc; NVP: nevirapina; RBT: rifabutina; RMP: rifampicina.
Las bases del tratamiento de la tuberculosis en pacientes coinfectados son, en esencia, similares a las de la población general utilizándose las mismas combinaciones de fármacos con el propósito de erradicar las diferentes poblaciones bacilares y evitar la aparición de resistencias secundarias96. Es importante recalcar la importancia del adecuado cumplimiento del tratamiento y de ofertar tratamiento supervisado a todos aquellos grupos de pacientes con predictores, a priori, de mal cumplimiento (usuarios de drogas por vía parenteral [UDVP] activos, indigentes, presos, antecedentes de abandonos previos o de pérdidas de seguimiento previas en consultas externas, entre otros)97.
Número de fármacosAl igual que en pacientes no coinfectados, la decisión de iniciar el tratamiento con 3 (rifampicina más isoniazida más pirazinamida) o 4 (añadiendo etambutol) fármacos se basa en las tasas de resistencia primaria a la isoniacida. Así, si ésta es superior al 4% o desconocida (raro en nuestro país, pero frecuente en varios países en desarrollo que son origen de uno de cada cuatro nuevos pacientes infectados por el VIH), debe añadirse un cuarto fármaco (etambutol o estreptomicina) hasta conocer el antibiograma (AI).
Duración del tratamientoLos ensayos clásicos demostraron que 6 meses de duración eran el estándar de tratamiento, siempre que el mismo incluyera rifampicina, e isoniazida durante los 6 meses, complementado con pirazinamida los primeros 2 meses. Incluso en pacientes no inmunodeprimidos si, por la razón que sea, no se puede utilizar alguno de estos fármacos básicos y es necesario sustituir alguno de ellos por otro de primera o segunda línea, es imprescindible prolongar el tratamiento para disminuir el riesgo de recurrencia96. En pacientes infectados por el VIH diversos estudios han descrito un mayor riesgo de recurrencias de tuberculosis que en pacientes no infectados98.
La gran limitación de estos estudios es que muy pocos pacientes han recibido TARGA, por lo que la aplicabilidad de los mismos a nuestra práctica clínica es discutible. En cualquier caso, y mientras no dispongamos de datos con TARGA, teniendo en cuenta también la trascendencia de la tuberculosis como problema de salud pública, parece prudente plantear que, como norma general, el tratamiento debe durar 9 meses (BII). En aquellos pacientes que tienen una aceptable situación inmunitaria (más de 200 CD4/μl), buena respuesta clínica y microbiológica al tratamiento de la tuberculosis y buena recuperación inmune con TARGA, podría acortarse el tratamiento a 6 meses (BIII). En aquellos pacientes con tuberculosis pulmonar es importante disponer de controles microbiológicos mensuales hasta la negativización de los cultivos. En pacientes infectados por el VIH gravemente inmunodeprimidos (CD4 < 100/μl) no es aconsejable el tratamiento intermitente. En caso de no poder administrar isoniazida o rifampicina, la duración es incierta, pero probablemente se deba continuar 12-18 meses (BIII)99. Es fundamental disponer, siempre que sea posible, de controles microbiológicos periódicos durante el tratamiento: la presencia de un cultivo positivo al cuarto mes de tratamiento implica un fracaso del mismo y un tratamiento específico del caso.
Interacciones, momento de inicio de TARGA y fármacos elegiblesLas guías actuales de TARGA recomiendan iniciar el tratamiento con dos análogos de nucleósidos/nucleótidos) y, como tercer fármaco, un ITINN o un IP potenciado con ritonavir (IP/r)100. El problema estriba en que las rifamicinas (rifampicina > rifabutina > rifapentina) son inductores potentes de la familia enzimática del citocromo CYP3A, incluyendo CYP3A4 (la rifabutina es además un sustrato). Dado que los ITINN y los IP se metabolizan en este sistema enzimático, las interacciones se convierten en un problema relevante. La rifabutina constituye una alternativa, aunque precisa ajuste de dosis.
Debido a esta interacción, los IP/r no se pueden utilizar con rifampicina, ya que sus niveles son infraterapéuticos. Aunque inicialmente se pensó que saquinavir/r constituía una excepción a esta regla, la alta incidencia de hepatotoxicidad con esta combinación contraindica su utilización (BII)101.
Las opciones de TARGA en pacientes coinfectados son dos: a) TARGA basado en un ITINN (el más estudiado es efavirenz), en que el único ajuste necesario sería aumentar la dosis de EFV a 800 mg/día para aquellos pacientes de más de 60 kg102 (algunos autores prefieren ajustar la dosis de efavirenz según los niveles plasmáticos), o b) utilizar rifabutina en lugar de rifampicina, para poder asociar IP/r. El uso de rifabutina presenta varios problemas: a) requiere ajuste de dosis del fármaco, y la dosis de rifabutina es de 150 mg 3 días por semana con la mayoría de IP/r (v. tabla 5); b) en algunos IP hay que aumentar la dosis o están contraindicados (LPV/r); c) incluso en los IP que se pueden utilizar, sus niveles son muy "sensibles" a si el paciente no toma rifabutina, por lo que se requiere tratamiento supervisado, y d) como ya se ha comentado, en pacientes con CD4 < 100/μ1, se ha descrito desarrollo de resistencias en pacientes tratados con rifamicinas en pautas intermitentes. Por todo ello, es preferible mantener la pauta estándar de la tuberculosis y basar el TARGA en INNTI (BII). Si por la razón que sea (resistencias, toxicidad, etc.) no se pueden utilizar ITINN, es importante conocer que no hay interacciones relevantes entre rifampicina y análogos de nucleósido, o enfuvirtida, por lo que se puede intentar construir, en caso de necesidad, un régimen alternativo de TARGA. La información disponible respecto a las interacciones entre rifampicina y nuevas familias de fármacos (inhibidores de CCR5 e inhibidores de integrasa) se puede consultar en la tabla 6. En casos de tuberculosis multirresistente en que sea preciso utilizar otros fármacos de primera o segunda línea, pueden utilizarse tanto IP/r como ITINN, dado que no se han descrito interacciones relevantes, ni con fármacos antituberculosos de segunda línea. Es importante recordar también la interacción entre rifampicina y metadona que suele obligar a aumentar la dosis de metadona en estos pacientes.
Otro problema importante es definir el momento idóneo del TARGA. Está claro que, tras el diagnóstico de tuberculosis, la prioridad es el tratamiento de la propia tuberculosis. El tratamiento concomitante de la infección por VIH implica, por un lado, un aumento del riesgo de toxicidad con la dificultad añadida de identificar el fármaco causal y, en segundo lugar, un riesgo de síndrome de reconstitución inmune (v. más adelante) en pacientes gravemente inmunodeprimidos103. Por otro lado, está demostrado que un inicio tardío en pacientes inmunodeprimidos se asocia a una mayor morbilidad y mortalidad en los meses siguientes104. Una aproximación práctica podría ser esperar 2 semanas tras el inicio del tratamiento de la tuberculosis antes de introducir los antirretrovirales en pacientes con linfocitos CD4+ por debajo de 100/μl. Para pacientes en situación inmunológica menos comprometida (CD4+ entre 100 y 200 CD4/μl) probablemente se puede esperar a la fase de mantenimiento (aunque introduciendo desde el principio la profilaxis primaria de otras infecciones oportunistas), antes de iniciar TARGA. Con linfocitos CD4+ por encima de 200/μl, probablemente se puede iniciar el tratamiento durante la fase de mantenimiento, y se puede esperar a acabar el tratamiento de la tuberculosis antes de iniciar el TARGA en pacientes con CD4+ superiores a 350/μl (BIII).
La toxicidad causada por los antituberculosos es también más frecuente en pacientes infectados por el VIH, aunque el tratamiento de la misma no se diferencia de la de los pacientes no coinfectados98,105.
Por último, se han descrito recientemente casos de tuberculosis multirresistente. La tuberculosis con resistencia extensa (XRD-TB) se define como aquella tuberculosis que, además de ser resistente a isoniazida y rifampicina, lo es también al menos tres de las seis principales familias de fármacos de segunda línea (aminoglucósidos, polipéptidos, fluorquinolonas, tioamidas, cicloserina y ácido paraaminosalicílico)106. Se trata de un escenario extremadamente preocupante por el riesgo de extensión y transmisión de cepas con muy difícil tratamiento (si lo hay106).
Mycobacterium avium complex (MAC)La enfermedad diseminada por MAC aparece en fases muy avanzadas de la infección por el VIH, concentrándose de forma casi exclusiva en el grupo de pacientes con recuentos de linfocitos CD4+ menores a 50/μl. Esta enfermedad no ha tenido en España la misma relevancia que en otros países desarrollados.
Al igual que sucede con la tuberculosis, la enfermedad diseminada por MAC ha de tratarse con combinación de fármacos, pues la monoterapia induce en pocas semanas la aparición de resistencias. Estas micobacterias presentan, además, resistencia intrínseca a varios antituberculosos habituales como son isoniazida, pirazinamida y, frecuentemente, estreptomicina.
La pauta más eficaz y que se asocia a menor incidencia de resistencias a macrólidos es la asociación de claritromicina más etambutol más rifabutina107, aunque presenta la limitación de la interacción con fármacos antirretrovirales. En algunos casos, una alternativa puede ser claritromicina y etambutol. Con azitromicina hay menos experiencia, pero puede reemplazar a claritromicina si se debe utilizar efavirenz.
Infecciones causadas por bacterias (tabla 7)Los pacientes infectados por el VIH tienen una mayor incidencia de infecciones bacterianas no sólo por la inmunodepresión celular, sino también por alteraciones de la inmunidad humoral y otros factores predisponentes. Estas infecciones, producidas casi siempre por bacterias habituales, pueden tener presentaciones atípicas, a menudo cursan con bacteriemia y tienen alta tasa de recidiva, especialmente en pacientes con CD4 más bajos. A continuación, se comentará el tratamiento de las infecciones bacterianas más frecuentes.
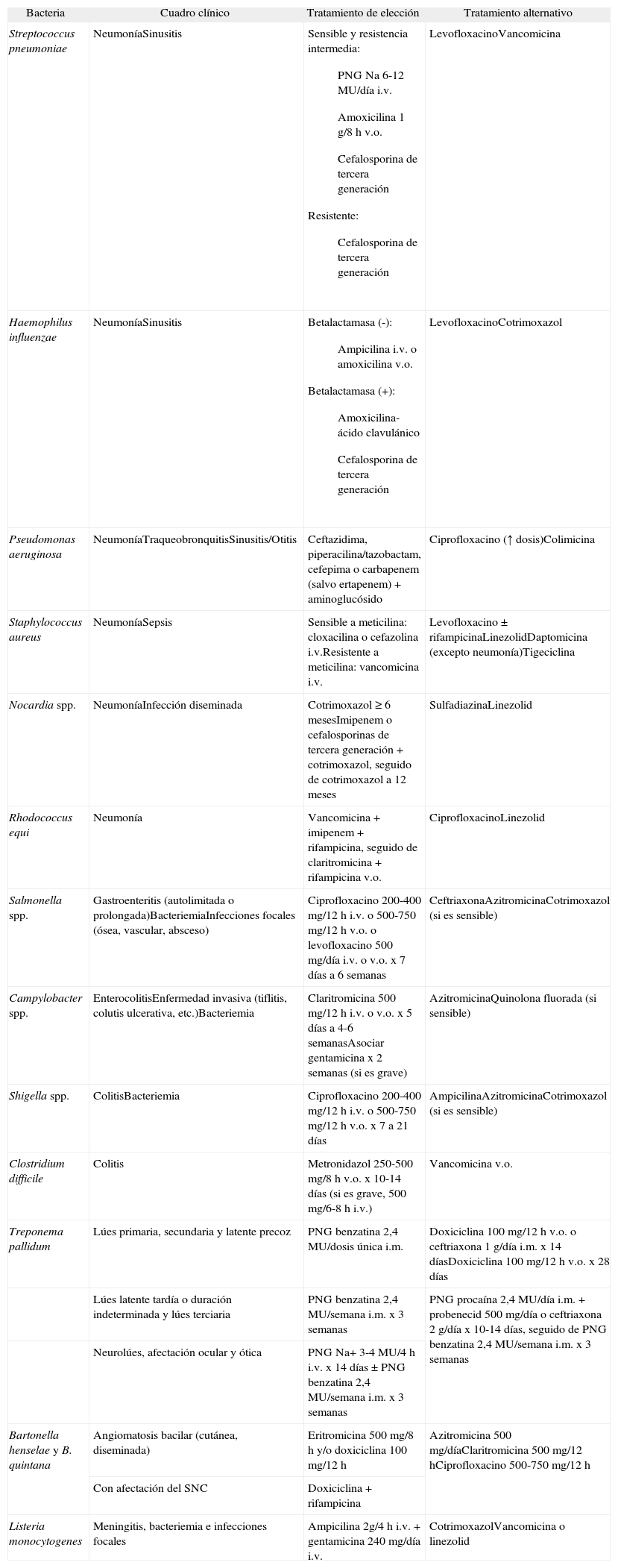
Tratamiento de las infecciones bacterianas en pacientes infectados por el virus de la inmunodeficiencia humana
| Bacteria | Cuadro clínico | Tratamiento de elección | Tratamiento alternativo |
| Streptococcus pneumoniae | NeumoníaSinusitis | Sensible y resistencia intermedia:
| LevofloxacinoVancomicina |
| Haemophilus influenzae | NeumoníaSinusitis | Betalactamasa (-):
| LevofloxacinoCotrimoxazol |
| Pseudomonas aeruginosa | NeumoníaTraqueobronquitisSinusitis/Otitis | Ceftazidima, piperacilina/tazobactam, cefepima o carbapenem (salvo ertapenem) + aminoglucósido | Ciprofloxacino (↑ dosis)Colimicina |
| Staphylococcus aureus | NeumoníaSepsis | Sensible a meticilina: cloxacilina o cefazolina i.v.Resistente a meticilina: vancomicina i.v. | Levofloxacino ± rifampicinaLinezolidDaptomicina (excepto neumonía)Tigeciclina |
| Nocardia spp. | NeumoníaInfección diseminada | Cotrimoxazol ≥ 6 mesesImipenem o cefalosporinas de tercera generación + cotrimoxazol, seguido de cotrimoxazol a 12 meses | SulfadiazinaLinezolid |
| Rhodococcus equi | Neumonía | Vancomicina + imipenem + rifampicina, seguido de claritromicina + rifampicina v.o. | CiprofloxacinoLinezolid |
| Salmonella spp. | Gastroenteritis (autolimitada o prolongada)BacteriemiaInfecciones focales (ósea, vascular, absceso) | Ciprofloxacino 200-400 mg/12 h i.v. o 500-750 mg/12 h v.o. o levofloxacino 500 mg/día i.v. o v.o. x 7 días a 6 semanas | CeftriaxonaAzitromicinaCotrimoxazol (si es sensible) |
| Campylobacter spp. | EnterocolitisEnfermedad invasiva (tiflitis, colutis ulcerativa, etc.)Bacteriemia | Claritromicina 500 mg/12 h i.v. o v.o. x 5 días a 4-6 semanasAsociar gentamicina x 2 semanas (si es grave) | AzitromicinaQuinolona fluorada (si sensible) |
| Shigella spp. | ColitisBacteriemia | Ciprofloxacino 200-400 mg/12 h i.v. o 500-750 mg/12 h v.o. x 7 a 21 días | AmpicilinaAzitromicinaCotrimoxazol (si es sensible) |
| Clostridium difficile | Colitis | Metronidazol 250-500 mg/8 h v.o. x 10-14 días (si es grave, 500 mg/6-8 h i.v.) | Vancomicina v.o. |
| Treponema pallidum | Lúes primaria, secundaria y latente precoz | PNG benzatina 2,4 MU/dosis única i.m. | Doxiciclina 100 mg/12 h v.o. o ceftriaxona 1 g/día i.m. x 14 díasDoxiciclina 100 mg/12 h v.o. x 28 días |
| Lúes latente tardía o duración indeterminada y lúes terciaria | PNG benzatina 2,4 MU/semana i.m. x 3 semanas | PNG procaína 2,4 MU/día i.m. + probenecid 500 mg/día o ceftriaxona 2 g/día x 10-14 días, seguido de PNG benzatina 2,4 MU/semana i.m. x 3 semanas | |
| Neurolúes, afectación ocular y ótica | PNG Na+ 3-4 MU/4 h i.v. x 14 días ± PNG benzatina 2,4 MU/semana i.m. x 3 semanas | ||
| Bartonella henselae y B. quintana | Angiomatosis bacilar (cutánea, diseminada) | Eritromicina 500 mg/8 h y/o doxiciclina 100 mg/12 h | Azitromicina 500 mg/díaClaritromicina 500 mg/12 hCiprofloxacino 500-750 mg/12 h |
| Con afectación del SNC | Doxiciclina + rifampicina | ||
| Listeria monocytogenes | Meningitis, bacteriemia e infecciones focales | Ampicilina 2g/4 h i.v. + gentamicina 240 mg/día i.v. | CotrimoxazolVancomicina o linezolid |
i.m.: intramuscular; i.v.: intravenoso; MU: millones de unidades; PNG: penicilina G; SNC: sistema nervioso central; VIH: virus de la inmunodeficiencia humana; v.o.: vía oral.
La neumonía bacteriana es una de las principales causas de morbilidad y una de las principales causas de ingreso hospitalario en los pacientes con infección por el VIH108. Los principales agentes etiológicos son Streptococcus pneumoniae109–111 y, en menor medida, Haemophilus influenzae112. Staphylococcus aureus, Pseudomonas aeruginosa y otros bacilos gramnegativos son más frecuentes en pacientes con CD4+ inferiores a 100/μl, con patología pulmonar de base, ingresos previos con tratamiento antibiótico, drogadictos y adquisición nosocomial113. Mycoplasma pneumoniae, Chlamydia psitacci, Coxiella burnetti y Legionella pneumophila son poco frecuentes, aunque han de considerarse en función de datos epidemiológicos y clínico-radiológicos.
El tratamiento antimicrobiano empírico de la neumonía bacteriana en el paciente infectado por el VIH tendría que cubrir a los patógenos más frecuentes y no difiere del recomendado en las guías terapéuticas del paciente no infectado por el VIH114,115. El tratamiento antimicrobiano de las infecciones bacterianas del tracto respiratorio en pacientes infectados por el VIH incluye una cefalosporina de tercera generación sola o asociada a levofloxacino o claritromicina, en función de la gravedad del paciente (AIII), en las dosis habituales usadas en otros pacientes. En pacientes con factores de riesgo de infección por P. aeruginosa se ha de utilizar cefepima o imipenem.
Neumonía por otras bacteriasLa infección pulmonar por Nocardia spp. y Rhodococcus equi son propias de pacientes con inmunodepresión celular, por lo que pueden afectar a pacientes con infección evolucionada por el VIH. No se ha establecido todavía cuál es el mejor régimen terapéutico ni la duración adecuada de la infección por Nocardia. El tratamiento preferido sigue siendo cotrimoxazol, asociando imipenem o ceftriaxona si existe enfermedad diseminada, en función de un estudio que demostró sinergia en modelos experimentales (BIII). Se recomienda un mínimo de 6 meses de tratamiento y hasta 12 meses si existe afectación del SNC116.
R. equi es un patógeno descrito originalmente en animales, que en pacientes inmunodeprimidos, en especial los infectados por el VIH, produce neumonías de evolución subaguda, con tendencia a la cavitación, bacteriemia (70-80%) y diseminación extrapulmonar117. No hay ningún tratamiento de elección bien establecido. Se recomienda la combinación de 2 o 3 antibióticos bactericidas (vancomicina, imipenem o rifampicina) como tratamiento inicial (4-6 semanas), preferentemente por vía parenteral, y continuar con dos antibióticos por vía oral con actividad intracelular (eritromicina o claritromicina más rifampicina) por un tiempo prolongado (igual o superior a 6 meses) para evitar las recidivas (BIII)118.
Infecciones intestinales bacterianasLas bacterias que con más frecuencia producen diarrea en pacientes con infección por el VIH en los países desarrollados son especies no tíficas de Salmonella, Campylobacter jejuni y Shigella spp.119,120. Cada vez es más frecuente la diarrea producida por toxina de Clostridium difficile. Los principales cuadros clínicos son gastroenteritis aguda autolimitada, diarrea prolongada con o sin enfermedad invasiva (tiflitis, ulceraciones intestinales, adenitis mesentérica), bacteriemia con o sin síntomas intestinales y/o enfermedad extraintestinal121. El tratamiento de elección de la salmonelosis es una quinolona fluorada (AIII)121, preferiblemente ciprofloxacino (AIII), durante un tiempo variable según el tipo de afectación. A diferencia de los cuadros autolimitados del inmunocompetente sano, en el paciente con infección por el VIH ha de tratarse siempre, debido al riesgo de bacteriemia, sobre todo si los CD4+ están por debajo de 200/μl (BIII). La alternativa es una cefalosporina de tercera generación o cotrimoxazol si la cepa es sensible (BIII). La duración del tratamiento es de 5-7 días en cuadros ligeros y de hasta 6 semanas o más en cuadros graves o con frecuentes recidivas (BIII). El tratamiento de elección en la infección por Campylobacter es un macrólido, ya que la resistencia a las quinolonas es cada vez más frecuente (BIII)122. En bacteriemia o enfermedad invasiva se puede asociar gentamicina (CIII). El tratamiento de elección de la shigelosis es una quinolona fluorada (AIII) durante 5-7 días y las alternativas ampicilina (si la cepa causal es sensible), azitromicina o cotrimoxazol (aunque la resistencia es cada vez mayor) (BIII)123,124. En el caso de bacteriemia es recomendable prolongar el tratamiento 2 semanas (AIII). El tratamiento de elección de la colitis por C. difficile es metronidazol y la alternativa, vancomicina v.o. (BIII)125.
Infecciones sistémicas bacterianasSífilisLa coexistencia de lúes e infección por el VIH es relativamente frecuente; se puede observar hasta en el 7% de pacientes126. Las formas de presentación clínica son similares a las de la población general, aunque en pacientes infectados por el VIH se han descrito formas atípicas, mayor incidencia de fracasos terapéuticos con pautas estándar y cuadros de neurosífilis más precoces127.
La penicilina G sigue siendo el tratamiento de elección (AII) para todos los estadios clínicos de lúes128. En caso de alergia, sería recomendable intentar una desensibilización, aunque los regímenes con doxiciclina son una alternativa útil (BIII). Algunos datos de la literatura médica apoyan el uso de ceftriaxona, pero hay que tener en cuenta la posibilidad de la reacción alérgica cruzada con penicilina (BIII).
Los pacientes con sífilis primaria, secundaria o latente precoz (menos de 1 año) e infección por el VIH tendrían que recibir una dosis de penicilina G benzatina (2,4 MU) por vía i.m. (AII)128–130. Las alternativas doxiciclina, ceftriaxona o azitromicina no han sido suficientemente evaluadas en estos pacientes como para considerarlas tratamientos de primera línea (BIII). No se recomienda la asociación amoxicilina/probenecida (DII)131. Algunos autores opinan que una única dosis de 2,4 MU de penicilina G benzatina o incluso una segunda o tercera dosis semanal pueden ser insuficientes para curar la afectación precoz del SNC o prevenir las recidivas en estos pacientes, y que sería mejor utilizar penicilina procaína 1,2 MU/día i.m. durante 10-14 días (CIII)128.
Los pacientes con sífilis latente tardía (más de 1 año) o de duración desconocida y con sífilis terciaria tendrían que ser tratados con penicilina G benzatina 3 dosis (AIII) y si son alérgicos con doxiciclina (BIII), una vez descartada la afectación del SNC mediante una punción lumbar (AIII).
Los pacientes con neurolúes, afectación ocular u ótica han de ser tratados con penicilina G sódica seguida o no de penicilina G benzatina (AII). El tratamiento alternativo sería penicilina G procaína i.m. más probenecida seguida de penicilina benzatina (CIII). Otra opción sería ceftriaxona, cada vez más utilizada por permitir el tratamiento sin ingreso hospitalario (CIII).
Bartonelosis (angiomatosis bacilar)Es una zoonosis cuyo reservorio principal es el gato doméstico. Bartonella henselae y B. quintana pueden producir varios síndromes clínicos en pacientes con infección por el VIH, especialmente con cifras de linfocitos CD4+ inferiores a 50/μl132, que incluyen angiomatosis bacilar cutánea, angiomatosis bacilar diseminada (peliosis hepática y/o esplénica, ósea, pulmonar o del SNC) o bacteriemia crónica.
La recomendación actual de tratamiento es eritromicina y/o doxiciclina como primera elección (AII). Azitromicina o claritromicina podrían sustituir a la eritromicina como tratamiento alternativo (BII) con una menor eficacia, mientras que ciprofloxacino sería un tratamiento de segunda línea (CIII). El tratamiento ha de prolongarse 3 o más meses para evitar las recidivas (AII).
ListeriosisLa listeriosis es de 100 a 1.000 veces más frecuente en pacientes con sida que en la población general, aunque su incidencia en la mayoría de las series es inferior al 0,1%. Suele producir meningitis, meningoencefalitis, abscesos cerebrales y bacteriemias, en especial en pacientes con linfocitos CD4+ inferiores a 100/μl133. El tratamiento es similar al de otros pacientes inmunodeprimidos. Ampicilina más gentamicina es la pauta más utilizada y ha demostrado sinergia in vitro (BII). Cotrimoxazol es una buena alternativa para pacientes alérgicos a penicilina y penetra muy bien en el SNC (BIII). La asociación de ampicilina y cotrimoxazol tendría una tasa más baja de fracasos y secuelas neurológicas que la pauta clásica (BIII)134. La duración del tratamiento no está bien establecida y se ha sugerido alargar el tratamiento según el cuadro clínico (bacteriemia 2 semanas, meningitis 3 o más semanas, absceso cerebral y rombencefalitis 6 semanas) (CIII).
Parasitosis importadas (tabla 8)El aumento de la inmigración y de los viajes a países tropicales ocasiona un incremento de la detección de enfermedades importadas en nuestro país.
Tratamiento de las principales infecciones parasitarias importadas
| Microorganismo/localización | Tratamiento de elección | Tratamiento alternativo |
| Entamoeba histolytica | ||
| Portador asintomáticoEnfermedad intestinal leve a moderadaEnfermedad intestinal grave o extraintestinal | Paramomicina v.o. 500 mg/8 h x 5-10 díasMetronidazol v.o. 500-750 mg/8 h x 7-10 díasTinidazol v.o. 2 g/día x 3 díasMetronidazol (v.o. o i.v.) 750 mg/8 h x 7-10 díasTinidazol v.o. 2 g/día x 5 días | Furoato de diloxanida 500 mg/8 h, 10 díasIodoquinol 650 mg/8 h, 20 díasDihidroemetina i.m. 1-1,5 mg/kg peso/día hasta un máximo de 5 días (administrado como coadyuvante en combinación con metronidazol) |
| Malaria no complicadaa | ||
| P. falciparum sensible a cloroquina, P. vivax, P. ovale y P. malariae | Cloroquina v.o. 25 mg/kg de base, dosis total, dividido en una dosis diaria (10-10-5 mg/kg) durante 3 días, o administrado a las 0, 6, 24 y 48 h (10-5-5-5 mg/kg)En los casos de malaria por P. vivax y P. ovale, añadir además tratamiento erradicador con primaquina v.o. 30 mg/kg de base al día durante 14 díasb | Hidroxicloroquina v.o. 620 mg de base seguida de 310 mg de base a las 6, 24 y 48 h |
| P. vivax resistente a cloroquina | Quinina (base)c v.o. 25 mg/kg/día en 3 dosis, de 3 a 7 días + Doxiciclina v.o. 100 mg/BID, 7 días o Tetraciclina v.o. 250 mg/QID, 7 días o Clindamicina v.o. 20 mg/kg/día dividido BID o QID (7 días)Mefloquina v.o. 25 mg/kg de base, administrada en 2 dosis de 15-10 mg/kg separadas por 6-24 h. Con ambas pautas, añadir primaquina en las dosis descritas previamente | |
| P. falciparum resistente a cloroquina | Quinina más doxiciclina, tetraciclina o clindamicina igual que la anteriorMefloquina igual que la anteriorAtovacuona-proguanild v.o. 4 comprimidos (250 mg atovacuona + 100 mg de proguanil) QD durante 3 días | |
| Malaria grave | Quininae i.v. 20 mg sal/kg como dosis de carga administrada en 4 h, seguida de 10 mg sal/kg/8 h tras la dosis de carga, de 3 a 7 díasAsociar a: doxiciclina i.v. 100 mg BID y pasar a oral en cuanto sea posible, 7 días o tetraciclina v.o. 250 mg QD, 7 días o clindamicina i.v. 10 mg base/kg como dosis de carga seguido de 5 mg base/kg/8 h pasando a v.o. en cuanto sea posible, 7 días | Quinidina (gluconato) i.v.: 6,25 mg base/kg (= 10 mg sal/kg) como dosis de carga en 1-2 h, seguido de 0,0125 mg base/kg/min (= 0,02 mg sal/kg/min) en infusión continua al menos durante 24 h. Como pauta alternativa puede dosificarse 15 mg base/kg (= 24 mg sal/kg) como dosis de carga infundido en 4 h, seguido de 7,5 mg base/kg (= 12 mg sal/kg) infundido en 4 h cada 8 h a partir de la dosis de carga. Una vez que la parasitación es < 1% y el paciente tolera por boca, completar el tratamiento con quinina oralAñadir doxiciclina, tetraciclina o clindamicina como en la pauta anterior |
| Trypanosoma cruzi | ||
| Infección aguda o congénita | Benznidazolf v.o. 5-7,5 mg/kg día, dividido en 2 dosis, de 30 a 60 días | Nifurtimox v.o. 8-10 mg/kg día, dividido en 2-3 dosis de 30 a 60 díasg |
| Infección crónica precoz | Benznidazol v.o. 5 mg/kg día, dividido en 2 dosis, de 30 a 60 días | Nifurtimox v.o. 8 mg/kg día, dividido en 2-3 dosis de 30 a 60 días |
| Infección crónica tardía | Benznidazol v.o. 5 mg/kg día, dividido en 2 dosis, de 60 a 90 días | Nifurtimox v.o. 8 mg/kg día, dividido en 2-3 dosis de 60 a 90 días |
| Trypanosoma brucei gambiense | ||
| Fase precoz | Pentamidina i.v. o i.m. de 4 a 300 mg/día (7 días) | |
| Fase tardía | Eflornitina i.v. 100 mg/kg QD (14 días) | Melarsoprol i.v. 2,2 mg/kg al día (10 días) |
| Trypanosoma brucei rhodesiense | ||
| Fase precoz | Suramina i.v. 5 mg/kg el primer día, luego 20 mg/kg (hasta 1 g) los días 3, 5, 12, 19, 26 | |
| Fase tardía | Pretratamiento con suramina, 5 mg/kg el primer día y 20 mg/kg el tercer día. Luego melarsoprol i.v. 1,8 mg/kg (día 5), 2,16 mg/kg (día 6), 2,52 mg/kg (días 7 y 14), 2,88 mg/kg (día 15), 3,24 (día 16), 2,9 (día 20), 3,6 (hasta 180 mg, días 23, 24 y 25) | |
| Cyclospora cayetanensis | Cotrimoxazol (160/800 mg) v.o. BID (7 días)h | Ciprofloxacino 500 mg v.o. BID (7 días) |
| Strongyloides stercoralis | ||
| Infestación intestinal | Ivermectina v.o. 200 μg/kg QD, repetir la dosis a la semanaAlbendazoli v.o. 400 mg BID (3-5 días) | Albendazol v.o. 800 mg BID (3 días) |
| Síndrome de hiperinfestación | Ivermectina v.o. 200 μg/kg QD (7-10 días)Albendazol v.o. 400 mg BID (7-10 días) | |
| Schistosoma spp. | Praziquantelj v.o. 40 mg/kg en dosis únicaEn el caso de S. japonicum o S. mekongi administrar 2 dosis de 30 mg/kg separadas por 3 h | Metrifonato v.o. 10 mg/kg en dosis única |
| Taenia solium | ||
| Cisticercosis | Esteroides para el control de los síntomas + albendazoli v.o. 400 mg BID (8-30 días) prazicuantel v.o. 100 mg/kg/día en 3 dosis (1 día), seguido de 50 mg/kg/día en 3 dosis (29 días) | |
| Filariosis | ||
| Onchocerca volvulusLoa loa | Ivermectina v.o. 150 μg/kg, dosis única, cada 6-12 mesesDietilcarbamacina v.o. 6 mg/kg, en 3 dosis (21 días) | En casos de hipermicrofilaremia, considerar iniciar antes albendazol v.o. 200 mg BID durante 21 días y luego administrar ivermectina o dietilcarbamacina |
| Wuchereria bancrofti, Brugia malayi y Brugia timori | Dietilcarbamacina v.o. 6 mg/kg, en 3 dosis (10-14 días) | |
| Mansonella perstans | Albendazol v.o. 400 mg BID (10 días)Mebendazol v.o. 100 mg, BID (30 días) | |
| Mansonella streptocerca | Dietilcarbamacina v.o. 6 mg/kg, en 3 dosis de 12-21 días | Ivermectina v.o. 200 μg/kg, en dosis única |
| Mansonella ozzardi | ||
| Larva migratoria cutánea | Albendazol v.o. 400 mg BID (3 días)Ivermectina v.o. 200 μg/kg QD (1-2 días) | |
| Larva migratoria visceral | Albendazol v.o. 400 mg BID (5 días)Mebendazol v.o. 100-200 mg, BID (5 días) | |
En el embarazo está contraindicado el uso de primaquina y doxiciclina. Con atovacuona y clindamicina existen pocos datos, por lo que, por lo general, no se recomienda. La mefloquina se desaconseja en el primer trimestre. En el caso de infecciones por P. vivax o P. ovale durante el embarazo, se diferirá la cura radical con primaquina hasta después del parto, manteniendo a la embarazada en profilaxis con cloroquina una vez tratado el episodio agudo. En los casos de paludismo resistente, se valorará el riesgo-beneficio del uso de fármacos como mefloquina, atovacuona proguanil, clindamicina o doxicilina.
La primaquina se utiliza para eliminar las formas durmientes hepáticas de ambas especies y prevenir las recaídas. Dado que la primaquina puede causar anemia hemolítica en personas con déficit de G6PDH, los pacientes deben ser estudiados previamente a su administración. Si existe un déficit parcial se puede administrar en dosis de 45 mg a la semana durante 8 semanas. En Oceanía y el sudeste asiático puede ser recomendable duplicar la dosis de primaquina debido a la aparición de cepas resistentes.
Para las infecciones adquiridas en África y Sudamérica, la quinina se administra 3 días, mientras en que las adquiridas en el sudeste asiático se recomiendan 7 días.
El uso de quinina o quinidina i.v. requiere de una monitorización en una unidad de cuidados intensivos por la potencial aparición de arritmias fatales o hipoglucemia.
Se considera al benznidazol de elección por su mayor facilidad de adquisición (se solicita por medicamentos extranjeros). Nifurtimox sólo está disponible en Argentina y Alemania.
En los casos de inoculación accidental la duración será de 10-15 días empezando inmediatamente después de la misma.
En pacientes con infección por el VIH hay que añadir profilaxis secundaria con cotrimoxazol (160/800 mg) un comprimido 3 veces por semana.
En casos de sospecha de infección con sensibilidad disminuida, hay que administrar una dosis de 60 mg/kg en dos tomas separadas por 3 h. BID: dos veces al día; i.m.: intramuscular; i.v.: intravenoso; QD: una vez al día; QID: cuatro veces al día; TID: tres veces al día; VIH: virus de la inmunodeficiencia humana; v.o.: vía oral.
De las especies del género Entamoeba que pueden infectar al hombre sólo E. histolytica tiene capacidad invasiva. El tratamiento de la amebiasis invasiva (intestinal y extraintestinal) se basa en los nitroimidazoles y un amebicida de luz intestinal para la erradicación definitiva de los quistes (el metronidazol elimina menos del 50% de los quistes)135–137 (AI). En los casos de colitis fulminante, incluso con perforación, siempre que sea posible se intentará un cuidado conservador evitando la cirugía y añadiendo antibióticos que cubran la flora intestinal138 (BII).
Los abscesos hepáticos, como regla general, no han de drenarse quirúrgicamente, ya que este procedimiento no acelera la recuperación y la respuesta al tratamiento médico es muy buena (superior al 90%)139 (AI). Puede considerarse la aspiración, con o sin drenaje continuo, cuando la respuesta es tórpida, el diagnóstico es dudoso, el absceso es de gran tamaño (más de 10 cm de diámetro o más de 300 cm3) o existe peligro de rotura inminente, especialmente si es el pericardio (AII). En el caso del empiema o la pericarditis amebiana, secundarias a la rotura de un absceso, el drenaje percutáneo con o sin aspiración mejora el pronóstico (además, suele ser necesaria la cirugía), mientras que la peritonitis puede beneficiarse de un cuidado más conservador138 (BII).
Plasmodium spp.En líneas generales la pauta terapéutica se basará en la especie del parásito, si puede ser resistente a los antimaláricos, en la situación clínica del paciente y en los resultados del laboratorio. Los derivados de la artemisina en combinación con otros antimaláricos son de los fármacos más eficaces para el tratamiento de la malaria. No obstante, y debido a que no pueden conseguirse en nuestro país, no se comentarán. En aquellos individuos que tomando profilaxis desarrollen una malaria, se utilizará un fármaco distinto para el tratamiento.
Las interacciones entre los antimaláricos y los antirretrovirales están poco estudiadas, aunque afectarían principalmente a los ITINN y los IP, ya que comparten vías metabólicas en el hígado (principalmente por el citocromo P-450)140: la quinina se metaboliza fundamentalmente en el hígado, por lo que sus niveles podrían aumentar con la administración conjunta de IP/r, mientras que la disminuirían en presencia de efavirenz o nevirapina. Estos efectos podrían afectar su eficacia o el perfil de toxicidad. La inhibición del CYP2C19 por ritonavir (RTV) podría tener un efecto deletéreo sobre la eficacia del proguanil (ya que el metabolito activo es el cicloguanil). Sin embargo, la combinación de proguanil con atovaquona (Malarone®) no se vería afectada, ya que la sinergia se establece con el proguanil, compensando la menor transformación en cicloguanil. RTV (200 mg/12 h) no disminuiría significativamente los niveles de mefloquina aunque sí ocurriría a la inversa. El uso conjunto de halofantrina o lumefantrina (en menor medida) con IP podría producir un aumento del intervalo QT, por lo que actualmente está contraindicado. La administración con ITINN podría disminuir su eficacia. Los niveles de atovacuona disminuyen significativamente con la administración de lopinavir/r, por lo que podría ser necesario un aumento de dosis. La atovacuona incrementa los niveles de zidovudina significativamente pero no a la inversa. Potencialmente, los efectos sobre el SNC de efavirenz y mefloquina podrían sumarse.
Tripanosoma cruzi (enfermedad de Chagas)La tripanosomiosis americana o enfermedad de Chagas se comporta como otras infecciones oportunistas en el paciente coinfectado141. La mayoría de los casos son reactivaciones, en sujetos con menos de 200 CD4+/μl, y afecta al SNC en forma de encefalopatía, particularmente con granulomas. Esto obliga al diagnóstico diferencial con toxoplasmosis, entre otras enfermedades. El tratamiento con benznidazol o nifurtimox (fármaco que en la actualidad no se produce) de la enfermedad congénita, en fase aguda, o en los casos accidentales está indicado, pues son en los que se obtienen las mejores tasas de curación137,142 (AI). A medida que la parasitosis se cronifica, la utilidad es más dudosa, y generalmente se recomienda en la fase crónica reciente (menos de 10 años de evolución) y menos en la fase crónica tardía (BII). Los casos de encefalopatía chagásica asociados a la inmunodeficiencia por el VIH requieren tratamiento con benznidazol durante un mínimo de 6 semanas, aunque no está establecido claramente cuál ha de ser la extensión del mismo (AIII). Iniciar u optimizar el TARGA en estos casos resulta aconsejable. La adición de itraconazol podría ser de utilidad, así como el tratamiento en fases precoces (parasitemia patente asintomática) antes de que se produzcan daños irreversibles (CIII)143.
Benznidazol y nifurtimox pueden producir molestias gastrointestinales y exantema cutáneo, así como, más raramente, anemia, granulocitopenia, afectación del SNC y neuropatía periférica. No existen datos de interacción de benznidazol con los antirretrovirales, aunque en estudios con ratas se ha visto que puede producir una inhibición de la hidroxilación mediada por el citocromo P-450. En relación con sus efectos adversos, habría que tener precaución con toxicidades potencialmente aditivas: el exantema cutáneo (ITINN), las alteraciones del SNC (efavirenz) y la neuropatía periférica y los trastornos hematológicos (nucleósidos).
Trypanosoma brucei rhodesiense y T. brucei gambiense (tripanosomiosis africana)Para decidir el tratamiento en la tripanosomiosis africana hay que tener en cuenta la especie del parásito y si el paciente está en una fase precoz, o tardía137. Para la tripanosomiosis gambiense precoz el tratamiento de elección es la pentamidina144 (AII). En la fase crónica el tratamiento de elección es la eflorinitina, que, siendo tan eficaz como el melarsoprol, es menos tóxica (AI). El melarsoprol ha de ser usado en la pauta continua de 10 inyecciones en días consecutivos145 (AI). El principal problema de este fármaco es su toxicidad (4-6% de muertes asociadas) como consecuencia de una encefalopatía reactiva (no por toxicidad de los arsenicales constituyentes del fármaco). La prednisolona reduce en un 70% el riesgo de la misma sin que se vea afectada la eficacia del tratamiento146 (AI). Generalmente, se usan antihelmínticos y antimaláricos como tratamiento adyuvante para evitar posibles complicaciones infecciosas. El tratamiento de la encefalopatía se basa en el uso de anticonvulsivos y corticoides para controlar la inflamación reactiva.
El curso clínico de la tripanosomiosis rodesiense es mucho más agresivo y puede evolucionar rápidamente (en semanas) a una meningoencefalitis fatal si no se trata. La terapia de elección es la suramina144 (AII) y hay que evitar el melarsoprol en la medida de lo posible por la toxicidad del SNC. Generalmente, se administra una dosis de prueba inicial por si hubiera una reacción anafiláctica. Las reacciones adversas más comunes son urticaria, proteinuria y fiebre. En el caso de fases tardías de la enfermedad, con diseminación al SNC, el único fármaco activo es el melarsoprol, ya que la eflornitina no difunde al SNC, y T. b. rhodesiense es resistente a la misma. Dado que la incidencia de encefalopatía por melarsoprol es mayor que con T. b. gambiense, se recomienda comenzar con una pequeña dosis de melarsoprol e ir aumentando progresivamente la misma, además de un pretratamiento con suramina144 (BIII). También parece razonable el uso de prednisolona para la prevención de la encefalopatía y otros antiparasitarios como coadyuvantes (BIII).
Cyclospora cayetanensisEl tratamiento de elección es el cotrimoxazol administrado durante 1 semana137 (AI) (tabla 8). En pacientes que no toleran este tratamiento la alternativa sería ciprofloxacino, aunque parece menos eficaz (BI). En personas infectadas por el VIH ha de instaurarse profilaxis secundaria con cotrimoxazol, ya que la recurrencia es la regla tras el episodio agudo147 (AII).
Strongyloides stercolarisEl objetivo del tratamiento es la erradicación total del parásito para evitar el síndrome de hiperinfestación148. No existen pruebas diagnósticas suficientemente sensibles para determinar el éxito del tratamiento, aunque puede utilizarse la disminución en los títulos de la serología o del recuento de eosinófilos. La ausencia de larvas en heces no es fiable como marcador de curación. Ivermectina y albendazol son los fármacos de elección para el tratamiento, aunque no existen ensayos controlados que permitan determinar la dosis o el esquema terapéutico ideal137,149,150 (AII). En los pacientes con síndrome de hipeinfestación, el tratamiento ha de prolongarse de 7 a 10 días y retirar los corticoides en la medida de lo posible. No existen datos sobre interacciones potenciales de albendazol e ivermectina con los antirretrovirales.
Schystosoma haematobiumEl tratamiento de elección para todas las formas de esquistosomiasis es el praziquantel (AI). Es un fármaco que se tolera bien y suele administrarse en dosis única. Su uso no está contraindicado en el embarazo y se ha demostrado eficaz en los niños. En los casos de infección aguda (menos de un mes desde la exposición), su eficacia es mucho menor ya que no es activo sobre las esquistosómulas, por lo que es necesario un segundo ciclo de tratamiento pasadas 4 semanas. En estos casos los derivados de la artemisina se han mostrado eficaces. En algunas áreas de Senegal y Egipto podría haberse desarrollado cierto grado de resistencia al praziquantel, lo que obligaría a un incremento de las dosis137,151.
Taenia solium (cisticercosis)Albendazol y praziquantel han mostrado eficacia en la enfermedad parenquimatosa, medida como reducción del tamaño de las lesiones quísticas, o resolución más temprana de las lesiones en quistes degenerados (BI)137,152–154. El praziquantel sufre un primer paso hepático que reduce su biodisponibilidad. Los corticoides y anticomiciales (carbamazepina y fenitoína) disminuyen aún más sus niveles. Esto hace que, en general, se prefiera el uso de albendazol (que requiere también menos comprimidos), con el que, además, hay más ensayos clínicos controlados. Los niveles de praziquantel podrían verse elevados con el uso conjunto con IP, especialmente con ritonavir.
El tratamiento inicial de los pacientes con cisticercosis cerebral y signos inflamatorios ha de ser sintomático (control de la hipertensión intracraneal y de las convulsiones). Los quistes parenquimatosos se tratan con albendazol y corticoides (dexametasona 6 mg/día o prednisona 40-60 mg/día) durante 8-30 días. Los pacientes con quistes subaracnoideos o quistes muy grandes han de recibir tratamiento prolongado (30 días) o el doble de dosis de albendazol (30 mg/kg/día). En los casos de hidrocefalia obstructiva está indicada la cirugía junto al tratamiento con albendazol y corticoides. Siempre que se inicie tratamiento médico hay que descartar la existencia de cisticercosis ocular (aunque se usen corticoides), ya que la reacción inflamatoria puede producir daños irreparables. Ocurre lo mismo con la cisticercosis espinal.
Filariosis (oncocercosis, loasis)El tratamiento de elección para la oncocercosis es la ivermectina137,155 (AI), que tiene actividad microfilaricida pero no sobre los parásitos adultos, por lo que se administra en dosis única cada 6-12 meses durante 10-14 años (hasta la muerte de los parásitos adultos). Las reacciones tras el tratamiento son frecuentes (prurito cutáneo, edemas o dolor de espalda), especialmente con altos grados de infestación. Dado que la respuesta se relaciona con el grado de inmunidad frente al parásito, se ha sugerido que en aquellos sujetos con menor reactividad las dosis podrían administrarse cada 3 meses (BII). Se ha propuesto el tratamiento previo con doxiciclina (100 mg/día vía oral durante 6 semanas) para la eliminación de la bacteria endosimbionte Wolbachia, lo que esterilizaría a las hembras de Oncocercus volvulus disminuyendo drásticamente la producción de microfilarias (BII). La dietilcarbamazina (DEC) no debe utilizarse para el tratamiento de la oncocercosis, porque la rápida muerte de las microfilarias puede producir ceguera y una reacción grave generalizada.
El tratamiento de elección para las infestaciones por Loa loa, en pacientes amicrofilarémicos o cuando el grado de parasitación es bajo (menos de 2.500 microfilarias/ml), es la dietilcarbamazina, que también tiene actividad sobre los parásitos adultos137,156 (AII) (tabla 8). Los efectos adversos más frecuentes son fiebre, náuseas, prurito, artralgias y edemas de Calabar (tumefacción dolorosa y transitoria de extremidades) que pueden controlarse con antihistamínicos. Cuando el grado de microfilaremia es alto, la lisis masiva de las microfilarias por la dietilcarbamazina puede producir shock, coma, insuficiencia renal e incluso una encefalopatía mortal. La pauta de inicio escalonado de dietilcarbamazina puede desencadenar también esta reacción, por lo que no se recomienda en parasitaciones altas. En los casos de hipermicrofilaremia se ha propuesto la aféresis previa al tratamiento con dietilcarbamazina, el uso de ivermectina o de albendazol, que disminuirían más lentamente la microfilaremia157. No obstante, con ivermectina también se han descrito reacciones graves en un 30-70% de los casos. El tratamiento con albendazol durante 3 semanas ha demostrado disminuir las microfilarias progresivamente158, por lo que en los pacientes hipermicrofilarémicos su uso, seguido de dietilcarbamazina o ivemectina, podría ser una opción alternativa a la aféresis sanguínea.
En el tratamiento de la filariosis linfática se usa la dietilcarbamazina137 (BII) durante 10-14 días. El uso concomitante de ivermectina (400 μg/kg) o albendazol (400 mg) en dosis única, junto con dietilcarbamazina, también en monodosis se ha mostrado igual de efectivo. Al igual que con la oncocercosis, se ha visto que la doxiciclina disminuye la microfilaremia y elimina los adultos al actuar sobre la bacteria endosimbionte Wolbachia159.
Para el tratamiento de Mansonella perstans se usa el mebendazol o el albendazol, mientras que para M. streptocerca el fármaco de elección es la dietilcarbamazina (BII). M. ozzardi no es sensible a dietilcarbamazina, aunque parece que la ivermectina es activa reduciendo la microfilaremia a corto y largo plazo (BI)137,160,161.
Síndrome de reconstitución inmuneEl diagnóstico de la infección por el VIH avanzada es relativamente frecuente en nuestro país4,162. Estos pacientes tienen criterios para iniciar TARGA. Un porcentaje relativamente elevado de pacientes presentará, a pesar de tener una respuesta viral e inmune excelente al TAR-GA, un deterioro clínico paradójico denominado síndrome de reconstitución inmune (SRI) o síndrome inflamatorio de reconstitución inmune (SIRI)163,164. A pesar de ello, un ensayo clínico reciente (ACTG A5164)165 demuestra que no ha de retrasarse el inicio del TARGA, que en esta población podría originar un mayor riesgo de progresión de la enfermedad o muerte166.
Etiología e incidenciaLos microorganismos que se asocian con más frecuencia al SRI son las micobacterias (M. tuberculosis y micobacterias atípicas como MAC, M. leprae y bacilo de Calmette-Guérin), los hongos (Cryptococcus neoformans, P. jiroveci y micosis regionales) y los virus del grupo herpes (CMV, VVZ, VHS y el herpesvirus humano tipo 8), los poliomavirus (como los virus JC y BK), los virus del Molluscum contagiosum, el parvovirus B19 y los virus de la hepatitis B y C (VHB y VHC)92,103,163,164,167–174. Aunque se han descrito casos de SRI con otras bacterias (Rhodococcus, Nocardia, Bartonella) y parásitos (T. gondii, Leishmania, S. stercoralis, Cryptosporidium), la frecuencia es mucho menor175. El SRI también se ha descrito en tumores, como el sarcoma de Kaposi163,164,167–169, linfoma176 y cáncer de pulmón177, así como en fenómenos autoinmunes tipo lupus-like178 o de expresión endocrina como la enfermedad de Graves tras el inicio del TARGA163,179.
El porcentaje de pacientes que desarrolla el SRI es variable. En estudios de cohortes de pacientes que inician TARGA el SRI oscila entre el 15 y el 25%. En series de pacientes con IO la frecuencia es mayor, pudiendo llegar a ser de hasta el 45%.
Criterios diagnósticosLa mayoría de autores163,164,167–169,175 están de acuerdo en que los pacientes con SRI tienen estos tres criterios: a) existe una relación temporal con el inicio del TARGA, y es característica la reducción rápida de la carga viral plasmática del VIH (mayor 2 log10 copias/ml) y el aumento súbito de los linfocitos CD4+; b) existe un empeoramiento clínico y/o radiológico o de pruebas de imagen atípico, de características inflamatorias, o la aparición de una infección oportunista, en general durante las primeras 12 semanas de TARGA efectivo (SRI inicial), aunque en ocasiones también se han descrito casos de SRI más allá de los 3 meses (SRI tardío), y c) se ha descartado el fracaso microbiológico al tratamiento antimicrobiano de la infección oportunista, la toxicidad farmacológica, la enfermedad autoinmune o una nueva complicación oportunista no relacionada con el SRI.
Manifestaciones clínicasEn general, las presentaciones atípicas de las infecciones oportunistas y tumores que pueden sugerir o hacer pensar en la existencia de un SRI se pueden resumir de la siguiente forma: a) enfermedad localizada en los ganglios linfáticos, el hígado, el bazo, la piel, los pulmones y el SNC; b) reacción inflamatoria y/o atípica exagerada en los órganos afectados, que incluye la formación de granulomas, supuración, necrosis o de infiltrados linfocitarios perivasculares, y c) aumento de las lesiones existentes o insuficiencia del órgano afectado después de existir una mejoría clínica inicial con el tratamiento antimicrobiano específico antes del inicio del TARGA.
Prevención y tratamiento del SRI y optimización del TARGANo se conoce la prevención o el tratamiento terapéutico del SRI163,164,167–169,180,181. En general, se recomienda que los pacientes continúen el tratamiento específico frente a las IO y el TARGA (CIII). El tratamiento adyuvante con antiinflamatorios no esteroideos es frecuente y en las formas más graves se administran corticoides (CIII)163,164,167–169,180,181. En ocasiones es necesaria la cirugía para desbridar abscesos (CIII). El curso clínico suele ser prolongado (semanas) y la mayoría de pacientes mejoran, aunque se han descrito casos mortales en pacientes con meningitis criptocócica o LMP182,183. En aquellos casos de SRI que son de una gravedad tal que la vida del paciente corre peligro, se podría considerar la posibilidad de interrumpir temporalmente el TARGA hasta que haya mejorado la situación del paciente, manteniendo el tratamiento de la infección subyacente y el tratamiento antiinflamatorio (CIII).
La experiencia clínica con el uso de otras alternativas terapéuticas como inmunosupresores (metrotexato184), o los agentes antifactor de necrosis tumoral (etanercept185, talidomida186 o pentoxifilina187) es muy escasa y circunscrita en casos aislados de tuberculosis o lepra en pacientes con o sin infección por el VIH.
Los Centers for Disease Control and Prevention-National Institutes of Health-Infectious Diseases Society of America (CDC-NIH-IDSA188) recomendaban en pacientes sin TARGA previo con IO diferentes de la tuberculosis, iniciar TARGA de forma inmediata cuando no existía tratamiento antimicrobiano efectivo para la IO (p. ej., criposporidiasis o LMP). En el resto de casos, el TARGA debería iniciarse 2-4 semanas después de iniciado el tratamiento antimicrobiano de la IO. Sin embargo, recientemente se han presentado los resultados del ACTG A5164165, el primer ensayo clínico aleatorizado que evaluaba la estrategia de iniciar el TARGA de forma inmediata, durante los primeros 14 días del inicio del tratamiento antimicrobiano de las IO (no se incluían pacientes con tuberculosis), o de forma diferida, a partir de las 4 semanas, que ha cambiado esta recomendación de un nivel CIII a un AI. La mayoría de pacientes iniciaron un TARGA basado en LPV/r. Se aleatorizaron 282 pacientes, 141 por cada rama del estudio. El 63% de pacientes tenía una neumonía por P. jiroveci, el 13% una meningitis criptocócica y el 10% una neumonía bacteriana. Las cifras (medianas) basales de linfocitos CD4+ y de carga viral del VIH-1 en plasma fueron de 29/μl y 5,07 log, respectivamente. El TARGA se inició en las ramas inmediata y diferida una mediana de 12 días y 45 días después del inicio del tratamiento de la IO, respectivamente. El aumento de CD4+ fue similar en ambas ramas del estudio, pero los pacientes con TARGA inmediato tardaron menos tiempo en alcanzar una cifra de CD4+ superior a 50-100/μ1, tuvieron una menor progresión a sida o muerte (p = 0,035), y tardaron más en progresar a sida o muerte (p = 0,02). Los pacientes incluidos en la rama de TARGA inmediato tuvieron una mayor tendencia a tener cambios de TARGA más precoces (p = 0,15), pero no existieron diferencias significativas con respecto a los efectos adversos grados 3-4, adherencia al tratamiento, hospitalizaciones o SRI (8 casos en la rama inmediata y 12 en la diferida). En función de este estudio165, se puede recomendar el inicio de TARGA, de forma ideal a los 10-14 días de inicio de la IO y preferentemente antes de los 28 días, en pacientes con IO diferentes de la tuberculosis, siempre y cuando no existan contraindicaciones clínicas (AI).
Por el contrario, cuando las IO aparecen en los pacientes que están recibiendo TARGA188, han de distinguirse varias situaciones clínicas: a) cuando la IO aparece en las primeras 12 semanas del TARGA probablemente se trata de un SRI que pone de manifiesto una IO subclínica (p. ej., tuberculosis o LMP); en estos casos ha de continuarse el TARGA e iniciarse el tratamiento de la IO (CIII); b) cuando la IO aparece a partir de las 12 semanas, en pacientes con un TARGA efectivo, puede tratarse de un SRI tardío o de una nueva IO, ya que en ocasiones no se restaura la respuesta específica de patógeno; en estos casos también ha de continuarse el TARGA e iniciarse el tratamiento de la IO (CIII), y c) cuando la IO ocurre en el contexto de un fracaso vírico al TARGA, refleja una progresión de la enfermedad, el tratamiento de ésta ha de iniciarse de forma inmediata, ha de solicitarse un estudio de resistencias a los antirretrovirales y se ha de administrar un nuevo TARGA (CIII).
Panel de expertos de GESIDA y Plan Nacional sobre el SidaCoordinador: Daniel Podzamczer.
Redactores: Carlos Barros, Juan Berenguer, Félix Gutiérrez, José Antonio Iribarren, José M. Miró, José Pérez Molina, Daniel Podzamczer.
Revisores: Koldo Aguirrebengoa, José Ramón Arribas, Vicente Boix, Pedro Cahn, Ángeles Castro, Joan Caylá, Javier Cobo, Juan Enrique Corzo, Javier de la Torre, Fernando Dronda, Javier Ena, Vicenj Falcó, Elena Ferrer, Pablo Labarga, Jaime Locutura, Josep Mallolas, Santiago Moreno, Antonio Ocampo, Imma Ocaña, Julián Olalla, Belén Padilla, M.a Jesús Pérez Elías, Rosa Polo, Joaquín Portilla, Melcior Riera, Antonio Rivero, Miguel Salavert y José Sanz.
AgradecimientosA los socios de GESIDA que han enviado comentarios/sugerencias al borrador del documento expuesto en la web de GESIDA: Carlos Dueñas, Silvana Fiorante, Juan Emilio Losa y Víctor J. Moreno.