La infección de prótesis articular es un problema creciente de salud pública. El cuerpo extraño determina la formación de biocapas bacterianas que son resistentes a los mecanismos de defensa y a los antibióticos. El 60% están causadas por estafilococos. La infección suele producirse en el quirófano o en el postoperatorio inmediato y, más raramente, por vía hematógena. Se distinguen la infección posquirúrgica precoz (IPP), la infección crónica tardía (ICT), la infección hematógena aguda (IHA) y la forma de cultivos intraoperatorios positivos (CIOP). En las IPP e IHA la precocidad diagnóstica es decisiva para intentar salvar la prótesis y en la ICT el problema estriba en el diagnóstico diferencial con el aflojamiento aséptico. La combinación de rifampicina-levofloxacino 8 semanas es el tratamiento de elección para las IPP e IHA causadas por estafilococos sensibles, tratadas con desbridamiento y retención de prótesis. En las ICT se requiere recambio protésico y una antibioticoterapia de 6 semanas.
Prosthetic joint infection is an increasing public health problem. The bacterial biofilms that form on these foreign bodies are resistant to host defence mechanisms and antimicrobial therapy. Sixty per cent of prosthetic joint infections are caused by Staphylococcus sp., and they are usually acquired during surgery or in the early post-operative period, but can also occur by haematogenous seeding. There are several kinds of prosthetic joint infections: early postoperative infection (EPI), late postoperative infection (LPI), haematogenous infection (HI), and positive operative cultures. In EPI and HI, early diagnosis is mandatory to save the implant, and in LPI the main issue is the differential diagnosis with aseptic loosening. The treatment of choice for susceptible staphylococcal EPI and HI is debridement and a combination of rifampin and levofloxacin for 8 weeks, with retention of the implant. In LPI, replacement of the prosthesis is required, followed by antibiotic therapy for 6 weeks.
La infección relacionada con prótesis articulares constituye actualmente un problema de salud pública de primera magnitud en la mayoría de países desarrollados. La práctica de una artroplastia ha supuesto uno de los avances sanitarios más significativos en las últimas décadas. El desarrollo tecnológico, el envejecimiento progresivo de la población y la prolongación de la vida de enfermos con patología subyacente han propiciado un incremento exponencial en el número de pacientes sometidos a esta práctica. La implantación de una prótesis de cadera, rodilla y, en menor grado, de hombro y otras articulaciones ha llegado a ser un hecho habitual en la mayoría de los hospitales españoles. La infección es su principal complicación. La presencia del material protésico, la laboriosidad de la intervención quirúrgica y los factores de riesgo del huésped predisponen fuertemente a ello. Esta complicación supone una catástrofe para el paciente y una carga asistencial y económica muy pesada para el sistema sanitario. Un número elevado de estos pacientes pierden su artroplastia y tienen que ser sometidos a repetidas intervenciones y a antibioticoterapia prolongada1–3.
Epidemiología y factores de riesgoEn EE.UU., la repercusión social de la práctica de una artroplastia y su posible infección ha sido motivo de una reciente investigación4. En el año 2005 se implantaron en EE.UU. más de 700.000 artroplastias, dos tercios de ellas en mujeres. Cerca del 90% fueron primarias, con un predominio mayor de 2:1 de prótesis de rodilla/cadera (PTR/ PTC), mientras que entre las artroplastias de revisión esta proporción fue de 1:1. Alo largo del período 1990-2005 se apreció un incremento en la artroplastia de cadera superior a 1,7 veces y en la de rodilla de más de 3. La previsión de aumento para la cadera en 2030 se calculó entre 2 y 3 veces (cifra de 572.000 artroplastias primarias y 96.700 de revisión) y para la rodilla, entre 7 y 8 veces (3.480.000 artroplastias primarias y 268.200 de revisión). El número de casos con infecciones en 2005 fue 9.800, 6.400 de rodilla y 3.400 de cadera (el 1,4% global, con una distribución equivalente en la cadera y la rodilla). La infección determinó el 8,4% de las artroplastias de revisión en cadera y el 16,8% en rodilla. Las infecciones previstas para 2030 se cifraron en 46.000 en la cadera (6,5%) y 175.000 en la rodilla (6,8%).
En general, las tasas medias de infección global durante los primeros 2 años de postoperatorio son: artroplastia primaria: en PTC el 1,5%; en PTR el 2,5%; artroplastia de revisión (aproximadamente el doble): en PTC el 3,2%; en PTR el 5,6%. La infección comporta una gran morbilidad y también una mortalidad entre el 2 y el 7% en pacientes mayores de 80 años. El coste adicional de una artroplastia infectada se cuantificó hace unos años en más de 50.000 dólares (unas 10 veces por encima de su coste basal)5–7.
En España no existen estudios pormenorizados al respecto, pero el número estimado de artroplastias es de unas 30.000/año, con una incidencia media de infección del 3 o 4%, si se considera la población de pacientes con artritis reumatoide, diabetes, obesidad o sometidos a repetidos recambios, grupo de enfermos de frecuencia creciente.
Los factores de riesgo asociados con infección de la artroplastia son: el antecedente de una infección "superficial" postoperatoria de la herida quirúrgica, sin afectación aparente de la prótesis (odds ratio [OR]: 35,9), una clasificación operatoria NNIS (National Nosocomial Infection Surveillance) superior a 2 (OR: 3,9), la presencia concomitante de neoplasia (OR: 3,1) y artroplastias previas en la articulación (OR: 2)5. También se asocian a un mayor riesgo la diabetes mellitus, la obesidad, la desnutrición, la artritis reumatoide, el tratamiento con corticoides y la infección urinaria concomitante5,6,8.
El riesgo de infección protésica en el curso de una bacteriemia, si se considera el conjunto de microorganismos, es bajo (0,3%), pero este riesgo se estableció en más del 30% en el curso de una bacteriemia por Staphylococcus aureus, con especial frecuencia en la rodilla (50%)9. De hecho, el riesgo de infección protésica vendría mejor dado por una tasa de incidencia prótesis-año que por un mero porcentaje global, ya que el riesgo de tener una colonización hematógena o desarrollar una infección posquirúrgica de aparición tardía persiste a lo largo de la vida de la prótesis. Esta tasa fue de 5,9 por 1.000 prótesis-año durante los primeros 2 años tras el implante y de 2,3 por 1.000 prótesis-año durante los siguientes 8 años en un estudio2.
PatogeniaLas características particulares de estas infecciones vienen determinadas por la presencia del biomaterial protésico y su interrelación con los tejidos del huésped y los microorganismos infectantes. El implante facilita la infección, que puede producirse con un inóculo bacteriano muy bajo (menos de 100 unidades formadoras de colonias/g) y por microorganismos poco virulentos y habitualmente contaminantes. Esta predisposición varía según la composición y propiedades del biomaterial. El proceso de adhesión bacteriana a la prótesis y la posterior formación de las biocapas, en las que las bacterias están aglutinadas por un polisacárido bacteriano llamado slime, ha sido ampliamente tratado en un capítulo previo de esta serie10. En las biocapas más profundas las bacterias están en fase "durmiente o estacionaria", en un medio con escasa oxigenación, elevada cantidad de materiales de desecho y pH bajo. Estas bacterias expresan una tolerancia antibiótica de carácter fenotípico, con aumento de la concentración bactericida mínima (CBM) de los antibióticos11. La resistencia antibiótica derivada de las biocapas bacterianas ha sido también motivo de otro capítulo de la presente serie12. Las biocapas se forman con notable rapidez, de manera que se consideran ya maduras a los 7 días de evolución13. Existe una limitación variable de la penetración de los antibióticos, que además pueden sufrir una posible inactivación, aunque estos factores parecen tener menos significación. Este fenómeno afecta a todos los antibióticos, que pueden requerir concentraciones 500-1.000 veces superiores, pero no repercute por igual en todos ellos14,15. Así, los más afectados en el caso de S. aureus son los aminoglucósidos, los glucopéptidos y los betalactámicos, mientras las fluoroquinolonas, rifampicina, macrólidos, clindamicina y linezolid mantienen mejor actividad. En el caso de los bacilos gramnegativos (BGN), las fluoroquinolonas muestran la mayor actividad12,14,15. También la alterada función fagocitaria en las inmediaciones del cuerpo extraño, la presencia de bacterias intracelulares y de variantes pequeñas de las colonias bacterianas (SCV)16 son factores importantes en la deficitaria respuesta antimicrobiana de estas infecciones. Las bacterias más superficiales se desprenden de las biocapas y, al recuperar su estado planctónico, son las responsables de los síntomas clínicos de la infección y se vuelven sensibles a los antibióticos13–15.
En la mayoría de ocasiones los microorganismos alcanzan la prótesis en el propio quirófano o en el postoperatorio inmediato, aunque la infección puede manifestarse mucho tiempo después.
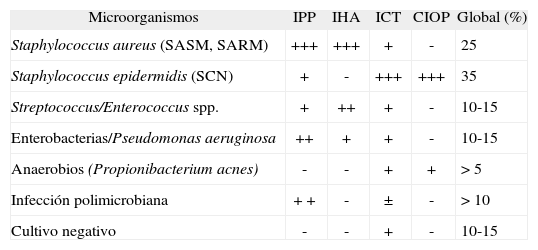
MicrobiologíaVaría según la epidemiología y los tipos de infección considerados1–3,5–7. El 75% de los casos son causados por cocos grampositivos, con gran predominio de estafilococos (60%); el 25% son S. aureus sensibles o resistentes a la meticilina y el 35% Staphylococcus coagulasa negativos (SCN). Los BGN, enterobacterias y Pseudomonas aeruginosa causan el 10-15% de los casos. En los últimos años se describen con mayor frecuencia las infecciones debidas a diversas especies de Streptococcus y Enterococcus faecalis (10-15%) y entre las bacterias anaerobias Propionibacterium acnes (> 5%)17. Más del 10% son infecciones polimicrobianas y en el 10-15% de los casos los cultivos son negativos18. S. aureus y los BGN tienen un especial protagonismo en las infecciones posquirúrgicas precoces3,19, mientras que en las posquirúrgicas tardías y en la forma "cultivos operatorios positivos" predominan microorganismos poco virulentos, como SCN y P. acnes3. En las infecciones hematógenas son frecuentes S. aureus, S. agalactiae y otros, así como enterobacterias diversas20 (tabla 1).
Importancia de los diferentes microorganismos responsables de las infecciones de prótesis articulares según los tipos de infección
| Microorganismos | IPP | IHA | ICT | CIOP | Global (%) |
| Staphylococcus aureus (SASM, SARM) | +++ | +++ | + | - | 25 |
| Staphylococcus epidermidis (SCN) | + | - | +++ | +++ | 35 |
| Streptococcus/Enterococcus spp. | + | ++ | + | - | 10-15 |
| Enterobacterias/Pseudomonas aeruginosa | ++ | + | + | - | 10-15 |
| Anaerobios (Propionibacterium acnes) | - | - | + | + | > 5 |
| Infección polimicrobiana | + + | - | ± | - | > 10 |
| Cultivo negativo | - | - | + | - | 10-15 |
CIOP: cultivos intraoperativos positivos; IHA: infección hematogénea aguda; ICT: infección crónica tardía; IPP: infección posquirúrgica precoz; SARM: Staphylococcus aureus resistente a meticilina; SASM: Staphylococcus aureus sensible a meticilina; SCN: Staphylococcus coagulasa negativos.
Según el tiempo de aparición de la infección tras la colocación de la prótesis y el contexto clínico, se han sugerido diversas clasificaciones, entre las cuales una de las más utilizadas es la de Tsukayama et al1,21.
Infección posquirúrgica precoz (IPP)3,19Se manifiesta en el primer mes tras la cirugía del implante con predominio de los signos inflamatorios locales, celulitis y secreción purulenta de la herida quirúrgica. Puede haber dolor en la articulación y fiebre, sólo a veces elevada, con escalofríos, afectación sistémica y bacteriemia. En los pacientes con IPP el principal problema diagnóstico es diferenciar una infección superficial de una infección de la prótesis, pero cualquier infección de la herida quirúrgica debe hacer plantear la posible afectación del implante.
Infección crónica tardía (ICT)3Se presenta a partir del segundo mes tras la cirugía, con predominio de la clínica ortopédica sobre los síntomas de infección y, a menudo, con aflojamiento protésico. Pueden manifestarse meses o años después a pesar de su adquisición quirúrgica, debido al pequeño inóculo bacteriano y la baja virulencia de los microorganismos causales. La sintomatología es larvada, y el diagnóstico diferencial, con el aflojamiento aséptico, es difícil de establecer. El síntoma principal es el dolor de características mecánicas o inflamatorias. Muchos de estos pacientes presentaron un postoperatorio tórpido, con infección de la herida quirúrgica y problemas en su cicatrización. Algunos desarrollan una fístula cutánea.
Infección hematógena aguda (IHA)20De presentación precoz o tardía, está asociada a bacteriemia ya sea documentada o en función de una sospecha clínica. En las primeras semanas del postoperatorio, cuando existe un particular riesgo de que una bacteriemia colonice la prótesis recién implantada, el diagnóstico puede confundirse con el de IPP. En los casos tardíos, la aparición brusca de dolor e inflamación local en la articulación afectada y fiebre son característicos. El diagnóstico es claro en los pacientes con prótesis previamente indolora y buena funcionalidad, pero a veces la infección se establece en pacientes con dolor crónico y aflojamiento aséptico previo, que facilita el anidamiento de la bacteriemia. La positividad del hemocultivo o del cultivo de la cavidad articular y la presencia de otro foco de infección en algunos casos sugieren el diagnóstico.
Cultivos intraoperatorios positivos (CIOP)Se producen en pacientes con sospecha preoperatoria de "aflojamiento aséptico" de la prótesis articular y hallazgo de cultivos positivos de las muestras operatorias al ser sometidos a un recambio en un tiempo. Son infecciones subclínicas tratadas con recambio protésico en un tiempo.
La frecuencia relativa de los diferentes tipos de infección protésica depende de las características epidemiológicas de la población estudiada, pero se cifra en alrededor del 35% en IPP, el 50% en ICT, el 10% en IHA y el 5% en CIOP1,19–21.
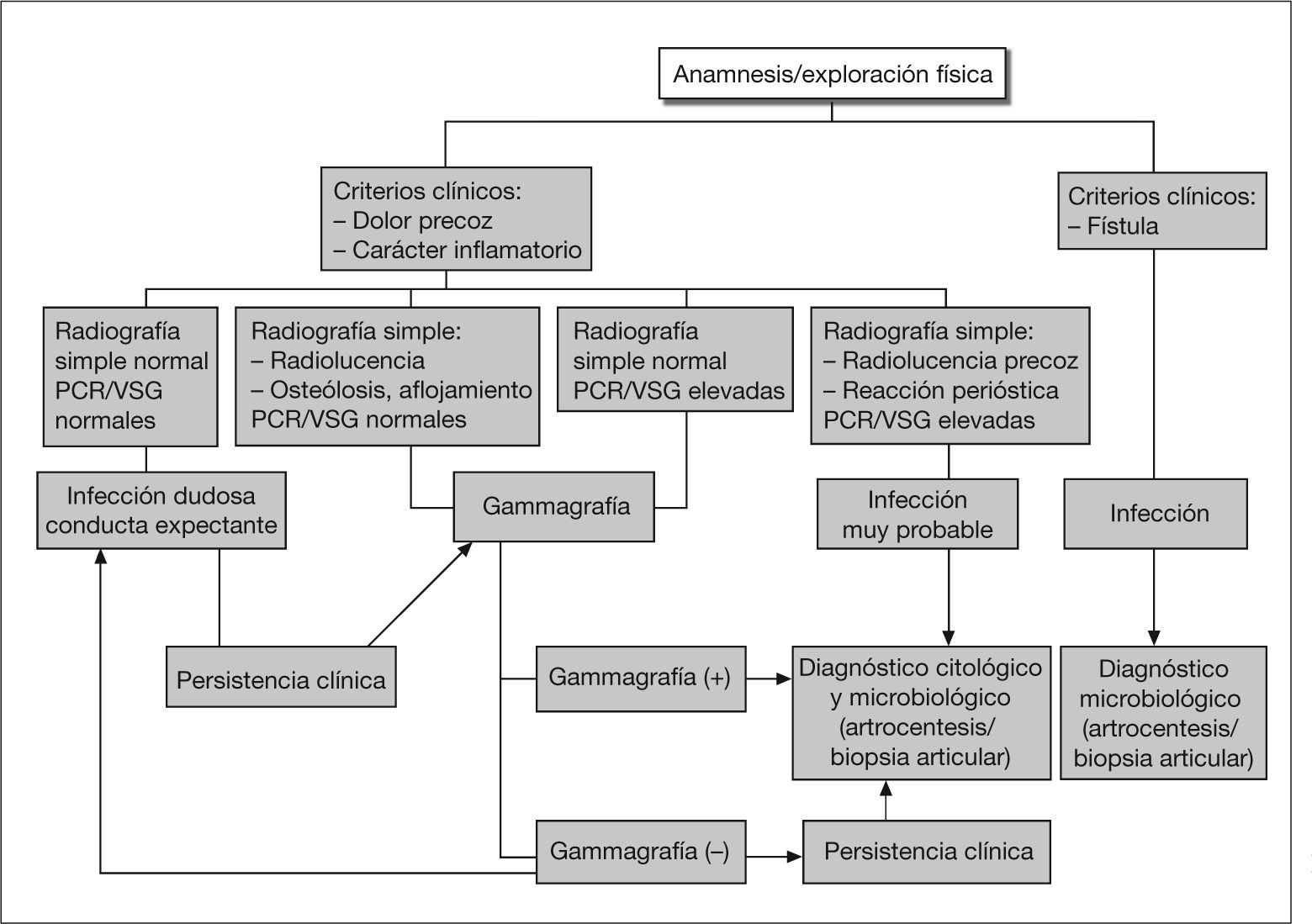
DiagnósticoSu diagnóstico requiere un alto índice de sospecha, por la importancia de su precocidad en las IPP e IHA y su dificultad en las ICT.
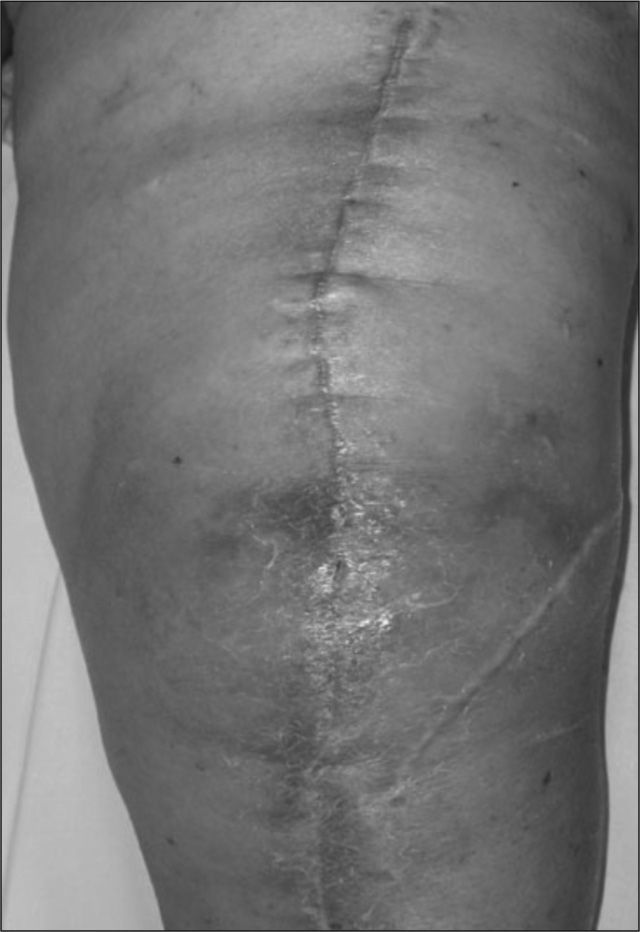
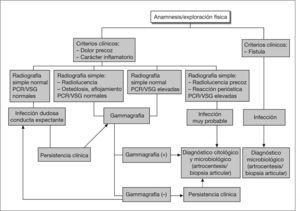
Infección posquirúrgica precozEn las IPP, el diagnóstico se basa en el criterio clínico de la herida quirúrgica. Excepto si la infección es muy superficial, se debe plantear afectación de la prótesis si se observa celulitis o supuración de la herida (fig. 1). Las exploraciones complementarias no son de gran ayuda, pues se detectan todavía los cambios inflamatorios posquirúrgicos, en las cifras elevadas de los reactantes de fase aguda, como la velocidad de sedimentación globular (VSG) y la proteína C reactiva (PCR) y en las pruebas de imagen. En los casos con fiebre o afectación general sin inflamación de la herida puede intentarse una punción articular guiada por pruebas de imagen para realizar un estudio microbiológico3,19.
Infección crónica tardíaEn las ICT se plantea el diagnóstico diferencial con la disfunción o aflojamiento aséptico de la prótesis (figs. 2 y 3). Se consideran criterios de infección la presencia de un trayecto fistuloso, líquido articular purulento o pus alrededor de la prótesis en la cirugía, crecimiento del mismo microorganismo en 2 o más cultivos de líquido sinovial o tejido periprotésico o la observación de inflamación aguda en el examen histopatológico del tejido periprotésico sin otra causa conocida3,7,22–25.
Características clínicasLa anamnesis y la exploración física son de gran importancia. La presencia de fístula o signos inflamatorios locales son indicativos de ICT, pero en muchos casos el dolor local es el único síntoma y el diagnóstico, difícil de establecer3. La precocidad de la aparición del dolor en los primeros meses tras la cirugía y su carácter más o menos inflamatorio sugieren una ICT.
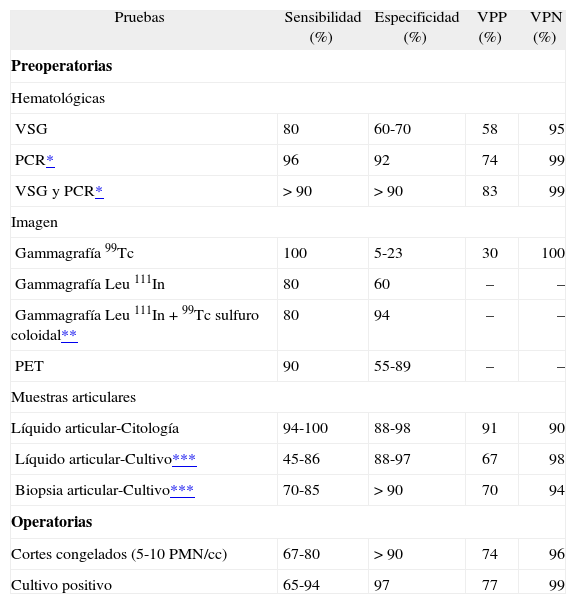
Pruebas analíticasLa determinación de los reactantes de fase aguda en sangre es útil: la sensibilidad de la VSG es 0,8 y su especificidad, 0,6-0,7; la sensibilidad y especificidad de la PCR es mayor y la de ambas pruebas conjuntamente superan el 0,9; su valor es más cuestionable en presencia de enfermedades inflamatorias crónicas, que causan falsos positivos (valor predictivo positivo [VPP] 0,75). Por el contrario, su negatividad hace poco probable una ICT (valor predictivo negativo [VPN] 0,99)24,25. En la ICT de PTR su sensibilidad y especificidad podrían ser algo menores. El incremento de la interleucina 6 (IL-6) mostró una máxima sensibilidad y especificidad en un estudio. La detección de leucocitosis tiene baja sensibilidad3.
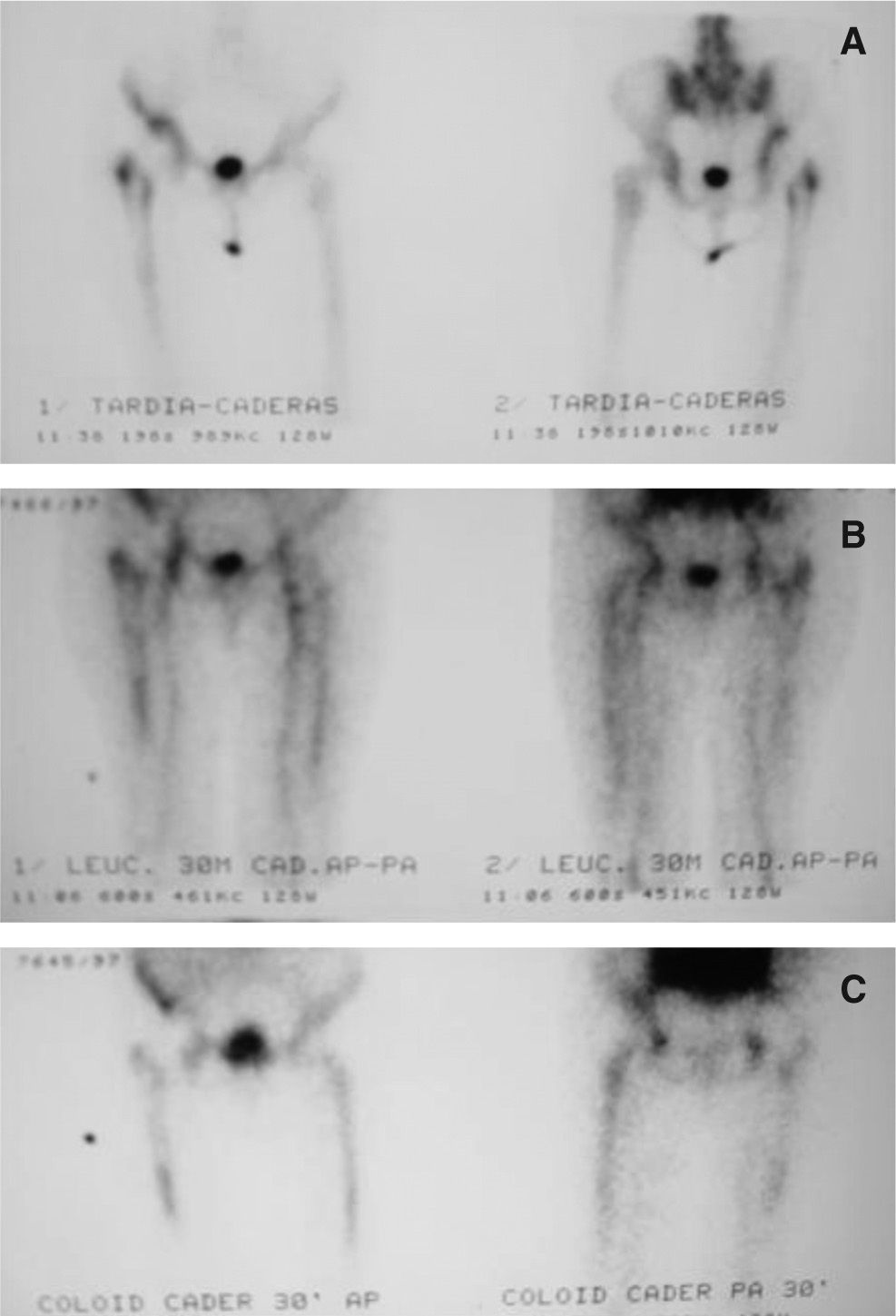
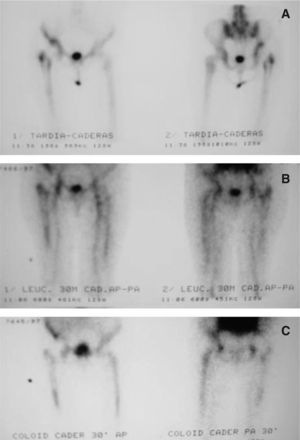
Pruebas de imagenLa radiología simple no es de utilidad en los primeros 6 meses tras la cirugía, pero posteriormente puede empezar a aparecer radioluminiscencia de la interfase cemento-hueso, valorable cuando es mayor de 2 mm, osteólisis periprotésica y modificaciones de los elementos del implante. Estas alteraciones son similares a las observadas en el aflojamiento aséptico, pero su precocidad de aparición es sugestiva de ICT. La presencia de reacción periostal es un signo más específico de infección3,7. La gammagrafía ósea con 99mTc difosfonato de metileno (MDP) no es valorable durante el primer año poscirugía y, en general, es una prueba con escasa especificidad3. La gammagrafía de referencia es la de leucocitos marcados con 111In, con una sensibilidad del 80%, pero en las prótesis no cementadas la captación de la médula ósea desplazada ocasiona falsos positivos. Su especificidad mejora si se realiza conjuntamente con 99mTc con coloide de sulfuro BMS que sólo es captado por la médula ósea (sensibilidad el 80%, especificidad el 94%)26; con todo, un número significativo de casos no son detectados (fig. 4). Entre las técnicas de reciente aparición destacan la gammagrafía con anticuerpos antigranulocitos (99mTc con anticuerpos monoclonales anti-NCA-90) y la tomografía por emisión de positrones con fludeoxiglucosa 18F, pero no aportan ventajas significativas3,6,7. La tomografía computarizada (TC) y la resonancia magnética (RM) no son útiles para excluir la infección protésica (tabla 2).
A) Gammagrafía con 99Tc en un paciente intervenido de prótesis de cadera derecha 2 años antes: hipercaptación cadera derecha: B) Gammagrafía con leucocitos marcados con In en el mismo paciente: hipercaptación discreta en la misma área. C) Gammagrafía con sulfuro coloidal en el mismo paciente: hipercaptación discreta en la misma área. Diagnóstico gammagráfico: no sugestivo de infección protésica, por concordancia de la hipercaptación de leucocitos marcados y sulfuro coloidal. Diagnóstico final del paciente: infección protésica (falso negativo de la gammagrafía).
Sensibilidad y especificidad de las diferentes pruebas diagnósticas en las infecciones crónicas de prótesis articulares
| Pruebas | Sensibilidad (%) | Especificidad (%) | VPP (%) | VPN (%) |
| Preoperatorias | ||||
| Hematológicas | ||||
| VSG | 80 | 60-70 | 58 | 95 |
| PCR* | 96 | 92 | 74 | 99 |
| VSG y PCR* | > 90 | > 90 | 83 | 99 |
| Imagen | ||||
| Gammagrafía 99Tc | 100 | 5-23 | 30 | 100 |
| Gammagrafía Leu 111In | 80 | 60 | – | – |
| Gammagrafía Leu 111In + 99Tc sulfuro coloidal** | 80 | 94 | – | – |
| PET | 90 | 55-89 | – | – |
| Muestras articulares | ||||
| Líquido articular-Citología | 94-100 | 88-98 | 91 | 90 |
| Líquido articular-Cultivo*** | 45-86 | 88-97 | 67 | 98 |
| Biopsia articular-Cultivo*** | 70-85 | > 90 | 70 | 94 |
| Operatorias | ||||
| Cortes congelados (5-10 PMN/cc) | 67-80 | > 90 | 74 | 96 |
| Cultivo positivo | 65-94 | 97 | 77 | 99 |
Leu In: leucocitos marcados con indio; PCR: proteína C reactiva; PET: tomografía por emisión de positrones; PMN: polimorfonucleares; Tc: tecnecio; VPN: valor predictivo negativo; VPP: valor predictivo positivo; VSG: velocidad de sedimentación globular.
Los cultivos de exudado de fístula tienen una dudosa Habilidad3, excepto en fístulas de corta evolución y aislamiento de S. aureus. La artrocentesis es un procedimiento que hay que considerar cuando se sospecha ICT. La punción de la cadera debe hacerse bajo control radiológico y puede ser útil la inyección de suero salino en la cavidad articular previa a la aspiración. El líquido articular debe remitirse para tinción de Gram, cultivo y recuento celular. El punto de corte diferencial respecto del aflojamiento aséptico se estableció en más de 1.700 leucocitos/μl o más del 65% de polimorfonucleares en un reciente estudio, muy por debajo del habitualmente utilizado en el diagnóstico de artritis séptica (sensibilidad del 94-97%, especificidad del 88-98%)27; otros lo han situado en más de 3.000 leucocitos/μl25. La sensibilidad de la tinción de Gram es inferior al 25% y la del cultivo oscila según las series (45-86%). Por el contrario, la especificidad es elevada (88-97%), si se selecciona el grupo de pacientes con alta sospecha de infección24. Algunos autores prefieren, por su mayor sensibilidad, el cultivo de la biopsia sinovial realizada en quirófano bajo control radioscópico. Incluso en los casos con un diagnóstico claro de infección, se aconseja intentar hacer un diagnóstico microbiológico prequirúrgico, ya que permite preparar un espaciador impregnado con un antibiótico adecuado y un tratamiento específico en el postoperatorio inmediato; a veces, la presencia de una bacteria multirresistente comporta una modificación del planteamiento quirúrgico7.
Muestras articulares quirúrgicasLa confirmación diagnóstica se establece mediante la observación intraoperatoria de signos macroscópicos de infección periimplante, los estudios histológicos para visualización directa de leucocitos y el aislamiento de bacterias en muestras quirúrgicas apropiadas obtenidas en distintas localizaciones alrededor de la prótesis3,22–25. El punto de corte diferencial entre ICT y aflojamiento de la prótesis se ha establecido en más de 5-10 polimorfonucleares por campo en muestras histológicas intraoperatorias (sensibilidad del 67-80%), criterio no valorable en pacientes con enfermedades inflamatorias crónicas. El grado de inflamación puede variar en un mismo paciente según las áreas3,7,23.
Los cultivos de las muestras quirúrgicas son el procedimiento diagnóstico de referencia, aunque la detección frecuente de falsos negativos y positivos es inherente a la ICT22. A menudo, la infección es polimicrobiana y los cultivos detectan sólo una parte de la población bacteriana residente en las biocapas. La infección es parcheada, causada por bacterias incluidas mayoritariamente en biopelículas, con un inóculo bajo y microorganismos de difícil crecimiento, presencia de SCV y bacterias intracelulares3,16,22; además, los microorganismos responsables pueden ser contaminantes habituales, lo que dificulta su interpretación22. La observación de falsos negativos se relaciona con la toma previa de antibióticos, por lo que se aconseja suspender la antibioterapia con un intervalo mínimo de dos semanas antes de la intervención3,7,24. Así, han de obtenerse entre 4 y 6 muestras intraoperatorias para cultivo22, incluyendo: punción de la articulación antes de abrirla, membrana sinovial y biopsia ósea periarticular, material periprotésico, y si se retira la prótesis, muestras de las cavidades endomedular y cotiloidea. No se aconseja utilizar torundas, pues es preferible inocular las muestras líquidas en un frasco de hemocultivos tipo Bactec® y las sólidas se deben remitir al laboratorio lo antes posible en un frasco estéril. Han de utilizarse cultivos especiales en medio aerobio y anaerobio, incluyendo medios líquidos enriquecidos, incubados un mínimo de 7 días, para recuperar algunos microorganismos con requerimientos nutricionales o de crecimiento tardío3,22,24. La sensibilidad de los cultivos intraoperatorios en estas condiciones es del 65-94%, pero puede incrementarse si se emplea un medio líquido de transporte28. También se ha reportado el aumento de rentabilidad del cultivo del implante mediante su previa sonicación29.
En casos con ausencia de signos clínicos de infección y negatividad del cultivo estándar, catalogados como "aflojamiento aséptico", se ha demostrado la presencia de bacterias, si bien no se conoce con qué frecuencia ocurre y en qué medida éstas contribuyen al fallo del implante.
En los últimos años se han desarrollado técnicas para la identificación bacteriana distintas al cultivo convencional, de las que todavía no se dispone de experiencia suficiente, pero que abren un nuevo paradigma de futuro en la identificación microbiológica de las biocapas30,31. Se han de destacar entre los métodos moleculares la reacción en cadena de la polimerasa universal 16S (rDNSA, rRNA) y la reacción en cadena de la polimerasa a tiempo real (RT-PCR). Entre los métodos microscópicos, el de inmunofluorescencia (IFM) parece ser el más apropiado y actualmente disponible no basado en el cultivo, y se está trabajando para simplificarlo. Una prueba de IFM rápida capaz de detectar la infección durante el procedimiento quirúrgico sería un gran soporte para elegir el tratamiento más adecuado. También se ha descrito un método serológico eficaz mediante ELISA inmunoglobulina G (IgG) anti-lipoteicoico31.
Infección hematógena agudaLos hemocultivos tienen un papel fundamental en el diagnóstico etiológico de estas infecciones. Para documentar la afectación de la prótesis en el contexto de una sepsis pueden ser útiles las pruebas de imagen, como la gammagrafía con galio o leucocitos marcados o la ecografía o la TC para objetivar la presencia de líquido articular, pero finalmente es el estudio del líquido articular, en su aspecto macroscópico, celularidad y cultivo, mediante artrocentesis, el que permite la confirmación diagnóstica.
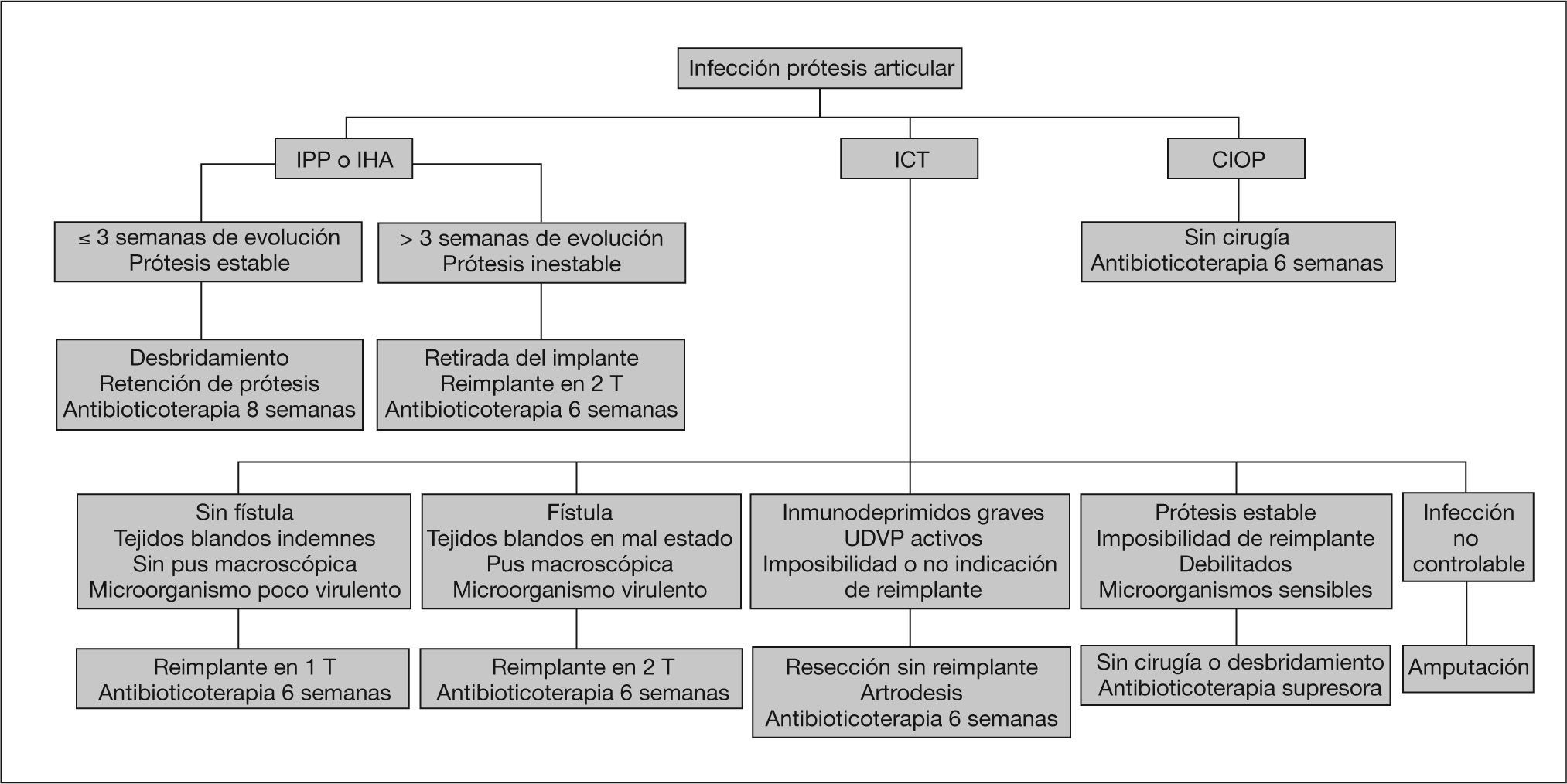
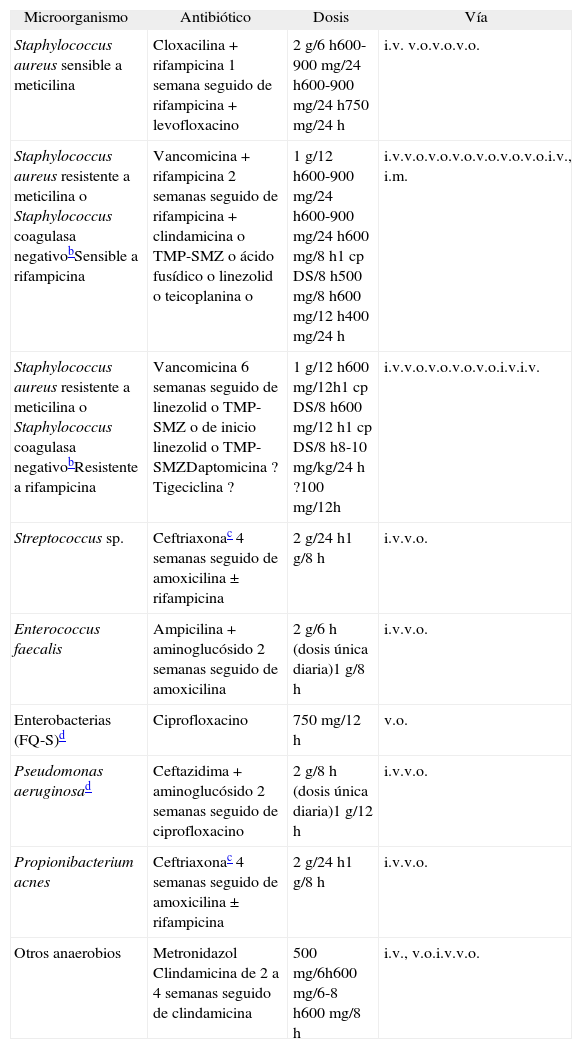
TratamientoEn una gran mayoría de infecciones protésicas se requiere un tratamiento combinado médico-quirúrgico con desbridamiento o retirada de la prótesis y antibioticoterapia para lograr la erradicación de la infección. La precocidad terapéutica es un elemento decisivo en la posibilidad de salvar la artroplastia1–3,32,33 (tabla 3).
Tratamiento antibióticoa de los microorganismos causantes de infección de prótesis articular
| Microorganismo | Antibiótico | Dosis | Vía |
| Staphylococcus aureus sensible a meticilina | Cloxacilina + rifampicina 1 semana seguido de rifampicina + levofloxacino | 2 g/6 h600-900 mg/24 h600-900 mg/24 h750 mg/24 h | i.v. v.o.v.o.v.o. |
| Staphylococcus aureus resistente a meticilina o Staphylococcus coagulasa negativobSensible a rifampicina | Vancomicina + rifampicina 2 semanas seguido de rifampicina + clindamicina o TMP-SMZ o ácido fusídico o linezolid o teicoplanina o | 1 g/12 h600-900 mg/24 h600-900 mg/24 h600 mg/8 h1 cp DS/8 h500 mg/8 h600 mg/12 h400 mg/24 h | i.v.v.o.v.o.v.o.v.o.v.o.v.o.i.v., i.m. |
| Staphylococcus aureus resistente a meticilina o Staphylococcus coagulasa negativobResistente a rifampicina | Vancomicina 6 semanas seguido de linezolid o TMP-SMZ o de inicio linezolid o TMP-SMZDaptomicina ?Tigeciclina ? | 1 g/12 h600 mg/12h1 cp DS/8 h600 mg/12 h1 cp DS/8 h8-10 mg/kg/24 h ?100 mg/12h | i.v.v.o.v.o.v.o.v.o.i.v.i.v. |
| Streptococcus sp. | Ceftriaxonac 4 semanas seguido de amoxicilina ± rifampicina | 2 g/24 h1 g/8 h | i.v.v.o. |
| Enterococcus faecalis | Ampicilina + aminoglucósido 2 semanas seguido de amoxicilina | 2 g/6 h (dosis única diaria)1 g/8 h | i.v.v.o. |
| Enterobacterias (FQ-S)d | Ciprofloxacino | 750 mg/12 h | v.o. |
| Pseudomonas aeruginosad | Ceftazidima + aminoglucósido 2 semanas seguido de ciprofloxacino | 2 g/8 h (dosis única diaria)1 g/12 h | i.v.v.o. |
| Propionibacterium acnes | Ceftriaxonac 4 semanas seguido de amoxicilina ± rifampicina | 2 g/24 h1 g/8 h | i.v.v.o. |
| Otros anaerobios | Metronidazol Clindamicina de 2 a 4 semanas seguido de clindamicina | 500 mg/6h600 mg/6-8 h600 mg/8 h | i.v., v.o.i.v.v.o. |
Las infecciones polimicrobianas pueden requerir combinaciones diversas y algunos antibióticos de espectro amplio como amoxicilina-ácido clavulánico, piperacilina-tazobactam o carbapenímicos pueden estar indicados.
cp DS: comprimido de doble dosificación; FQ-S: sensible a fluoroquinolonas; i.v.: intravenoso; i.m.: intramuscular; TMP-SMZ: trimetoprima-sulfametoxazol; v.o.: oral.
Las infecciones por Staphylococcus coagulasa negativos a menudo se deben a varias cepas con diferente sensibilidad; ello resta fiabilidad al antibiograma, si no se realiza un "arrastre" de las cepas de las placas. Un tratamiento de espectro restringido comporta cierto riesgo de seleccionar cepas resistentes inicialmente no detectadas.
En presencia del cuerpo extraño, los antibióticos son eficaces frente a las bacterias planctónicas de las biocapas más superficiales o las que se desprenden en el medio y a menudo controlan los síntomas inflamatorios durante el tratamiento, pero esta eficacia es muy limitada frente a la población sesil de las biocapas profundas y los síntomas reaparecen al suprimirlos o poco tiempo después12–15. Con frecuencia, la infección no se cura hasta que no se retira el material protésico, hecho que facilita mucho la acción antibiótica. Sin embargo, el objetivo prioritario del tratamiento es curar la infección, salvando la artroplastia, lo cual puede intentarse en las IPP, las IHA y las formas CIOP1,3,7,19–21,33. En estas situaciones la antibioticoterapia debe dar respuesta a una máxima exigencia. Es indispensable la identificación de los microorganismos responsables para proporcionar una antibioticoterapia dirigida y administrada durante largos períodos. Los criterios farmacodinámicos habituales, referidos a las infecciones bacterianas en estado planctónico, no son aplicables a estas infecciones. Se deben alcanzar altas concentraciones en el interior de las biocapas, mantener una buena actividad frente a las bacterias estacionarias y ser poco tóxica en pautas prolongadas. La importancia relativa de estos factores ha sido tratada ya en otro capítulo de esta serie12 y es un tema de controversia, pero podría depender del tipo de antibiótico y del microorganismo; el parámetro que se correlaciona mejor con la eficacia terapéutica es el cociente de área bajo la curva/concentración bactericida mínima (AUC/MBC) de las bacterias en fase estacionaria3,7,11. Apenas existen ensayos controlados, prospectivos, con criterio de evidencia sobre los tratamientos más idóneos, incluyendo tipo de antibiótico, vía y tiempo de administración.
La rifampicina es considerada el antibiótico de elección para el tratamiento de la infección de prótesis articular estafilocócica, por su aceptable actividad bactericida frente a las bacterias en fase estacionaria, su actividad intracelular y su capacidad de difusión en las biocapas. No obstante, el rápido desarrollo de resistencias obliga a utilizarla siempre en combinación con otro agente antiestafilocócico. Entre estas combinaciones, la pauta oral prolongada de rifampicina-fluoroquinolonas ha mostrado gran eficacia y buena tolerabilidad, en modelos animales y en la infección humana, aunque existen pocos estudios, la mayoría no comparativos, que incluyen un número reducido de pacientes34,35. La dosis de rifampicina, 600-900 mg/día, no está bien establecida y, según criterios farmacodinámicos, parece preferible su administración en monodosis en ayunas36. Estas pautas han utilizado ciprofloxacino u ofloxacino en dosis convencionales, con una actividad reducida frente a estafilococos en fase estacionaria y cuyo principal papel sería evitar el desarrollo de resistencias a rifampicina, la cual prevendría, a su vez, la aparición de resistencias a las quinolonas. La rifampicina ejerce un efecto antagonista sobre las fluoroquinolonas frente a las bacterias en fase planctónica, pero no en la fase estacionaria y ello no tendría significación clínica en este tipo de infecciones. En los últimos años se ha recomendado incluir levofloxacino en dosis elevadas (750 mg/día) en esta combinación, por su actividad in vitro y propiedades farmacodinámicas, pero la información clínica es escasa3,36,37. Levofloxacino a estas dosis ha mostrado una gran actividad bactericida frente a S. aureus en fase estacionaria e incluso ha sido más eficaz que rifampicina en un modelo experimental de cuerpo extraño38. La posible importancia clínica del antagonismo de rifampicina sobre la eficacia de las fluoroquinolonas con elevada actividad frente a bacterias en fase estacionaria debería ser evaluada, y también la dosis más apropiada de levofloxacino en estas pautas de combinación.
De una manera empírica, estas pautas se han utilizado durante períodos muy prolongados, inicialmente de 6-9 meses34 y más recientemente acortados a 3 meses para las prótesis de cadera y a 6 para las de rodilla3,35. La infección de prótesis de rodilla tiene un pronóstico peor que la de cadera34,35, pero no hay evidencia del beneficio de prolongar especialmente la pauta antibiótica en esta localización; el período mínimo necesario de tratamiento no se conoce. Se ha sugerido que la monitorización de la PCR hasta su normalización podría ser una buena guía para fijar la duración de la antibioticoterapia36, pero debería ser confirmado. La mayoría de S. aureus sensibles a meticilina (SASM) lo son también a quinolonas, pero el 50% de los SCN y la mayoría de S. aureus resistente a la meticilina (SARM) en España son resistentes, lo cual debe tenerse en cuenta en los tratamientos empíricos. Las combinaciones de rifampicina con clindamicina, linezolid, cotrimoxazol o ácido fusídico pueden ser alternativas eficaces según los casos3,7.
Los antibióticos betalactámicos (cloxacilina y cefalosporinas) y los glucopéptidos, que actúan en la pared bacteriana en fase exponencial, han sido los considerados de elección frente a los cocos grampositivos, pero requieren vía parenteral y pierden gran parte de su actividad bactericida en el seno de las biocapas12,14,15. Linezolid por su actividad in vitro, frente a S. aureus y SCN sensibles y resistentes a la meticilina, su biodisponibilidad oral del 100% y su alta penetración tisular y en las biocapas, es una alternativa en la infección protésica estafilocócica12. No obstante, no tiene buena actividad bactericida frente a estafilococos ni en fase planctónica ni en fase estacionaria y no fue eficaz en monoterapia en un modelo de infección de cuerpo extraño por SASM38. No se dispone de ensayos clínicos prospectivos en estas infecciones, pero los resultados de algunos estudios abiertos han sido satisfactorios39. Su toxicidad hematológica y neurológica puede suponer una limitación para su administración prolongada. El papel de la combinación dalfopristina-quinupristina y el de antibióticos de reciente adquisición, como la tigeciclina y la daptomicina, esta última con una notable actividad bactericida frente a bacterias en fase estacionaria, está en estudio. Actualmente, no está bien definido el tratamiento más adecuado para las infecciones de prótesis articulares por SARM, cuando no se puede utilizar rifampicina.
En las infecciones por enterobacterias y P. aeruginosa, las quinolonas son los antibióticos de elección, por su capacidad de difusión, su gran efecto bactericida sobre BGN en fase estacionaria, su actividad intracelular y la posibilidad de administración oral prolongada12,14,15. Su uso empírico ha de tener en cuenta la elevada tasa de resistencia de Escherichia coli y otros BGN. Ciprofloxacino (750 mg/12 h) es el más utilizado; en infecciones por P. aeruginosa se aconseja aumentar la dosis (1 g/12 h) y utilizar una combinación antibiótica las primeras semanas, para disminuir el riesgo de aparición de resistencias. Los aminoglucósidos no son eficaces en las infecciones protésicas ya que pierden gran parte de su actividad bactericida en el seno de las biocapas12,15.
La importancia de la adherencia bacteriana y de la formación de biocapas en las infecciones por otros microorganismos como Streptococcus spp., E. faecalis y P. acnes ha sido poco estudiada. Los betalactámicos son los antibióticos de elección, a pesar de que globalmente no se consideran eficaces en el seno de las biocapas2,3,40,41. La posible aportación de la rifampicina no se conoce, aunque algunos autores han preconizado su empleo41. El tratamiento de las infecciones graves por E. faecalis, tipo endocarditis, requiere de una combinación antibiótica bactericida, pero no existe información del comportamiento antibiótico en las biocapas de las infecciones protésicas por estos microorganismos. Las fluoroquinolonas son poco eficaces frente a biocapas de P. acnes.
El problema de la antibioticoterapia puede verse incrementado en los casos no raros de IPP polimicrobianas, en los que el diseño de la pauta escogida debe considerar simultáneamente varias de las dificultades expuestas en los párrafos precedentes.
En algunos pacientes con ICT, no tributarios de cirugía de recambio o explante protésico por sus condiciones generales, puede intentarse una antibioticoterapia supresiva de larga duración, o incluso de por vida, para aliviar la situación clínica42 (fig. 5). Sus indicaciones y resultados no están bien establecidos, pero son requisitos mínimos el disponer de un diagnóstico microbiológico de fiabilidad y de antibióticos con buena tolerabilidad y biodisponibilidad oral. Raramente se consigue la erradicación microbiana.
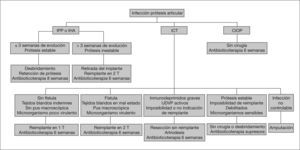
Algoritmo de tratamiento según los tipos de infección de prótesis articular y su contexto clínico. Según referencias3,7 (modificadas) y la opinión de los autores.
UDVP: usuarios de drogas por vía parenteral; CIOP: cultivos intraoperatorios positivos; IHA: infección hematogénea aguda; ICT: infección crónica tardía; IPP: infección posquirúrgica precoz; T: tiempo.
En las IPP y en las IHA es razonable plantear inicialmente un desbridamiento con retención de la prótesis, si ésta no se encuentra aflojada, los tejidos blandos están en condiciones, disponemos de antibióticos efectivos para la microbiología responsable y el cuadro clínico no supera las 3 semanas de evolución3,7,41,43 (fig. 5). Así la probabilidad de curar estas infecciones sin retirar la prótesis se relaciona fundamentalmente con el tiempo de evolución de la infección y, por tanto, con el grado de desarrollo de las biocapas bacterianas, que "envejecen" rápidamente y se vuelven refractarias a la antibioticoterapia13. Algunos autores utilizan un período posquirúrgico algo más prolongado, 2 o 3 meses, para definir la población con IPP3,7, pero la clasificación de Tsukayama et al1,21 parece más adecuada para enfatizar la necesidad de un tratamiento precoz. Algunos pacientes con IPP se diagnostican más allá del mes posterior a la cirugía, sin que por ello deban clasificarse como ICT. De hecho, a menudo es difícil precisar el tiempo de evolución clínica, ya que el inicio del dolor o la aparición de problemas en la herida quirúrgica pueden no resultar evidentes. Las tasas de curación con esta práctica quirúrgica han sido inferiores al 50% en series retrospectivas32,44, pero superiores al 70% en las prospectivas, con utilización óptima de la antibioticoterapia1,3,7,19,36. El tipo de desbridamiento quirúrgico es decisivo en las posibilidades de curar la infección sin retirar la prótesis y debe ser exhaustivo e incluir el cambio de polietileno, con lo que se puede acceder a todos los recovecos articulares1. En casos de prótesis no cementadas, se puede aprovechar el procedimiento quirúrgico para retirar temporalmente los componentes protésicos, ampliar el desbridamiento y reimplantarlos de nuevo tras su esterilización. Algunos autores fijan en pocos días de evolución clínica el límite para obtener una buena tasa de éxitos32,33. Los resultados dependen también de la dualidad microorganismo responsable-oferta antibioticoterapia, con un peor pronóstico para las infecciones por S. aureus, y en especial por SARM33,36,37, y un pronóstico más favorable para las debidas a estreptococos y enterobacterias19,20,33,40.
En las ICT, la retirada de la prótesis se considera necesaria, seguida de un recambio en uno o dos tiempos o de una artrodesis. Los resultados obtenidos con estos procedimientos quirúrgicos son difícilmente comparables, ya que se basan en estudios retrospectivos, con pautas heterogéneas de antibioticoterapia2,3,7,41,45. Su elección depende, en parte, de las diferentes escuelas quirúrgicas, pero la cirugía en dos tiempos ha sido la principal referencia6,46. El recambio de la prótesis en dos tiempos incluye la retirada inicial de la prótesis, colocación de un espaciador de cemento impregnado con antibióticos, antibioticoterapia sistémica durante 6 semanas y retirada del espaciador y colocación de una nueva prótesis en el intervalo de pocas semanas. Es el tratamiento más utilizado, con una curación cercana al 90% y el procedimiento de elección en infecciones crónicas con tejidos blandos dañados, presencia de pus, fístulas o microorganismos de difícil erradicación3,7,46. Algunos autores prefieren prescindir del espaciador en las infecciones producidas por microorganismos multirresistentes3,7. La exigencia a la antibioticoterapia en el curso de este procedimiento con retirada del material protésico es menor que en el caso de las infecciones tratadas sólo con desbridamiento quirúrgico y retención de la prótesis. Los espaciadores impregnados de antibiótico permiten mantener un menor acortamiento de la extremidad y un grado de movilidad. La antibioticoterapia local puede contribuir a la erradicación microbiana, pero tiene como principal función el impedir la colonización secundaria del espaciador entendido como cuerpo extraño47. Con diferencia, el antibiótico más utilizado en el cemento ha sido gentamicina, que se libera en el medio alcanzando niveles elevados durante semanas, con buena tolerabilidad; no obstante, hoy en día muchas cepas de SCN son resistentes a gentamicina. Aunque se han empleado otros antibióticos, la alternativa más frecuente a gentamicina ha sido la vancomicina, por su perfil de actividad frente a SCN, si bien su liberación en el medio se considera irregular y, a menudo, insatisfactoria. Con cierta frecuencia se aíslan SCN en muestras habituales tomadas en el segundo tiempo quirúrgico, en pacientes que han seguido una buena evolución clínica; estos microorganismos suelen ser resistentes a los antibióticos del espaciador y sistémicos utilizados en los pacientes. Aunque algunos autores han considerado estos casos infecciones persistentes, es probable que en muchos de ellos se trate de superinfecciones48. La importancia clínica de estos hallazgos y el papel del espaciador como factor predisponente para estas colonizaciones debería ser evaluado. La práctica de una punción articular preoperatoria previa al reimplante debería reservarse para los casos con una evolución clínica insatisfactoria, aquéllos con persistencia de cifras elevadas de PCR o los causados por microorganismos virulentos de difícil tratamiento como SARM, SCV de S. aureus, y P. aeruginosa multirresistente3,7,16.
El recambio en un tiempo consiste en la colocación de una segunda prótesis en el mismo tiempo quirúrgico en que se retira la infectada y permite un más fácil reimplante y una recuperación funcional más rápida. Algunos estudios refieren tasas de curación del 86-100%, pero su eficacia es tema de controversia. Debería reservarse para casos con buenas condiciones quirúrgicas locales y debidos a microorganismos poco virulentos3,46,49. Si bien se ha considerado condición sine qua non para su uso la fijación con cemento con antibióticos, esto ha sido recientemente cuestionado49.
Los pacientes con CIOP no suelen requerir una nueva intervención quirúrgica y siguen una buena evolución con una pauta antibiótica de unas 6 semanas, aunque no está bien establecido el período mínimo necesario de antibioticoterapia50.