La incidencia anual de tuberculosis (TB) humana por Mycobacterium bovis ha disminuido considerablemente en los países industrializados desde inicios del sigloXX. El objetivo de este estudio fue conocer las características epidemiológicas, clínicas y microbiológicas de esta enfermedad en Castilla y León (CyL).
MétodosEstudio retrospectivo de los casos de TB por M. bovis de CyL en un periodo de 10 años, comparando la epidemiología, los factores de riesgo y la evolución entre las formas pulmonares (TBP) y extrapulmonares (TBEP).
ResultadosSe recopilaron 75 casos de TB por M. bovis: 45 TBP y 31 TBEP. La incidencia acumulada de TB por M. bovis fue de 0,3 casos por 100.000 habitantes. Se mantuvo estable entre el primer y el segundo quinquenio (0,27 vs. 0,33, p=0,656), a pesar del descenso de la incidencia global de la TB (13,58 vs. 10,71, p<0,0001). La edad media fue de 66,2+21,3 años, principalmente varones (63%) y nacidos en España (92%). TBP fue significativamente más frecuente en varones, mayores de 66 años, con inmunosupresión o fumadores. La mortalidad fue del 9%, asociada a la edad, a la inmunosupresión o a un tratamiento diferente al recomendado por la OMS.
ConclusionesLa incidencia de TB por M. bovis en CyL es superior a la de España y otros países europeos, y se mantuvo estable a pesar del descenso de la TB por MTC. Afectó mayoritariamente a población nacida en España que vivía en zonas rurales y con elevada media de edad.
The annual incidence of tuberculosis (TB) from Mycobacterium bovis in humans has considerably declined in industrialised countries since the early twentieth century. The objective of this study was to determine the epidemiological, clinical and microbiological characteristics of patients with this illness in Castile and León (CyL).
MethodsRetrospective study of all M. bovis TB cases in CyL over a 10-year period, comparing the risk factors, the epidemiology and the clinical course between pulmonary (PTB) and extrapulmonary TB (EPTB).
Results75 cases of TB were due to M. bovis: 45 PTB and 31 EPTB. The annual incidence of TB due to M. bovis was 0.3 cases per 100,000. It remained stable between the first and second five-year period (0.27 vs. 0.33, p=0.656). However, the overall incidence of TB fell in both five-year periods (13.58 vs. 10.71, p<0.0001). The mean age was 66.2+21.3 years, mainly men (63%) and Spanish patients (92%). PTB was significantly more frequent in men, aged over 66 years, with immunosuppressive conditions or who were smokers. Mortality was 9%, associated with higher age, immunosuppression or treatment different from that recommended by the WHO.
ConclusionsThe incidence of M. bovis TB in CyL was higher than that for Spain and for other European countries, and remained stable despite the decreased the TB due to MTC. It affected mostly Spanish-born patients who lived in rural areas and with a high mean age.
Mycobacterium bovis, miembro del complejo Mycobacterium tuberculosis (MTC), es un patógeno zoonótico que infecta principalmente al ganado vacuno. Los humanos se infectan por inhalación de aerosoles contaminados con esta micobacteria, consumo de productos lácteos no pasteurizados o por contacto continuo y cercano con animales infectados1. La transmisión de persona a persona ha sido ocasionalmente descrita tanto en pacientes inmunocompetentes como en inmunodeprimidos2,3. Las especies de MTC se agrupan en 8 linajes estrechamente relacionadas filogenéticamente. La clínica, radiología o patología de las principales especies del MTC que causan tuberculosis (TB) en humanos —M. tuberculosis, Mycobacterium africanum y M. bovis— es indistinguible1. Sin embargo, su diferenciación es de gran interés epidemiológico y terapéutico. Históricamente, la separación taxonómica se basaba en las características fenotípicas, resistencia antibiótica, distribución geográfica y afinidad por el hospedador1, siendo sustituidas por los métodos moleculares, más rápidos, precisos y específicos4,5.
La incidencia anual de casos de M. bovis en humanos ha disminuido considerablemente en los países industrializados desde inicios del sigloXX, debido a las campañas de erradicación en animales. Actualmente, representa menos de un 2% de todos los casos de TB, aunque puede haber áreas y poblaciones con una mayor prevalencia6-8. La mayoría de los casos diagnosticados son atribuidos a reactivación de una infección latente adquirida antes de la era de la pasteurización o bien adquirida en países no industrializados6-11.
La TB bovina ha sido endémica en la comunidad autónoma de Castilla y León (CyL), estando actualmente en fase de erradicación debido a la implantación del programa nacional de erradicación de la TB bovina desde el año 198512. La prevalencia de cabañas infectadas se ha reducido del 5,11% en 2006 al 1,93% en el 201513. Sin embargo, hay poca información de la importancia y evolución de la TB humana por M. bovis de esta comunidad. El objetivo de este estudio fue conocer las características epidemiológicas, clínicas y microbiológicas de la TB por M. bovis en CyL en función de la localización pulmonar y extrapulmonar, así como su comparación con la TB por MTC de los informes epidemiológicos de esta comunidad autónoma.
Materiales y métodosEstudio retrospectivo de todos los casos de TB por M. bovis recogidos en los sistemas de información del laboratorio (SIL) de los 14 hospitales públicos de CyL (comunidad autónoma integrada por 9 provincias y 14 Áreas de Salud) entre los años 2006 y 2015, ambos inclusive. Se consideró un solo aislamiento por paciente. Se excluyeron los pacientes con TB por M. bovis BCG. Los cultivos de las muestras se realizaron en cada hospital. La identificación fenotípica y/o genotípica y los estudios de sensibilidad antibiótica a los antituberculosos de primera línea se realizaron en los laboratorios de referencia de cada Área de Salud. Quince cepas (20%) fueron identificadas mediante las sondas de hibridación GenoType MTBC (HAIN Lifescience, Alemania). Cuarenta y cuatro cepas (59%) fueron identificas en el Centro Nacional de Micobacterias (Instituto de Salud CarlosIII, Majadahonda, Madrid, España) por el método genotípico descrito por Rodríguez et al.7, basado en la ampliación del gen gyrB y la detección de la región de diferencia 1 (RD1), así como la detección de la mutación C169G (H57D) en el gen pncA como otro elemento diferenciador de M. bovis y Mycobacterium caprae. En 16 cepas (21%), se consideró la monorresistencia a pirazinamida (PZA) como criterio principal de identificación de M. bovis, junto con otras características morfológicas y bioquímicas propias de esta especie1.
Se revisaron las historias clínicas de todos los pacientes con TB por M. bovis. Los datos demográficos, bacteriológicos, clínicos, factores de riesgo, tratamiento y evolución se recogieron en una base de datos diseñada para este estudio. Adicionalmente, se cuantificó el número total de casos confirmados de TB por Área de Salud para estimar la proporción de TB debida a M. bovis.
Los pacientes se agruparon en dos categorías en función de la localización: pulmonar (TBP) y extrapulmonar (TBEP). En esta última categoría se incluyeron pacientes con o sin afectación pulmonar concomitante y la TB pleural.
Los factores de riesgo incluidos en el estudio fueron: a) vida rural, pacientes que vivían en poblaciones inferiores a 2.000 habitantes o se dedicaban a la agricultura; b) contacto animal, personas con contacto directo con el ganado vacuno; c) viaje al extranjero, pacientes que procedían o habían viajado a un país endémico de TB; d) condiciones inmunosupresoras, comprende a los pacientes con enfermedad renal en estadio final o a trasplantados de órganos o con tratamientos inmunosupresores o con otras condiciones inmunosupresoras indicadas en la historia clínica excluyendo a los pacientes coinfectados con VIH o con diabetes mellitus; e) estatus VIH; f) diabetes mellitus; g) fumador, y h) sin factores de riesgo, pacientes que no presentaron ninguno de los factores anteriormente citados.
Los tratamientos se dividieron en dos categorías: a) tratamiento recomendado por la Organización Mundial de la Salud (OMS) para MTC con resistencia a PZA14 consistente en 2 meses de isoniazida (INH) y rifampicina (RIF) y etambutol (ETB), seguido de 7 meses de INH y RIF durante 2 meses y b) otros, que incluyen combinaciones de INH, RIF, ETB y PZA u otras asociaciones que contenían PZA o bien tratamientos cuya duración fue inferior o superior a los 9 meses.
La evolución de los pacientes se registró inicialmente como curación, fallecimiento, recaída o desconocido. Posteriormente, se reclasificaron en curación y fallecimiento para estudiar la influencia de varios factores de riesgo en la evolución.
Los resultados fueron analizados usando el programa SPSS (Statistical Package for Social Sciences, versión 20.0, SPSS Inc, Chicago, IL, EE.UU.). Las variables cualitativas fueron analizadas usando la prueba χ2 o el test exacto de Fisher y las variables cuantitativas mediante el test t de Student. Las diferencias se consideraron estadísticamente significativas si p<0,05.
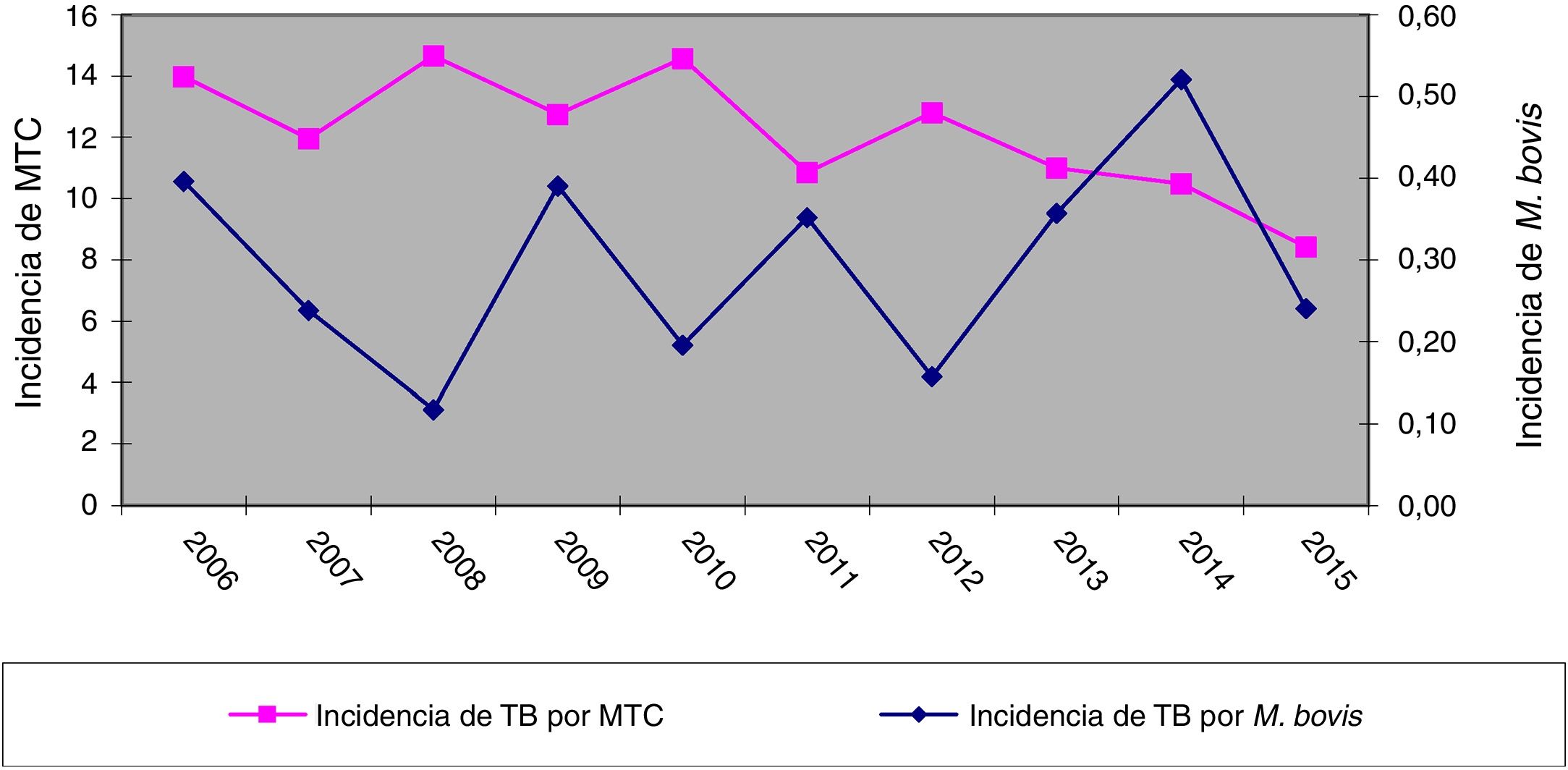
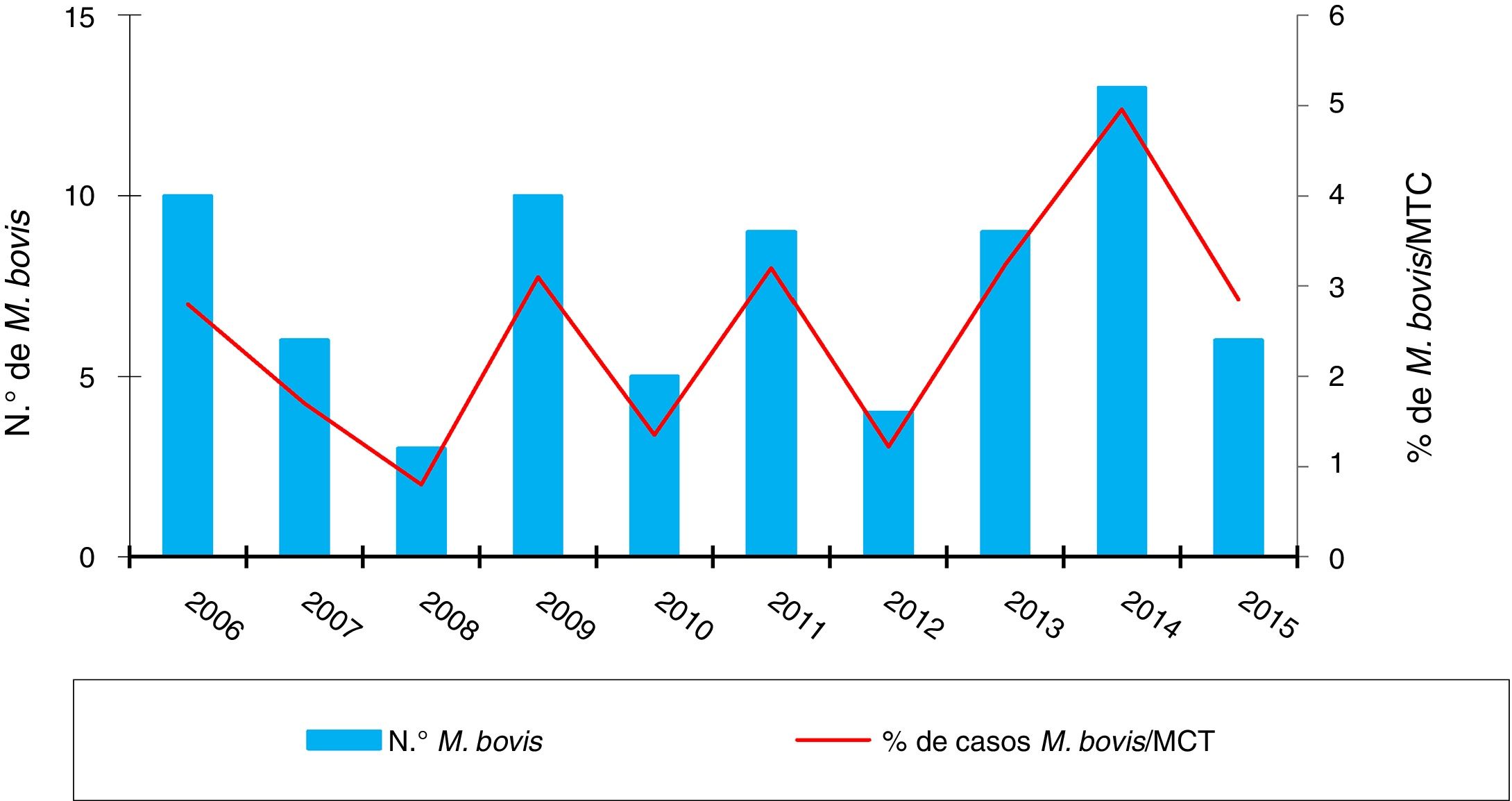
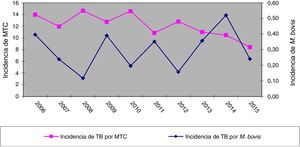
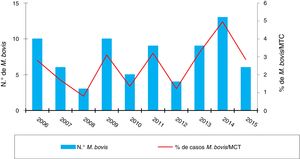
ResultadosEn los 10 años incluidos en el estudio se confirmaron 3.080 casos de TB en CyL, de los cuales 75 (2,43%) se debieron a M. bovis y 3 (0,10%) a M. caprae. La incidencia global de TB disminuyó significativamente entre el primer y el segundo quinquenio (13,58 vs. 10,71 casos por 100.000 habitantes, p<0,0001). En cambio, la incidencia atribuida a M. bovis se mantuvo estable (0,27 vs. 0,33 casos por 100.000 habitantes, p=0,656) (fig. 1). Como consecuencia, la proporción de TB por M. bovis con respeto al total de MTC presentó una tendencia creciente entre ambos quinquenios (1,8% vs. 2,85%, p=0,001), más debida a una disminución de la TB por MTC que a un incremento de la atribuida a M. bovis (fig. 2).
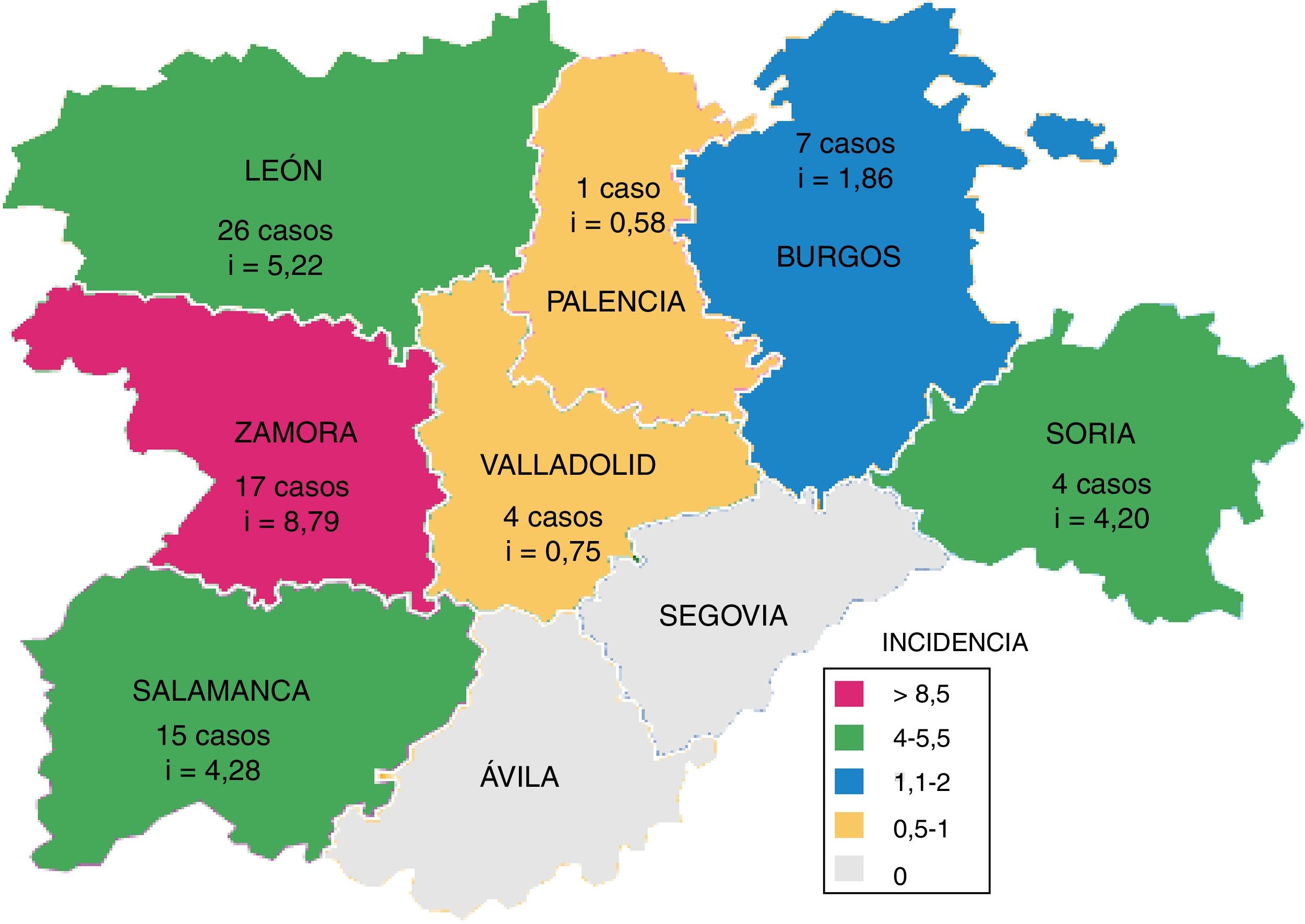
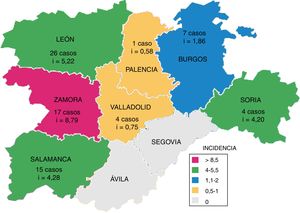
En la figura 3 se muestra el número de casos de TB por M. bovis y la incidencia acumulada por provincia, que fue significativamente superior en las provincias occidentales (León, Zamora y Salamanca; p=0,031).
En esta población predominó la TBP, 44 casos (59%). De los 31 pacientes que presentaron TBEP, 5 tuvieron además localización pulmonar. La TB diseminada (26%) y la linfática (26%) fueron las TBEP más frecuentes. El resto fueron ósea y/o articular (5 casos), cutánea (4 casos), genitourinaria (2 casos), pleural (un caso) y digestiva (un caso).
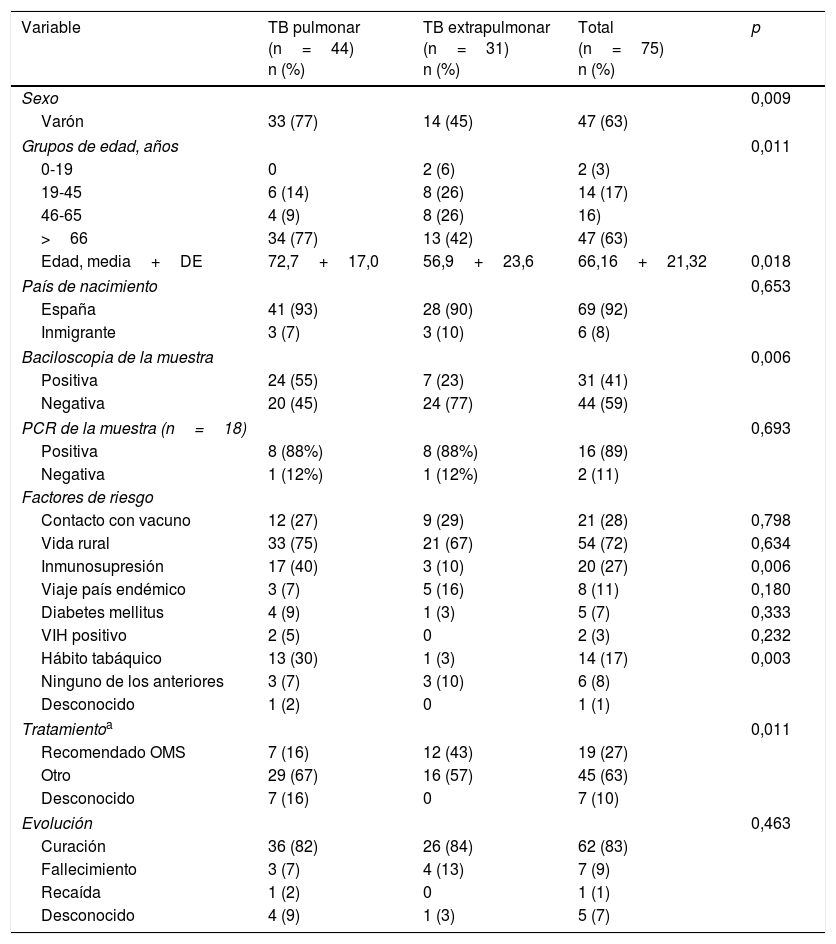
Las características epidemiológicas, clínicas y microbiológicas de la TB por M. bovis en función de la localización se muestran en la tabla 1. La TBP fue significativamente más frecuente en hombres y en pacientes con mayor media de edad. Únicamente hubo 2 casos de TB infantil, ambos niños habían nacido en España y habían viajado al país de sus progenitores (Marruecos). La mayoría de los pacientes habían nacido en España (92%), el resto procedía de Marruecos (3 casos), Rumania (un caso), Tailandia (un caso) y sin precisar (un caso). No se encontró asociación entre la localización y el lugar de procedencia del paciente (p=0,687). Los pacientes más bacilíferos presentaban TBP (p=0,006).
Características de la tuberculosis por Mycobacterium bovis pulmonar y extrapulmonar de Castilla y León. 2006-1015
| Variable | TB pulmonar (n=44) n (%) | TB extrapulmonar (n=31) n (%) | Total (n=75) n (%) | p |
|---|---|---|---|---|
| Sexo | 0,009 | |||
| Varón | 33 (77) | 14 (45) | 47 (63) | |
| Grupos de edad, años | 0,011 | |||
| 0-19 | 0 | 2 (6) | 2 (3) | |
| 19-45 | 6 (14) | 8 (26) | 14 (17) | |
| 46-65 | 4 (9) | 8 (26) | 16) | |
| >66 | 34 (77) | 13 (42) | 47 (63) | |
| Edad, media+DE | 72,7+17,0 | 56,9+23,6 | 66,16+21,32 | 0,018 |
| País de nacimiento | 0,653 | |||
| España | 41 (93) | 28 (90) | 69 (92) | |
| Inmigrante | 3 (7) | 3 (10) | 6 (8) | |
| Baciloscopia de la muestra | 0,006 | |||
| Positiva | 24 (55) | 7 (23) | 31 (41) | |
| Negativa | 20 (45) | 24 (77) | 44 (59) | |
| PCR de la muestra (n=18) | 0,693 | |||
| Positiva | 8 (88%) | 8 (88%) | 16 (89) | |
| Negativa | 1 (12%) | 1 (12%) | 2 (11) | |
| Factores de riesgo | ||||
| Contacto con vacuno | 12 (27) | 9 (29) | 21 (28) | 0,798 |
| Vida rural | 33 (75) | 21 (67) | 54 (72) | 0,634 |
| Inmunosupresión | 17 (40) | 3 (10) | 20 (27) | 0,006 |
| Viaje país endémico | 3 (7) | 5 (16) | 8 (11) | 0,180 |
| Diabetes mellitus | 4 (9) | 1 (3) | 5 (7) | 0,333 |
| VIH positivo | 2 (5) | 0 | 2 (3) | 0,232 |
| Hábito tabáquico | 13 (30) | 1 (3) | 14 (17) | 0,003 |
| Ninguno de los anteriores | 3 (7) | 3 (10) | 6 (8) | |
| Desconocido | 1 (2) | 0 | 1 (1) | |
| Tratamientoa | 0,011 | |||
| Recomendado OMS | 7 (16) | 12 (43) | 19 (27) | |
| Otro | 29 (67) | 16 (57) | 45 (63) | |
| Desconocido | 7 (16) | 0 | 7 (10) | |
| Evolución | 0,463 | |||
| Curación | 36 (82) | 26 (84) | 62 (83) | |
| Fallecimiento | 3 (7) | 4 (13) | 7 (9) | |
| Recaída | 1 (2) | 0 | 1 (1) | |
| Desconocido | 4 (9) | 1 (3) | 5 (7) | |
Los factores de riesgo más frecuentes en estos pacientes fueron vivir en un medio rural (72%) y tener contacto directo con ganado vacuno (28%). La predisposición a padecer TBP fue mayor en los pacientes fumadores y en los que tenían condiciones inmunosupresoras.
Setenta y cuatro de las cepas de M. bovis fueron monorresistentes a PZA y una cepa presentó resistencia a INH y PZA. Tan solo 19 pacientes (27%) recibieron el tratamiento recomendado por la OMS, siendo más frecuente en los pacientes con TBEP (p=0,011) y en los que curaron (p<0,001). Cuarenta y un pacientes (63%) evolucionaron satisfactoriamente con un tratamiento que o bien incluía PZA en los 2 primeros meses y/o bien la duración del tratamiento no fue de 9 meses. No se pudo conocer la evolución de 7 pacientes (10%) por cambio de Área de Salud o por falta de asistencia a la revisión.
La mortalidad global de estos pacientes fue del 9% (tabla 2): 4 pacientes murieron antes de iniciar el tratamiento y 3 durante el mismo. La mortalidad fue superior en varones, aunque no se encontraron diferencias significativas. Los pacientes fallecidos tenían una media de edad superior a los que se curaron y las condiciones inmunosupresoras estuvieron significativamente más presentes. Las enfermedades de base de estos 5 pacientes fallecidos fueron: diabetes (un caso), enfermedad renal en estadio terminal (un caso), cáncer rectal (un caso), enfermedad hematológica maligna (un caso) y EPOC grave tratado con corticoides (un caso).
Evolución de los pacientes con tuberculosis por Mycobacterium bovis
| Curación (n=63) | Fallecimiento (n=7) | p | |
|---|---|---|---|
| Sexo | 0,187 | ||
| Varón | 38 (60) | 6 (86) | |
| Edad, media+DE | 64,3+22,2 | 78,2+11,6 | 0,030 |
| Inmunosupresión | 12 (19) | 5 (71) | 0,002 |
| Tratamientoa | <0,001 | ||
| OMS | 16 (25) | 0 (0) | |
| Otro | 41 (65) | 3 (43) | |
En el decenio de 2006 al 20015, la incidencia media anual de casos confirmados de TB por M. bovis en CyL fue superior a la de España y a la de otros países europeos15. Igualmente, la proporción de casos por M. bovis con respecto al total de TB (2,43%) también fue superior a la de Asturias (1,4% en 2006-2014)16, a la global de España (1,9%, en 2004-2007)7, Holanda (1,4% en 1993-2007)6 o Reino Unido (1,5% en 2003)10. El riesgo de TB zoonótica en CyL puede ser mayor al de otras regiones, ya que es una importante región ganadera y el 26,4% de la población vive en zonas rurales.
En nuestra población, al igual que en otras regiones con bajas tasas de TB, los esfuerzos encaminados para la erradicación de la TB han contribuido a la disminución de la TB por M. tuberculosis, pero no han conseguido reducir la causada por M. bovis, indicando el diferente comportamiento de estas dos especies8,17. En este aspecto podría influir el hecho de que otros animales domésticos y salvajes pueden ser fuente de infección para el hombre1,10,18.
La mayor incidencia de casos humanos de TB por M. bovis se presentaron en las provincias occidentales de la comunidad, mientras que la mayor prevalencia de rebaños con TB bovina se localizan en el sur de CyL12,13. Esta disparidad puede ser debida a las diferencias en la detección de esta enfermedad en cada Área de Salud.
El predominio de la TBP es un hallazgo comparable al de otras poblaciones de nuestro entorno7,10,11, difiriendo de Holanda con un 59% de TBEP6. Históricamente, las principales localizaciones de la TB por M. bovis eran la digestiva y la linfática. La disminución de la incidencia de TBEP podría deberse a que la vía aérea sea la principal vía de trasmisión tras la generalización de la pasteurización de la leche10,17 y a la mayor dificultad diagnóstica, lo que acaba reduciendo la sospecha clínica hasta estadios avanzados de la enfermedad19,20.
La TBEP fue más frecuente en mujeres, al igual que en otros estudios de TB por M. bovis7,16 o por M. tuberculosis20. Las causas de este hecho no son bien conocidas, algunos autores lo han asociado a factores socioeconómicos, a las diferentes vías de infección en cada sexo, a factores hormonales o a la inmunidad celular6,21.
La edad avanzada de los pacientes y la presencia de condiciones inmunosupresoras sugieren la reactivación de una infección antigua previa a la era de la pasteurización. Así, en regiones donde la TB bovina ha sido prácticamente erradicada, los casos residuales que aparecen en pacientes de mayor edad se asocian a reactivación de una lesión durmiente, mientras que si la TB es en pacientes jóvenes se considera una infección primaria9,21. Sin embargo, en el estudio de Palacios et al.16 un 47% de los genotipos en cepas humanas eran comunes a los del ganado vacuno, sugiriendo una reciente transmisión independiente de la edad. Los espoligotipos más frecuentes en las cepas de TB bovina de CyL son SB0121, SB0134 y SB033922. Los 2 primeros se han identificado en humanos y en el ganado de Asturias16 e Inglaterra11. Lamentablemente, la falta de tipado de nuestras cepas no nos ha permitido extraer conclusiones en este sentido.
La diabetes mellitus ha sido fuertemente relacionada con la TBP20, y el VIH con la TBEP23. Sin embargo, en nuestro estudio no se encontró tal asociación, probablemente debido al escaso número de pacientes con estos factores de riesgo.
Aunque el 63% de nuestros pacientes no fueron tratados según la recomendación de la OMS, su evolución fue satisfactoria. La baja resistencia de MTC a los fármacos antituberculosos de primera línea, inferior al 6%24,25, podría explicar la mejoría de los pacientes a pesar del retraso de la identificación microbiológica. Una rápida y fiable identificación de la especie micobacteriana, así como una comunicación inmediata con el clínico, podrían mejorar estos resultados.
La mortalidad de esta enfermedad fue inferior a la de otros estudios similares6,16. Probablemente asociada a múltiples factores6,10,16 como la edad avanzada y/o la inmunosupresión.
En comparación con la TB por M. bovis, los pacientes con TB por MTC de CyL en el año 201525 tenían una media de edad menor (52,7+24,5) y un mayor porcentaje de inmigrantes (17,5%), de TB infantil (6,7%) y de formas pulmonares (73%). El principal factor de riesgo fue el contacto con enfermo de TB (13,41%). Las provincias con mayor incidencia fueron Palencia, León y Zamora.
Una de las limitaciones de este estudio fue el desconocimiento de los patrones de la radiología de tórax de los pacientes, así como el tiempo de curación de la enfermedad.
En conclusión, la incidencia de TB por M. bovis en CyL se mantuvo estable a pesar del descenso de la TB por MTC y de que la TB bovina está en fase de erradicación. Afectó mayoritariamente a población nacida en España y con elevada media de edad. La localización pulmonar fue la más frecuente. La detección de los genotipos de M. bovis de la población contribuiría a detectar los focos de infección y a evitar su transmisión. Consideramos necesaria una estrecha colaboración entre la sanidad humana y la animal para el control y erradicación de esta enfermedad.
AutoríaT. Nebreda Mayoral ha escrito el manuscrito y ha sido revisado por los coautores. T. Nebreda Mayoral, M.F. Brezmes Valdivieso, N. Gutiérrez Zufiaurre, S. García de Cruz, C. Labayru Echeverría, R. López Medrano, L. López-Urrutia Lorente, A. Tinajas Puertas y O. Rivero Lezcano han participado en el diseño del estudio y análisis de datos.
Conflicto de interesesDeclaramos que no hay conflictos de interés.
Agradecemos la ayuda de la Dra. M.S. Jiménez (Centro Nacional de Micobacterias, Instituto de Salud Carlos III, Majadahonda, Madrid, España) en la identificación de Mycobacterium bovis. Agradecemos al resto de miembros del grupo GRUMICALE (Grupo de Micobacterias de Castilla and Leon): B. Nogueira González, Hospital Clínico Universitario de Valladolid, Valladolid; R. Sánchez Arroyo, Hospital de Ávila, Ávila; S. Hernando-Real, Hospital de Segovia, Segovia; O. Rivero-Lezcano, Complejo Asistencial Universitario de León, León; B. Ullivarri Francia, Hospital Santiago Apóstol, Miranda de Ebro-Burgos; R. Rodríguez-Tarazona, Hospital Santos Reyes, Aranda de Duero-Burgos; I. Antolín Ayala, Hospital de Medina del Campo, Medina del Campo-Valladolid, su interés en la búsqueda de casos de Mycobacterium bovis y aportación de los casos de TB de sus Áreas de Salud.